Слитые клетки-партнеры
Иллюстрации
Показать всеВ изобретении описаны клетки-партнеры слияния, дающие возможность получения гетерогибридом из клеток биологических видов, отличающихся от мыши. Гетерогибридомы получают путем слияния миеломных клеток, полученных из животного первого биологического вида, с лейкозными клетками, полученными из животного второго биологического вида, которые имеют дополнительную S-фазу в клеточном цикле и обладают свойством диплоидизации. Клетка-партнер слияния SPYMEG депонирована под номером FERM ВР-10761 и может быть использована для получения гибридомы. Описана гибридома, продуцирующая антитела, полученная слиянием клетки-партнера слияния и третьей клетки с антителопродуцирующей способностью. В изобретении описаны способы получения клетки-партнера слияния, гибридомы и антителопродуцирующей клетки, а также способы получения антител. Использование изобретения обеспечивает стабильное и несложное продуцирование веществ с использованием гибридом в широком диапазоне видов животных. Полученные по изобретению гибридомы стабильно сохраняют фенотип в течение всего процесса клонирования. 8 н. и 12 з.п. ф-лы, 10 ил., 2 табл.
Реферат
Область техники
Настоящее изобретение относится к слитым клеткам и гибридомам.
Предпосылки изобретения
Гибридомы (слитые клетки) используются для получения веществ с помощью культур клеток. Существует много животных клеток, которые продуцируют коммерчески или академически полезные вещества. Однако обычно трудно культивировать животные клетки, и не существует способа стабильного культивирования животных клеток в течение длительного периода с сохранением их способности продуцировать вещества. В таких обстоятельствах был предложен способ создания клеток, имеющих оба признака - способность к росту в культуре и способность продуцировать вещества. Этим способом созданы гибридомы посредством слияния клеток, продуцирующих биологически активное вещество, а в качестве клеток-партнеров слияния миеломных клеток, которые можно неограниченно и стабильно пересевать in vitro.
Когда моноклональные антитела продуцируют посредством слияния клеток, гибридомы проверяют по таким характеристикам как производительность антител и связывающая способность, и отобранные клетки клонируют до гомогенности. Тогда клетки вырастают в гомогенную клеточную популяцию и продуцируют моноклональные антитела. Такие гибридомы выращивают в культурах in vitro или in vivo (в асците) и развивают до продукции антител в большом масштабе. Способ создания моноклональных антител с использованием слияния клеток уже известен (см. непатентный документ 1). Предполагается, что моноклональные антитела являются более специфичными по сравнению с поликлональными антителами, очищенными из антисывороток. Таким образом, моноклональные антитела используют в качестве мощного инструмента в различных иммунологических исследованиях.
Когда слитые клетки принадлежат одному виду, их просто называют «гибридомами». В основном этим способом получают мышиные моноклональные антитела и т.п. С другой стороны, антителопродуцирующие клетки, полученные при слиянии клеток, выделенных из особых видов с бессмертными клетками, полученными от разных видов, называют «гетерогибридомами». Термин «гетерогибрид» является синонимом гетерологичного слияния, и полученные клетки называют «гетерогибридомами». Кроме того, антителопродуцирующие клетки, полученные путем слияния клеток, полученных из трех видов животных, называют «триомами». Полученные этим способом моноклональные антитела представляют собой антитела крыс и хомяков. Гетерогибридомы между мышью и крысой или между мышью и хомяком получены путем слияния мышиных миеломных клеток с лимфоцитами, полученными из крыс или хомяков, которым был введен представляющий интерес антиген. Полученные таким образом гетерогибридомы клонируют, обеспечивая производство моноклональных антител, полученных из каждого иммунизированного животного.
До настоящего времени публиковались сообщения о гетерогибридомах, продуцирующих моноклональные антитела человека, кролика, коровы и овцы (см. непатентные документы 2-5 и патентные документы 1 и 2).
Однако продукция моноклональных антител гетерогибридомами считается более затрудненной, так как филогенетическое расстояние между клетками биологических видов, подвергаемыми слиянию, увеличивается. Например, крайне трудно продуцировать антитела с использованием гибридом между мышью и кроликом или между мышью и человеком. Так как гибридомы имеют аберрантное число хромосом, при сегрегации дочерним клеткам не всегда достаются одинаковые пары хромосом, и некоторые хромосомы могут быть потеряны.
Непатентный документ 1: Waldman, T., Science 252:1657-1662 1991
Непатентный документ 2: Proc. Natl. Acad. Sci. USA 80:7308-7312, 1983
Непатентный документ 3: Raybould et al., Science 240:1788-1790, 1988
Непатентный документ 4: Kennedy et al., J. Gen. Virol. 69:3023-3032, 1988
Непатентный документ 5: Flynn et al., J. Immunol. Methods 121:237-246, 1989
Патентный документ 1: патент США № 4634664 specification
Патентный документ 2: патент США № 4977081 specification
Описание изобретения
Решаемые в данном изобретении проблемы
Целью настоящего изобретения является предоставление способов, которые обеспечили бы стабильное и несложное продуцирование веществ с использованием гибридом в широком диапазоне видов животных. В частности, целью настоящего изобретения является получение новых партнеров слияния, эффективных для получения гибридом, и способов получения партнеров слияния. Другой целью настоящего изобретения является обеспечение продукции гибридом, полученных путем слияния клеток, продуцирующих вещество, и партнеров слияния, полученных согласно настоящему изобретению, способы получения гибридом и способы получения веществ с использованием таких гибридом.
Способы решения проблем
В производстве веществ с использованием техник слияния клеток существуют различные проблемы, не касающиеся клеток некоторых животных, таких как мышь. Например, не существует пригодной клетки, которую можно использовать в качестве партнера слияния при слиянии клеток, и это является существенной проблемой, которая должна быть преодолена в техниках слияния клеток других животных. Авторы настоящего изобретения обнаружили, что клетка, пригодная в качестве партнера слияния, может быть получена путем слияния особых типов клеток. Стабильные гибридомы предоставлены путем слияния немышиных клеток с клетками-партнерами слияния, созданными авторами настоящего изобретения. Авторы изобретения показали, что полученные таким образом гибридомы стабильно сохраняли фенотип в течение всего процесса клонирования и были так же пригодны, как и клетки, продуцирующие вещество. Таким образом авторы настоящего изобретения его и осуществили. Кроме того, они показали, что антитела, специфически распознающие антигены, могут быть получены с использованием гибридом согласно изобретению.
В частности, настоящее изобретение относится к описанным ниже клеткам-партнерам слияния и гибридомам между клетками-партнерами слияния и продуцирующими вещество клетками. Настоящее изобретение относится также к способам получения этих клеток и способам производства веществ с использованием гибридом.
[1] Клетка-партнер слияния, которая может быть получена путем слияния:
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которой есть дополнительная S-фаза;
[2] клетка-партнер слияния по п. [1], где животное первого биологического вида представляет собой мышь, и миеломная клетка выбрана из группы, состоящей из линий мышиных миеломных клеток MOPC21, P3X63AG8, SP2/0, NS-1, P3.X63AG8.653, F0, S194/5.XXO.BU-1, FOX-NY, и SP2/0-Ag14 и клеточных линий, полученных из этих клеточных линий;
[3] клетка-партнер слияния по п. [1], где животное второго биологического вида представляет собой человека, и лейкозная клетка выбрана из группы, состоящей из лейкозных клеточных линий MEG-01, HEL, UT-7, M07e, MEG-A2, и DAMI и клеточных линий, полученных из этих клеточных линий;
[4] клетка-партнер слияния по п. [1], где первая клетка представляет собой SP2/0-Ag14, и вторая клетка представляет собой MEG-01;
[5] клетка-партнер слияния SPYMEG, депонированная под инвентарным номером FERM BP-10761;
[6] гибридома, которую можно получить путем слияния
(1) клетки-партнера слияния, которая может быть получена путем слияния
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, в клеточном цикле которой имеется дополнительная S-фаза, и
(2) третьей клетки;
[7] гибридома по п. [6], где животное первого биологического вида представляет собой мышь, и миеломная клетка выбрана из группы, состоящей из линий мышиных миеломных клеток MOPC21, P3X63AG8, SP2/0, NS-1, P3.X63AG8.653, F0, S194/5.XXO.BU-1, FOX-NY, и SP2/0-Ag14 и клеточных линий, полученных из этих клеточных линий;
[8] гибридома по п. [6], где животное второго биологического вида представляет собой человека, и лейкозная клетка выбрана из группы, состоящей из лейкозных клеточных линий MEG-01, HEL, UT-7, M07e, MEG-A2, и DAMI и клеточных линий, полученных из этих клеточных линий;
[9] гибридома по п. [6], где первая клетка представляет собой SP2/0-Ag14, и вторая клетка представляет собой MEG-01;
[10] гибридома по п. [6], где клетка-партнер слияния представляет собой SPYMEG, депонированную под инвентарным номером FERM BP-10761;
[11] гибридома по п. [6], где третья клетка представляет собой клетку, полученную из животного того же биологического вида, из которого была получена вторая клетка;
[12] гибридома по п. [11], где третья клетка представляет собой антителопродуцирующую клетку;
[13] способ получения клетки-партнера слияния, предусматривающий следующие стадии:
(1) слияние
(а) миеломной клетки, полученной из животного первого биологического вида, и
(б) лейкозной клетки, полученной из животного второго биологического вида, жизненный цикл которой содержит дополнительную S-фазу, и
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры;
[14] способ получения гибридомы, предусматривающий следующие стадии:
(1) слияние антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) культивирование клеток, слитых на стадии (1), и сбор гибридомы из культуры;
[15] способ получения антителопродуцирующей клетки, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) сбор полученной на стадии (1) гибридомы в качестве антителопродуцирующей клетки;
[16] способ по п. [15], дополнительно предусматривающий стадию клонирования гибридомы, полученной на стадии (1);
[17] способ производства антител, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния антителопродуцирующей клетки с клеткой-партнером слияния, полученной способом по п. [13], и
(2) культивирование гибридомы, полученной на стадии (1), и сбор антител из культуры;
[18] способ по п. [17], дополнительно предусматривающий стадию клонирования гибридомы, полученной на стадии (1);
[19] способ производства антител против инфекционного заболевания, предусматривающий следующие стадии:
(1) получение гибридомы путем слияния клетки-партнера слияния, полученной способом по п. [13], с антителопродуцирующей клеткой, полученной из субъекта, который подвергался воздействию патогенетического антигена инфекционного заболевания, и
(2) культивирование гибридомы, полученной на стадии (1), и сбор антител против инфекционного заболевания из культуры, и
[20] способ по п. [19], где инфекционное заболевание представляет собой грипп, СПИД или вирусный гепатит.
Альтернативно, настоящее изобретение относится к применению слитых клеток в качестве клеток-партнеров слияния, которые могут быть получены путем слияния клеток (а) и (б), описанных ниже. В частности, настоящее изобретение относится к применению слитых клеток в качестве клеток-партнеров слияния, которые должны быть слиты с антителопродуцирующими клетками:
(а) миеломные клетки, полученные из животного первого биологического вида, и
(б) лейкозные клетки, полученные из животного второго биологического вида, клеточный цикл которых содержит дополнительную S-фазу.
Эффекты изобретения
Настоящее изобретение относится к клеткам-партнерам слияния, которые при слиянии с гетерологичными клетками дают возможность получения стабильных гибридом. Гибридомы, полученные путем слияния клеток с клетками-партнерами слияния согласно изобретению, стабильно продуцируют вещества. В частности, слияние между антителопродуцирующими клетками и клетками-партнерами слияния согласно изобретению приводит к тому, что полученные гибридомы продуцируют антитела, полученные из антителопродуцирующих клеток. В предпочтительном варианте осуществления слияние между клетками-партнерами слияния согласно изобретению и человеческими или мышиными антителопродуцирующими клетками приводит к тому, что полученные гибридомы продуцируют, соответственно, человеческие или мышиные антитела. Ранее полагали, что сложно поддерживать человеческие антителопродуцирующие клетки. Таким образом, настоящее изобретение связано с достоверным эффектом в виде предоставления клеток, которые стабильно продуцируют антитела человека.
Стабильное сохранение фенотипов в гибридомах представляет собой важную особенность не только для продукции веществ, но также и для клонирования клеток. Например, для получения моноклональных антител в качестве антителопродуцирующих клеток были клонированы гибридомы. Клонирование клеток означает получение клеточной популяции из одной клетки. Таким образом, очень сложно клонировать представляющие интерес клетки, если клеточные фенотипы не стабильны в циклах деления отдельных клеток. Так как гибридомы, предоставленные согласно изобретению, стабильно поддерживают свои клеточные фенотипы, они действительно могут быть клонированы.
Краткое описание рисунков
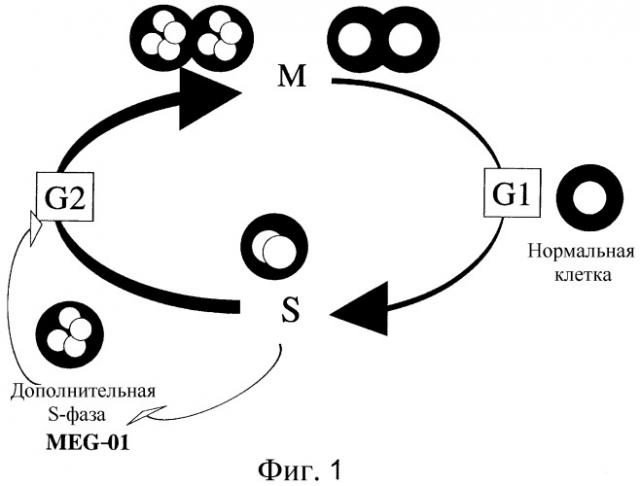
На Фиг. 1 представлена диаграмма клеточного цикла MEG-01.
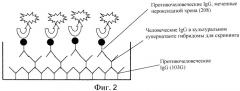
Фиг. 2 представляет собой диаграмму схемы ELISA-скрининга человеческих IgG-продуцирующих гибридом.
На Фиг. 3 приведены фотографии, на которых приведено морфологическое сравнение между клетками-партнерами слияния согласно изобретению SPYMEG и известной клеткой-партнером слияния Karpas.
На Фиг. 4 показаны фотографии, на которых приведено подтверждение IgG в каждой элюционной фракции клонов KO142(+), MK16(+) и MK99(+). На этих фотографиях (+) и (-) означают, соответственно, ELISA-положительные и -отрицательные клоны.
На Фиг. 5 показаны фотографии, на которых приведено подтверждение IgG в образце после диализа и концентрация элюционной фракции каждого клона.
Фиг. 6 представляет собой диаграмму, показывающую каждую стадию улучшенного способа слияния клеток с использованием SPYMEG.
Фиг. 7 представляет собой диаграмму, на которой показано сравнение количества образованных клонов и продуцирующих IgG клонов до и после улучшения способа слияния клеток. Показано количество лунок, положительных в отношении образования колоний, и количество лунок, положительных в отношении продукции IgG в четырех 96-луночных планшетах. При усовершенствовании стадии клеточного слияния было значительно увеличено как количество лунок, положительных в отношении образования колоний, так и положительных в отношении продукции IgG. С помощью гриппозного скрининга из лунок было выделено множество антител, которые специфически распознают гриппозную вакцину. Таким образом, впервые успешно были установлены антитела, которые специфически распознавали антиген.
Фиг. 8 представляет собой диаграмму реактивности IgG-продуцирующих клонов к гриппу с помощью ELISA.
Фиг. 9 представляет собой фотографию Вестерн-блоттинга для оценки реактивности к гриппозной вакцине.
Фиг. 10 представляет собой фотографию SDS-PAGE очищенного человеческого IgG (6-19) в подтверждение его реактивности. Приведенные в таблице значения представляют собой оптическую плотность при длине волны 450 нм в ELISA с использованием планшетов, сенсибилизированных гемагглютининовой гриппозной вакциной.
Лучший вариант осуществления изобретения
Здесь «гибридома» относится к клетке, полученной путем клеточного слияния. В основном гибридомы получены путем слияния гетерологических клеток или клеток, которые гомологичны, но получены из различных животных или тканей. Гибридомы также включают клетки, полученные в результате слияния гомологических клеток, относящихся к одному типу клеток. Кроме того, гибридомы согласно изобретению также включают в себя слитые клетки, полученные путем слияния двух или более клеток. В частности, гибридомы согласно изобретению включают в себя также слитые клетки β, полученные путем слияния клетки В с гибридомой α, полученной в результате слияния клеток А и Б.
(клетка А)×(клетка Б)=[гибридома α]
[гибридома α]×(клетка В)=[гибридома β]
где три типа клеток, а именно клетка А, клетка Б и клетка В, которые были слиты для получения гибридомы β, могут быть получены из животных любых видов. Таким образом, в настоящем изобретении биологические виды, из которых получают клетки, могут быть одинаковыми или различными. В частности, гибридомы, полученные слиянием трех типов клеток, иногда обозначают как «триомы».
В предпочтительном варианте осуществления настоящего изобретения биологические виды клетки А (первая клетка) и клетки Б (вторая клетка) отличаются друг от друга, тогда как биологические виды клетки Б и клетки В (третья клетка) одинаковы. Гибридомы согласно изобретению также включают в себя слитые клетки, полученные когда биологические виды клетки А и клетки В одинаковы или биологические виды клетки А, клетки Б и клетки В отличаются друг от друга.
В основном клетки, полученные путем клеточного слияния и в течение длительного периода легко пересеваемые in vitro, в частности, называют «гибридомами». Таким образом, предпочтительными гибридомами согласно изобретению являются клетки, которые легко пересеваются in vitro в течение длительного периода после клеточного слияния. Альтернативно, предпочтительными гибридомами согласно изобретению являются клетки, которые продолжают расти после предельного разведения. Другими словами, клетки, которые могут продолжать расти после предельного разведения, включены в клетки, которые могут быть легко пересеяны in vitro в течение длительного периода после клеточного слияния.
Кроме того, предпочтительные гибридомы согласно изобретению представляют собой клетки, которые сохраняют фенотип клеток, использованных при клеточном слиянии. В настоящем изобретении клеточные фенотипы, подлежащие сохранению в гибридомах, включают способность клеток продуцировать вещества. Например, когда клетки, использованные при слиянии клеток, продуцируют антитела или цитокины, предпочтительные гибридомы согласно изобретению сохраняют способность продуцировать эти вещества.
Однако гибридомы согласно изобретению необязательно сохраняют полный фенотип клеток, использованных при слиянии клеток. Таким образом, когда сохранение фенотипов, например, продукции антигенов клеточной поверхности или ферментов и факторов транскрипции, которые накапливаются в клетке, желательно, в дополнение к продукции описанных выше антител, эти фенотипы также включаются в фенотип, подлежащий сохранению в гибридомах. Однако когда продукция этих веществ не является необходимой, гибридомы, лишенные способности продуцировать эти вещества, также включаются в гибридомы согласно изобретению, пока они продолжают продуцировать необходимые вещества.
Здесь «клетки-партнеры слияния» относится к клеткам, которые при слиянии с другими клетками дают возможность получить гибридомы. Предпочтительные клетки-партнеры слияния согласно изобретению дают возможность клеткам выживать in vitro в течение длительного периода после слияния клеток.
Кроме того, клетки-партнеры слияния предпочтительно имеют подходящие селекционные маркеры для скрининга. Селекционный маркер относится к фенотипу, который позволяет (или не позволяет) выживать в особых культуральных условиях.
Известные селективные маркеры животных клеток включают в себя гипоксантин-аминоптерин-тимидиновую чувствительность (в дальнейшем сокращается как «ГАТ-чувствительность»), являющуюся результатом гипоксантин-гуанин-фосфорибозилтрансферазной недостаточности (в дальнейшем сокращается как «ГГФРТ-недостаточность») или тимидинкиназная недостаточность (в дальнейшем сокращается как «ТК-недостаточность»). В ГАТ-селективной среде ГАТ-чувствительные клетки не могут синтезировать ДНК и, таким образом, будут погибать. Однако при слиянии с нормальными клетками полученные клетки могут продолжать синтезировать ДНК «реутилизационным» путем, характерным для нормальных клеток, и, таким образом, способны расти даже в ГАТ-селективной среде.
ГГФРТ- или ТК-недостаточные клетки могут быть отобраны с использованием среды, содержащей 6-тиогуанин, 8-азагуанин (в дальнейшем сокращается как «8АГ»), или 5'-бромодезоксиуридин. Нормальные клетки погибают при встраивании этих аналогов пиримидина в ДНК. В отличие от этого, клетки, страдающие от недостатка этих ферментов, могут выживать в селективной среде, потому что они не способны встраивать эти аналоги пиримидина. Другой селективный маркер называется устойчивостью к G418 и обеспечивает устойчивость к 2-дезоксистрептаминовым антибиотикам (аналогам гентамицина) благодаря гену резистентности к неомицину.
Настоящее изобретение относится к клеткам-партнерам слияния, которые могут быть получены путем слияния
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, клеточный цикл которых имеет дополнительную S-фазу.
Настоящее изобретение относится также к способам производства клеток-партнеров слияния, предусматривающим следующие стадии:
(1) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(b) лейкозных клеток, полученных из животного второго биологического вида, клеточный цикл которых имеет дополнительную S-фазу, и
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры.
Здесь подразумевается, что миеломные клетки, полученные из животного первого биологического вида, получены из миелом, которые могут быть клонированы независимо. Фраза «могут быть клонированы независимо» означает, что рост может быть начат даже из одной клетки, и пересев можно проводить постоянно в условиях искусственной среды.
В настоящем изобретении миеломные клетки, полученные из животного первого биологического вида, могут быть любыми клетками, пока они обеспечивают клетки-партнеры слияния при слиянии с лейкозными клетками. Известные клетки, которые можно использовать в качестве миеломных клеток согласно изобретению, включают в себя, например, описанные ниже клетки. В списке клеточных линий, приведенном ниже, «ATCC» означает инвентарный номер в American Tissue and Culture Collection, тогда как «JCRB» означает инвентарный номер в банке клеток JCRB (Japanese Collection of Research Bioresources). Таким образом, все клеточные линии доступны в этих клеточных банках. Клеточные линии в банке клеток JCRB распространяются через Health Science Research Resources Bank (HSRRB).
MOPC21 (ATCC номер: HB-8411)
P3X63AG8 (ATCC номер: T1B9)
SP2/0 (ATCC номер: CRL 1581)
NS-1 (ATCC номер: TIB18)
P3.X63AG8.653 (ATCC номер: CRL 1580)
F0 (ATCC номер: CRL 1646)
S194/5.XXO.BU-1 (ATCC номер: CRL 1580)
FOX-NY (ATCC номер: CRL 1732)
SP2/0-Ag14 (JCRB номер: 0029)
Среди этих клеточных линий предпочтительными свойствами, описанными выше, обладает группа линий мышиных миеломных клеток и клеточные линии, полученные из этих линий мышиных миеломных клеток. Под полученными клеточными линиями подразумеваются клеточные линии, которые переклонированы после введения дополнительных фенотипов, таких как устойчивость к лекарственным средствам.
В настоящем изобретении лейкозные клетки, полученные из животного второго биологического вида, представляют собой лейкозные клетки, клеточный цикл которых имеет дополнительную S-фазу. Обычный клеточных цикл эукариотической клетки приведен ниже. Растущие клетки продолжают делиться, в то время как повторяется цикл с G1-фазы до M-фазы. Рост клетки останавливается, когда клеточный цикл достигает стабильного состояния, называемого G0-фазой, после M-фазы.
-[G1-фаза]-[S-фаза]-[G2-фаза]-[M-фаза]-
В каждом клеточном цикле S-фаза представляет собой период синтеза нуклеиновых кислот. В этот период полагают, что геномная ДНК образует хромосомы после репликации, и клетка готовится к клеточному делению. Удвоившаяся в M-фазе геномная ДНК распределяется по двум клеткам в ходе митоза. Однако в некоторых клетках наблюдали феномен, когда клеточный цикл не проходит стадию клеточного деления после репликации геномной ДНК. Период после синтеза ДНК, в котором клеточный цикл не приводит к делению клетки в М-фазе, был назван «дополнительной S-фазой». Было обнаружено, что не поделившиеся клетки накапливают синтезированную геномную ДНК и, таким образом, содержат повышенное количество ДНК. Например, среднее число хромосом у MEG-01, которая является лейкозной клеточной линией, предпочтительной в настоящем изобретении, составляет 2n=104. Это значительно больше, чем количество хромосом в нормальных клетках (2n=46). Причиной наличия у MEG-01 дополнительной S-фазы является то, что в ее клеточном цикле увеличивается количество геномной ДНК, и, таким образом, имеется свойство диплоидизации (Oncogene 13:695-703, 1996) (Фиг. 1).
Таким образом, ожидается, что настоящее изобретение имеет эффект предупреждения потери хромосом, полученных гетерогибридомами от антителопродуцирующих клеток за счет использования лейкозных клеток, которые имеют дополнительную S-фазу в своем клеточном цикле и свойство диплоидизации.
В настоящем изобретении лейкозные клетки, чей клеточный цикл имеет дополнительную S-фазу, получены от биологического вида, отличающегося от другого биологического вида, от которого получены описанные выше миеломы, и, предпочтительно, от того же биологического вида, от которого получена третья клетка, описанная ниже. Такие лейкозные клетки могут быть получены из гематопоэтических тканей или периферической крови животного с лейкемией. Гематопоэтические ткани включают в себя костный мозг, селезенку, лимфатические узлы и т.п. Лейкемия включает в себя, например, мегакариотическую лейкемию. Лейкоциты, мононуклеарные клетки или им подобные могут быть выделены, например, путем центрифугирования периферической крови и сбора клеточных фракций с определенным удельным весом способом с фиколлом.
Кроме того, если выделенные лейкозные клетки обладают дополнительной S-фазой в их клеточном цикле, они могут быть оценены с использованием в качестве индикатора увеличения хромосом в клетках. Увеличение хромосом может быть подтверждено, например, на основе увеличения плоидности (общего числа хромосом) клеток, обработанных 12-O-тетрадеканоил-форбол-13-ацетатом (ТФА). Такое увеличение плоидности может быть обнаружено с помощью проточного цитометра или анализатора плоидности.
Альтернативно, известные лейкозные клетки также могут быть использованы в настоящем изобретении. Известные клетки, которые можно использовать в качестве лейкозных, полученных из животного второго биологического вида, в настоящем изобретении включают в себя, например, указанные ниже клеточные линии. MEG-01 и HEL представляют собой линии человеческих мегакариотических лейкозных клеток (Blood 66:1384-1392, 1985; J. Clin. Invest. 85:1072-1084).
MEG-01 (ATCC № CRL-2021)
HEL (JCRB № 0062)
UT-7 (N. Komatsu et al., Cancer Res. 51: 341-348, 1991)
M07e (Avanzi GC et al., J. Cell Physiol. 1990 Dec; 145(3):458-64)
MEG-A2 (JCRB № IFO50478)
DAMI (Blood 89:4238, 1997)
В частности, MEG-01 проявляет устойчивость к 8АГ, которая полезна в качестве селективного маркера. Кроме того, когда MEG-01 не продуцирует иммуноглобулин, она является предпочтительной в качестве партнера для слияния с антителопродуцирующими клетками для получения гибридом.
Клетки-партнеры слияния согласно изобретению могут быть получены путем слияния миеломных клеток, полученных из животного первого биологического вида, с лейкозными клетками, полученными из животного второго биологического вида, чей клеточный цикл имеет дополнительную S-фазу. Известные способы слияния клеток, такие как способ с полиэтиленгликолем (PEG) и электрослияние, можно использовать для достижения слияния клеток.
Способ с полиэтиленгликолем проводят в соответствии со следующей процедурой. Сначала оптимизируют соотношение между миеломными и лейкозными клетками для каждых отдельных условий слияния. Специалисты в данной области могут выбрать оптимальную концентрацию полиэтиленгликоля (PEG), на основе молекулярной массы PEG или ему подобного. Например, 35% PEG1500 (Aldrich, Milwaukee, Wisconsin) является одним из требований к обычному слиянию клеток. 1 мл 35%-ного PEG1500 медленно добавляют к клеточному осадку/смеси клеток на протяжении 1,5 минут. Затем клеточную суспензию понемногу разбавляют средой, не содержащей сыворотку, а затем средой, содержащей сыворотку, для достижения слияния клеток.
Другие подходящие способы, которые также могут быть использованы для достижения слияния клеток, включают электрослияние. В этом способе клетки помещают в специальный буфер и затем выравнивают посредством подачи напряжения. Выровненные клетки могут быть эффективно слиты друг с другом благодаря тому, что шанс контакта друг с другом повышается.
Смесь для слияния суспендируется, например, при плотности клеток 8×105 клеток/мл в 150 мл среды HB-GRO (Irvine Scientific, Santa Ana, California), содержащей 15% фетальной телячьей сыворотки. Затем клетки разделяют на равные порции по 2,0×105 клеток/на лунку в 96-луночные планшеты. Клетки можно инкубировать в атмосфере с 5%-10% CO2 при 37°C для получения 8АГ-резистентных клеток-партнеров слияния. Полученные клетки-партнеры слияния могут быть клонированы, если потребуется. Клонированные клетки-партнеры слияния способствуют поддержанию репродуктивности в полученных гибридомах.
Например, SP2/0-Ag14 можно использовать в качестве миеломной клетки, полученной из животного первого биологического вида, в то время как MEG-01 можно использовать в качестве лейкозной клетки, полученной из животного второго биологического вида, клеточный цикл которой имеет дополнительную S-фазу.
Клетки-партнеры слияния, подготовленные, как описано выше, сами могут быть пересеяны в течение длительного периода и, таким образом, могут быть использованы в качестве обычных клеток-партнеров слияния для получения моноклональных антител из антителопродуцирующих клеток. В частности, подобно тому, как линии мышиной миеломы признаны для производства мышиных гомогибридом, клетки можно использовать в качестве слитых клеток, которые дают возможность получения стабильных гибридом с использованием антителопродуцирующих клеток, полученных из биологических видов, отличающихся от мыши. Среди клеток-партнеров слияния, полученных согласно изобретению, клетка-партнер слияния SPYMEG, полученная путем слияния мышиной миеломной клетки линии SP2/0-Ag14 с клеточной линией человеческой миеломы MEG-01, депонирована под инвентарным номером FERM BP-10761 в International Patent Organism Depositary.
(а) Название и адрес депозитарного учреждения
Название: National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary.
Адрес: (Почтовый индекс: 305-8566) Central 6, 1-1-1 Higashi, Tsukuba-shi, Ibaraki-ken, Japan.
(б) Дата размещения: 24 февраля 2006.
(в) Входной номер: FERM BP-10761
(перенесен из FERM P-20816 размещен 24 февраля 2006).
Настоящее изобретение относится к гибридомам, которые могут быть получены с использованием клеток-партнеров слияния, описанных выше. В частности, настоящее изобретение относится к гибридомам, которые могут быть получены путем слияния
(1) клетки-партнера слияния, которая может быть получена путем слияния
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза, и
(2) третьей клетки.
Настоящее изобретение относится также к способам получения гибридом, которые содержат следующие стадии:
(1) слияние
(а) миеломных клеток, полученных из животного первого биологического вида, и
(б) лейкозных клеток, полученных из животного второго биологического вида, в клеточном цикле которых имеется дополнительная S-фаза;
(2) культивирование клеток, слитых на стадии (1), и сбор клеток-партнеров слияния из культуры;
(3) слияние третьей клетки с клеткой-партнером слияния, собранных на стадии (2), и
(4) культивирование клеток, слитых на стадии (3), и сбор гибридомы из культуры.
Биологический вид третьей клетки согласно изобретению является сходным или отличающимся от биологического вида первой клетки и второй клетки. В частности, можно использовать клетки человека, кролика, мыши, крысы, коровы, козы, овцы или подобных. Более конкретно, при использовании слитых клеток, полученных из мышиной миеломы (первая клетка) и человеческих лейкозных клеток (вторая клетка), третью клетку предпочтительно получают из человека или мыши. В частности, тот факт, что человеческие клетки можно использовать в качестве третьей клетки, представляет собой большое преимущество клеток-партнеров слияния согласно изобретению.
Третья клетка согласно изобретению представляет собой клетку, которая предположительно в конечном счете дает долгоживущую культуру. Более конкретно, например, клетки, обладающие способностью продуцировать представляющие интерес вещества, можно использовать в качестве третьей клетки. Гибридомы, которые способны к долговременному поддержанию клеток, обладающих представляющим интерес фенотипом, могут быть получены посредством клеточного слияния между описанными выше клетками и слитыми клетками согласно изобретению. Образование гибридом, дающих возможность длительного поддержания клеток, как правило, называется «иммортализацией».
В настоящем изобретении любую клетку, продуцирующую представляющее интерес биологически активное вещество, можно использовать в качестве третьей клетки. Предпочтительные биологически активные вещества согласно изобретению включают в себя антитела. Другими словами, антителопродуцирующие клетки являются предпочтительными в качестве третьей клетки согласно изобретению. Антителопродуцирующие клетки включают в себя, например, лейкоциты (периферические лимфоциты) и клетки селезенки. Способы сбора таких клеток из живого тела известны. Более специфические примеры третьей клетки включают антителопродуцирующие клетки, полученные из животных, подвергавшихся воздействию патогенного антигена инфекционного заболевания. Животные, подвергавшиеся воздействию патогенного антигена инфекционного заболевания, включают в себя животных, вакцинированных патогенным антигеном (вакциной) инфекционного заболевания, и животных, которые пережили инфекцию. Здесь инфекционное заболевание не ограничено частностями; однако к предпочтительным примерам относятся грипп, СПИД и вирусные гепатиты, такие как HCV и HBV.
В частности, лимфоциты периферической крови являются предпочтительными в качестве антителопродуцирующих клеток согласно изобретению. Лимфоциты периферической крови могут быть легко получены через забор крови. Гибридомы, продуцирующие мышиные антитела, могут быть легко получены путем приготовления гибридом из лимфоцитов периферической крови мыши согласно изобретению. Альтернативно, гибридомы, продуцирующие антитела человека, могут быть быстро получены путем приготовления гибридом из лимфоцитов периферической крови человека согласно изобретению.
В настоящем изобретении слитая клетка может быть слита с третьей клеткой тем же способом, который использовался при клеточном слиянии описанных выше первой и второй клеток. Слияние клеток может быть достигнуто при использовании способа с PEG или электрослияния. Например, когда лимфоциты периферической крови человека слились с SPYMEG в качестве партнеров слияния согласно изобретению, предпочтительные условия включают в себя следующие условия.
Во-первых, количество лейкоцитов периферической крови (PBL), подлежащих слиянию, предпочтительно составляет от 1×107 до 108 клеток. SPYMEG и PBL смешивают вместе в соотношении от 2:1 до 10:1. Клетки осаждают посредством центрифугирования, и полученный супернатант удаляют. Для слияния клеток к фракции собранных клеток добавляют полиэтиленгликоль (PEG). Концентрация PEG, используемого при слиянии клеток, составляет от 30% до 70%, предпочтительно, от 40% до 60%, и более предпочтительно, 50%. В зависимости от количества клеток, к клеткам добавляют от 0,1 до 2,0 мл, предпочтительно, от 0,6 до 1,0 мл раствора PEG в течение 60-90 секунд, помешивая с помощью пипетки. После добавления раствора PEG клеточную суспензию постоянно помешивают пипеткой в течение 2-3 минут. Затем при помешивании постепенно, в течение 30-60 секунд, добавляют от 10 до 14 мл среды, не содержащей сыворотку. После добавления среды, не содержащей сыворотку, смесь центрифугируют. После центрифугирования супернатант удаляю