Способ прогнозирования риска развития гестоза на основе генетических маркеров
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к акушерству и гинекологии, может быть использовано для прогнозирования риска развития гестоза. Способ включает выделение геномной ДНК обследуемой женщины, проведение ПЦР-исследования участков генов MTHFR и РАI1 путем смешивания компонент и добавления олигопраймеров с последующим анализом полиморфизма длин рестрикционных фрагментов и визуализацией электрофореграммы в полиакриламидном геле. Для амплификации с целью исследования участка гена MTHFR используют прямой праймер CCAGTCCCTGTGGTCTCTTCAT и обратный праймер AGGGAGCTTATGGGCTCTCCT; с целью исследования участка гена РАI1 используют прямой праймер CAGAGAGAGTCTGGCCACGT и обратный праймер CGTGATTGTCTAGGTTTTGTCTGTCTAGG. При выявлении генотипов MTHFR 677Т/Т и/или РАI1-675 4G/4G прогнозируют риск развития гестоза. 2 ил.
Реферат
Изобретение относится к области медицины, а именно к акушерству и гинекологии, связано с разработкой способа прогнозирования риска развития осложнений беременности, в частности гестоза, в результате проведения молекулярно-генетических исследований и может быть использовано для оценки степени риска развития гестоза.
Гестоз относится к одной из важнейших проблем современного акушерства и гинекологии и на сегодняшний день является основной причиной материнской и перинатальной заболеваемости и смертности. Частота гестоза по данным разных авторов колеблется от 7 до 25% всех беременных. Гестоз развивается у 6-12% здоровых беременных и у 20-40% беременных, имеющих экстрагенитальную патологию. Несмотря на многочисленные исследования, до сих пор нет четкого представления о причинах возникновения гестоза, отсутствуют точные сведения о патогенезе заболевания и, как следствие, не разработаны достоверные методы его диагностики, нет единого мнения о способах прогнозирования развития гестоза и оценки степени риска возникновения этого тяжелейшего осложнения беременности.
Анализ патентной и специальной литературы показал, что в настоящее время существует огромное число способов диагностики и прогнозирования степени тяжести гестоза. Условно их можно разделить на четыре типа: способы, основанные на проведении физиологических тестов; способы, основанные на проведении морфологических исследований; способы, основанные на иммунологических методах исследования, и способы, основанные на исследовании биохимических показателей беременной женщины (Орлов А.В., патент РФ №2249212, 2005 г., Ростовский НИИ акушерства и педиатрии МЗ РФ).
В качестве примера физиологических тестов можно привести способ доклинической стадии гестоза с хроническим пиелонефритом, при котором методом ультразвуковой допплерометрии на основании увеличения систолодиастолического отношения (СДО) в артериях паренхимы почки в 17-21 неделю диагностируют доклиническую стадию гестоза (Патент РФ №98111316, 2000 г., Пожидаев В.В., Быстрицкая Т.С.). Существует способ диагностики гестозов беременных путем проведения газоразрядной визуализации пальцев руки, и при увеличении биосекториальной площади печени справа до 1600 мм2 и более и уменьшении секториальной площади почек слева до 1400 мм2 и менее устанавливается нетипично протекающий гестоз (Патент РФ №2217054, 2003 г., Иркутский государственный институт усовершенствования врачей). Известен способ доклинического прогнозирования развития гестоза у беременных путем определения диаметров артериол dA и венул dV в мм методом бульбарной биомикроскопии, и при соотношении dA/dV меньше 0,5 прогнозируется развитие гестоза (Патент РФ №2207798, 2003 г. Дальневосточный государственный медицинский университет).
Способы, основанные на морфологических методах исследований. Известен способ диагностики гестоза по оценке адренореактивности эритроцитов беременных женщин (патент РФ №2138805, 1999 г. Кировский государственный медицинский институт). Существует способ прогнозирования гестоза у женщин, перенесших тяжелый гестоз в результате проведения пункционной биопсии почки, и при наличии в стенке сосудов и в капиллярах клубочков ее отложений иммуноглобулинов классов G, и/или М, и/или А со средней или выраженной степенью флюоресценции прогнозируют повторное развитие тяжелой формы гестоза (патент РФ №2239839, 2004 г. Научный центр акушерства, гинекологии и перинатологии РАМН).
Способы, основанные на иммунологических методах исследования. Существует способ доклинической диагностики гестоза, основанный на определении антифосфолипидных антител в сыворотке крови в сроке 13-14 недель беременности (патент РФ №2135999, 1999 г. Научный центр акушерства, гинекологии и перинатологии РАМН). Известен способ прогнозирования возникновения и развития гестоза в третьем триместре беременности в результате исследования наиболее информативных показателей иммунного статуса (фагоцитарное число, показатель спонтанного НСТ-теста моноцитов, количество натуральных киллеров CD16+CD56+, количество Т-хелперов CD4+, уровень низкомолекулярных ЦИК) (патент РФ №2279085, 2006 г. Уральский НИИ охраны материнства и младенчества). Известен способ прогнозирования гестоза на основе определения концентрации антител к нейроспецифической енолазе и глиофибриллярно-кислому протеину в сыворотке крови беременных (патент РФ №2287823, 2006 г. Государственное образовательное учреждение высшего профессионального образования Московская медицинская академия им. И.М.Сеченова).
Способы, основанные на исследовании биохимических показателей. Известен способ прогнозирования позднего токсикоза беременных путем определения уровней липидов и фосфолипидов в критические для беременности сроки, показатели которых повышаются при токсикозе беременности (авторское свидетельство №1572534, 1990 г., Муратова P.M., Краснопольский В.И., Юрьева Э.А., Алексеева Н.В., Воздвиженская Е.С.). В патенте РФ №2133037, 1999 г., предлагается определение в плазме крови активности катепсина G, что дает возможность диагностировать гестоз (Гребенкин Б.Е.). В патенте РФ №2138817, 1999 г., для диагностики позднего гестоза беременных определяют количество слюно-спермального глобулина в слюне беременных женщин в период с 28 недельного срока, и при его содержании, равном или более 128 мкг/мл, диагностируют поздний гестоз беременных (Ивановский научно-исследовательский институт материнства и детства). В патенте РФ №2263913, 2005 г., в сроке 6-13 недель гестации в периферической венозной крови определяют активность катепсина D, и при его значении, равном или более 0,021 ед. акт. ф/ч, прогнозируют развитие гестоза в 3 триместре (Государственное учреждение "Ивановский научно-исследовательский институт материнства и детства им. В.Н.Городкова" Минздрава России). Известен способ определения степени тяжести гестоза, который заключается в изучении показателей содержания прокальцитонина в сыворотке крови у беременной (патент РФ №2342666, 2008 г. Государственное образовательное учреждение высшего профессионального образования "Пермская государственная медицинская академия имени академика Е.А.Вагнера Федерального агентства по здравоохранению и социальному развитию"). Известен способ прогнозирования акушерской патологии на основе определения содержания в сыворотке крови в первом триместре беременности женщины фактора роста плаценты и сосудисто-эндотелиального фактора роста. Рассчитывают коэффициент их соотношения. При его величине, равной 2, прогнозируют синдром задержки роста плода (СЗРП). При величине, равной 3, прогнозируют гестоз. При его величине, равной 4, - преждевременные роды (патент РФ №2339954, 2008 г., ФГУ Ростовский НИИ акушерства и педиатрии Федерального агентства по здравоохранению и социальному развитию).
Основным недостатком всех вышеперечисленных методов является невозможность диагностики и прогнозирования развития гестозов еще до наступления беременности. Кроме того, выявляют последствия, которые могут уже проявляться на самых ранних сроках, а не причину возникновения гестоза.
В нашем изобретении мы останавливаемся на генетических дефектах как факторах риска гестоза. Выявлено большое число генетических маркеров гестоза. Вместе с тем, анализ патентной литературы показал, что до сих пор не предложен способ прогнозирования гестоза на основе генетических исследований, то есть способа-аналога нет.
Однако существуют способы прогнозирования и оценки риска развития ряда других заболеваний человека, основанные на исследовании соответствующих генов предрасположенности. Известен способ определения генетической предрасположенности к онкологическим заболеваниям мочеполовой системы. Способ осуществляется следующим образом. Проводят исследование гена GP3a, при этом при обнаружении в нем сочетания аллелей PL-A1 и PL-A2 устанавливают предрасположенность к онкологическим заболеваниям, в том числе к инвазивным и метастатическим формам. А исследования гена GP3a осуществляют путем выделения ДНК методом полимеразной цепной реакции, причем ген исследуют в сухой капле крови на бумажном носителе и в качестве праймеров для полимеразной цепной реакции используют 5′gctccaatgtacggggtaaa и 5′ctcctcagacctccaccttg, синтезируют ДНК-продукт длиной 384 нуклеотидных пары, который расщепляют рестриктазой Mspl, образуя фрагменты ДНК, при этом идентифицируют аллель PL-A1 по фрагментам длиной 290 и 80 нуклеотидных пар, а аллель PL-A2 по фрагментам длиной 175, 120 и 80 нуклеотидных пар (патент РФ №2280079, 2006 г. Серегин А.А.)
Недостатком данного способа является неприменимость конкретного метода для диагностики и прогнозирования гестоза, он по совокупности существенных признаков выбран нами в качестве прототипа.
В основу изобретения положена задача разработки способа прогнозирования риска развития гестоза на основе генетических маркеров, позволяющего оценить риск его возникновения как у беременных женщин, так и у женщин, только планирующих беременность.
Технический результат изобретения основан на прогнозировании риска развития заболевания в результате исследования методом ПЦР с дальнейшей обработкой эндонуклеазами рестрикции участков генов MTHFR и РАI1.
Достижение технического результата обеспечивается тем, что в способе прогнозирования риска развития гестоза на основе генетических маркеров, включающем выделение геномной ДНК обследуемого, проведение ПЦР-исследования участков генов MTHFR и РАI1 путем смешивания компонент и добавления олигопраймеров с последующим анализом полиморфизма длин рестрикционных фрагментов и визуализацией электрофореграммы в полиакриламидном геле, для амплификации с целью исследования участка гена MTHFR используют праймеры CCAGTCCCTGTGGTCTCTTCAT (прямой) и AGGGAGCTTATGGGCTCTCCT (обратный); с целью исследования участка гена РАI1 используют праймеры CAGAGAGAGTCTGGCcACGT (прямой) и CGTGATTGTCTAGGTTTTGTCTGTCTAGG (обратный), и при выявлении генотипов MTHFR 677Т/Т и/или РАI1 -675 4G/4G прогнозируют риск развития гестоза.
Использование специфических праймеров позволяет провести амплификацию указанных генов, что в свою очередь необходимо для выявления генотипов, связанных с риском развития гестоза.
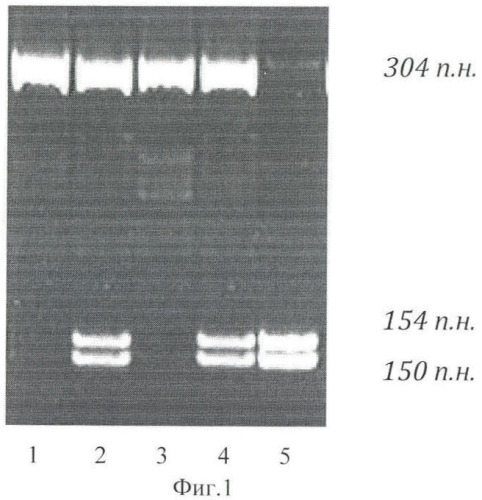
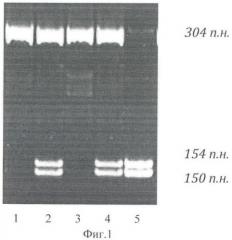
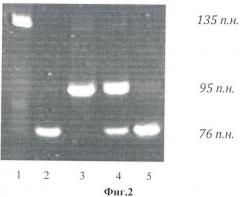
Изобретение поясняется фиг.1, на которой представлена электрофореграмма результата обработки эндонуклеазой рестрикции HinFI ПЦР-продуктов гена MTHFR, и фиг.2, на которой представлена электрофореграмма результата обработки эндонуклеазой рестрикции Bsc4 I ПЦР-продуктов гена PAI1.
Способ осуществляется следующим образом.
1. Сбор биологического материала для генетического исследования
Генетическое тестирование в первую очередь необходимо женщинам, планирующим первую беременность, женщинам, планирующим беременность с гестозом в анамнезе, беременным женщинам вне зависимости от срока беременности.
Материалом для генетического исследования может быть кровь, буккальный эпителий, полученные от обследуемого пациента.
2. Выделение ДНК из полученного материала
На сегодняшний день известно множество способов выделения ДНК. В последнее время широкое распространение получили методы, позволяющие экстрагировать высокоочищенную ДНК, а также автоматизировать процесс ее выделения. Это - широкий спектр коммерческих наборов реагентов, производимых американскими и европейскими компаниями.
ДНК может быть выделена самыми разнообразными способами в зависимости от того, какой был взят биоматериал
- классическими методами:
с использованием протеиназы К с последующей депротеинизацией либо фенольным методом, либо солевым методом;
- с помощью коммерческих наборов
- автоматически (с помощью специальных роботов и специальных наборов).
3. Исследование участков генов MTHFR и PAI1.
Можно использовать самые разнообразные молекулярно-генетические методы: анализ полиморфизма длин рестрикционных фрагментов после полимеразной цепной реакции (ПЦР-ПДРФ), ПЦР с использованием аллель-специфичных праймеров (ПЦР-АСП), метод "обратной дот-блот-гибридизации" (ПЦР-АСО), ПЦР в реальном времени, анализ конформации одноцепочечных фрагментов (SSCP), масс-спектрометрические методы, биочипы и многие др. Использовать метод детекции мутаций без предварительной амплификации непосредственно на геномной ДНК (инвазивное расщепление олигонуклеотидов (Invader)).
Для получения специфических продуктов ПЦР подбирают праймеры. Их разрабатывают согласно общепринятым критериям.
В качестве праймеров для проведения полимеразной цепной реакции используют уникальные последовательности, приведенные ниже:
а) для исследования участка гена MTHFR:
Праймеры:
Прямой F: CCAGTCCCTGTGGTCTCTTCAT
Обратный R: AGGGAGCTTATGGGCTCTCCT
б) для исследования участка гена РАI1:
Прямой F: CAGAGAGAGTCTGGCcACGT
Обратный R: CGTGATTGTCTAGGTTTTGTCTGTCTAGG
После подбора праймеров проводят амплификацию. Причем температура отжига праймеров одинакова для обоих ПЦР (она составляет 58-60°С).
Существуют разнообразные химические подходы к синтезу олигонуклеотидных праймеров, например фосфодиэфирный метод, гидрофосфорильный метод и т.д., но наибольшее распространение в настоящее время имеет фосфорамидитный метод. Синтез праймеров осуществляют, используя автоматические ДНК/РНК синтезаторы, например, (без ограничения) производства фирмы Applied Biosystems (США).
Непосредственно полимеразная цепная реакция может быть проведена с использованием любого вида термостабильной полимеразы, работающей в соответствующем буфере. Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ) в принятых концентрациях. Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты за исключением праймеров.
Проведение реакции позволяет наработать достаточное количество ПЦР-продукта для дальнейшего анализа рестрикцией.
Непосредственно рестрикция эндонуклеазами может быть проведена с использованием определенных ферментов, способных «расщеплять» ПЦР-продукты в определенных сайтах (указанных ниже), которые работают в соответствующих буферах и при соответствующих условиях, рекомендованных производителями. Для рестрикции могут быть использованы ферменты разных производителей.
а) для исследования участка гена MTHFR:
Рестриктаза HinFI (сайт G|ANTC)
б) для исследования участка гена PAI1:
Bsc4 I (сайт CCNNNNN↓NNGG)
После обработки эндонуклеазами рестрикции проводят детекцию фрагментов ДНК в полиакриламидном или ином гелях разной процентности, рекомендованной для разделения соответствующих ПЦР-продуктов. Подтверждением результата прохождения ферментативного гидролиза служат наличие соответствующих бэндов.
При анализе гена MTHFR можно выявить три фрагмента длиной 304 п.н., 154 п.н., 150 п.н., соответствующие разным генотипам. О наличии генотипа Т/Т в исследуемом образце судят по наличию на двух фрагментов длиной 154 п.н., 150 п.н.
При анализе гена PAI1 можно выявить четыре фрагмента длиной 95 п.н., 76 п.н., 40 п.н., 21 п.н., соответствующие разным генотипам. О наличии генотипа 4G/4G в исследуемом образце судят по наличию на двух фрагментов длиной 95 п.н., 40 п.н.
4. Прогнозирование риска развития гестоза
При выявлении генотипов MTHFR 677T/T и/или PAI1 -675 4G/4G прогнозируют риск развития гестоза.
Изобретение подтверждается примерами конкретного осуществления способа.
Пример 1. Использование предложенного способа для выявления риска гестоза.
У группы беременных женщин берут венозную кровь (2-5 мл), которую добавляют в пробирки с ЭДТА. Далее, из лейкоцитов периферической крови стандартным методом выделяют ДНК.
Для каждого из образцов ДНК готовят две ПЦР смеси в пробирках объемом 25 мкл (соответствующие двум генам). Состав смеси следующий: 67 мМ трис-HCl, рН 8,8 при 25°С; 16,6 мМ (NH4)2SO4; 6,7 мМ MgCl2; 6,7 мкм ЭДТА; 10 мМ 2-меркаптоэтанола, 170 мкг БСА, смесь четырех основных dNTP в концентрации 0,8 мМ каждого, термостабильная ДНК-полимераза 0,5 ед./мкл и праймеры по 10 пмоль каждого. В каждую пробирку вносят по 1 мкл ДНК. Всю смесь нагревают при 95°С в течение 5 мин, затем проводят 35 циклов амплификации с использованием любого отечественного и зарубежного термоциклера по следующей схеме: 95°С - 30 сек, 60°С - 30 сек, 72°С - 1 мин. Завершающая инкубация: 72°С - 5 мин.
Далее выполняют идентификацию продуктов, используя электрофоретическое разделение продуктов ПЦР в 6% полиакриламидном геле (ПААГ), приготовленном на десятикратном трис-боратном буфере в аппарате для вертикального электрофореза с длиной стекла 20-22 см. Для приготовления 40 мл 6% геля смешивают: 8 мл 30% р-р акриламида (29 г акриламида; 1 г N,N метилен-бисакриламида на 100 мл водного раствора), 4 мл 10× ТБЕ (89 мМ трис-борат (рН 8,3-8,6), 2 мМ ЭДТА), 28 мл дистиллированной воды, 40 мкл тетраэтилендиамина (TEMED), 400 мкл персульфата аммония (PSA). Перед заливкой раствор тщательно перемешивают. После амплификации непосредственно к аликвотам реакционной смеси (~10 мкл) добавляют буфер для нанесения проб (~2 мкл) и проводят электрофорез (шестикратный буфер для нанесения проб состоит из 0,25% бромфенола, 0,25% ксиленцианола и 15% фикола). Электрофорез проводят при напряжении 100 В до тех пор, пока образец не входит в гель и не проходит около 1 см от начала лунок. В дальнейшем напряжение увеличивают до 300 В. Остановку электрофореза проводят за 1 см до выхода бромфенола из геля. Затем гель окрашивают в водном растворе этидиум-бромида (0,5 мкг/мл), а визуализацию результатов проводят в проходящем ультрафиолетовом свете на трансиллюминаторе Macrovue (LKB, Великобритания).
При подтверждении результата прохождения амплификации, по наличию соответствующих бэндов (полос) (для гена MTHFR - 304 п.н., для гена PAI1 - 135 п.н.) получившийся продукт ПЦР подвергают ферментативному гидролизу по схеме (на одно исследование):
А) в пробирку №1 (ген MTHFR)
- 0,5 мкл эндонуклеазы рестрикции HinFI (Fermentas)
- 1,5 мкл буфер R (Fermentas)
- 8 мкл воды
- 5 мкл продукта мультиплексной ПЦР.
Б) в пробирку №2 (ген PAI1)
- 0,5 эндонуклеазы рестрикции мкл Bsc4 I (Sibenzyme)
- 1,5 мкл буфер W (Sibenzyme)
- 8 мкл воды
- 5 мкл продукта мультиплексной ПЦР.
Гидролиз проводят в течение 12 часов при температуре 37°С. Данные эндонуклеазы рестрикции расщепляют специфическую последовательность ДНК или же этого не происходит.
Затем проводят электрофорез в 8% полиакриламидном геле. Определяемые мутации, количество и размер визуализируемых фрагментов приведены на фиг.1 и 2.
На фиг.1 представлена электрофореграмма результата обработки эндонуклеазой рестрикции HinFI ПЦР-продуктов гена MTHFR.
Справа указаны размеры амплифицированного участка в нуклеотидных парах. Снизу указаны номера дорожек на электрофорезе.
Дорожка 1 - соответствует наличию генотипа С/С по гену MTHFR.
Дорожка 2 - соответствует наличию генотипа С/Т по гену MTHFR.
Дорожка 3 - соответствует наличию генотипа С/С по гену MTHFR.
Дорожка 4 - соответствует наличию генотипа С/Т по гену MTHFR.
Дорожка 5 - соответствует наличию генотипа Т/Т по гену MTHFR.
При выявлении генотипов MTHFR только для образца 5 прогнозируют риск развития гестоза.
На фиг.2 представлена электрофореграмма результата обработки эндонуклеазой рестрикции Bsc4 I ПЦР-продуктов гена PAI1.
Справа указаны размеры амплифицированного участка в нуклеотидных парах. Снизу указаны номера дорожек на электрофорезе. Бенды, соответствующие фрагментам в 40 и 21 п.н. не приведены (так как не несут информативной значимости).
Дорожка 1 - соответствует ПЦР продукту гена PAI1.
Дорожка 2 - соответствует наличию генотипа 5G/5G по гену PAI1.
Дорожка 3 - соответствует наличию генотипа 4G/4G по гену PAI1.
Дорожка 4 - соответствует наличию генотипа 5G/4G по гену PAI1.
Дорожка 5 - соответствует наличию генотипа 5G/5G по гену PAI1.
При выявлении генотипов PAI1 только для образца 3 прогнозируют риск развития гестоза.
Предлагаемый способ основан на генетическом исследовании, прост в исполнении, не требует дорогостоящего оборудования
Предлагаемый способ может быть применен в таких медицинских организациях, как медико-генетические лаборатории, родильные дома, женские консультации, организации, осуществляющие комплексное медицинское обслуживание, поликлиники и др.
Способ имеет важное практическое значение, так как позволяет начать терапевтические и профилактические мероприятия на самых ранних сроках или еще до наступления беременности, направленные на снижение частоты такого социально-значимого заболевания, как гестоз.
Способ прогнозирования риска развития гестоза на основе генетических маркеров, включающий выделение геномной ДНК обследуемой женщины, проведение ПЦР-исследования участков генов MTHFR и РАН путем смешивания компонент и добавления олигопраймеров с последующим анализом полиморфизма длин рестрикционных фрагментов и визуализацией электрофореграммы в полиакриламидном геле, отличающийся тем, что для амплификации с целью исследования участка гена MTHFR используют прямой праймер CCAGTCCCTGTGGTCTCTTCAT и обратный праймер AGGGAGCTTATGGGCTCTCCT; с целью исследования участка гена РАН используют прямой праймер CAGAGAGAGTCTGGCCACGT и обратный праймер CGTGATTGTCTAGGTTTTGTCTGTCTAGG и при выявлении генотипов MTHFR 677Т/Т и/или РАН -675 4G/4G прогнозируют риск развития гестоза.