Новые комбинации нерамексана для лечения нейродегенеративных расстройств
Иллюстрации
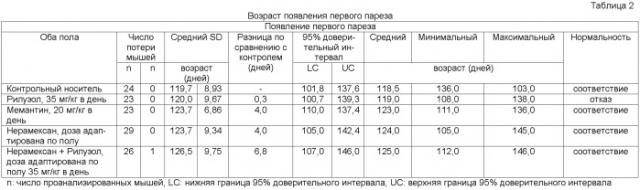
Показать всеИзобретение относится к применению нерамексана или его фармацевтически приемлемой соли в комбинации с ингибитором выброса глутамата для лечения нейродегенеративных расстройств, а также эмоциональной лабильности и псевдобульбарного аффекта, связанных с нейродегенеративными расстройствами. Ингибитор выброса глутамата выбран из рилузола и его фармацевтически приемлемых солей. Нейродегенеративное расстройство представляет собой заболевание моторного нейрона. Лечение комбинацией нерамексана с рилузолом обеспечивает ослабление прогрессирования нейродегенеративного заболевания, которое превосходит ослабление, обусловленное лечением только рилузолом. 4 н. и 31 з.п. ф-лы, 4 табл.
Реферат
Область техники, к которой относится изобретениe
Изобретение относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), а также к применению таких комбинаций в лечении нейродегенеративных расстройств.
Уровень техники изобретения
Глутамат является главным возбуждающим медиатором в ЦНС, а глутаматэргическая дисфункция вовлечена в острую нейродегенерацию (например, удар и травму), хроническую нейродегенерацию (например, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, боковой амиотрофический склероз (ALS)) и в симптоматологию многих неврологических и психиатрических расстройств (например, эпилепсии, болезни Паркинсона, наркотической зависимости, депрессии, тревоги и хронической боли).
Эксайтотоксичность дает вклад в нейронную дегенерацию при многих заболеваниях ЦНС, включая ишемию, травму и эпилепсию, а также такие хронические заболевания, как болезнь Альцгеймера (AD), болезнь Паркинсона и боковой амиотрофический склероз (ALS). Глутамат активирует постсинаптические рецепторы, включая ионотропный рецептор N-метил-D-аспартата (NMDA). Была выдвинута гипотеза о том, что избыточная активация рецепторов NMDA играет ключевую роль в развитии нейродегенеративных расстройств [Krieger et al., C. Trends Pharmacol. Sci, 1996, 17, 114-120; Danysz et al., Neurotox Res, 2002, 4, 119-126; Arundine and Tymianski, Cell Calcium, 2004, 34, 325-337].
Болезни моторного нейрона представляют собой нейродегенеративные расстройства, которые связаны с прогрессирующей потерей моторных нейронов. Примеры болезней моторного нейрона включают боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Было высказано предположение о том, что перспективным подходом для терапии нейродегенеративных заболеваний является применение таких ингибиторов выброса глутамата (GRI), как рилузол, ламотригин, фосфенитоин, габапентин, прегабалин и лубелузол. Считается, что эффективность GRI при лечении нейродегенеративных заболеваний связана со способом их действия, а именно с блокадой глутаматной трансмиссии прежде, чем она станет нейротоксической, или с воспрепятствованием нейронным разрядам во время судорожных припадков [Benismon et al., N Engl J Med, 1994, 330, 585-591; Lacomblez et al., Lancet, 1996, 347, 1425-1431].
Боковой амиотрофический склероз (ALS) затрагивает верхние и нижние моторные нейроны. Заболевание встречается в спорадической и генетической формах, которые клинически неразличимы. Механизм, лежащий в основе характерной селективной дегенерации и гибели моторных нейронов при этом частом заболевании моторных нейронов у взрослых, неизвестен, однако одной из ведущих гипотез селективной гибели моторных нейронов является опосредованная глутаматом эксайтотоксичность [Rothstein, et al., Clin. Neurosci, 1995, 3, 348-359].
Рилузол, также известный как 2-амино-6-трифторметоксибензотиазол или 6-(трифторметокси)бензотиазол-2-амин, является единственным официально разрешенным к применению лекарством для лечения бокового амиотрофического склероза (ALS) и в настоящее время выпускается фирмой Sanofi Aventis под торговым названием RILUTEK®. Рилузол демонстрирует улучшение бульбарной функции и функции конечностей, а также лишь небольшое, хотя и статистически значимое улучшение времени выживания (т.е. до 90 дней по сравнению с плацебо). Таким образом, имеется потребность в улучшении лекарственной терапии при ALS.
Приблизительно в 20% случаев ALS имеет моногенную природу и наследуется по аутосомно-доминантному типу (семейный ALS - fALS). Самой частой причиной fALS являются точковые мутации в гене, кодирующем супероксиддисмутазу 1 (SOD1), фермент, ответственный за утилизацию супероксидных ионов [Rosen et al., Nature. 1993; 362(6415):59-62].
Патологическими признаками ALS является дегенерация нижних моторных нейронов в стволовой части головного мозга и спинном мозге, а также верхних моторных нейронов в двигательной области коры головного мозга и пирамидных путях, сопровождающаяся реактивным глиозом. Точный патогенный механизм, лежащий в основе селективной гибели моторных нейронов при ALS, еще не выяснен, хотя и было предположено множество возможных механизмов спорадического ALS и ALS, связанного с SOD1 [Van Damme et al., Neurodegenerative Dis. 2005; 2:147-159].
Избыточная экспрессия мутаций гена SOD1 у мышей и крыс имитирует клинические и патологические признаки ALS у человека (нейроны дегенерируют, и животные погибают вскоре после появления симптомов). Для развития ALS-подобных фенотипов у мышей при короткой продолжительности жизни требуется высокий уровень РНК SOD1. Ключевую роль в понимании патогенеза ALS и в тестировании новых терапевтических вмешательств, направленных на защиту от нейродегенерации, играют экспериментальные модели ALS [Gurney, N Engl. J Med. 1994 Dec 22; 331(25):1721-2; Dal Canto et al., Am J Pathol. 1994 Dec; 145(6):1271-9]. Трансгенная мышь SOD1(G93A) представляет одну из наиболее частых моделей, используемых для исследования терапевтических вмешательств [Julien, Drug Discovery Today: Dis. Models Winter 2006; 3(4):331-339)].
Механизмы и процессы, ответственные за селективную утрату моторных нейронов, еще неизвестны и вполне могут быть мультифакториальными. Одной из ведущих гипотез селективной гибели моторных нейронов является эксайтотоксичность, опосредованная глутаматом [Rothstein et al., Ann. Neurol. 1990, 28, 18-25; Rothstein, Clinical Neuroscience, 1995, 3, 348-359; Shaw et al., Neurol, 1997, 244, S3-S14]. Эксайтотоксичность описывает нейронную дегенерацию, индуцированную избыточной стимуляцией глутаматных рецепторов, высвобождающихся из пресинаптических окончаний. Подробную характеристику эксайтотоксических механизмов и их значения при ALS см. в ссылке Van Damme et al., Neurodegenererative Dis, 2005, 2:147-159.
В последние годы научные исследования ALS были нацелены на разработку противоэксайтотоксических соединений, таких как рилузол, которые препятствуют возбуждающей нейротрансмиссии [Ludolph et al., J Neural Transm, 1999 [Suppl] 55:79-95].
Ведущим механизмом нейронной дегенерации в широком спектре неврологических расстройств, по-видимому, является избыточная активация рецепторов N-метил-D-аспартата (NMDA) [Lipfon, et al., N Engl. J Med, 1994 Mar 3, 330(9):613-22].
Мемантин, неконкурентный антагонист рецептора NMDA, продемонстрировал положительные эффекты на мышиной модели ALS SOD1(G93A) в отношении прогрессирования болезни и выживания [Wang et al., Eur J Neurosci, 2005 Nov, 22(9):2376-80].
Декстрометорфан, хорошо известный неконкурентный антагонист рецептора NMDA, продемонстрировал положительные эффекты при лечении эмоциональной лабильности и псевдобульбарных аффектов [патент США № 5206248]. Эмоциональная лабильность (EL) представляет собой заболевание центральной нервной системы, когда больной испытывает быстрые и значительные изменения настроения, которые легко провоцируются и могут быстро исчезать. Более тяжелой формой эмоциональной лабильности является псевдобульбарный аффект (PBA), при котором наблюдаются эпизоды неуправляемого смеха и/или плача, непредсказуемые и, по-видимому, имеющие лишь незначительную связь или вообще не имеющие связи с фактическими событиями или реальными ощущениями субъекта. EL и PBA связаны с нейродегенеративными расстройствами, которые могут включать, но не ограничиваясь ими, боковой амиотрофический склероз (ALS), рассеянный склероз (MS), деменции, включая болезнь Альцгеймера, болезнь Паркинсона, инсульт и травматическое повреждение головного мозга. Подробное описание PBA представлено в ссылке Schiffer and Pope [J. Neuropsychiatry Clin. Neurosci., 2005, 17(4), 447-454].
Нерамексан, также известный как 1-амино-1,3,3,5,5-пентаметилциклогексан, является членом класса орально активных 1-аминоциклогексанов и может быть полезен при терапии различных заболеваний, особенно определенных неврологических заболеваний, включая болезнь Альцгеймера и невропатическую боль. Полагают, что терапевтическое действие нерамексана связано с подавлением воздействий избыточного глутамата на рецепторы NMDA нервных клеток, и на этом основании данное соединение также классифицируется как антагонист NMDA или антагонист рецептора NMDA. Более специфически, нерамексан, по-видимому, является неконкурентным антагонистом NMDA-рецептора с аффинностью от низкой до умеренной, который, как полагают, избирательно блокирует эксайтотоксические эффекты, связанные с аномальной трансмиссией глутамата.
Сущность изобретения
Настоящее изобретение относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), а также к применению таких комбинаций в лечении нейродегенеративных расстройств.
Следующий аспект изобретения относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), а также к применению таких комбинаций в лечении эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами.
Следующий аспект изобретения относится к применению нерамексана в лечении эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами.
Следующий аспект изобретения относится к применению ингибитора выброса глутамата (GRI) в лечении эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами.
Следующий аспект изобретения относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), а также к применению таких комбинаций в лечении заболеваний моторного нейрона, включая боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Следующий аспект изобретения относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), выбранный из рилузола, RP66055, габапентина, прегабалина, ламотригина, лубелузола, фосфенитоина, сипатригина, MS-153 и FP-0011, а также к применению таких комбинаций в лечении заболеваний моторного нейрона, включая боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Следующий аспект изобретения относится к комбинациям, содержащим нерамексан и ингибитор выброса глутамата (GRI), выбранный из рилузола, RP66055, габапентина, прегабалина, ламотригина, лубелузола, фосфенитоина, сипатригина, MS-153 и FP-0011, а также к применению таких комбинаций в лечении бокового амиотрофического склероза (ALS).
Следующий аспект изобретения относится к комбинациям, содержащим нерамексан и рилузол, а также к способу лечения субъекта с диагностированным боковым амиотрофическим склерозом (ALS), включающему введение указанному субъекту эффективного количества комбинации нерамексана и рилузола.
Следующий аспект изобретения относится к применению комбинации, содержащей нерамексан и ингибитор выброса глутамата (GRI), для производства медикамента для лечения нейродегенеративных расстройств.
Следующий аспект изобретения относится к применению комбинаций, содержащих нерамексан и ингибитор выброса глутамата (GRI), для производства медикамента для лечения заболеваний моторного нейрона, включая боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Следующий аспект изобретения относится к применению комбинаций, содержащих нерамексан и ингибитор выброса глутамата (GRI), выбранный из рилузола, RP66055, габапентина, прегабалина, ламотригина, лубелузола, фосфенитоина, сипатригина, MS-153 и FP-0011, для производства медикамента для лечения заболеваний моторного нейрона, включая боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Следующий аспект изобретения относится к применению комбинации, содержащей нерамексан и ингибитор выброса глутамата (GRI), выбранный из рилузола, RP66055, габапентина, прегабалина, ламотригина, лубелузола, фосфенитоина, сипатригина, MS-153 и FP-0011, для производства медикамента для лечения бокового амиотрофического склероза (ALS).
Следующий аспект изобретения относится к применению комбинации, содержащей нерамексан и рилузол, для производства медикамента для лечения субъекта с диагностированным боковым амиотрофическим склерозом (ALS).
Следующий аспект изобретения относится к способу лечения нейродегенеративного расстройства у нуждающегося в этом субъекта, причем указанный способ включает введение первого количества нерамексана и второго количества ингибитора выброса глутамата, а первое и второе количество в комбинации эффективны для лечения нейродегенеративного расстройства.
Следующий аспект изобретения относится к такому способу, в котором ингибитор выброса глутамата выбирают из рилузола, RP66055, габапентина, прегабалина, ламотригина, лубелузола, фосфенитоина, сипатригина, MS-153 и FP-0011.
Следующий аспект изобретения относится к такому способу, в котором нейродегенеративное расстройство представляет собой заболевание моторного нейрона.
Следующий аспект изобретения относится к такому способу, в котором заболевание моторного нейрона представляет собой боковой амиотрофический склероз.
Следующий аспект изобретения относится к способу лечения бокового амиотрофического склероза у нуждающегося в этом субъекта, причем указанный способ включает введение первого количества нерамексана и второго количества рилузола, а первое и второе количество в комбинации эффективны для лечения бокового амиотрофического склероза.
Следующий аспект изобретения относится к способу лечения эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами, у нуждающегося в этом субъекта, причем указанный способ включает введение первого количества нерамексана и второго количества ингибитора выброса глутамата (GRI), а первое и второе количество в комбинации эффективны для лечения эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами.
Следующий аспект изобретения относится к способу лечения эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами, у нуждающегося в этом субъекта, причем указанный способ включает введение терапевтически эффективного количества нерамексана.
Следующий аспект изобретения относится к способу лечения эмоциональной лабильности (EL) и/или псевдобульбарных аффектов (PBA), связанных с нейродегенеративными расстройствами, у нуждающегося в этом субъекта, причем указанный способ включает введение терапевтически эффективного количества ингибитора выброса глутамата (GRI).
Дополнительный аспект изобретения относится к фармацевтической композиции для лечения нейродегенеративных расстройств, содержащей терапевтически эффективное количество комбинации нерамексана и ингибитора выброса глутамата (GRI), а также, по меньшей мере, один фармацевтически приемлемый наполнитель.
Следующий аспект изобретения относится к фармацевтической композиции для лечения заболеваний моторного нейрона, включая боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию, причем указанная композиция содержит терапевтически эффективное количество комбинации нерамексана и ингибитора выброса глутамата (GRI), включая рилузол, RP66055, габапентин, прегабалин, ламотригин, лубелузол, фосфенитоин, сипатригин, MS-153 и FP-0011, а также, по меньшей мере, один фармацевтически приемлемый наполнитель.
Следующий аспект изобретения относится к фармацевтической композиции для лечения бокового амиотрофического склероза (ALS), содержащей терапевтически эффективное количество комбинации нерамексана и рилузола, а также, по меньшей мере, один фармацевтически приемлемый носитель или наполнитель.
Следующий аспект изобретения относится к фармацевтической композиции для лечения бокового амиотрофического склероза (ALS), содержащей терапевтически эффективное количество комбинации нерамексана и рилузола в рецептурном составе с быстрым или модифицированным высвобождением.
Подробное описание изобретения
Термин "комбинация" применительно к активным ингредиентам используется для определения единой фармацевтической композиции (препаративной формы), содержащей два активных агента (например, фармацевтическая композиция, содержащая нерамексан и рилузол), или двух раздельных фармацевтических композиций, каждая из которых содержит активный агент (например, фармацевтическая композиция, содержащая нерамексан или рилузол) и которые вводятся совместно.
В смысловых пределах настоящего изобретения термин "совместное введение" используется для ссылки на введение нерамексана и GRI (например, рилузола) одновременно в одной композиции, одновременно в разных композициях или последовательно. Однако для того чтобы последовательное введение можно было считать совместным, нерамексан и второй активный агент должны быть введены раздельно, но с таким интервалом по времени, который все-таки позволяет добиться результирующего полезного эффекта в лечении нейродегенеративного расстройства (например, бокового амиотрофического склероза (ALS)) у млекопитающего.
Термин "лечить" используется здесь для обозначения устранения или облегчения у субъекта, по меньшей мере, одного симптома заболевания. В смысловых пределах настоящего изобретения термин "лечить" также обозначает задержку, отсрочку начала (то есть период перед клинической манифестацией заболевания) и/или снижение риска прогрессирования или ухудшения заболевания.
Термин "болезни моторного нейрона" включает боковой амиотрофический склероз (ALS), индуцированный вирусом полиомиелит, латиризм, первичный боковой склероз, прогрессирующую мышечную атрофию, псевдобульбарный паралич, прогрессирующий бульбарный паралич, прогрессирующий супрануклеарный паралич, болезнь Кеннеди и спинальную мышечную атрофию.
Нерамексан (1-амино-1,3,3,5,5-пентаметилциклогексан) раскрыт в патентах США №№ 6034134 и 6071966, содержание которых включено в описание в качестве ссылки. Согласно изобретению нерамексан может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на нерамексан в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Термин "ингибитор выброса глутамата (GRI)" включает рилузол, RP66055, габапентин, прегабалин, ламотригин, лубелузол, фосфенитоин, сипатригин, MS-153 и FP-0011.
Рилузол (2-амино-6-трифторметоксибензотиазол или 6-(трифторметокси)бензотиазол-2-амин) раскрыт в патенте США № 4370338, содержание которого включено в описание в качестве ссылки. Согласно изобретению рилузол может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на рилузол в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
RP66055 (3-{2-[1-(4-фторфенил-пиперизинил)]этил}-2-имино-6-трифторметоксибензотиазолин) раскрыт в ссылке Jimonet et al., Bioorg Med. Chem, 1994 2:793-8. Согласно изобретению RP66055 может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на RP66055 в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Габапентин (2-[1-(аминометил)циклогексил]уксусная кислота) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на габапентин в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Прегабалин ((S)-3-(аминометил)-5-метилгексаноевая кислота) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на прегабалин в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Ламотригин (6-(2,3-дихлорфенил)-1,2,4-триазин-3,5-диамин) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на ламотригин в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Лубелузол ((S)-4-[(2-бензотиазолил)метиламино]-α-[(3,4-дифтор-фенокси)метил]-1-пиперидинэтанол) раскрыт в патенте США № 5434168. Согласно изобретению лубелузол может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на лубелузол в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Фосфенитоин (2,5-диоксо-4,4-дифенил-имидазолидин-1-ил)метоксифосфоновая кислота) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на фосфенитоин в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Сипатригин (2-(4-метилпиперазин-1-ил)-5-(2,3,5- трихлорфенил)пиримидин-4-амин) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на сипатригин в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
MS-153 ((R)-(-)-5-метил-1-никотиноил-2-пиразолин) согласно изобретению может применяться в виде любой из его фармацевтически приемлемых солей, сольватов, изомеров, конъюгатов, пролекарств, метаболитов и производных, причем любые ссылки на MS-153 в этом описании следует понимать как относящиеся также к указанным солям, сольватам, изомерам, конъюгатам, пролекарствам, метаболитам и производным.
Фармацевтически приемлемые соли включают, но не ограничиваясь ими, такие кислотно-аддитивные соли, как соли, полученные посредством добавления соляной, метилсульфоновой, бромисто-водородной, йодисто-водородной, хлорной, серной, азотной, фосфорной, уксусной, пропионовой, гликолевой, молочной, пировиноградной, малоновой, янтарной, фумаровой, винной, лимонной, бензойной, угольной, коричной, миндальной, метансульфоновой, этансульфоновой, гидроксиэтансульфоновой, бензолсульфоновой, п-толуолсульфоновой, циклогексансульфаминовой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетилсалициловой кислоты. Все указанные соли (или другие аналогичные соли) могут быть приготовлены традиционными способами. Природа соли не имеет принципиального значения при том условии, что она нетоксична и существенно не нарушает желательную фармакологическую активность.
Термин "аналог" или "производное" используется здесь в общепринятом фармацевтическом смысле для обозначения молекулы, которая структурно сходна с эталонной молекулой (такой как нерамексан или рилузол), но была модифицирована целенаправленным и управляемым способом для замены одного или более специфических заместителей в эталонной молекуле на альтернативный заместитель, посредством чего создается молекула, которая структурно сходна с эталонной молекулой. Синтез и скрининг аналогов (например, с применением структурного и/или биохимического анализа) для идентификации незначительно модифицированных вариантов известного соединения, которые могут обладать улучшенными или смещенными свойствами (например, повышенной мощностью и/или избирательностью по отношению к специфическому целевому типу рецептора, большей способностью проходить через гематоэнцефалические барьеры млекопитающих, менее выраженными побочными эффектами и т.д.), представляют собой такой подход к конструированию лекарств, который хорошо известен в фармацевтической химии.
Термин "терапевтически эффективный" применительно к дозе или величине означает такое количество соединения или фармацевтической композиции, которое достаточно для достижения желательной активности при введении нуждающемуся в лечении млекопитающему.
Термин "подпороговый" относится к такому количеству активного ингредиента, которое недостаточно для вызова реакции, то есть к количеству, не достигающему минимально эффективного количества, если активный ингредиент используется в виде монотерапии.
Термин "субоптимальный" в том же контексте означает количество активного ингредиента, вызывающее реакцию, но не в ее полном объеме, которого можно достичь при увеличении количества.
Термин "аддитивный" относится к сочетанному эффекту при введении двух соединений, когда общая реакция равна или приблизительно равна сумме реакций при введении указанных соединений в виде монотерапии.
Термин "синергический" относится к сочетанному эффекту при введении двух терапевтических соединений, когда общая реакция превышает сумму двух индивидуальных эффектов. Термин «синергия» также относится к сочетанному эффекту при введении определенного количества одного соединения, которое при введении в виде монотерапии не вызывает заметной реакции, но при введении в комбинации с другим терапевтическим соединением вызывает общую реакцию, которая превышает реакцию, вызванную только вторым соединением.
Терминологическое определение "фармацевтически приемлемый" при использовании в связи с предлагаемыми изобретением композициями относится к молекулярным сущностям и другим ингредиентам таких композиций, которые физиологически переносимы и в типичном случае не вызывают нежелательных реакций при введении млекопитающему (например, человеку). Термин "фармацевтически приемлемый" также может означать лекарственное средство, разрешенное регулирующим ведомством федеральной или региональной (на уровне штата) администрации, либо перечисленное в фармакопее США или в других общепризнанных фармакопеях как средство, применяемое для лечения млекопитающих и, более конкретно, человека.
Термин "носитель" применительно к предлагаемым изобретением композициям относится к разбавителю, наполнителю или переносчику, вместе с которым вводится активное соединение (например, нерамексан). Такие фармацевтические носители могут представлять собой стерильные жидкости, например воду, солевые растворы, водные растворы декстрозы, водные растворы глицерина и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. масла. Пригодные фармацевтические носители описаны в ссылке "Remington's Pharmaceutical Sciences" by A.R. Gennaro, 20th Edition.
Термин "около" или "приблизительно" обычно означает отклонение от данной величины или диапазона в пределах 20%, альтернативно, в пределах 10% или 5%. Альтернативно, особенно в биологических системах, термин "приблизительно" означает отклонение в пределах десятичного логарифма (то есть порядка величины), включая двукратное значение данной величины.
В связи со способами, предлагаемыми настоящим изобретением, также предлагаются фармацевтические композиции, содержащие терапевтически эффективное количество нерамексана и/или терапевтически приемлемое количество GRI (например, рилузола). Композиции, предлагаемые изобретением, могут дополнительно содержать носитель или наполнитель (в любом случае фармацевтически приемлемый). Композиции могут быть составлены для введения один раз в день, для введения два раза в день или для введения три раза в день.
Композиция или единичный активный ингредиент, предлагаемые настоящим изобретением, могут быть использованы для производства медикамента для лечения одного из упомянутых заболеваний, когда медикамент адаптирован или соответствующим образом приготовлен для специфического введения, как это раскрыто здесь (например, для введения один раз в день, два раза в день или три раза в день). С этой целью упаковочный вкладыш и/или информация для больного содержат соответствующие сведения.
В соответствии с настоящим изобретением лекарственная форма композиций может быть твердой, полутвердой или жидкой рецептурой согласно следующему описанию.
Композиции могут вводиться перорально, местно, парентерально или через слизистые оболочки (например, буккально, посредством ингаляции или ректально) в стандартных дозовых формах, содержащих традиционные нетоксичные фармацевтически приемлемые носители. Композиции могут вводиться перорально в виде капсул, таблеток и т.п. форм либо в виде полутвердых или жидких препаративных форм (см. Remington's Pharmaceutical Sciences, 20th Edition, by A.R. Gennaro).
Для перорального введения в виде таблеток или капсул композиции могут быть скомбинированы с нетоксичными, фармацевтически приемлемыми формообразующими средствами, такими как связывающие агенты (например, пептизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнителями (например, лактозой, сахарозой, глюкозой, маннитом, сорбитом и другими редуцирующими и нередуцирующими сахарами, микрокристаллической целлюлозой, сульфатом кальция или вторичным кислым фосфатом кальция), скользящими веществами (например, стеаратом магния, тальком или кварцем, стеариновой кислотой, стеарилфумаратом натрия, глицерилбегенатом, стеаратом кальция и т.п.), дезинтегрирующими агентами (например, картофельным крахмалом или натриевой солью гликолята крахмала), смачивающими агентами (например, лаурилсульфатом натрия), красителями и ароматизаторами, желатином, подсластителями, натуральными и синтетическими смолами (такими как гуммиарабик, трагакант или альгинаты), буферными солями, карбоксиметилцеллюлозой, полиэтиленгликолем, восками и т.д.
Таблетки могут быть покрыты концентрированным сахарным раствором, который может содержать, например, гуммиарабик, желатин, тальк, двуокись титана и т.п. В альтернативном варианте таблетки могут быть покрыты полимером, который растворяется в быстро испаряющемся органическом растворителе или в смеси органических растворителей. В специальных вариантах осуществления изобретения нерамексан вводят в таблетки с быстрым высвобождением (IR) или с модифицированным высвобождением (MR). Твердые лекарственные формы с быстрым высвобождением позволяют осуществить высвобождение большей части или всего активного ингредиента в течение короткого периода времени, например 60 минут или менее, и делают возможным быстрое всасывание лекарства (например, препаративные формы с быстрым высвобождением нерамексана раскрыты в опубликованных патентных заявках США №№ 2006/0002999 и 2006/0198884, содержание которых включено в описание в качестве ссылки). Твердые пероральные лекарственные формы с модифицированным высвобождением позволяют осуществлять длительный выброс активного ингредиента в течение растянутого периода времени в попытках поддержать терапевтически эффективный уровень лекарства в плазме для увеличения временного интервала приема лекарства и/или модифицировать другие фармакокинетические свойства активного ингредиента (например, препаративные формы с модифицированным высвобождением нерамексана раскрыты в опубликованной патентной заявке США № 2007/0141148, содержание которой включено в описание в качестве ссылки).
Для приготовления препаративной формы в виде мягких желатиновых капсул активные вещества можно смешивать, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активных веществ с использованием вышеуказанных наполнителей для таблеток, например лактозы, сахарозы, сорбита, маннита, крахмалов (например, картофельного крахмала, кукурузного крахмала или амилопектина), производных целлюлозы или желатина. Твердые желатиновые капсулы также можно заполнять жидкими или полутвердыми формами лекарства.
Композиции, предлагаемые изобретением, можно также вводить в микросферы или микрокапсулы, например, изготовленные из полигликолевой кислоты/молочной кислоты (PGLA) (см., например, патенты США №№ 5814344, 5100669 и 4849222, публикации PCT №№ WO 95/11010 и WO 93/07861). Для достижения контролируемого высвобождения лекарства можно применять биологически совместимые полимеры, включая, например, полимолочную кислоту, полигликолевую кислоту, сополимеры полимолочной и полигликолевой кислот, полиэпсилон капролактон, полигидроксибутировую кислоту, полиортоэфиры, полиацетали, полигидропираны, полицианоакрилаты и поперечно сшитые или алифатические блок-сополимеры гидрогелей.
Также можно применить оформление композиций, предлагаемых изобретением, в виде полутвердых или жидких препаративных форм. Активный ингредиент (то есть нерамексан и/или, например, рилузол) может занимать в препаративной форме от 0,1 до 99% по весу, более конкретно от 0,5 до 20% по весу (применительно к препаративным формам для инъекций), а также от 0,2 до 50% по весу (применительно к пероральным препаративным формам).
В одном из вариантов осуществления изобретения композиции вводят в виде препаративных форм с модифицированным высвобождением. Препаративные формы с модифицированным высвобождением являются средством для улучшения согласия больных, а также для обеспечения эффективной и безопасной терапии за счет снижения частоты неблагоприятных реакций на лекарство. По сравнению с препаративными формами быстрого высвобождения препаративные формы с модифицированным высвобождением можно использовать для пролонгирования фармакологического действия после введения и для снижения вариабельности концентраций лекарства в плазме с учетом временного интервала между введением доз, то есть для исключения или для уменьшения острых пиков.
Лекарственная форма с модифицированным высвобождением может содержать сердцевину, или покрытую лекарственным веществом, или содержащую лекарственное вещество. Затем имеющуюся сердцевину покрывают полимером, модифицирующим высвобождение, внутри которого и диспергируется лекарственное вещество. Полимер, модифицирующий высвобождение, постепенно разрушается, высвобождая лекарство в течение длительного времени. Таким образом, самый наружный слой композиции эффективно замедляет, следовательно, регулирует диффузию лекарства в покровном слое после того, как композиция вступает в контакт с водной средой внутри организма, т.е. в желудочно-кишечном тракте. Чистая скорость диффузии лекарства зависит, главным образом, от способности желудочного сока проникать через покровный слой или матрицу, а также от растворимости лекарства как такового.
Еще в одном варианте осуществления изобретения композиции имеют форму жидких пероральных препа