Опосредованное рнкi ингибирование rho-киназы для лечения глазных нарушений
Иллюстрации
Показать всеИзобретение относится к области медицины и касается опосредованного PHKi ингибирования RHO-киназы для лечения глазных нарушений. Сущность изобретения включает РНК-интерференцию для ингибирования экспрессии мРНК Rho-киназы для лечения пациентов с глазными нарушениями, особенно для лечения внутриглазного давления, глазной гипертензии и глаукомы. Мишени мРНК Rho-киназы включают мРНК гена ROCK1. Преимущество изобретения заключается в создании средства, обладающего улучшенными свойствами. 11 н. и 45 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области композиций интерферирующих РНК для ингибирования экспрессии мишеней мРНК Rho-киназы при глазных нарушениях, в частности, для снижения внутриглазного давления при лечении глазной гипертензии и глаукомы.
Предпосылки изобретения
Глаукома представляет собой гетерогенную группу оптических нейропатий с некоторыми общими клиническими признаками. Потеря зрения при глаукоме происходит вследствие селективной гибели ганглионарных клеток сетчатки в нейральной сетчатке, которая клинически диагностируется по характерным изменениям зрительного поля, дефектам слоя нервных волокон и прогрессирующей экскавации диска зрительного нерва (ДЗН). Одним из основных факторов риска развития глаукомы является наличие глазной гипертензии (OHT), т.е. повышенного внутриглазного давления (ВГД). Нормальное ВГД необходимо для поддержания формы глаза и для обеспечения градиента давления, обеспечивающего поток водянистой влаги к лишенных сосудов роговице и хрусталику. Уровни ВГД также могут принимать участие в патогенезе глаукомы нормального давления (NTG), что доказано наличием пациентов с улучшением после снижающих ВГД лекарственных средств. После поправок на центральную толщину роговицы показателей ВГД у пациентов с NTG обнаружено, что у многих этих пациентов присутствует глазная гипертензия.
Повышенное ВГД, связанное с глаукомой, возникает в результате повышенного сопротивления оттоку водянистой влаги в трабекулярной сети (ТС), небольшом количестве специализированной ткани, расположенной в радужно-роговичном угле передней камеры глаза. Глаукоматозные изменения в ТС включают потерю клеток в ТС и отложение и накопление экстрацеллюлярного осадка, включая белковый бляшкообразный материал. Кроме того, также существуют изменения, происходящие при глаукоме в ДЗН. В глазах при глаукоме происходят морфологические и непостоянные изменения в глиальных клетках ДЗН. В ответ на повышенное ВГД и/или транзиторные ишемические инсульты, происходят изменение состава внеклеточного матрикса ДЗН и изменения в морфологии глиальных клеток и аксонов ганглионарных клеток сетчатки.
Первичные глаукомы являются следствием нарушений в токе внутриглазной жидкости, которые имеют анатомическое или физиологическое основание. Вторичные глаукомы возникают в результате повреждения или травмы глаз или предшествующего заболевания. Первичная открытоугольная глаукома (ПОУГ), также известная как хроническая или простая глаукома, представляет собой большинство всех первичных глауком. ПОУГ характеризуется дегенерацией трабекулярной сети, приводящей к аномально высокому сопротивлению оттоку жидкости из глаза. Следствием такого сопротивления является увеличение ВГД, которое необходимо для прохождения нормально продуцируемой глазами жидкости при увеличенном сопротивлении.
Связанные с Rho, содержащие двойную спираль протеинкиназы, также известные как Rho-киназы или ROCK, являются эффекторами семейства Rho малых ГТФ-связывающих белков (Rho-ГТФазы). Существуют доказательства, что путь передачи сигнала Rho-ГТФазы играет роль в регуляции оттока водянистой влаги, например, посредством изменения организации цитоскелета трабекулярной сети (ТС) и/или клеток цилиарной мышцы (ЦМ). Низкомолекулярные ингибиторы Rho-киназы вызывают обратимые изменения морфологии и организации цитоскелета клеток ТС, снижают сократительную способность изолированной ткани ЦМ и увеличивают легкость оттока водянистой влаги в органной культуре (Waki M. et al., Curr Eye Res. 22:470-4 (2001); Honjo M. et al, Invest Ophthalmol Vis Sci. 42:137-44 (2001); Rao PV. et al., Mol. Vis. 11:288-97 (2005); Rao PV. et al., Invest Ophthalmol. Vis Sci. 42:1029-37 (2001)). Подобные эффекты происходят при экспрессии доминантно-негативных Rho-связывающих доменов. Однако обработка низкомолекулярными ингибиторами Rho-киназы также вызывает вазодилатацию и гиперемию конъюнктивы. Кроме того, эффективность основанных на низкомолекулярных соединениях лекарственных средств является относительно кратковременной, требуя введения дозы в течение каждых суток, а в некоторых случаях эффективность с течением времени снижается.
Ввиду важности глазной гипертензии в глаукоме и побочных эффектов применяемых ранее способов лечения, было бы желательным иметь улучшенный способ лечения глазной гипертензии.
Сущность изобретения
Настоящее изобретение относится к интерферирующей РНК, подавляющей экспрессию мРНК Rho-киназы, снижая, таким образом, внутриглазное давление у пациентов с глазной гипертензией или глаукомой или с риском развития гипертензии или глаукомы. Мишени Rho-киназы включают ROCK1 (также известную как ROCKI, ROKP или p160ROCK) и ROCK2 (также известную как ROCKII или ROKα). Интерферирующая РНК по изобретению эффективна для лечения пациентов с глазной гипертензией или глаукомой, такой как глаукома нормального давления и открытоугольная глаукома.
Один из вариантов осуществления настоящего изобретения относится к способу снижения экспрессии мРНК Rho-киназы у индивида. Способ включает введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель. В одном из вариантов осуществления введение проводят в глаз индивида для снижения экспрессии мишени при глазной гипертензии у человека.
В одном из вариантов осуществления изобретения интерферирующая РНК содержит цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной непрерывной комплементарности по меньшей мере из 19 нуклеотидов. Кроме того, антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, которые являются смысловыми последовательностями кДНК, кодирующими ROCK1 и ROCK2, соответственно (инвентарные номера GenBank NM_005406 и NM_004850, соответственно). Антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Введение такой композиции снижает экспрессию Rho-киназы у индивида.
В одном из вариантов осуществления изобретения интерферирующая РНК сконструирована так, чтобы ее целью была мРНК, соответствующая SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077. В другом варианте осуществления изобретения, интерферирующая РНК сконструирована так, чтобы ее целью была мРНК, соответствующая SEQ ID NO:2, содержащей нуклеотид 1102, 1865, 2000, 2229, 2514, 2584, 2738, 3305, 4111, 4652, 5184, 5187, 5255, 5315, 5439, 5450, 5578, 5579, 5611, 5625, 5795, 6000, 6228, 6264, 584, 1337, 1678, 2773, 2814, 2941, 3357, 3398, 3481, 3633, 3644, 3645, 3767, 3836, 4023, 4097, 5202 или 5440.
Настоящее изобретение также относится к введению индивиду в дополнение к первой интерферирующей РНК второй интерферирующей РНК. Способ включает введение индивиду второй интерферирующей РНК с длиной от 19 до 49 нуклеотидов и содержащей цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной комплементарности по меньшей мере из 19 нуклеотидов; где антисмысловая цепь второй интерферирующей РНК в физиологических условиях гибридизуется со второй частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, а антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности по меньшей мере из 19 нуклеотидов со второй гибридизующейся частью из мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Вторая интерферирующая РНК может иметь мишенью ту же мРНК, что и первая интерферирующая РНК, или может иметь мишенью другую мРНК. Кроме того, подобным образом можно вводить третью, четвертую или пятую и т.д. интерферирующую РНК.
Другой вариант осуществления изобретения представляет собой способ снижения экспрессии Rho-киназы у индивида, включающий введение индивиду композиции, содержащей эффективное количество одноцепочечной интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель.
Для снижения экспрессии ROCK1 одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1, содержащей нуклеотид 605, 653, 659, 1248, 1562, 1876, 2266, 2474, 2485, 2740, 2808, 2834, 3007, 3146, 3199, 3245, 3379, 3453, 3511, 3513, 3519, 3781, 3782, 998, 1132, 1200, 1648, 1674, 1708 или 2077, и интерферирующая РНК содержит область по меньшей мере почти абсолютной комплементарности по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1. Таким образом снижается экспрессия ROCK1.
Для снижения экспрессии ROCK2 одноцепочечная интерферирующая РНК в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:2, содержащей нуклеотид 1102, 1865, 2000, 2229, 2514, 2584, 2738, 3305, 4111, 4652, 5184, 5187, 5255, 5315, 5439, 5450, 5578, 5579, 5611, 5625, 5795, 6000, 6228, 6264, 584, 1337, 1678, 2773, 2814, 2941, 3357, 3398, 3481, 3633, 3644, 3645, 3767, 3836, 4023, 4097, 5202 или 5440, и интерферирующая РНК содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:2. Таким образом снижается экспрессия ROCK2.
Другой вариант осуществления изобретения представляет собой способ лечения глазной гипертензии или глаукомы у пациента. Способ включает введение в глаз индивида композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит цепь смысловых нуклеотидов, цепь антисмысловых нуклеотидов и область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов. Антисмысловая цепь в физиологических условиях гибридизуется с частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, и содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с гибридизующейся частью мРНК, соответствующей SEQ ID NO:1 или SEQ ID NO:2, соответственно. Таким образом проводят лечение глазной гипертензии или глаукомы.
Другой вариант осуществления изобретения представляет собой способ лечения глазной гипертензии или глаукомы у пациента, где способ включает введение в глаз индивида композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК, содержащая область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79, где таким образом проводят лечение глазной гипертензии.
Другой вариант осуществления изобретения представляет собой способ снижения экспрессии мишени мРНК Rho-киназы у индивида, включающий введение индивиду композиции, содержащей эффективное количество интерферирующей РНК с длиной от 19 до 49 нуклеотидов и фармацевтически приемлемый носитель, где интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79, как указано ниже.
Если мишень мРНК Rho-киназы представляет собой мРНК ROCK1, интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей SEQ ID NO:3, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78 или SEQ ID NO:79.
Если мишень мРНК Rho-киназы представляет собой мРНК ROCK2, то интерферирующая РНК содержит область по меньшей мере из 13 последовательных нуклеотидов, по меньшей мере на 90% комплементарную или по меньшей мере на 90% идентичную с предпоследними 13 нуклеотидами 3'-конца мРНК, соответствующей SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71 или SEQ ID NO:72.
В дополнительном варианте осуществления настоящего изобретения область последовательных нуклеотидов представляет собой область по меньшей мере из 14 последовательных нуклеотидов, по меньшей мере на 85% комплементарную или по меньшей мере на 85% идентичную с предпоследними 14 нуклеотидами 3'-конца мРНК, соответствующей последовательности с идентификатором последовательности. Еще в одном варианте осуществления изобретения область последовательных нуклеотидов представляет собой область, как правило, из 15, 16, 17 или 18 последовательных нуклеотидов, по меньшей мере на 80% комплементарную или по меньшей мере на 80% идентичную с предпоследними 15, 16, 17 или 18 нуклеотидами, соответственно, 3'-конца мРНК, соответствующей последовательности-мишени, определяемой идентификатором последовательности.
Дополнительный вариант осуществления изобретения представляет собой способ лечения глазной гипертензии у пациента, где способ, включающий введение индивиду композиции, содержащей молекулу двухцепочечной siРНК, снижающей экспрессию гена ROCK1 или ROCK2 вследствие РНК-интерференции, где длина каждой цепи молекулы siРНК независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и одна из цепей молекулы siРНК содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1 или ROCK2, соответственно, так, что молекула siРНК обуславливает расщепление мРНК вследствие РНК-интерференции.
Вариантом осуществления настоящего изобретения являются композиции, содержащие интерферирующую РНК с длиной от 19 до 49 нуклеотидов и с нуклеотидной последовательностью любой из SEQ ID NO:3 и SEQ ID NO:9 - SEQ ID NO:79 или комплементарных им и фармацевтически приемлемый носитель. В одном из вариантов осуществления интерферирующая РНК является выделенной. Термин "выделенная" обозначает, что интерферирующая РНК не содержит ее общего природного окружения.
Другим вариантом осуществления изобретения являются композиции, содержащие молекулу двухцепочечной siРНК, снижающую экспрессию гена ROCK1 или ROCK2 вследствие РНК-интерференции, где длина каждой цепи молекулы siРНК независимо составляет приблизительно от 19 до приблизительно 27 нуклеотидов; и одна из цепей молекулы siРНК содержит нуклеотидную последовательность со значительной комплементарностью с мРНК, соответствующей гену ROCK1 или ROCK2, соответственно, так, что молекула siРНК обуславливает расщепление мРНК вследствие РНК-интерференции.
Настоящее изобретение имеет преимущество по сравнению с низкомолекулярными ингибиторами Rho-киназ, так как нежелательный побочный эффект современных низкомолекулярных лекарственных средств, например, гиперемия, можно отделить от желательного эффекта снижения внутриглазного давления.
Применение любого из вариантов осуществления, как описано в настоящем документе, в получении лекарственного средства для снижения экспрессии мРНК ROCK1 или ROCK2 также представляет собой вариант осуществления настоящего изобретения.
Краткое описание чертежей
На фиг.1 предоставлен "вестерн"-блот ROCK1 клеток GTM-3, трансфицированных siРНК ROCK1 № 1, № 2, № 3 и № 4; siРНК ROCK2 № 1, № 2, № 3 и № 4; группой siРНК ROCK1; ненаправленной контрольной siРНК; контрольным буфером (без siРНК). Концентрация siРНК составляла 100 нМ. Стрелки указывают положения полос 160 кДа белка ROCK1 и 42 кДа белка актина.
На фиг.2 предоставлен "вестерн"-блот ROCK1 клеток GTM-3, трансфицированных siРНК ROCK1 № 1, № 2, № 3, и № 4, и ненаправленной контрольной siРНК, каждая при 10 нМ, 1 нМ и 0,1 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK1 и 42 кДа белка актина.
На фиг.3 предоставлен "вестерн"-блот ROCK2 клеток GTM-3, трансфицированных siРНК ROCK2 № 1, № 2, № 3, и № 4, a ROCK1 pool, и ненаправленная контрольная siРНК, каждая при 100 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK2 и 42 кДа белка актина.
На фиг.4 предоставлен "вестерн"-блот ROCK2 клеток GTM-3, трансфицированных siРНК ROCK2 № 1, № 2, № 3, и № 4, и ненаправленная контрольная siРНК, каждая при 10 нМ, 1 нМ, и 0,1 нМ, и контрольным буфером (без siРНК). Стрелки указывают положения полос 160 кДа белка ROCK2 и 42 кДа белка актина.
Подробное описание изобретения
РНК-интерференция (РНКi) представляет собой процесс, при котором двухцепочечная РНК (dsРНК) используется для подавления экспрессии гена. Хотя необходимости быть связанным с теорией нет, РНКi начинается с расщепления более длинных dsРНК на малые интерферирующие РНК (siРНК) подобным РНКазе III ферментом, дайсером. SiРНК представляют собой dsРНК, длина которых, как правило, составляет приблизительно от 19 до 28 нуклеотидов, или от 20 до 25 нуклеотидов, или от 21 до 22 нуклеотидов и которые часто содержат на "липкие" 3'-концы из 2 нуклеотидов и 5'-фосфатный и 3'-гидроксильный концы. Одна цепь siРНК встроена в рибонуклеопротеиновый комплекс, известный как индуцированный РНК подавляющий комплекс (RISC). RISC использует эту цепь siРНК для идентификации молекул мРНК, которые, по меньшей мере частично комплементарны встроенной цепи siРНК, а затем расщепляет эту мРНК-мишень или ингибирует ее трансляцию. Таким образом, цепь siРНК, которая встроена в RISC, известна как направляющая цепь или антисмысловая цепь. Другая цепь siРНК, известная как цепь-пассажир или смысловая цепь, удаляется из siРНК, и она, по меньшей мере частично гомологична мРНК-мишени. Специалистам в данной области понятно, что, в принципе, встроиться в RISC и функционировать в качестве направляющей цепи может любая из цепей siРНК. Однако конструкция siРНК (например, пониженная стабильность дуплекса siРНК на 5'-конце антисмысловой цепи) может благоприятствовать встраиванию в RISC антисмысловой цепи.
Опосредованное RISC расщепление мРНК с последовательностью по меньшей мере частично комплементарной направляющей цепи, приводит к снижению стационарного уровня этой мРНК и соответствующего белка, кодируемого этой мРНК. Альтернативно, RISC также может снижать экспрессию соответствующего белка вследствие репрессии трансляции без расщепления мРНК-мишени. С RISC также могут взаимодействовать и подавлять экспрессию генов другие молекулы РНК и подобные РНК молекулы. Примеры других молекул РНК, которые взаимодействуют с RISC, включают короткошпилечную РНК (кшРНК), одноцепочечную siРНК, микроРНК (мкРНК) и являющиеся субстратом дайсера 27-членные дуплексы. Как применяют в настоящем документе, если не указано иначе, термин "siРНК" относится к двухцепочечной интерферирующей РНК. Примеры подобных РНК молекул, которые могут взаимодействовать с RISC, включают молекулы РНК, содержащие один или несколько химически модифицированных нуклеотидов, один или несколько дезоксирибонуклеотидов и/или одну или несколько связей, отличающихся от фосфодиэфирных. Для целей настоящего обсуждения все молекулы РНК или подобные РНК молекулы, которые могут взаимодействовать с RISC и принимать участие в опосредованных RISC изменениях экспрессии генов, обозначают "интерферирующая РНК". Таким образом, siРНК, кшРНК, мкРНК и являющиеся субстратом дайсера 27-членные дуплексы являются подгруппами "интерферирующей РНК".
Доказано, что интерферирующая РНК по вариантам осуществления изобретения каталитически действует на расщепление мРНК-мишени, т.е. интерферирующая РНК способна осуществлять ингибирование мРНК-мишени в субстехиометрических количествах. По сравнению со способами лечения с применением антисмысловых структур, для обеспечения терапевтического эффекта в таких условиях расщепления необходимо значительно меньше интерферирующей РНК.
Настоящее изобретение относится к применению интерферирующей РНК для ингибирования экспрессии мРНК Rho-киназы (ROCK), таким образом снижая внутриглазное давление у пациентов с глаукомой. Существует две изоформы Rho-киназы: ROCK1 (также известная как ROCKI, ROKβ или p160ROCK) и ROCK2 (также известная как ROCKII или ROKα). Как указано в настоящем документе, в соответствии с настоящим изобретением интерферирующая РНК, предоставляемая экзогенно или экспрессируемая эндогенно, особенно эффективна для подавления мРНК ROCK.
Низкомолекулярные ингибиторы ROCK вызывают обратимые изменения в морфологии и организации цитоскелета клеток трабекулярной сети, снижают сократительную способность изолированной ткани цилиарной мышцы и увеличивают легкость оттока водянистой влаги в органной культуре. Сходные эффекты происходят при экспрессии доминантно-негативных Rho-связывающих доменов. Обработка низкомолекулярными ингибиторами ROCK снижает ВГД, однако доказано, что такая обработка также вызывает гиперемию. Низкомолекулярные ингибиторы ROCK, проверенные к настоящему времени, в дополнение к ROCK1 и ROCK2 ингибируют несколько киназ. Ожидают, что применение интерферирующей РНК по настоящему изобретению со специфичностью к мРНК ROCK1 или ROCK2 позволит отделить желательный эффект обработки снижения ВГД от нежелательного эффекта обработки гиперемии.
Если не указано иначе, приводимые в настоящем документе последовательности нуклеиновой кислоты записаны в направлении от 5' к 3'. Как применяют в настоящем документе, термин "нуклеиновая кислота" относится или к ДНК, или РНК, или к их модифицированным формам, содержащим пуриновые или пиримидиновые основания, существующие в ДНК (аденин "A", цитозин "C", гуанин "G", тимин "T") или в РНК (аденин "A", цитозин "C", гуанин "G", урацил "U"). Предоставленная по настоящему документу интерферирующая РНК может содержать основания "T", особенно на 3'-концах, несмотря на то, что основания "T" не встречаются в РНК в природе. "Нуклеиновая кислота" включает термины "олигонуклеотид" и "полинуклеотид" и может относиться к одноцепочечной молекуле или к двухцепочечной молекуле. Двухцепочечная молекула формируется посредством спаривания оснований по Уотсону-Крику между основаниями A и T, основаниями C и G и между основаниями A и U. Цепи двухцепочечной молекулы могут быть частично, в значительной степени или полностью комплементарными друг другу и могут формировать гибридный дуплекс, сила связывания которого зависит от характера и степени комплементарности последовательности оснований.
Последовательность мРНК легко вывести из последовательности соответствующей последовательности ДНК. Например, SEQ ID NO:1 представляет смысловую цепь последовательности ДНК, соответствующей мРНК ROCK1. Последовательность мРНК идентична последовательности смысловой цепи ДНК с заменой оснований "T" на основания "U". Таким образом, последовательность мРНК ROCK1 известна из SEQ ID NO:1, а последовательность мРНК ROCK2 известна из SEQ ID NO:2.
мРНК Rho-киназы (ROCK1 и ROCK2): связанные с Rho, содержащие двойную спираль протеинкиназы, также известные как Rho-киназы или ROCK, являются эффекторами семейства Rho малых ГТФ-связывающих белков (Rho-ГТФазы). Существуют доказательства, что путь передачи сигнала Rho-ГТФазы играет роль в регуляции оттока водянистой влаги, например, посредством изменения организации цитоскелета трабекулярной сети (ТС) и/или клеток цилиарной мышцы (ЦМ).
ROCK представляют собой серин/треонин протеинкиназы, которые активируются посредством ГТФ-связанной Rho. Активация ROCK приводит к фосфорилированию нескольких субстратов, вовлеченных в сборку актиновых филаментов и сократимость клеток, включая, например, легкую цепь миозина, фосфатазу легких цепей миозина, LIM-киназу, аддуцин, ERM. Таким образом, ROCK регулируют широкое множество клеточных процессов, включая формирование волокон натяжения, сокращение, адгезию, миграцию, фагоцитоз, апоптоз и цитокинез. Двумя изоформами ROCK являются ROCK1 (также известная как ROCKI, ROKβ или p160ROCK) и ROCK2 (также известная как ROCKII или ROKα). Две изоформы являются очень сходными, особенно в их киназных доменах (92% идентичности на уровне аминокислот), однако, они проявляют различия в тканевом распределении и внутриклеточной локализации, что указывает на то, что они могут иметь особые, не дублирующиеся функции. И ROCK1, и ROCK2 экспрессируются в передней части глаза человека.
В базе данных GenBank из National Center for Biotechnology Information на ncbi.nlm.nih.gov предоставлена последовательность ДНК для ROCK1 в виде инвентарного номера NM_005406, приведенная в "Списке последовательностей" как SEQ ID NO:1. SEQ ID NO:1 представляет последовательность смысловой цепи ДНК, соответствующую мРНК, кодирующей ROCK1 (за исключением замены оснований "T" на основания "U"). Кодирующую последовательность ROCK1 составляют нуклеотиды 1-4065.
Эквивалентами приведенной выше последовательности мРНК ROCK1 являются формы альтернативного сплайсинга, аллельные формы, изозимы или родственные формы. Родственной является мРНК ROCK1 других видов млекопитающих, которая гомологична SEQ ID NO:1 (ортолог).
В базе данных GenBank представлена последовательность ДНК для ROCK2 в виде инвентарного номера NM_ 004850, приведенная в "Списке последовательностей" как SEQ ID NO:2. SEQ ID NO:2 представляет последовательность смысловой цепи ДНК, соответствующую мРНК, кодирующей ROCK2 (за исключением замены оснований "T" на основания "U"). Кодирующую последовательность ROCK2 составляют нуклеотиды 450-4616.
Эквивалентами приведенной выше последовательности мРНК ROCK2 являются формы альтернативного сплайсинга, аллельные формы, изозимы или родственные формы. Родственной является мРНК ROCK2 других видов млекопитающих, которая гомологична SEQ ID NO:2 (ортолог).
Снижение экспрессии мРНК: Как используют в настоящем документе, фраза "снижение экспрессии мРНК" означает введение или экспрессию количества интерферирующей РНК (например, siРНК) для снижения трансляции мРНК-мишени в белок или посредством расщепления мРНК, или посредством прямого ингибирования трансляции. Снижение экспрессии мРНК-мишени или соответствующего белка обычно обозначают как "нокдаун" и представляют относительно уровней, существующих после введения или экспрессии ненаправленной контрольной РНК (например, ненаправленная контрольная siРНК). Вариантами осуществления по настоящему документу предусмотрен нокдаун экспрессии в размере от 50% до 100% включительно. Однако в рамках настоящего изобретения не обязательно, чтобы достигались такие уровни нокдауна. В одном из вариантов осуществления для снижения ВГД вводят одну интерферирующую РНК, направленную к одной из мишеней Rho-киназ. В других вариантах осуществления для снижения ВГД вводят две или более интерферирующих РНК, направленных к одной и той же мишени Rho-киназы (например, ROCK1). В других вариантах осуществления для снижения ВГД вводят две или более интерферирующих РНК, направленных к обеим мишеням Rho-киназ (например, ROCK1 и ROCK2).
Как правило, нокдаун оценивают, измеряя уровни мРНК с применением амплификации при количественной полимеразной цепной реакции (кПЦР) или измеряя уровни белка при "вестерн"-блоттинге или в твердофазном иммуноферментном анализе (ELISA). Анализ уровня белка обеспечивает оценку расщепления мРНК, а также ингибирования трансляции. Дополнительные способы для измерения нокдауна включают гибридизацию раствора РНК, защиту от нуклеаз, "нозерн"-гибридизацию, наблюдение за генной экспрессией с применением микрочипов, связывание антител, радиоиммунный анализ и анализ активированных флуоресценцией клеток.
Ингибирование ROCK1 или ROCK2 также можно определить in vitro, оценивая уровни мРНК-мишени или уровни белка-мишени, например, в клетках ТС человека после трансфекции интерферирующей РНК для ROCK1 или ROCK2, как описано ниже.
Указанное в настоящем документе ингибирование мишеней также предполагают у человека и млекопитающего при наблюдении улучшения симптомов глаукомы, таких как, например, улучшение внутриглазного давления, улучшения при потере полей зрения или улучшения при изменениях диска зрительного нерва.
Интерферирующая РНК: В одном из вариантов осуществления изобретения интерферирующая РНК (например, siРНК) содержит смысловую цепь и антисмысловую цепь, а смысловая и антисмысловая цепи содержат область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов. В дополнительном варианте осуществления изобретения интерферирующая РНК (например, siРНК) содержит смысловую цепь и антисмысловую цепь, а антисмысловая цепь содержит область по меньшей мере почти абсолютной непрерывной комплементарности, по меньшей мере из 19 нуклеотидов с последовательностью-мишенью мРНК ROCK1 или ROCK2, а смысловая цепь содержит область по меньшей мере почти абсолютной непрерывной идентичности, по меньшей мере из 19 нуклеотидов с последовательностью-мишенью мРНК ROCK1 или ROCK2, соответственно. В дополнительном варианте осуществления изобретения интерферирующая РНК содержит область по меньшей мере из 13, 14, 15, 16, 17 или 18 последовательных нуклеотидов с определенным процентом комплементарности последовательностей или с определенным процентом идентичности последовательностей с предпоследними 13, 14, 15, 16, 17 или 18 нуклеотидами, соответственно, 3'-конца соответствующей последовательности-мишени в пределах мРНК.
Длина каждой цепи интерферирующей РНК составляет от 19 до 49 нуклеотидов и может составлять 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 нуклеотидов.
Антисмысловая цепь siРНК представляет собой активный направляющий фактор siРНК, в котором антисмысловая цепь встроена в RISC, таким образом позволяя RISC идентифицировать мРНК-мишень по меньшей мере с частичной комплементарностью к антисмысловой цепи siРНК для расщепления или репрессии трансляции.
В вариантах осуществления настоящего изобретения последовательности-мишени интерферирующей РНК (например, последовательности-мишени siРНК) в пределах последовательности-мишени мРНК выбирают с применением доступных средств конструирования. Затем интерферирующие РНК, соответствующие последовательности-мишени ROCK1 или ROCK2, тестируют посредством трансфекции клеток, экспрессирующих мРНК-мишень, с последующей оценкой нокдауна, как описано выше.
Способы выбора последовательностей-мишеней для siРНК предоставлены в Tuschl, T. et al., "The siRNA User Guide", исправленном 6 мая 2004 года, доступном на веб-сайте Rockefeller University; в Technical Bulletin № 506, "siRNA Design Guidelines", Ambion Inc. на веб-сайте Ambion; и в других доступных на веб-сайтах средствах конструирования, например, на веб-сайтах Invitrogen, Dharmacon, Integrated DNA Technologies, Genscript или Proligo. Начальные параметры поиска могут включать содержание G/C от 35% до 55% и длины siРНК от 19 до 27 нуклеотидов. Последовательность-мишень может находиться в кодирующей области или в 5'- или 3'-нетранслируемых областях мРНК.
Вариант осуществления 19-нуклеотидной последовательности-мишени ДНК для мРНК ROCK1 находится в положениях нуклеотидов SEQ ID NO:1 от 605 до 623:
5'-ATAACATGCTGCTGGATAA-3' SEQ ID NO:3.
siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 21-нуклеотидые цепи и 2-нуклеотидые "липкие" 3'-концы, представляет собой:
5'-AUAACAUGCUGCUGGAUAANN-3' SEQ ID NO:4
3'-NNUAUUGUACGACGACCUAUU-5' SEQ ID NO:5.
Каждый остаток "N" может представлять собой любой нуклеотид (A, C, G, U, T) или модифицированный нуклеотид. 3'-конец может содержать ряд остатков "N" в промежутке и включая 1, 2, 3, 4, 5 и 6. Остатки "N" на каждой цепи могут быть одним и тем же остатком (например, UU, AA, CC, GG или TT) или они могут быть различными (например, AC, AG, AU, CA, CG, CU, GA, GC, GU, UA, UC или UG). "Липкие" 3'-концы могут быть одинаковыми или они могут быть различными. В одном из вариантов осуществления обе цепи содержат "липкие" 3'-концы UU.
siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 21-нуклеотидные цепи и "липкие" 3'-концы UU на каждой цепи, представляет собой:
5'-AUAACAUGCUGCUGGAUAAUU-3' SEQ ID NO:6
3'-UUUAUUGUACGACGACCUAUU-5' SEQ ID NO:7.
Интерферирующая РНК также может содержать "липкий" нуклеотидный 5'-конец или она может содержать тупые концы. siРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:3 и содержащая 19-нуклеотидые цепи и тупые концы, представляет собой:
5'-AUAACAUGCUGCUGGAUAA-3' SEQ ID NO:80
3'-UAUUGUACGACGACCUAUU-5' SEQ ID NO:81.
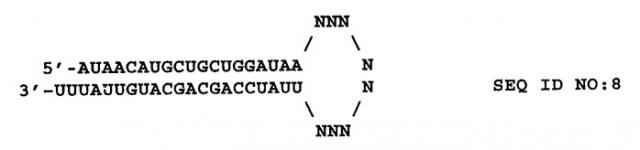
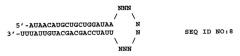
Цепи двухцепочечной интерферирующей РНК (например, siРНК) могут соединяться с формированием шпильки или структуры стебель-петля (например, кшРНК). кшРНК по изобретению, направленная на соответствующую последовательность мРНК SEQ ID NO:2 и содержащая двухцепочечную область стебля из 19 п.н. и "липкий" 3'-конец UU, представляет собой:
N представляет собой нуклеотид A, T, C, G, U или модифицированную форму, известную специалисту в данной области. Количество нуклеотидов N в петле представляет собой число от 3 до 23, или от 5 до 15, или от 7 до 13, или от 4 до 9, или от 9 до 11, включительно, или число нуклеотидов N составляет 9. Некоторые из нуклеотидов в петле могут участвовать во взаимодействиях с образованием пар нуклеотидов с другими нуклеотидами петли. Примеры олигонуклеотидных последовательностей, которые можно использовать для формирования петли, включают 5'-UUCAAGAGA-3' (Brummelkamp, T.R. et al (2002) Science 296:550) и 5'-UUUGUGUAG-3' (Castanotto, D. et al. (2002) RNA 8:1454). Специалисту в данной области понятно, что полученный в результате одноцепочечный олигонуклеотид формирует структуру стебля-петли или шпильки, содержащую двухцепочечную область, способную к взаимодействию с механизмом РНКi.
Последовательность-мишень siРНК, указанную выше, можно удлинить на 3'-конце для облегчения конструкции являющихся субстратом дайсера 27-членных дуплексов. Удлинение 19-нуклеотидной последовательности-мишени ДНК (SEQ ID NO:3), указанной в последовательности ДНК ROCK1 (SEQ ID NO:1) на 6 нуклеотидов, дает 25-нуклеотидную последовательность-мишень ДНК, находящуюся в положениях нуклеотидов SEQ ID NO:1 от 605 до 629;
5'-ATAACATGCTGCTGGATAAATCTGG-3' SEQ ID NO:82.
Являющийся субстратом дайсера 27-членный дуплекс по изобретению, направленный на соответствующую последовательность мРНК SEQ ID NO:10, представляет собой:
5'-AUAACAUGCUGCUGGAUAAAUCUGG-3' SEQ ID NO:83
3'-UUUAUUGUACGACGACCUAUUUAGACC-5' SEQ ID NO:84.
Два нуклеотида на 3'-конце смысловой цепи (т.е. нуклеотиды GG из SEQ ID NO:83) могут представлять собой дезоксинуклеотиды для улучшенного процессинга. Конструирование являющихся субстратом дайсера 27-членных дуплексов из последовательностей-мишеней длиной 19-21 нуклеотидов, такое как предоставлено в настоящем документе, дополнительно обсуждается на веб-сайте Integrated DNA Technologies (IDT) и в Kim, D.-H. et al., (февраль 2005) Nature Biotechnology 23:2; 222-226.
Когда интерферирующую РНК получают химическим синтезом, фосфорилирование в положении 5' нуклеотида на 5'-конце одной или обеих цепей (когда присутствуют) может увеличить эффективность и специфичность siРНК связанного комплекса RISC, но оно не обязательно, т.к. фосфорилирование может происходить внутриклеточно.
В таблице перечислены примеры последовательности-мишени ДНК ROCK1 и ROCK2 из SEQ ID NO:1 и SEQ ID NO:2, соответственно, из которых конструируют siРНК по настоящему изобретению указанным выше способом. ROCK1 и ROCK2 кодируют две изоформы Rho-киназы, как указано выше.
| Таблица Последовательности-мишени ROCK1 и ROCK2 для siРНК | ||
| Последовательности-мишени ROCK1 | № стартового нуклеотида относительно SEQ ID NO:1 | SEQ ID NO: |
| ATAACATGCTGCTGGATAA | 605 | 3 |
| GTACTTGTATGAAGATGAA | 653 | 9 |
| GTATGAAGATGAATAAGGA | 659 | 10 |
| TAGCTCCAATGCAGATAAA | 1248 | 11 |
| ATCAGTTGGAAGACTTAAA | 1562 | 12 |
| GACCTTCAAGCTCGAATTA | 1876 | 13 |
| GAACATTTGACTGGAAATA | 2266 | 14 |
| TAGCTCAGCTTACGAAACA | 2474 | 15 |
| ACGAAACAGTATAGAGGAA | 2485 | 16 |
| TTTGAATTGACGCAAGAAA | 2740 | 17 |
| CACTGTTAGTCGGCTTGAA | 2808 | 18 |
| ACAGCATGCTAACCAAAGA | 2834 | 19 |
| GTTAACAAATTGGCAGAAA | 3007 | 20 |
| ACCAGATGGTAGTGAAACA | 3146 | 21 |
| GTAGAAGAATGTGCACATA | 3199 | 22 |
| GCAAAGAGAGTGATATTGA | 3245 | 23 |
| GTACCAAATAGAGGAAATA | 3379 | 24 |
| GTTCTATAATGACGAACAA | 3453 | 25 |
| GATAAACTGTTTCACGTTA | 3511 | 26 |
| TAAACTGTTTCACGTTAGA | 3513 | 27 |
| GTTTCACGTTAGACCTGTA | 3519 | 28 |
| TGTCGAAGATGCCATGTTA | 3781 | 29 |
| GTCGAAGATGCCATGTTAA | 3782 | 30 |
| AACGACATCTCTTCTTCAA | 998 | 73 |
| GAAGAAACATTCCCTATTC | 1132 | 74 |
| TAGCAATCGTAGATACTTA | 1200 | 75 |
| GCCAATGACTTACTTAGGA | 1648 | 76 |
| GGACACAGCTGTAAGATTG | 1674 | 77 |
| GAGATGAGCAAGTCAATTA | 1 |