Применение полимеров
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, конкретно к использованию полимера, содержащего тиольные группы, при получении имплантата для наращивания ткани, где полимером основы является полисахарид. Полимеры, содержащие тиольные группы, оказывают антиоксидантное действие и характеризуются более продолжительным временем пребывания на участке применения. 3 н. и 10 з.п. ф-лы, 4 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к применению полимеров для наращивания ткани по медицинским и косметическим показаниям.
Уровень техники
Для наращивания тканей обычно используют полимеры, подобные, например, гиалуроновой кислоте, сшитой производными простого эфира и сложного эфира (сшитой дивинилсульфоном: WO 2006/056204; сшитой альдегидами: US 4713448; сшитой полифункциональными эпоксисоединениями: ЕР 0161887). После имплантирования в организм человека данные соединения могут привести к возникновению воспалительных реакций, аллергических реакций и реакций на чужеродные тела (Parade et al., Skinmed. 4 (2005): 345-349; Lemperle et al., Plast. Reconstr. Surg. 118 (2006): 92S-107S). Такие воспалительные процессы могут привести к выработке реакционно-способных соединений кислорода.
Активирование кислорода с образованием реакционно-способных соединений кислорода (свободных радикалов и нерадикальных соединений кислорода) представляет собой часть нормальных процессов обмена веществ в рамках клеточных процессов, автоокислительных реакций и ферментативных реакций. Дополнительными причинами образования реакционно-способных соединений кислорода являются, например, воспалительные процессы, повреждения суставов и тканей, а также экзогенные факторы окружающей среды, такие как УФ-излучение, сигаретный дым, радиационное воздействие и озон. Обычно существует баланс между окислительными и восстановительными процессами. Однако в случае превалирования окислительных реакций будет развиваться окислительный стресс (окислительное состояние). В результате атаки свободных радикалов липиды, белки и ДНК становятся поврежденными. Данное повреждение, помимо прочего, вероятно, является причиной возникновения возрастных изменений и заболеваний, например, старения кожи, диабета, сосудистых заболеваний и нейродегенеративных заболеваний.
Свободные радикалы, такие как гидроксильные радикалы, во многих случаях также несут ответственность за воспалительные заболевания, например, за развитие и сохранение воспалительных заболеваний суставов, таких как ревматоидный артрит. В состоянии артроза свободные радикалы будут вызывать разложение гиалуроновой кислоты в синовиальной жидкости, что приведет к уменьшению вязкости и смазывающего действия синовиальной жидкости (Lepperdinger et al. in Chemistry and Biology of Hyaluronan (2004): 71-82).
Обычно слезная жидкость также содержит акцепторы радикалов, такие как, например, цистеин, аскорбиновая кислота и восстановленный глутатион, и антиоксидантные ферменты, такие как, например, лактоферрин и лизоцим, для того, чтобы защитить поверхность глаза от окислительного повреждения свободными радикалами (гидроксильными радикалами, например) (Rose et al., Proc. Soc. Exp. Biol. Med. 217 (1998): 397-407).
В результате удаления свободных радикалов акцепторами радикалов воспалительные процессы могут быть ингибированы. Эндогенные защитные функции в отношении реакционно-способных соединений кислорода реализуют ферменты, такие как каталаза, супероксиддисмутаза (SOD) и глутатионпероксидаза (GPx), а также восстановленный глутатион (GSH) и железо- и медьобразующие белки (например, ферритин, альбумин, лактоферрин). Важными экзогенными антиоксидантами являются аскорбиновая кислота и ее производные, токоферол и ретиноиды. Большинство противовоспалительных низкомолекулярных лекарственных препаратов, таких как, например, диклофенак и пироксикам, также обладают свойствами акцептирования радикалов (Aruoma and Halliwell, Xenobiotica 18 (1988): 459-470).
Гиалуроновая кислота, которую зачастую используют для наращивания тканей, сама по себе демонстрирует незначительное противовоспалительное действие и является слабым акцептором гидроксильных радикалов. Для увеличения антиокислительного действия гиалуроновой кислоты и уменьшения воспалительных реакций после инъекции гиалуроновой кислоты было предложено объединенное применение гиалуроновой кислоты и маннита (WO 2004/073759). Однако данный тип применения является невыгодным, поскольку маннит может диффундировать из депо гиалуроновой кислоты. В одном дополнительном подходе фермент супероксиддисмутазу конъюгировали с гиалуроновой кислотой, что в результате приводило к 30%-ному уменьшению активности фермента (Sakurai et al. Glycoconj J. 14 (1997): 723-728). Хотя оба предложения и увеличивают антиокислительное действие гиалуроновой кислоты, желательное действие продолжается в течение короткого периода времени, поскольку всасывание гиалуроновой кислоты не замедлено. Немодифицированная гиалуроновая кислота, то есть несшитая гиалуроновая кислота, всасывается в течение пары часов или суток после ее имплантирования в организм человека.
Раскрытие изобретения
Поэтому цель настоящего изобретения заключается в предложении соединений для наращивания тканей, которые благодаря своим свойствам акцептирования радикалов и комплексообразования ионов многовалентных металлов оказывают антиоксидантное действие и одновременно характеризуются более продолжительным временем пребывания на участке применения.
Поэтому настоящее изобретение относится к использованию полимера, содержащего тиольные группы, при получении имплантата для наращивания и стабилизации ткани, где полимером является полисахарид, который предпочтительно является биоразлагаемым. Применение предпочтительно реализуют в виде субдермальной, интрадермальной, подкожной или внутримышечной инъекции.
Как было обнаружено, полимеры, содержащие тиольные группы, то есть физиологически переносимые полимерные соединения, содержащие тиольные группы, являются в особенности хорошо подходящими для наращивания тканей, где данные полимеры в то же самое время проявляют и противовоспалительное/антиокислительное защитное действие.
Окислительные процессы играют решающую роль в большом количестве заболеваний, поскольку такие процессы приводят к повреждению ДНК, белков и липидов. Окислительные процессы могут быть индуцированы, соответственно, внешними причинами (например, факторами окружающей среды, такими как излучение (УФ-излучение, ионизирующее излучение), окислители и тому подобное) и внутренними причинами (например, воспалениями).
Непосредственное сочетание тиольных антиоксидантов и полимера обладает теми преимуществами, что антиокислительное защитное действие будет сохраняться в течение всего времени пребывания полимера, и что сшивание, обусловленное функциями дисульфидных связей, будет вносить свой вклад в стабильность полимера. Примеры улучшения гидроксиакцепторных и антиокислительных свойств гиалуроновой кислоты, достигаемого в результате тиолирования, продемонстрированы на фигуре 2, фигуре 3 и фигуре 4.
В соответствии с настоящим изобретением термин «имплантат» относится к инъецируемому, предпочтительно стерильному, жидкостному, гелеобразному или полутвердому препарату, который в течение периода времени продолжительностью, по меньшей мере, от нескольких недель до месяца или даже годами по существу будет оставаться на участке применения или в его окрестности вплоть до, по меньшей мере, частичного, предпочтительно по существу полного, разложения имплантата.
В соответствии с одним предпочтительным вариантом реализации полимер, содержащий тиольные группы, имеет молекулярную массу, равную, по меньшей мере, 10000 г/моль, предпочтительно, по меньшей мере, 25000 г/моль, в частности, по меньшей мере, 50000 г/моль.
Молекулярная масса полимера изобретения, содержащего тиольные группы, имеет особое значение в случае важности при использовании полимера сохранения последнего прямо на активном участке или в его непосредственной окрестности в течение более продолжительного периода времени, чем в случае антиоксидантов, известных до настоящего времени, которые имеют существенно меньшую молекулярную массу. Это в особенности выгодно в случае важности контроля процессов локального окисления или их прекращения, соответственно, или их ослабления. Поэтому предпочитается, чтобы полимер, содержащий тиольные группы, имел бы, по меньшей мере, молекулярную массу 10000 г/моль.
Тиольные группы в полимере предпочтительно образуют меж- и/или внутримолекулярные дисульфидные связи.
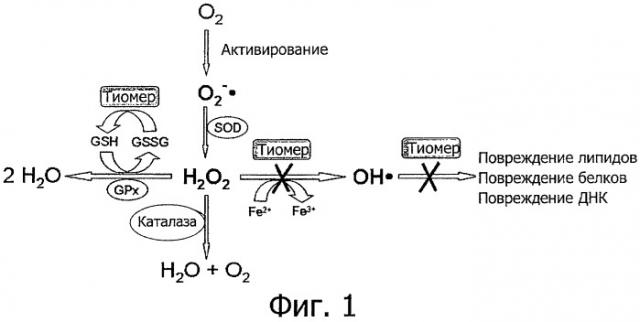
Способность полимера изобретения, содержащего тиольные группы, образовывать дисульфидные связи является необходимой в случае важности проявления антиоксидантных свойств на активном участке или в его окрестности. Как проиллюстрировано на фигуре 1, восстановленный полимер, содержащий тиольные группы, может быть использован для восстановления глутатиондисульфида, который играет решающую роль при дезинтоксикации перекиси водорода. Кроме того, вследствие своих антиоксидантных свойств полимеры, содержащие тиольные группы, ингибируют окислительный стресс, непосредственно вызванный гидроксильными радикалами, и, таким образом, они могут предотвратить повреждение ДНК, липидов и белков. Кроме того, полимеры, содержащие тиольные группы, ингибируют образование гидроксильных радикалов в результате комплексообразования ионов двухвалентного железа. Таким образом, для перекиси водорода реакция Фентона с образованием гидроксильных радикалов может быть, соответственно, прекращена или в значительной степени подавлена.
По завершении синтеза полимера, соответствующего настоящему изобретению, все его тиольные группы предпочтительно доступны в виде свободных тиольных групп, так что полимер будет сшитым в малой степени или даже несшитым вообще. Это делает возможным получение однофазных водных растворов полимеров, которые могут быть легко подвергнуты дальнейшей обработке, и делает возможным введение в упомянутые полимеры фармацевтических эксципиентов или фармацевтически активных соединений.
Впоследствии в контролируемых условиях протекает сшивание при изменении значения pH до физиологических значений pH в диапазоне pH 6-10,5 в присутствии кислорода. Добавление сшивателя не является необходимым. Для применения при наращивании тканей по медицинским и косметическим причинам предпочтительным является неполное сшивание полимеров через дисульфидные мостики.
Как можно также продемонстрировать, полимеры для наращивания ткани, содержащие тиольные группы и сшитые через дисульфидные мостики, характеризуются намного более высокой стабильностью в сопоставлении с обычно использующимися полимерами, известными на современном уровне техники.
Полимер, соответствующий настоящему изобретению, может быть использован в косметических или терапевтических целях при предпочтительном наращивании мягкой ткани, в частности кожной ткани, мышечной ткани и соединительной ткани. Косметическое наращивание кожи предпочтительно используют для косметического ухода за глубокими морщинами в области лица, в частности на носогубных складках, верхнегубных складках и лобных складках, тонкими складками в области глаз и щек, небольшими неровностями кожи и складками щек в случае морщинистых щек.
Часть полимера, образованная тиольными группами, предпочтительно составляет более чем 20 мкмоль/г полимера, предпочтительно более чем 50 мкмоль/г полимера, в частности более чем 100 мкмоль/г полимера.
Антиоксидантные свойства полимеров изобретения, содержащих тиольные группы, являются в особенности выгодными в случае содержания в полимере, по меньшей мере, 50 мкмоль тиольных групп на один грамм полимера.
В соответствии с изобретением подходящими для использования являются полимеры, которые являются физиологически переносимыми, и которые могут быть модифицированы тиольными группами. Полимеры основы выбирают из группы полисахаридов. Полимеры, содержащие тиольные группы, предпочтительно выбирают из группы, состоящей из гиалуроновой кислоты, содержащей тиольные группы, хитозана, содержащего тиольные группы, и в особенности выгодными для использования в соответствии с изобретением оказались комбинации данных полимеров, содержащих тиольные группы.
Некоторые из данных полимеров, такие как, например, тиолированная гиалуроновая кислота, уже используются в качестве эксципиентов в лекарственных препаратах, например, для более легкого и эффективного введения активных веществ в слои слизистых оболочек (смотрите, например, документ WO 00/25823). Однако, как неожиданно было установлено в настоящее время, такие полимерные соединения сами проявляют фармакологическое действие и могут быть использованы в качестве антиоксидантов. Тиольные группы полимеров способны значительно увеличить антиоксидантные свойства, возможно имеющиеся у нетиолированных полимеров, или придать антиоксидантные свойства полимерам.
Влияние на время пребывания может оказать выбор полимера. Биополимеры гиалуроновая кислота и хитозан разлагаются под действием, соответственно, гиалуронидазы и лизоцима, естественным образом присутствующих в организме млекопитающего, в частности, человека. Для разложения синтетических полимеров, подобных полиакриловой кислоте или полиакриламиду, в организме млекопитающего никаких ферментов не имеется, следствием чего является то, что упомянутые полимеры должны быть удалены из организма посредством хирургии, при этом биоразлагаемые полимеры разлагаются под действием ферментов в течение периода времени продолжительностью, по меньшей мере, 6, 12, 24 или даже 60 месяцев и, следовательно, удаляются из организма.
По меньшей мере, одну тиольную группу полимера, использующегося в изобретении, предпочтительно получают из физиологически переносимого тиольного соединения, например, цистеина, цистеамина и N-ацетилцистеина, что подразумевает возможность использования данных тиольных соединений или их производных для тиолирования полимеров.
В соответствии с изобретением тиолирование может быть осуществлено при использовании всех типов химических реакций, по которым тиольные соединения связываются с полимерами, в частности, с полимерами, растворимыми в воде. По нескольким причинам для тиолирования рекомендуется использование цистеина и производных цистеина, поскольку первый, с одной стороны, является физиологически переносимым, а с другой стороны, простым и дешевым в получении. Цистеин и производные цистеина предпочтительно могут быть связаны с сополимером через амидную связь. С другой стороны, полимер изобретения также может быть получен таким образом, чтобы в ходе получения полимера был бы (со)полимеризован, по меньшей мере, один мономер, содержащий тиольные группы, который в полимере имел бы свободные тиольные группы, что подразумевает неучастие тиольных групп непосредственно в реакции полимеризации. В соответствии с изобретением такой полимер, который содержит, по меньшей мере, один мономер, который имеет свободные тиольные группы в полимере, также является предпочтительным (смотрите, например, работу Bernkop-Schntlrch, Adv. Drag Deliv. Rev. 57 (2005): 1569-1582).
В зависимости от участка применения или активного участка имплантат изобретения предусматривается в виде соответствующей рецептуры. Каждое из вспомогательных веществ, требуемых в данном случае, будет зависеть от рецептуры и достаточно известно для специалиста в соответствующей области техники (смотрите, например, работу Sarfaraz Niazi, «Handbook of Pharmaceutical Manufacturing Formulations», CRC Press (2004)).
Соответствующие изобретению полимеры, содержащие тиольные группы, при наращивании кожи также могут быть использованы подкожно и интрадермально. В косметике полимеры, такие как, например, гиалуроновая кислота, известны и представляют собой вспомогательные средства, зачастую использующиеся для ослабления признаков старения кожи (морщин, сухости, утраты эластичности), которые, помимо прочего, связаны с восстановлением гиалуроновой кислоты свободными радикалами в ткани (Agren et al., Free Radic. Biol. Med. 23 (1997): 996-1001). Благодаря антиоксидантным свойствам полимеров изобретения, содержащих тиольные группы, предпочтительно гиалуроновой кислоты, содержащей тиольные группы, протекающее с участием радикалов разложение гиалуроновой кислоты, содержащей тиольные группы, после подкожного или интрадермального применения замедляется.
В рецептурах для подкожного или интрадермального применения полимер, содержащий тиольные группы, может присутствовать с концентрацией 0,001-20% (мас./об.), предпочтительно 0,01-10% (мас./об.). Кроме того, рецептуры могут содержать дополнительные эксципиенты, которые обычно используют в препаратах для подкожного или интрадермального применения, например, буферные соли, стабилизаторы, эксципиенты для регулирования желательной осмоляльности, эксципиенты для регулирования желательной вязкости и эксципиенты для улучшения переносимости рецептуры. Осмоляльность и значение pH конечной рецептуры предпочтительно находятся в пределах физиологического диапазона.
Рецептуру имплантата в особенности предпочтительно составляют в виде гелеобразного или в виде водного, предпочтительно однофазного, препарата.
Рецептура имплантата, соответствующего изобретению, который содержит, по меньшей мере, один полимер, содержащий тиольные группы, может быть составлена во множестве применяемых форм. В особенности выгодным является предложение рецептуры в виде водного раствора/препарата. В случае предложения имплантата в виде водного раствора последний может быть простым образом введен подкожно, интрадермально или внутримышечно в желательном месте.
Использование в качестве имплантатов в организме человека полимеров, имеющих форму гелей и водных маловязких растворов или форму твердых препаратов (также в виде вставок для контролируемого высвобождения активного вещества), может привести к возникновению воспалительных реакций в окружающей ткани. Благодаря акцептированию радикалов и антиоксидантному действию, что демонстрируют полимеры изобретения, содержащие тиольные группы, данные воспалительные реакции могут быть, соответственно, ослаблены или полностью исключены. Это относится, например, к интрадермальному и подкожному применению полимеров, содержащих тиольные группы, для инъекции под морщины, к использованию полимеров, содержащих тиольные группы, для наращивания сфинктера и к имплантированию (полу)твердых препаратов на основе полимеров, содержащих тиольные группы.
Как оказалось, в особенности выгодным является использование полимера, соответствующего настоящему изобретению, в виде гомогенного однофазного водного препарата, который может легко размещаться после применения, и который равным образом может медленно разлагаться под действием ферментов, присутствующих на участке применения. В случае сшитых полимерных частиц, описанных, например, в документе WO 99/31167, могут быть получены только двухфазные рецептуры, которые состоят из суспензии частиц в среде жидкого носителя. При таких рецептурах трудно оценить количество имплантата, требуемое для наращивания (например, инъекций под морщины), поскольку среда носителя довольно быстро всасывается в организм, а оставшиеся частицы имеют значительно уменьшенный объем. Поэтому применение должно быть скорректировано, что делает получение удовлетворительного результата затруднительным.
Кроме того, в соответствии с одним предпочтительным вариантом реализации лекарственный препарат или имплантат дополнительно содержат, по меньшей мере, одно активное вещество; при применении в дерматологии, предпочтительно активное вещество из группы местных анестетиков (например, лидокаин, прилокаин, прокаин, мепивакаин), противогрибковых средств (например, омоконазол, клотримазол, бифоназол, миконазол, флоконазол, итраконазол, оксиконазол, фентиконазол, тербинафин, циклопирокс, аморолфин), антигистаминов, противоаллергических средств, противовоспалительных средств, антибиотиков (например, тетрациклин и его производные, фузидиновая кислота, хлорамфеникол, неомицин, бацитрацин, гентамицин, тиротрицин, мупироцин, виргиниямицин, рифаксимин и амикацин), химиотерапевтических средств, противовирусных средств, мягчителей, средств защиты кожи, средств для лечения ран, средств от угрей местного применения и кортикостероидов, нестероидных антифлогистиков, средства для лечения геморроев, антисептиков местного применения и иодсодержащих средств. В дополнение к этому в имплантате могут содержаться, по меньшей мере, один фармацевтический эксципиент из группы буферных солей, консервантов, эксципиентов для регулирования желательной осмоляльности, эксципиентов для регулирования желательной вязкости, стабилизаторов, мягчительных средств, материалов покрытий, добавок, улучшающих текучесть, связующих, смазывающих средств, наполнителей, обезвоживающих средств, дезинтегрирующих средств, растворителей, солюбилизаторов и эксципиентов для увеличения переносимости рецептуры.
Помимо полимеров изобретения, содержащих тиольные группы, и возможно примешанных эксципиентов, требуемых или выгодных для конкретных рецептур, лекарственный препарат или имплантат, соответственно, могут содержать дополнительные активные вещества. Активные вещества, которые предпочтительно примешивают к полимеру, содержащему тиольные группы, сами могут обладать антиоксидантными свойствами или могут использоваться для лечения, ослабления или предотвращения, соответственно, антиоксидантного заболевания или заболевания, вызванного окислительным стрессом. В порядке примера в данном контексте должны быть упомянуты противовоспалительные вещества и витамины, обладающие антиоксидантным действием.
В соответствии с одним предпочтительным вариантом реализации настоящего изобретения имплантат дополнительно содержит, по меньшей мере, один немодифицированный полимер. В имплантатах, которые содержат как полимеры, содержащие тиольные группы, так и также немодифицированные полимеры, их соотношение в смеси по отношению друг к другу является переменным. В соответствии с изобретением под «немодифицированными полимерами» обобщенно подразумевают, соответственно, полимеры, которые являются полностью немодифицированными, или которые являются модифицированными, но, тем не менее, не имеют тиольной группы.
В соответствии с одним предпочтительным вариантом реализации настоящего изобретения имплантат содержит полимер, содержащий тиольные группы, с концентрацией в диапазоне от 0,001 до 100% (мас.), предпочтительно от 0,01 до 90% (мас.), еще более предпочтительно от 0,05 до 80% (мас.); где введение более предпочтительно проводят с концентрацией в диапазоне от 0,1 до 20% или даже наиболее предпочтительно от 0,1 до 10%.
Имплантат, соответствующий изобретению, может либо полностью состоять из полимера, содержащего тиольные группы, либо последний может быть перемешан с эксципиентами, носителями и фармацевтически активными веществами.
Вследствие наличия в полимере изобретения тиольных групп полимер обладает антиоксидантными свойствами.
В соответствии с одним предпочтительным вариантом реализации настоящего изобретения наращиваемую ткань выбирают из группы, состоящей из кожной ткани, мышечной ткани и соединительной ткани.
Один дополнительный аспект настоящего изобретения относится к имплантату для наращивания ткани, содержащему, по меньшей мере, один определенный ранее полимер, содержащий тиольные группы.
Еще один дополнительный аспект настоящего изобретения относится к способу косметического ухода за кожей и уменьшения и/или предотвращения старения кожи, по которому определенный ранее полимер, содержащий тиольные группы, применяют подкожно и/или интрадермально.
Полимеры, содержащие тиольные группы, могут быть использованы для косметического ухода за кожей и уменьшения старения кожи. Полимеры, такие как, например, гиалуроновая кислота, представляют собой вспомогательные средства, хорошо известные и зачастую использующиеся в косметике, например, для инъекции под морщины и в губы. Для этой цели главным образом используют вязкий гель из длинноцепных молекул, который очень медленно разлагается в организме. В одном дополнительном способе полимеры разрушают под действием УФ-излучения, при помощи массажа вводят в кожу, а после этого подвергают обработке лазером, в результате чего введенные при помощи массажа полимерные фрагменты в коже снова вступают в реакцию с образованием макромолекул. Такие полимеры используются в качестве альтернативы коллагену.
Косметическое использование полимеров, в частности гиалуроновой кислоты, в результате может привести к возникновению отчасти проявляющихся побочных эффектов, таких как, например, кожная сыпь и покраснение, обусловленных окислительным стрессом. Как было установлено в настоящее время, при введении полимеров, содержащих тиольные группы, возникновение таких побочных эффектов может быть, соответственно, полностью предотвращено или в значительной степени подавлено.
Изобретение более подробно будет разъяснено при помощи следующих далее примеров и фигур, которыми оно, само собой разумеется, не ограничивается.
Фигура 1 демонстрирует схематическое представление механизма антиоксидантного действия полимеров, содержащих тиольные группы.
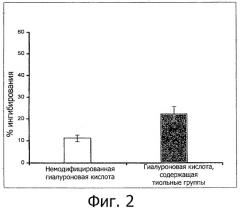
Фигура 2 демонстрирует ингибирование окисляющего действия гидроксильных радикалов под действием водных растворов тиолированной гиалуроновой кислоты с концентрацией 0,1% (мас./об.) в сопоставлении с немодифицированными полимерами (n≥3; ± станд. откл.).
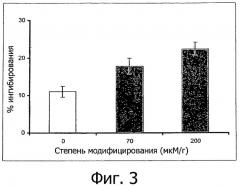
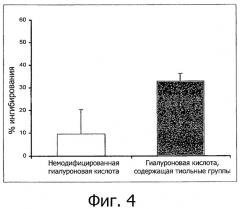
Фигура 4 демонстрирует ингибирование окисляющего действия гидроксильных радикалов под действием водных растворов тиолированной гиалуроновой кислоты с концентрацией 0,1% (мас./об.), модифицированной до различных степеней (200 мкмоль тиольных групп/г полимера и 70 мкмоль тиольных групп/г полимера), в сопоставлении с немодифицированной гиалуроновой кислотой (n≥4; ± станд. откл.).
Фигура 5 демонстрирует ингибирование окисления липидов для свиной роговицы in vitro под действием водных растворов тиолированной гиалуроновой кислоты с концентрацией 0,1% (мас./об.) в сопоставлении с немодифицированными полимерами (n≥3; ± станд. откл.).
Осуществление изобретения
ПРИМЕРЫ
Пример 1. Ингибирование окисляющего действия гидроксильных радикалов под действием полимеров изобретения, содержащих тиольные группы
Свойства акцептирования гидроксильных радикалов для полимеров изобретения, содержащих тиольные группы, оценивали в тесте с дезоксирибозой (Halliwell et al., Food Chem. Toxicol. 33 (1995): 601-617). В данной тест-системе гидроксильные радикалы генерируют под действием ионов железа, которые атакуют дезоксирибозу. Получающиеся в результате продукты разложения вступают в реакцию с тиобарбитуровой кислотой с образованием розового красящего вещества, оптическое поглощение которого измеряют. При использовании данного метода для полимеров изобретения, содержащих тиольные группы, тестируют свойства как акцептирования радикалов, так и также комплексообразования.
Для полимеров изобретения, содержащих тиольные группы, свойства акцептирования гидроксильных радикалов и комплексообразования в дезоксирибозном испытании также оценивали в зависимости от их концентрации и их степени модифицирования. Важно, чтобы полимеры изобретения, содержащие тиольные группы, все еще проявляли бы свое антиоксидантное действие даже и при низких концентрациях, поскольку таким образом - в комбинации с продленным временем пребывания данных полимеров, содержащих тиольные группы, - может быть получен долговременный эффект. Кроме того, в препаратах, предназначенных для глазного, внутрисуставного, интрадермального или подкожного применения, высокомолекулярные полимерные соединения могут быть использованы только при относительно низких начальных концентрациях, поскольку в противном случае вследствие их высокой вязкости оптимальная переносимость больше уже не будет обеспечена.
Для данного испытания получали свежие растворы полимеров в результате растворения полимера в фосфатном буфере при значении pH 7,4, так чтобы конечная концентрация полимера в общем тестируемом растворе составляла бы 0,1% (мас./об.). При необходимости значение pH у тестируемого раствора доводили до 7,4 в результате добавления NaOH.
Фосфатный буфер при значении pH 7,4 в отсутствие полимера использовался в качестве контрольного образца. К 0,6 мл тестируемого раствора сначала добавляли 0,1 мл раствора 2-дезокси-D-рибозы с концентрацией 10 ммоль/л.
Сразу же после добавления 0,1 мл свежеполученного раствора FeSO4 с концентрацией 10 ммоль/л образцы в течение 120 минут инкубировали при 37°C. Прохождение реакции прекращали в результате добавления 0,5 мл раствора трифторуксусной кислоты с концентрацией 2,5% (об./об.). После добавления 0,2 мл раствора тиобарбитуровой кислоты с концентрацией 1% (мас./об.) образцы в течение 20 минут инкубировали при 95°C для развития окраски. После этого образцы охлаждали до комнатной температуры и центрифугировали в течение 5 минут.Одну аликвоту тестируемого раствора переводили в микрофотометрические кюветы и измеряли оптическое поглощение при 532 нм.
Антиоксидантные свойства полимера изобретения рассчитывали в виде ингибирования окисления дезоксирибозы:
Ингибирование окисления в % = (1-(As/Ac))*100,
где As представляет собой оптическое поглощение образца, а Ac представляет собой оптическое поглощение контрольного образца.
Результаты проиллюстрированы на фигурах 2 и 3. В каждом случае по оси у проиллюстрировано ингибирование окислительного действия (в %) гидроксильных радикалов полимерами. Проиллюстрированные величины представляют собой средние значения, по меньшей мере, для 3 повторений испытания ± среднеквадратичное отклонение. На фигуре 2 продемонстрирована возможность значительного увеличения антиоксидантного действия гиалуроновой кислоты в результате ковалентного связывания тиольных соединений. Зависимость антиоксидантного действия полимеров, соответствующих изобретению, от степени модифицирования тиольными соединениями проиллюстрирована на фигуре 3 на примере тиолированной гиалуроновой кислоты. Таким образом, тиолированная гиалуроновая кислота, характеризующаяся степенью модифицирования 200 мкмоль тиольных групп/г полимера, демонстрирует более значительное антиоксидантное действие в сопоставлении с тиолированной гиалуроновой кислотой, характеризующейся степенью модифицирования 70 мкмоль тиольных групп/г полимера.
Пример 2. Ингибирование перекисного окисления липидов в коже под действием полимеров, содержащих тиольные группы
При использовании теста in vitro оценивали потенциал полимеров, содержащих тиольные группы, в отношении ингибирования окисления липидов дермы. Перекисное окисление внутриклеточных липидов, вызванное, например, действием УФ-излучения, приводит к повреждению кожи/дермы человека.
При использовании данного метода для полимеров, содержащих тиольные группы, тестируют свойства как акцептирования радикалов, так и комплексообразования (Halliwell et al., Food Chem. Toxicol. 33 (1995): 601-617). В данной тест-системе in vitro перекисное окисление липидов ускоряют в результате добавления ионов железа и нагревания. Окисленные фрагменты липидов (ВРТБК; вещества, реагирующие с тиобарбитуровой кислотой) вступают в реакцию с тиобарбитуровой кислотой с образованием розового красящего вещества, оптическое поглощение которого измеряют.
Получают свежие растворы полимеров в изотоническом фосфатном буфере, так чтобы конечная концентрация полимера в общем тестируемом растворе составляла бы 0,05% (мас./об.). Значение pH тестируемых растворов доводили до 7,4 в результате добавления NaOH. Изотонический фосфатный буфер при значении pH 7,4 использовался в качестве контрольного образца. К данным образцам добавляли 100 мг дермы свиньи. После добавления 0,3 мл свежеполученного раствора FeSO4 с концентрацией 20 ммоль/л образцы в течение 60 минут инкубировали при 95°C. Прохождение реакции прекращали в результате добавления 0,3 мл раствора трифторуксусной кислоты с концентрацией 20% (об./об.). После добавления 0,3 мл раствора тиобарбитуровой кислоты с концентрацией 1% (мас./об.) образцы в течение еще 20 минут инкубировали при 95°C и после охлаждения до комнатной температуры центрифугировали. Одну аликвоту переводили в микрофотометрические кюветы и измеряли оптическое поглощение при 532 нм.
Ингибирование перекисного окисления липидов рассчитывали в соответствии со следующим далее уравнением:
Ингибирование окисления в % = (1-(As/Ac))*100,
где As представляет собой оптическое поглощение образца, а Ac представляет собой оптическое поглощение контрольного образца.
Результаты проиллюстрированы на фигуре 5. На оси у в % отложено ингибирование окисления для соответствующих полимеров. Продемонстрированные величины представляют собой средние значения для 3 повторений испытаний+среднеквадратичное отклонение. Как с очевидностью следует из данных исследований, благодаря своим свойствам акцептирования радикалов, комплексообразования и, таким образом, антиоксидантным свойствам полимеры, содержащие тиольные группы, способны значительно уменьшить окисление липидов, вызванное воспалительными процессами.
Пример 3. Интрадермальное применение соответствующих настоящему изобретению полимеров, содержащих тиольные группы
Получали следующий препарат для интрадермального применения: 2 г гиалуроновой кислоты, содержащей тиольные группы, растворяли в стерильном изотоническом фосфатном буфере, перемешивали до получения частично сшитого полимера, набирали в шприцы и стерилизовали. 0,1 мл данной рецептуры интрадермально инъецировали в область спины кроликов. Данное применение вызывало минимальное местное раздражение, которое исчезало по истечении одних суток. Депо, образованное гиалуроновой кислотой, содержащей тиольные группы, было тактильно обнаруживаемым в течение всего периода наблюдений продолжительностью в две недели.
Пример 4. Получение препарата для подкожного и интрадермального применения при наращивании кожи
Препарат для подкожного и интрадермального использования изготавливали следующим образом: 1 г стерильной гиалуроновой кислоты, содержащей тиольные группы, в асептических условиях и в отсутствие кислорода растворяли в 100 мл стерильного фосфатного буфера при значении pH 7,4. Осмоляльность данного препарата регулировали в результате добавления NaCl и получали осмоляльность раствора в диапазоне от 200 до 400 мосмоль/кг. Раствором заполняли колбы и обеспечивали их газонепроницаемую упаковку.
Пример 5. Рецептура для наращивания рубцовой ткани
Препарат получали следующим образом: 3 г стерильной гиалуроновой кислоты, содержащей тиольные группы, в асептических условиях растворяли в 100 мл стерильного фосфатного буфера при значении pH 7,4 и подвергали неполному сшиванию. После этого регулировали осмоляльность при предложенном добавлении NaCl и получали осмоляльность раствора в диапазоне от 200 до 400 мосмоль/кг. Раствором заполняли колбы и обеспечивали их газонепроницаемое закрытие.
Пример 6. Рецептура для наращивания сфинктеров заднего прохода и мочеиспускательного канала
Полимеры, содержащие тиольные группы, использовали при наращивании внутреннего сфинктера заднего прохода для предотвращения возникновения анального недержания в результате обеспечения наличия в заднепроходном канале амортизации естественного происхождения. Ту же самую рецептуру также использовали и для наращивания сфинктеров мочеиспускательного канала (смотрите также документ US 5785642). Недержание представляет собой часто встречающуюся проблему, в частности, у женщин, у которых тазовое дно значительно ослаблено после беременности. В случае невозможности стимулирования мышц тазового дна обычными способами инъецирование материалов для наращивания мочеиспускательного канала представляет собой хорошую альтернативу.
Рецептуру для наращивания сфинктера получали следующим образом: 5 г стерильного хитозана, содержащего тиольные группы, в асептических условиях растворяли в 100 мл стерильного боратного буфера при значении pH 6,5 и подвергали неполному сшиванию, осмоляльность в результате добавления NaCl доводили до величины в диапазоне от 200 до 400 мосмоль/кг. Раствор набирали в шприцы.
Пример 7. Ферментативное разложение однофазной рецептуры сшитой гиалуроновой кислоты, содержащей тиольные гру