Биологические материалы и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана молекула антитела, которая избирательно связывается с клеточным поверхностным ICAM-1 и, при связывании с ICAM-1, индуцирует апоптоз в клетке-мишени, и молекула нуклеиновой кислоты, кодирующая указанное антитело. Также представлены способы и фармацевтические композиции для индукции апоптоза и их применение. Изобретение позволяет получать молекулы для индукции апоптоза клеток. 8 н. и 25 з.п. ф-лы, 11 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к молекулам, вовлеченным в индукцию апоптоза, способам и фармацевтическим композициям для индукции апоптоза и их применению.
Уровень техники
Антитела недавно стали белками терапевтического выбора, нацеленными на рак, но также и на лечение по другим показаниям (Brekke et al., Nat Rev Drug Discov 2003; 2:52-62). Появление инженерии антител обеспечило инструменты для создания человеческих антител из библиотек синтетических фагов, проявляющих сниженную иммуногенность и повышенную специфичность и аффинность благодаря их человеческой природе и большему разнообразию (Weiner et al., Nat Biotechnol 2005; 23:556-7). Исходные библиотеки особенно привлекательны, поскольку они могут применяться для выделения антител по их специфичности, включая само-антигены (Griffiths et al., Embo J 1993; 12:725-34), независимо от иммунизации и реконструкции новых библиотек. Клеточные поверхностные рецепторы составляют значительно более успешную группу антигенов, на которые нацелены современные лечебные средства, включая низкомолекулярные ингибиторы и антитела. Особый интерес представляют клеточные поверхностные рецепторы, которые уникально экспрессированы или проявляют повышенный уровень экспрессии в клетках-мишенях, и дополнительно способны передавать сигналы гибели или выживания для клеток. Такие дифференциально экспрессируемые рецепторы с присущими сигнальными свойствами позволяют осуществлять основанный на антителах таргетинг инфицированных микробами, трансформированных или иных клеток с нарушением функции.
Для лечения опухолей антитела, имеющие способность к индукции апоптоза в опухолевой клетке-мишени, не влияя на нормальную ткань, представляют особый интерес. Некоторые такие антитела применяются, зарегистрированы в Управлении по контролю за продуктами и медикаментами США (FDA) и представляют альтернативу стандартному лечению онкологических заболеваний, например, лимфомы (ритуксимаб, нацеленный на CD20) или рака молочной железы (трастузумаб или цетуксимаб, нацеленные, соответственно, на Her-2 и EGFR).
В настоящее время в клинической разработке имеются также другие антитела с апоптоз-индуцирующими эффектами. Однако, даже если эти антитела демонстрируют благоприятные эффекты у пациентов или при анализах у животных, все еще остается неудовлетворенная клиническая потребность.
Анти-идиотипический иммуноглобулиновый таргетинг В-клеточных опухолей был первой терапией с применением моноклональных антител, проведенной у человека (Miller et al., N Engl J Med 1982; 306:517-22). Разрушение опухолевых клеток посредством такого пассивного применения антител (Riechmann et al., Nature 1988; 332:323-7), или активной вакцинации собственным белком иммуноглобулина против опухоли пациента (Kwak et al., N Engl J Med 1992; 327:1209-15), как было продемонстрировано, вызывает регрессию опухоли или затормаживает ее развитие у пациентов с различными видами В-клеточных новообразований. Более недавний отчет описывает выработку полных человеческих анти-идиотипических антител с применением трансгенных мышей, дефицитных по продукции мышиных антител и экспрессирующих избранные локусы цепи антитела человека (Suarez et al., Mol Immunol 2004; 41:519-26).
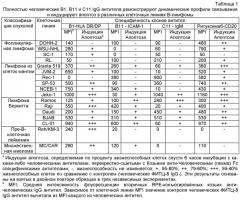
В настоящем изобретении использован способ конкурентного биопэннинга, где антиген клетки-мишени в форме цельных клеток и избыток вычтенного клеточного антигена в форме мембранных везикул одновременно подвергаются взаимодействию с фаговой библиотекой наивных антител n-CoDeR® (WO 2004/023140; Soderlind et al., Nat Biotechnol 2000; 18:852-6), для извлечения и последовательного тестирования фрагментов антител с отличной избирательностью в отношении клеток-мишеней В-лимфомы. Далее, функциональность избранных связывающих молекул была продемонстрирована по способности тестированных антител к индукции апоптоза в клетках-мишенях, но не в других клетках.
Идентифицированные специфичности антител включают HLA-DR/DP (B1 антитело изобретения) и поверхностный IgM (С11 антитело изобретения), а также ICAM-1 (В11 антитело изобретения), молекулу адгезии, не ассоциированную ранее с индукцией апоптоза. Выделенные антитела обладают аффинностью в суб-наномолярном и наномолярном диапазоне, непосредственно обеспечивая возможный выбор для целевой терапии антителами.
Раскрытие изобретения
В первом аспекте изобретение обеспечивает способ индукции апоптоза в клетке-мишени, включающий этапы:
а) обеспечения одной или более клеток-мишеней, несущих поверхностный клеточный антиген, ICAM-1;
b) обеспечения одной или более связывающих молекул, которые избирательно связываются с ICAM-1 клеточной поверхности и, при связывании с ICAM-1, индуцируют апоптоз клетки-мишени;
с) обработки клеток-мишеней согласно (а) связывающими молекулами согласно (b) для индукции апоптоза клеток-мишеней.
Предпочтительно связывающие молекулы являются молекулами антител.
Во втором аспекте изобретение обеспечивает способ индукции апоптоза в клетке-мишени, включающий этапы:
а) обеспечения одной или более клеток-мишеней, несущих поверхностный клеточный антиген, HLA-DR/DP и/или поверхностный IgM;
b) обеспечения одной или более молекул антител, избирательно связывающихся с HLA-DR/DP клеточной поверхности и/или поверхностным IgM и, при связывании с HLA-DR/DP и/или поверхностным IgM, индуцирующих апоптоз клетки-мишени;
с) обработки клеток-мишеней согласно (а) молекулами антител согласно (b) для индукции апоптоза клеток-мишеней.
В третьем аспекте изобретения обеспечивается связывающая молекула, которая избирательно связывается с ICAM-1 клеточной поверхности и, при связывании с ICAM-1, индуцирует апоптоз клетки-мишени. Альтернативно связывающая молекула является молекулой антитела, которая избирательно связывается с HLA-DR/DP клеточной поверхности и/или поверхностным IgM.
ICAM-1 также обозначается как CD54, но для целей данного применения будет использоваться ICAM-1.
Связывающие молекулы могут происходить от антител и основываться на молекулярном каркасе антител [Clackson Т et al., Nature. 1991 Aug 15; 352(6336):624-8, Marks JD et al., J Mol Biol. 1991 Dec 5; 222(3):581-97], который обширно используется во многих библиотеках, но связывающие молекулы также могут быть получены из других молекулярных каркасов, таких как каркас фибронектина [Weng S et al., Proteomics. 2002 Jan; 2(1):48-57] и каркас протеина A [Nord К, et al., Nat Biotechnol 1997 Aug; 15(8):772-7, Hogbom M et al., Proc Natl Acad Sci USA. 2003 Mar 18; 100(6):3191-6]. Каждый из этих каркасов может обладать преимуществом в зависимости от применения, и каркас антител, в качестве одного из примеров, может выгодно применяться для создания вариабельности, неотличимой от природной вариабельности.
Базовая структура антител, наиболее часто применяемый каркас, очень хорошо изучена. В принципе, каркасная структура, включающая бета-цепи, упорядоченные в виде двух слоев, представляет набор вариабельных петель, так называемых гипервариабельных участков (CDRs), которые обладают способностью связывать молекулы антигенов. Хотя антитела могут варьировать в структуре каркаса, наиболее обширная вариабельность наблюдается в CDRs. Значительная вариабельность между антителами является основой для их способности взаимодействовать специфическим образом с, в принципе, всеми типами молекулярных структур. Благодаря этой способности антитела обширно применяются для создания специфических связующих агентов, с применением для исследований, диагностики/прогноза заболевания и в качестве лечебных агентов, специфичных в отношении определенных структур-мишеней [Borrebaeck CA and Carlsson R, Curr Opin Pharmacol. 2001 Aug; 1(4):404-8].
Другими связывающими молекулами, не относящимися к антителам, применяющимися в данном изобретении, являются те, которые имеют структуры каркаса с высокой степенью стабильности, но допускающие вариабельность при введении в определенные позиции. Примером другой связывающей молекулы является домен фибронектина и большой домен протеина А из 58 аминокислот, который толерантен к вариабельности. Имеются также другие молекулярные складки, которые допускают определенную степень вариации. Такие примеры включают молекулы I и II классов главного комплекса гистосовместимости (МНС) и недавно открытый новый класс молекул, так называемых дефензинов, которые были идентифицированы как сходные по базовой структуре при сохранении значительной вариабельности последовательности между членами семейства генов, что свидетельствовало об их пригодности в качестве каркаса для сохранения молекулярного разнообразия. В дополнение, природный лиганд(ы), например, LFA-1 в случае ICAM-1 в качестве целевой молекулы, или его рекомбинантные варианты, могут являться специфическими связывающими молекулами, способными индуцировать апоптоз в клетках-мишенях.
Далее, связывающая молекула может быть любой молекулой, избирательно связывающей ICAM-1 клеточной поверхности клетки-мишени и, при связывании, индуцирующей апоптоз клетки-мишени.
Связывающая молекула является предпочтительно молекулой антитела.
В одном воплощении антигеном клеточной поверхности является ICAM-1.
Представленный скрининг обнаружил антитело (В11), специфичное в отношении ICAM-1 - рецептора, не связываемого ранее с апоптозом и, как считают, не обладающего существенными свойствами передачи отрицательных сигналов клеткам.
Идентификация ICAM-1 как молекулы, индуцирующей апоптоз, была прямым результатом скрининга, разработанного для выделения специфичностей в отношении всех поверхностных рецепторов, дифференциально экспрессируемых клетками-мишенями, и клетками, не являющимися мишенями, независимо от и без предшествующих знаний об их соответствующей идентичности. Было подтверждено, что ICAM-1 - индуцированная клеточная гибель была активным апоптотическим процессом, вовлекающим деполяризацию мембраны митохондрий. Деполяризация митохондриальной мембраны была ранее описана как при каспазо-зависимом, так и каспазо-независимом апоптозе (Nagy et al., J Mol Med 2003; 81:757-65).
Представленные находки далее показали, что эпитоп, связываемый В11 антителом, экспрессируется тканью В-лимфомы различного происхождения и позитивно регулируется в определенных клетках В-лимфомы по сравнению с покоящимися лейкоцитами периферической крови. Важно, что в дополнение к клеткам В-лимфомы клетки карциномы, экспрессирующие ICAM-1, также подвергаются алоптозу при обработке ICAM-1-специфичными В11-антителами in vitro (см. Пример 6).
Предварительные исследования продемонстрировали ограниченную экспрессию ICAM-1 нормальными тканями человека (Smith et al., J Clin Pathol 1990;43:893-900). ICAM-1 вовлекается в адгезию клетки к клетке и играет важную роль в иммунном ответе и воспалении посредством связывания с их рецептором LFA-1. Антитела, направленные на ICAM-1, используются для препятствия патологическому иммунному ответу и воспалению. Применение in vivo мышиных анти-ICAM-1 моноклональных антител (mAb) у яванских макак (Cosimi et al., J Immunol 1990; 144:4604-12), или применение при клинических испытаниях у людей, больных ревматоидным артритом, или пациентов с трансплантатом почки, также не выявило явной токсичности (Kavanaugh et al., Arthritis Rheum 1994; 37:992-9; Haug et al., Transplantation 1993; 55:766-72).
Новое открытие того, что ICAM-1-таргетинг может вести к апоптозу, демонстрирует возможность применения ICAM-1-специфичных связывающих молекул, таких как антитела, для лечения онкологических заболеваний различного происхождения, при условии, что они экспрессируют этот антиген.
На основании их экспрессии ICAM-1, типы онкологических заболеваний, которые могут быть лечены с помощью индуцирующего апоптоз анти- ICAM-1 антитела, такого как В11, включают: В-лимфому, миелому (Huang et al., (1993) Hybridoma 12 p661-75; Huang et al., (1995) Cancer Res 55 p610-6; Smallshaw et al., (2004) J Immunother 27 p419-24), рак желудка (Maruo et al., (2002) Int J Cancer 100 p486-90), рак молочной железы (Rosette et al., (2005) Carcinogenesis 26 p943-50), рак печени (Sun et al., (1999) J Cancer Res Clin Oncol 125 p28-34), рак легких (Grothey et al., (1998) Br J Cancer 77 p801-7), меланому (Wang et al., (2005) Int J Cancer 27 p419-24), рак мочевого пузыря (Roche et al., (2003) Thromb Haemost 89 1089-97) и рак простаты (Aalinkeel et al., (2004) Cancer Res 64 p5311-21). Экспрессия ICAM-1 также была выявлена на метастазах опухолей, как показано (Maruo et al., 2002), (Rosette et al., 2005), (Sun et al., 1999), (Grothey et al., 1998), (Aalinkeel et al., 2004), что указывает на возможность вмешиваться в процессы метастазирования с применением ICAM-1 специфических антител.
В другом воплощении поверхностным клеточным антигеном является HLA-DR/DP.
HLA-DR/DP в норме присутствует на, например, В-клетках и может выявляться как позитивно регулируемый на клетках В-лимфомы.
На сегодняшний день три различных вида HLA-DR специфических моноклональных антител проходят клинические испытания. Самым недавним дополнением к ним является человеческий IgG4 1D09C3, который был выделен из сходной по размеру наивной фаговой библиотеки, по сравнению с n-CoDeR®, но с применением твердофазного пэннинга очищенного антигена (Nagy et al., Nat Med 2002; 8:801-7).
В настоящем изобретении идентифицировано новое антитело человека (в1), направленное против HLA-DR/DP, которое быстро и с высокой эффективностью индуцирует апоптоз множества клеточных линий В-лимфомы, таким образом демонстрируя, что HLA-DR/DP связан с индукцией апоптоза клетки-мишени.
В1-антитело связывается с множеством клеточных линий В-лимфомы различного происхождения (см. Пример 1 и Таблицу 1) и. как было показано, индуцирует апоптоз в клетках, экспрессирующих HLA-DR/DP антиген. Далее, В 1-антитело показало более высокую мощность, чем Ритуксимаб при анализе на Raji клеточной линии В-лимфомы. Это особенно явно, когда применяется IgG4 формат В1 антител (Фиг.8).
На основании полученных данных, это антитело имеет подходящие характеристики для обработки HLA-DR/DP-экспрессирующих клеток В-лимфомы. В дополнение, наподобие таргетинга ревматоидного артрита и системной красной волчанки (СКВ) Ритуксимабом, В1 антитело может оказаться эффективным в элиминации активированных В-клеток при заболеваниях, где экспрессирующие HLA-DR/DP В-клетки являются вредоносными.
В еще одном воплощении поверхностным клеточным антигеном является поверхностный IgM.
IgM в его свободной форме существует в виде большой пентамерной структуры, чей высокий молекулярный вес способствует ее удержанию в пределах кровеносных сосудов.
Мономерный IgM может быть найден на клеточной стенке В-лимфоцитов и функционирует как рецептор антитела для распознавания антигена.
С11 антитело изобретения при связывании с поверхностным IgM, экспрессированным на клетках В-лимфомы, индуцирует апоптоз в быстрой и эффективной манере (см. Пример 1 и Таблицу 1). В противоположность идиотип-специфичным анти-IgM антителам, ранее использованным в клинике для лечения В-лимфомы, С11 антитело связывается с не-полиморфным эпитопом, экспрессируемым на В-клетках от различных доноров, и таким образом, является пригодным для лечения пациентов, страдающих В-лимфомой, независимо от идиотипа В-лимфомы.
В особенности, эффекторная молекула, например, анти- IgM антитело, может также быть любым типом специфически связывающей молекулы, которая вызывает апоптоз в IgM-экспрессирующих клетках различных идиотипов.
Кинетика В1-, В11- и С11-индуцированного апоптоза была быстрой, с максимальной эффективностью, наблюдавшейся уже спустя 3 часа в некоторых клеточных линиях. Быстрая эффекторная функция важна для лечебной эффективности, поскольку это снижает риск уклонения опухоли в результате, например, отсутствия экспрессии опухолевого антигена (Uyttenhove et al., J. Exp. Med. 1983; 157:1040-52; Kennedy et al., Br J Haematol 2002; 119:412-6) или мутации эпитопа (Weiner et al., J Immunol 1989; 142:343-51; Bai et al., J. Clin. Invest. 2003; 111:1487-96), и способно ограничить длительность лечения и побочные эффекты (Robert et al., Lancet Oncol 2005; 6:491-500).
Предпочтительно клеткой-мишенью является иммунная клетка или эпителиальная клетка и особо предпочтительно, чтобы иммунная клетка была В-лимфоцитом.
Удобно, чтобы клетка-мишень была связана с заболеванием. Предпочтительно, заболевание выбирают из группы, состоящей из: онкологического заболевания, аутоиммунного заболевания, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно, заболевание является онкологическим, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
Как определено в разделе определений данной заявки, фраза «молекула антитела» применяется для удобства и охвата, среди прочего, антител, фрагментов антител и производных антител.
Предпочтительно, молекулой антитела является IgG. IgG может быть представлен IgG1, IgG2, IgG3 или IgG4, но предпочтительно IgG1 и IgG4. Молекула антитела является предпочтительно гуманизированной или человеческой.
Предпочтительно, связывающая молекула или молекула антитела изобретения имеет последовательность любой из последовательностей вариабельного региона из Фигуры 9-11 или ее функционально эквивалентных гомологов.
В одном воплощении изобретения связывающая молекула или молекула антитела имеет последовательности вариабельных регионов из Фигуры 9 или их функционально эквивалентных гомологов.
В другом воплощении изобретения, связывающая молекула или молекула антитела имеет последовательности вариабельных регионов из Фигуры 10 или их функционально эквивалентных гомологов.
В еще одном воплощении изобретения, связывающая молекула или молекула изобретения имеет последовательность вариабельных регионов из Фигуры 11 или их функционально эквивалентных гомологов.
В четвертом аспекте изобретения обеспечивается нуклеиновая кислота, имеющая нуклеотидную последовательность, кодирующую связывающую молекулу или молекулу антитела, как указано в любом из предыдущих пунктов.
Предпочтительно нуклеиновая кислота имеет нуклеотидную последовательность из любой из фигур 9-11.
В пятом аспекте изобретения обеспечивается применение связывающей молекулы или молекулы антитела, как определено в первом или втором аспекте изобретения, для диагностики и/или лечения, и/или профилактики заболевания, требующего разрушения клетки-мишени. Также предусматривается применение связывающей молекулы или молекулы антитела, как определено в первом или втором аспекте изобретения, в производстве медикамента для лечения и/или профилактики заболевания, требующего разрушения клетки-мишени.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
Предпочтительно, заболевание, при котором применяется лечение, выбирают из группы, состоящей из: онкологических заболеваний; аутоиммунных заболеваний, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно заболевание, при котором применяется лечение, является онкологическим заболеванием, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В одном воплощении изобретения связывающая молекула или молекула антитела связывается специфически с ICAM-1 и/или имеет последовательность из фигуры 10, и применяется в отношении заболеваний, перечисленных выше.
В другом воплощении изобретения молекула антитела связывается специфически с HLA-DR/DP и/или имеет последовательность из фигуры 9, и применяется в отношении заболеваний: лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В еще одном воплощении изобретения молекула антитела связывается специфически с поверхностным IgM и/или имеет последовательность из фиг.11 и применяется в отношении заболеваний: лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В шестом аспекте изобретение обеспечивается фармацевтическая композиция, включающая связывающую молекулу или молекулу антитела изобретения и фармацевтически пригодный носитель, наполнитель или разбавитель.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
В седьмом аспекте изобретения обеспечивается in vitro способ индукции апоптоза в клетке-мишени, включающий этапы:
(i) обеспечения одной или более клеток-мишеней;
(ii) обеспечения одной или более связывающих молекул, как определено в первом воплощении изобретения;
(iii) обработки клеток-мишеней согласно (i) связывающими молекулами или молекулами антител согласно (ii), с индукцией таким образом апоптоза в клетках-мишенях.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
Предпочтительно клетки-мишени, обеспечиваемые на этапе (i), являются иммунными клетками или эпителиальными клетками. Предпочтительно, иммунные клетки являются В-лимфоцитами.
Предпочтительно клетки-мишени связаны с заболеванием, где заболевание выбирают из группы, состоящей из: онкологических заболеваний; аутоиммунных заболеваний, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно, заболевание является онкологическим заболеванием, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстого кишечника и рака простаты.
Значения применяемых терминов
Предполагается, что термин «молекула антитела» относится к любому из фрагмента антитела, или производного антитела. Он предназначен для охвата природных антител, синтетических антител, рекомбинантных антител или гибридов антител, таких как, без ограничений, одноцепочечные модифицированные молекулы антител, вырабатываемые фагом, отображающим вариабельные и/или константные участки легкой и/или тяжелой цепи иммуноглобулина, или другие иммунореактивные молекулы, способные связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники.
Термин «фрагмент антитела» применяется в отношении любого антитела, фрагмента антитела, или производного антитела. Он предназначен для охвата природных антител (т.е. молекулы, включающей четыре полипептидных цепи), синтетических антител, рекомбинантных антител или гибридов антител, таких как, без ограничений, одноцепочечные модифицированные молекулы антител, вырабатываемые фагом, отображающим вариабельные и/или константные участки легкой и/или тяжелой цепи иммуноглобулина, или другие иммунореактивные молекулы, способные связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники.
Термин «производное антитела» относится к модифицированной молекуле антитела, которая способна связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники, такой как фрагмент антитела (например, Fab или Fv фрагмент), или модифицированная молекула антитела, которая модифицирована добавлением одной или более аминокислот или других молекул для облегчения связывания антител с другим пептидом или полипептидом, с большим белком-носителем или с твердой подложкой (например, с аминокислотами тирозином, лизином, глутаминовой кислотой, аспарагиновой кислотой, цистеином и их производными, NH2-ацетильными группами или СООН-концевыми амидо-группами, среди прочего).
Термин "ScFv молекула" относится к любой молекуле, где VH и VL домены-партнеры соединены посредством гибкого олигопептида.
Термины «нуклеотидная последовательность» или «нуклеиновая кислота» или «полинуклеотид» используются взаимозаменяемо и по отношению к гетерополимеру нуклеотидов или последовательности этих нуклеотидов. Эти фразы также относятся к ДНК или РНК геномного или синтетического происхождения, которые могут быть одноцепочечными или двухцепочечными и могут представлять смысловую и антисмысловую цепь, к пептидной нуклеиновой кислоте (ПНК) или к любому ДНК-подобному или РНК-подобному материалу. В этих последовательностях А является аденином, Ц является цитозином, Т является тимином, Г является гуанином, а N является А, Ц, Г или Т(У). Понятно, что когда полинуклеотид является РНК, Т (Тимин) в представленной последовательности заменяется на У (урацил). В целом, сегменты нуклеиновых кислот, обеспечиваемые этим изобретением, могут быть собраны из фрагментов генома и коротких олигонуклеотидных линкеров, или из серий олигонуклеотидов, или из индивидуальных нуклеотидов, для обеспечения синтетической нуклеиновой кислоты, которая способна экспрессироваться в рекомбинантную транскрипционную единицу, включающую регуляторные элементы, полученные из микробного или вирусного оперона, или эукариотического гена.
Термин «полипептид», или «пептид», или «аминокислотная последовательность» относится к олигопептидной, пептидной, полипептидной или белковой последовательности или ее фрагменту и к молекулам природного происхождения или синтетическим. Полипептидный «фрагмент», «порция» или «сегмент» является последовательностью из аминокислотных остатков из по крайней мере 5 аминокислот, предпочтительно по крайней мере 7 аминокислот, наиболее предпочтительно из по крайней мере 17 или более аминокислот. Чтобы быть активными, любые полипептиды должны иметь достаточную длину для проявления биологической и/или иммунологической активности.
Термины «очищенный» или «существенно очищенный», как применяются здесь, обозначают, что указанные нуклеиновая кислота или полипептид присутствуют в основном свободными от других биологических макромолекул, например, полинуклеотидов, белков, и тому подобного. В одном воплощении, полинуклеотид или полипептид очищают так, что он состоит по крайней мере на 95% по весу, более предпочтительно по крайней мере на 99% по весу, из указанных представленных биологических макромолекул (но могут присутствовать вода, буферы, или другие малые молекулы, в особенности молекулы с молекулярной массой менее 1000 дальтон).
Термин «выделенный», как применяется здесь, относится к нуклеиновой кислоте или полипептиду, отделенному от по крайней мере одного другого компонента (например, нуклеиновой кислоты или полипептида), присутствующего с нуклеиновой кислотой или полипептидом в его природном источнике. В одном воплощении, нуклеиновая кислота или полипептид находятся в присутствии (если есть) только растворителя, буфера, иона или другого компонента, обычно присутствующего в его растворе. Термины «выделенный» и «очищенный» не охватывают нуклеиновые кислоты или полипептиды, присутствующие в их природном источнике.
Термин «рекомбинантный», как применяется здесь по отношению к полипептиду или белку, означает, что полипептид или белок получены из рекомбинантных (например, микробных, насекомых или млекопитающих) систем экспрессии. «Микробный» относится к рекомбинантным полипептидам или белкам, приготовленным из бактериальных или грибковых (например, дрожжевых) систем экспрессии. Как продукт «рекомбинантный микробный» обозначает полипептид или белок, по существу свободный от нативных эндогенных субстанций и не сопровождающийся связанным нативным гликозилированием. Полипептиды или белки, экспрессируемые в большинстве бактериальных культур, например, Escherichia coli, свободны от модификаций гликозилирования; полипептиды или белки, экспрессируемые в грибках, имеют форму гликозилирования, в общем отличающуюся от той, что экспрессируется в клетках млекопитающих.
Термин «избирательное связывание» и «избирательность связывания» указывает, что вариабельные участки антител изобретения распознают и связывают исключительно полипептиды изобретения (т.е. способны различать полипептид изобретения от других сходных полипептидов несмотря на идентичность, гомологию, или сходство последовательности, найденную в семействе полипептидов), но могут также взаимодействовать с другими белками (например, белком A Staphylococcus aureus или другими антителами в методике ИФА) посредством взаимодействий с последовательностями вне вариабельного участка антител, и в частности, в константном участке молекулы. Скрининговые анализы для определения избирательности связывания антител изобретения хорошо известны и рутинно практикуются в данной области техники. По исчерпывающему обсуждению таких анализов, см. Harlow et al., (Eds), Antibodies A Laboratory Manual; Cold Spring Harbor Laboratory; Cold Spring Harbor, N.Y. (1988), Chapter 6. Антитела, которые распознают и связывают фрагменты полипептидов изобретения, также обдуманы, обеспечивая, что антитела в первую очередь и наиболее избирательны для, как определено выше, полипептидов полной длины изобретения. Как с антителами, которые избирательны в отношении полипептидов полной длины, антитела изобретения, которые распознают фрагменты, являются теми, которые могут различать полипептиды из одного и того же семейства полипептидов несмотря на присущую идентичность, гомологию, или сходство, найденные в семействе белков.
Термин «аффинность связывания» включает обозначение силы связывания между молекулой антитела и антигеном.
Под термином «иммунная клетка» мы подразумеваем любые клетки, которые вовлекаются в иммунитет хозяина или воспалительный ответ, включая, но не ограничиваясь, В-клетки и Т-клетки.
Под термином «эпителиальная клетка» мы подразумеваем клетку эпителия. Эпителий является тканью, состоящей из слоя клеток. Эпителий может выстилать внутреннюю (например, эндотелий, который выстилает внутреннюю сторону кровеносных сосудов) или внешнюю (например, кожа) свободную поверхность тела.
Самый крайний слой нашей кожи построен из чешуйчатых эпителиальных клеток, как и слизистые мембраны, выстилающие внутреннюю поверхность рта и полостей тела. Внешние эпителиальные клетки выстилают внутреннюю часть легких, желудочно-кишечного тракта, репродуктивного и мочевого трактов и составляют экзокринные и эндокринные железы. Функции эпителиальных клеток включают секрецию, абсорбцию и защиту. Эпителиальные клетки находятся на базальной мембране.
Краткий перечень чертежей
Примеры, воплощающие конкретные предпочтительные аспекты изобретения, описаны со ссылкой на следующие чертежи, на которых:
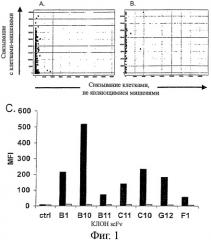
Фигура 1 - scFv, выделенный дифференциальным биопэннингом цельных клеток/ клеточных мембранных везикул, показывает высокую специфичность в отношении клеток-мишеней
Клоны scFv, выделенные дифференциальным биопэннингом, экспрессировали в Е.coli TOP10 клетках, и инкубировали с клетками Ramos или Jurkat и (А) scFv клонами, экспрессированными для первичного скрининга, или (В) семьюдесятью двумя произвольно выбранными и повторно экспрессированными scFv клонами. Связывание scFv выявляли с анти-Гис-MAb, и Су5-анти-мышиными поликлональными антителами. Клеточное связывание выявляли на макроконфокальном устройстве для скрининга с высокой производительностью FMAT. Клеточное связывание отображали в виде средней интенсивности флуоресценции с Ramos клетками-мишенями (Y-ось) и клетками не-мишенями Jurkat (Х-ось). (С) Связывание семи уникальных scFv клонов с клетками Ramos (закрашенные прямоугольники) и клетками Jurkat (не закрашенные прямоугольники). Контрольный scFv (ctrl) не связывается с какими-либо клетками.
Фигура 2. Индукция апоптоза анти-Ramos scFv
Клетки В-лимфомы Ramos последовательно инкубировали с анти-Ramos scFv, анти-Гис-mAb, и анти-мышиными поликлональными Ab на льду (с периодической отмывкой для удаления избытка несвязанного антитела), и инкубировали в увлажненной атмосфере при 5% CO2 и 37°С в течение 24 часов. Клетки собирали и подвергали комбинированному окрашиванию Аннексином V-AF488 (AV) и пропидиум-иодидом (PI). Клетки были оценены как жизнеспособные (AV- PI-, закрашенные круги Фиг.2С), ранние апоптотические (AV+ PI-, не закрашенные треугольники Фиг.2С), или поздние апоптотические/некротические (AV+PI+, не закрашенные ромбы Фиг.2С), на основании дифференциальной позитивности по AV и PI окрашиванию (определенному по квадратным координатам на Фиг.2 В). Результаты представлены построением (А) рассеяния в переднем направлении (FSC-высота) рассеяния в боковом направлении и (В) AV (FL-1) против PI (FL-3). Титруемый эффект scFv B1 и F1 также представлен (С). Семь уникальных клонов scFv инкубировали с клетками В-лимфомы (D) Ramos или (Е) Raji при 37°С в течение 24 часов при различной концентрации, и изучали влияние на индукцию апоптоза. Три scFv; B1, B11 и С11 показали титруемую активность по отношению к обеим клеточным линиям, в то время как апоптоз-индуцирующая способность scFv В10, С10, и G12 ограничивалась клетками В-лимфомы Ramos.
Фигура 3. Специфичности выделенных антител, включая HLA-DR/DP, IgM, и ICAM-1
A) 50-600×106 клеток В-лимфомы Raji лизировали с неионным детергентом Тритоном Х-100 при 0,5% об./об. и осаждали иммунопреципитацией со 100 мкг полного человеческого IgG1 формата B1 (полоса 1) и B11 (полоса 2) антитела, с последующей перекрестной сшивкой с Протеин-А-Сефарозой. Лизаты клеток В-лимфомы Ramos из 50×106 клеток использовали для осаждения 20 мкг С11 (полоса 3). Антитело-специфические полосы вырезали и подвергали расщеплению трипсином, и анализировали с помощью MALDI-TOF.
B) Связывание B1 IgG, B11 IgG и С11 IgG с клетками В-лимфомы специфически блокировалось пре-инкубированием с анти-HLA-DR/DP, анти-ICAM-1 или анти-IgM антителами, соответственно.
Чтобы подтвердить идентичность найденных с помощью MALDI-TOF антигенов клонов антител B1, B11 и С11, были проведены исследования по блокированию с коммерчески доступными антителами, с анализом проточной цитометрией. Клетки были предварительно блокированы с 10-кратным молярным избытком (по сравнению с человеческими антителами) видоспецифических блокирующих антител в течение 1 часа, с последующим добавлением какого-либо из выделенных клонов человеческих антител. Спустя 30 минут, клетки отмывали и выявляли связывание человеческого антитела с клетками при помощи ПЭ-конъюгированного козьего анти-человеческого IgG (Caltag Laboratories, Берлингейм, Калифорния, США). Блокирующими антителами, используемыми в исследовании, были: для B1 - мышиные моноклональные анти-HLA DR (Sigma, клон HK14) или анти-CD40 антитела (Beckton Dickinson, клон 5С3); для В11 - кроличьи поликлональные анти-ICAM-1 (Abcam, ab7815-250) или анти-CD22 антитела (Abeam, ab25135-100); для С11 - козьи поликлональные анти-IgM (Zymed, Южный Сан-Франциско, Калифорния, США, 62-7500) или анти-IgG антитела (Zymed, 62-8400).
Фигура 4. ICAM-1 рецептором поверхности клетки, ассоциированным с В-лимфомой, способным опосредовать программируемую клеточную гибель
А. 2 мкг/мл В11 или анти-ФИТЦ-8 (контроль) IgG1 добавляли к 4×105 клеток В-лимфомы CL-01, инкубировали в течение 2 часов на льду, с последующим добавлением 10 мкг/мл перекрестно-связанных вторичных Fab'2 козьих анти-человеческих Fc антител. Клетки инкубировали при 37°С в течение 6 часов, и определяли эффект инкубации с антителами посредством двух независимых анализов апоптоза. Клетки окрашивали или AV/PI (верхняя панель), подобно тому, как описано выше, или инкубацией с 5 мкг/мл реагентом JC-1, деполяризующим мембрану митохондрий, в течение 30 мин при комнатной температуре (нижняя панель). Индукцию апоптоза обнаруживали по снижению отношения интенсивности красной (у-ось)/ зеленой (х-ось) флуоресценции. (В) Гистологическая секция показывает примерное связывание В11 антител с тканью В-лимфомы. Криоконсервированную ткань, взятую от пациента с анапластической крупноклеточной В-лимфомой, окрашивали с В11 или ФИТЦ-8 (контроль) scFv антителом. Связывание антител выявляли с DAB (коричневое окрашивание). Вложенная картинка показывает окрашивание с контролем scFv. (С) CD45-PerCp-Cy5.5 mAb предварительно меченые Ramos клетки смешивали с полученными от донора мононуклеарными клетками периферической крови (PBMCs), и окрашивали различные популяции клеток флуорохром-конъюгированными CD-специфическими антителами и Alexa Fluor 647 Zenon предварительно меченым В11 IgG1 или контрольным ФИТЦ-8 IgG1. IgG B11 связывание с различными клеточными популяциями регистрировали на FL4 канале.
Фигура 5. Аффинность IgG B1 и IgG B11 в отношении клеток В-лимфомы
Клетки Raji (левые панели, IgG B1) или клетки Ramos (правые панели, IgG B11) инкубировали с повышающимися коли