Способ получения безметионинового интерферона-альфа2b человека
Иллюстрации
Показать всеИзобретение относится к микробиологической промышленности, медицинской биотехнологии и генной инженерии. Предложен новый способ получения безметионинового интерферона-альфа2b человека. Вначале конструируют рекомбинантные плазмидные ДНК, содержащие ген интерферона-альфа2b человека, перед которым расположен сайт протеолиза энтеропептидазой, и трансформируют ими клетки Escherichia coli. Культивируют клетки и выделяют тельца включения синтезированного предшественника. Затем осуществляют частичную ренатурацию выделенного предшественника в присутствии препятствующего замыканию дисульфидных связей дитиоэритриола. Проводят гидролиз предшественника ферментом энтеропептидазой с образованием безметионинового интерферона-альфа2b человека. После завершения реакции гидролиза предшественника проводят полную ренатурацию интерферона-альфа2b человека в присутствии способствующей замыканию дисульфидных связей пары соединений цистин и цистеин. Очистка полученного белка осуществляется методом хроматографии на КМ-сефарозе. 5 ил.
Реферат
Изобретение относится к микробиологической промышленности, медицинской биотехнологии, генной инженерии и представляет способ получения безметионинового интерферона-альфа2b человека.
Использование интерферонов в медицинской практике позволяет добиться значительных успехов в терапии онкологических и вирусных заболеваний [Pestka S. et al. Inter-ferons, interferon-like cytokines, and their receptors. Immunol Rev. 2004, 202:8-32; Masci P. et al. New and modified interferon alias: preclinical and clinical data. Curr Oncol Rep. 2003, 5(2):108-13]. В настоящее время широчайшее применение находят рекомбинантные интерфероны-альфа, полученные экспрессией в бактериях Escherichia coli [Baron E. et al. From cloning to a commercial realization: human alpha interferon. Crit Rev Biotechnol. 1990, 10(3):179-90.].
Основная проблема при выделении и очистке таких рекомбинантных белков - это наличие N-концевого метионина с остатком муравьиной кислоты. В норме в E.coli этот формилированный метионин удаляется двумя ферментами: пептидил-деформилазой, удаляющей остаток муравьиной кислоты с метионина, и метионинаминопептидазой, удаляющей сам N-концевой метионин. Но при суперэкспрессии в бактериях рекомбинантных белков количеств данных ферментов не хватает для эффективного протеолиза [Meinnel Т, Mechulam Y, Blanquet S. Methionine as translation start signal: a review of the enzymes of the pathway in Escherichia coli. Biochimie. 1993; 75(12):1061-75.].
В заявляемом способе предложено использовать фермент энтеропептидазу, которую с успехом используют в белковой инженерии [Mann NS et al. Enterokinase. Proc Soc Exp Biol Med. 1994; 206(2):114-8; Light A. et al. Enterokinase (enteropeptidase): comparative aspects. Trends Biochem Sci. 1989; 14(3):110-2]. Субстратом данного фермента является пептидная последовательность из 4-х остатков аспарагиновой кислоты и лизина - Asp-Asp-Asp-Asp-Lys (D4K в однобуквенном коде) [Likhareva VV et al. New substrates for enteropeptidase. I. Biologically active hepta-nonapeptides. Bioorg Khim. 2003 (2): 129-34.]. Таким образом, введя данный пептидный участок в аминокислотную последовательность интерферона-альфа2b человека непосредственно после N-концевого формилметионина, можно, после обработки энтеропептидазой, получить готовый к использованию безметиониновый интерферон-альфа2b человека.
Сведений об использовании энтеропептидазы для получения безметионинового интерферона-альфа2b человека в источниках информации не обнаружено.
Ближайшим аналогом заявляемого способа является способ (KR 20000065580) получения безметионинового интерферона-альфа2b человека путем его выщепления ферментом метионинаминопептидазой из синтезированного в клетках штамма E.coli КССМ 10053 белка-предшественника, являющегося метионинсодержащим интерфероном-альфа2b человека.
Задачей заявляемого изобретения является расширение арсенала способов получения безметионинового интерферона-альфа2b человека.
Задачу решают путем конструирования
- рекомбинантной плазмидной ДНК pSX51, кодирующей синтез предшественника безметионинового интерферона-альфа2b человека, имеющей размер 3236 п.н., содержащей ген интерферона-альфа2b человека с сайтом Asp-Asp-Asp-Asp-Lys для протеолиза энтеропептидазой под контролем лактозного и триптофанового промотеров, имеющий нуклеотидную последовательность SEQ ID NO 1;
- рекомбинантной плазмидной ДНК pIAH-417, кодирующей синтез предшественника безметионинового интерферона-альфа2b человека, имеющей размер 6177 п.н., содержащей ген интерферона альфа-2b человека с сайтом Asp-Asp-Asp-Asp-Lys для протеолиза энтеропептидазой и гексагистидиновым тагом под контролем индуцибельного промотера поздних генов фага Т7, имеющий нуклеотидную последовательность SEQ ID NO 2;
- рекомбинантного штамма Escherichia coli ВКПМ В-10390 - продуцента предшественника безметионинового интерферона-альфа2b человека, полученного трансформацией штамма Escherichia coli BL21 плазмидной ДНК, содержащей ген, соответствующий нуклеотидной последовательности SEQ ID NO 1;
- рекомбинантного штамма Escherichia coli ВКПМ В-10391 - продуцента предшественника безметионинового интерферона-альфа2b человека, полученного трансформацией штамма Escherichia coli BL21DЕ3 плазмидной ДНК, содержащей ген, соответствующий нуклеотидной последовательности SEQ ID NO 2,
а также разработки способа получения безметионинового интерферона-альфа2b человека путем микробиологического синтеза его предшественника путем культивирования бактерий Escherichia coli, содержащих плазмиды с генами интерферона-альфа-2b человека и сайт протеолиза энтеропептидазой Asp-Asp-Asp-Asp-Lys, выделение телец включения синтезированного предшественника, частичную ренатурацию выделенного предшественника в присутствии препятствующего замыканию дисульфидных связей дитиоэритритола, гидролиз предшественника ферментом энтеропептидазой с образованием безметионинового интерферона альфа-2b человека, а после завершения реакции гидролиза предшественника полную ренатурацию интерферона альфа-2b человека в присутствии способствующей замыканию дисульфидных связей пары соединений цистин и цистеин, с последующей очисткой безметионинового интерферона альфа-2b человека методом хроматографии на КМ-сефарозе.
Для решения задачи получают рекомбинантную плазмидную ДНК pSX51, состоящую из мультикопийного вектора pSX с включенным в него геном гибридного интерферона-альфа2b человека под контролем лактозного (Plac) и триптофанового промотеров (Ptrp). Ген гибридного интерферона-альфа2b представляет собой лидерный пептид Met-Ala-Asp-Asp-Asp-Asp-Lys (MAD4K), обеспечивающий эффективный протеолиз по сайту D4K↓ ферментом энтеропептидазой, и структурную часть гена интерферона-альфа2b человека с нуклеотидными заменами, обеспечивающими эффективный синтез белка в E.coli (37 (А→С), 39 (G→T), 40 (A→C), 42 (G→T), 67 (A→C), 69 (G→T), 70 (A→C), 72 (A→T), 96 (G→A), 100 (A→C), 102 (A→T), 114 (A→C), 120 (C→G), 126 (G→A), 129 (G→A), 330 (С→G), 339 (G→A), 342 (G→A), 487 (A→C), 489 (A→T), 495 (G→A)). Штамм E.coli BL21, трансформированный рекомбинантной плазмидой pSX51, за 12-14 часов ферментации накапливает 200 мг предшественника безметионинового интерферона-альфа2b человека на 1 л культуральной жидкости при культивировании в минеральной среде М9 (мас.%: Na2HPO4 - 17,2, КН2РO4 - 3, NaCl - 0,5, NH4Cl - 0,1, вода - остальное), содержащей 2 мл/л 1М MgSO4x7H2O, 1% кислотного гидролизата казеина, 1% глюкозы исходно и 40 мкг/мл канамицина сульфата при температуре 38-39°С. Наблюдаемый эффект достигается, во первых, за счет введения в реципиентную клетку Е.coli мультикопийного вектора (количество копий клонированного гена составляет 200-300 копий на геномный эквивалент), а, во-вторых, за счет использования двух сильных конститутивных промотеров, обеспечивающих эффективную транскрипцию клонированного гена. Заявляемый штамм E.coli BL21/pSX51 депонирован во Всероссийской коллекции промышленных микроорганизмов и имеет регистрационный номер ВКПМ В-10390.
Для решения задачи получают также рекомбинантную плазмидную ДНК pIAH-417, состоящую из вектора рЕТ16b с включенным в него геном гибридного интерферона-альфа2b человека под контролем индуцибельного промотера поздних генов фага Т7. Отличие гена гибридного интерферона-альфа2b человека в составе вектора pIAH-417 от такового в составе вектора pSX51 состоит во введении дополнительного участка нуклеотидной последовательности, кодирующей 6 остатков гистидина перед сайтом D4K4↓. Штамм E.coli BL21DE3, трансформированный рекомбинантной плазмидой pIAH-417 за 12-14 часов ферментации в среде LB/M9 (мас.%: NaCl - 1, бакто-триптона - 1, дрожжевого экстракта - 0,5, 2 мл/л 2М NaOH, среда М9 - остальное), содержащей 0,2% фруктозы исходно и 150 мкг/мл ампициллина, при температуре 37°С накапливает 100 мг предшественника безметионинового интерферона-альфа2b человека на 1 л культуральной жидкости. Условия индукции Т7-промотера: 20 г лактозы на 1 л культуральной среды; индукция проводится по достижении плотности бактериальной культуры 15 опт.ед. Заявляемый штамм E.coli BL21DE3/pIAH-417 депонирован во Всероссийской коллекции промышленных микроорганизмов и имеет регистрационный номер ВКПМ В-10391.
Конструирование штамма ВКПМ В-10390 и способ получения безметионинового интерферона-альфа2b человека с использованием этого штамма состояли из нескольких этапов.
Этап 1. Создание генно-инженерными методами гена гибридного интерферона-альфа2b человека, содержащего последовательность, кодирующую лидерный пептид MAD4K, и введение в данный ген сайтов для эндонуклеаз рестрикции.
Этап 2. Конструирование рекомбинантной плазмиды pSX51, основными характеристиками которой являются высокая копийность (200-300 копий на геномный эквивалент), удобный селективный маркер (устойчивость к антибиотику канамицину), 2 сильных промотера, обеспечивающих в штаммах E.coli эффективную экспрессию клонированного гена интерферона-альфа2b.
Этап 3. Трансформация сконструированной рекомбинантной плазмидой pSX51 штамма E.coli BL21, подтверждение соответствия нуклеотидной последовательности клонированного гена с последовательностью гена гибридного интерферона-альфа2b.
Этап 4. Ферментация полученного штамма E.coli BL21/pSX51 на минеральной среде М9, содержащей 1% кислотного гидролизата казеина, 1% глюкозы, 40 мкг/мл канамицина сульфата, при температуре 38-39°С.
Этап 5. Выделение из культуральной жидкости телец включения и растворение в 6М гуанидине. Частичная ренатурация белка и обработка ферментом энтеропептидазой.
Этап 6. Завершение ренатурации и очистка интерферона-альфа2b человека без N-концевого метионина от негидролизованной формы путем ионообменной хроматографии на карбоксиметилсефарозе (КМ-сефароза).
Конструирование штамма ВКПМ В-10391 и способ получения безметионинового интерферона-альфа2b человека с использованием этого штамма состояли из тех же этапов, что и в случае штамма ВКПМ В-10390, за несколькими исключениями: 1) ген гибридного интерферона-альфа2b человека содержал последовательность, кодирующую лидерный пептид MAH6D4K; 2) селективный маркер вектора pIAH-417 - устойчивость к антибиотику ампициллину; 3) используемый промотер - индуцибельный промотер поздних генов фага Т7; 4) сконструированной рекомбинантной плазмидой pIAH-417 трансформируют штамм E.coli BL21DE3; 5) ферментация полученного штамма E.coli BL21DE3/pIAH-417 осуществляется в среде LB/M9, содержащей 0,2% фруктозы исходно и 150 мкг/мл ампициллина, при температуре 37°С; 6) очистку интерферона-альфа2b человека без N-концевого метионина от негидролизованной формы проводят либо путем ионообменной хроматографии на КМ-сефарозе, либо хроматографической очистки на Ni-NTA-агарозе, либо последовательно путем ионообменной хроматографии на КМ-сефарозе и хроматографической очистки на Ni-NTA-агарозе.
Штаммы E.coli ВКПМ В-10390 и E.coli ВКПМ В-10391 обладают следующими культурально-морфологическими и физиолого-биохимическими признаками.
1. Морфологические признаки. Клетки - прямые палочки, 1,1-1,5×2.0-6,0 мкм, подвижные за счет перитрихальных жгутиков, грамотрицательные, неспороносные.
2. Культуральные признаки. Клетки штамма хорошо растут на стандартных, описанных для E.coli средах. При выращивании на полноценных агаризованных средах (LB-агар, агаризованная среда Хоттингера) колонии блестящие, гладкие, круглые, с ровными краями. При 37°С достаточно 12-14 часов роста. При выращивании в жидких средах в пробирках клетки образуют равномерную муть, достигая оптической плотности 2,4-2,6 при длине волны 600 нм за 10-12 часов роста при 37°С.
3. Физиолого-биохимические признаки. Температурный оптимум для роста клеток 37°С, факультативный анаэроб, оксидазоотрицательные, каталазоположительные, отрицательные по признакам образования H2S, гидролиза мочевины и активности липазы, катаболизируют D-глюкозу и другие углеводы с образованием кислоты и газа, источником азота могут служить минеральные соли в аммонийной форме, а также органические соединения в виде пептона, триптона, дрожжевого экстракта и аминокислот.
4. Генотипические признаки. Основной генотипический признак заявляемого штамма E.coli ВКПМ В-10390 (В F- dcm ompT hsdS(rB- mB-) gal) состоит в наличии гена предшественника безметионинового интерферона-альфа2b человека (с последовательностями, кодирующими сайт D4K для протеолиза ферментом энтеропептидазой) под регуляцией лактозного (Plac) и триптофанового промотеров (Ptrp), интегрированного в состав многокопийного экспрессионного вектора, содержащего в качестве селективного маркера ген устойчивости к канамицину. Основной генотипический признак заявляемого штамма E.coli ВКПМ В-10391 (В F- dcm ompT hsdS(rB- mB-) gal λ(DE3)) состоит в наличии гена предшественника безметионинового интерферона-альфа2b человека (с последовательностями, кодирующими сайт D4K для протеолиза ферментом энтеропептидазой и гексагистидиновой участок для очистки на Ni-NTA-агарозе) под регуляцией индуцибельного Т7-промотера, интегрированного в состав экспрессионного вектора, содержащего в качестве селективного маркера ген устойчивости к ампициллину.
5. Устойчивость к антибиотикам. Устойчивость к канамицину у штамма E.coli ВКПМ В-10390 не ниже 50 мкг/мл на твердых агаризованных средах, при наращивании в жидких полноценных средах - не менее 40 мкг/мл. Устойчивость к ампициллину у штамма E.coli ВКПМ В-10391 не ниже 150 мкг/мл на твердых агаризованных средах, при наращивании в жидких полноценных средах - не менее 120 мкг/мл.
6. Стабильность плазмиды pSX51 в штамме E.coli ВКПМ В-10390 и плазмиды pIAH-417 в штамме E.coli ВКПМ В-10391. При хранении клеток на агаризованной среде (сроком до 1 месяца), при серии последовательных пересевов (в течение не менее 6 месяцев) и в процессе культивирования в жидкой среде с антибиотиком не происходит потери и перестройки плазмид.
Способ в общем виде
Процесс биосинтеза предшественника безметионинового интерферона-альфа2b человека в штаммах E.coli включает стадии получения посевного материала, основную ферментацию, получение биомассы и выделение из нее фракции телец включения. Выращивание посевного материала и основную ферментацию штамма-продуцента предшественника безметионинового интерферона-альфа2b человека осуществляют в аэробных условиях.
- на минеральной среде М9, содержащей 2 мл/л 1М MgSO4×7H2O, 1% кислотного гидролизата казеина и 1% глюкозы исходно. В среду вносят канамицин в концентрации 40 мг/л. Биомассу выращивают при рН 7.0-7.4 и температуре 38°С-39°С до концентрации 20 оптических единиц (опт.ед.).
Или
- на среде LB/M9, содержащей 0,2% фруктозы исходно. В питательные среды вносят ампициллин в концентрации 150 мг/л. Биомассу выращивают при рН 7.0-7.4 и температуре 37°С.
После завершения процесса ферментации бактериальные клетки отделяют от культуральной среды центрифугированием при 5000 об/мин в течение 15 минут при температуре 4°С и ресуспендируют в буферном растворе, после чего выделяют фракцию телец включения [Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: a Laboratory Manual. - N.Y.: Cold Spring Harbor Laboratory Press, 1989]. Для последующего выделения предшественника безметионинового интерферона-альфа2b человека тельца включения растворяют в 8М гуанидине-НСl и далее проводят частичную ренатурацию белка-предшественника с добавлением восстановителя дитиоэритритола (ДТЭ), предотвращяющего замыкание SH-связей, при температуре 4°С в течение 7-9 часов. Далее ренатурационный раствор закисляют до рН 4,8 и добавляют фермент энтеропептидазу и CaCl2 (конечные концентрации 0,2 U/мл и 2 мМ соответственно). В нашей работе использовали энтеропептидазу, выделенную в ФГУП «ГосНИИгенетика» из слизистой оболочки двенадцатиперстной кишки свиней и очищенную последовательными хроматографиями на DEAE-целлюлозе, бензоамидин-агарозе и Butyl-Toyopearl; для финальной очистки использовали гель-фильтрацию на Toyopearl HW55. Удельная активность полученного препарата составляла 330 U/мг белка, или 12 U/мл (за 1 U энтерокиназной активности принято количество фермента, способного продуцировать за 1 мин при рН 5,0 и 25°С 1 нмоль трипсина из трипсиногена). Препараты энтерокиназы хранили в 50 мМ Трис-НСl буфере, рН 8, содержащем 0,5 М NaCl и 50% глицерин, при -20°С. Гидролиз предшественника безметионинового интерферона-альфа2b человека энтеропептидазой проводят в течение 16 часов при температуре 14°С-16°С. Ферментативную реакцию останавливают добавлением раствора мочевины (конечная концентрация 1М), затем добавляют пару соединений цистин и цистеин (конечная концентрация 1 мМ), способствующих замыканию дисульфидных связей, и доводят рН до 8,0 для осуществления полной ренатурации образовавшегося безметионинового интерферона-альфа2b человека. Смесь выдерживают при температуре 4°С в течение 24 час, а затем переходят к стадии хроматографической очистки. Ионообменное разделение безметионинового интерферона-альфа2b человека от негидролизованной формы предшественника проводят на карбоксиметил-сефарозе (КМ-сефарозе) в градиенте рН 5,0-7,0 [Препаративная жидкостная хроматография, под ред. Б.Бидлингмейера. - М.: Мир, 1990].
Заявляемая группа изобретений иллюстрируется следующими чертежами.
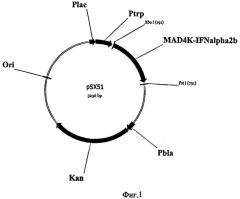
Фиг.1. Физико-генетическая карта рекомбинантной плазмиды рSХ51.
Рекомбинантная плазмида рSХ51 состоит из следующих фрагментов ДНК.
1) Последовательность с 1 нуклеотида по 194 нуклеотид (н.) включает фрагмент ДНК размером 194 п.о., содержащий триптофановый промотер (Ptrp) и последовательность Шайн-Дальгарно, ответственную за инициацию трансляции. 2) Последовательность с 195 н. по 713 н. включает фрагмент ДНК размером 519 п.о., содержащий ген интерферона альфа2b с сайтом для энтеропептидазы (МАD4К-интерферон-альфа2b). 3) Последовательность с 714 н. по 1156 н. включает фрагмент ДНК размером 442 п.о., содержащий последовательность строгого терминатора транскрипции rrnBT1T2. 4) Последовательность с 1157 н. по 2063 н. включает фрагмент ДНК размером 906 п.о., содержащий промотор гена β-лактамазы и структурную область гена kan. 5) Последовательность с 2064 н. по 3236 н. включает фрагмент ДНК размером 1173 п.о., содержащий последовательность, ответственную за репликацию плазмиды (ori) и lac промотер (Plac). XbaI и PstI - сайты рестрикции.
Фиг.2. Физико-генетическая карта рекомбинантной плазмиды pIAH-417.
Последовательность рекомбинантной плазмиды pIAH-417 соответствует стандартному вектору для клонирования pET16b (Novagen, США, кат.номер 69662-3) за исключением вставки по сайтам рестрикции Ncol и BamHI гена МАН6D4К-интерферона-альфа2b. NcoI и BamHI - сайты рестрикции. Amp-R - ген бета-лактамазы, обеспечивающий устойчивость к ампициллину. Ori - последовательность, ответственная за репликацию плазмиды. LacI - ген репрессора LacI. T7-promoter - индуцибельный промотер поздних генов фага Т7.
Фиг.З. Электрофоретическое разделение в денатурирующем 12% ПААГ фракций телец включения Escherichia coli.
М - белковые маркеры с известными молекулярными массами. 1 - образцы телец включения E.coli BL21/pSX50 (интерферон-альфа2b человека), 2 - образцы телец включения E.coli BL21/pSX51 (МАD4К-интерферон-альфа2b), 3 - образцы телец включения E.coli BL21DE3/pIAH-417 (МАН6D4К-интерферон-альфа2b).
Фиг.4. Разделение безметионинового интерферона от негидролизованной формы белка путем ионообменной хроматографии на КМ-сефарозе.
Ионообменное разделение безметионинового интерферона-альфа2b от негидролизованной формы проводят на КМ-сефарозе в градиенте рН 5,0-7,0. Элюирование исследуемых веществ осуществляли градиентом рН: в качестве буфера А использовали 50 мМ MES-Na рН 5,0, буфером Б служил 50 мМ MES-Na рН 7,0 (все буферы содержат 1 мМ ЭД-ТА). По оси абсцисс отложено время (в минутах), по оси ординат - оптическая плотность (в тысячных долях единиц поглощения).
Фиг.5. Электрофоретическое разделение в 12% ПААГ хроматографических фракций.
Номера фракций на фиг.5 соответствуют номерам фракций на фиг.4. Фракции 5 и 6 являются очищенным безметиониновым интерфероном-альфа2b человека.
Пример 1. Конструирование гена MAD4K-IFNальфа2b и создание плазмиды pSX51.
Ген MAD4K-IFNальфа2b получают из ДНК исходной плазмиды pSX50 с геном интерферона-альфа2b человека (предоставлена ООО «Фармапарк» по RU 2319502) методом ПЦР с использованием пары праймеров IFNd4k (5'-GCCTCTAGATGGCGGATGATGATGATAAATGTGATCTGCCTCAAACC-3') и IFN-R (5'-CAGCTGCAGGTCGACGGATCCTC-3'). Состав реакционной смеси: 10х буфер для ПЦР (конечная концентрация в смеси: 75 mM Tris-HCl (рН 8.8 at 25°C), 20 mM (NH4)2SO4, 0.01% (v/v) Tween 20) - 2 мкл, 25 mM MgCl2 (конечная концентрация - 2.5 mM) - 2 мкл, 1.25 mM dNTP (конечная концентрация - 0.125 mM) - 2 мкл, праймеры IFNd4k и IFN-R - по 5 pmol на реакцию каждого, ДНК pSX50 - 2 нг на реакцию, Taq-полимераза - 5 ед.акт. на реакцию, mQ H2O (деионизованная) - до 20 мкл. Амплификацию проводят в условиях: предварительная денатурация 94°С - 2 мин, 25 циклов (денатурация 94°С - 10 сек, отжиг праймеров 60°С - 10 сек, элонгация 72°С - 20 сек), заключительная элонгация 72°С - 5 мин. Полученную в ходе ПЦР ДНК наносят на 1% агарозный гель, проводят электрофорез, фрагмент соответствующий размерам гена, вырезают и очищают с помощью набора для выделения Fermentas (Литва). Для проведения дальнейшего клонирования получают плазмиду pSX50 с вырезанным по сайтам XbaI и PstI геном IFNальфа2b (pSX50 rest.). Состав реакционной смеси рестрикции: плазмида pSX50 - 2 мкл (200 нг), 10х буфер Trango Yellow+ (Fermentas (Литва); конечная концентрация в смеси: 33 mM Tris-acetate, рН 7,9, 10 mM Mg-acetate, 66 mM K-acetate, 0,1 mg/ml BSA) - 2 мкл, рестриктаза XbaI - 1 мкл (10 ед.акт.), рестриктаза Pst I - 1 мкл (10 ед.акт.), mQ H2O - 14 мкл. Далее плазмиду pSX50 rest. и ген MAD4K-IF Nальфа2b объединяют в молярном соотношении 1:8 (плазмида: вставка) и рестрицируют по сатам XbaI и PstI. Состав реакционной смеси рестрикции: плазмида pSX50 rest - 2 мкл (150 нг), ген MAD4K-IF Nальфа2b - 5 мкл (200 нг), 10х буфер Trango Yellow+ (Fermentas (Литва); конечная концентрация в смеси: 33 mM Tris-acetate, рН 7,9, 10 mM Mg-acetate, 66 mM K-acetate, 0,1 mg/ml BSA) - 2 мкл, рестриктаза XbaI - 1 мкл (10 ед.акт.), рестриктаза Pst I - 1 мкл (10 ед.акт.), mQ H2O - 9 мкл. Рестрикции проводят при 37°C в течение часа. Полученную смесь осаждают 2,5 объемами 96% этанола с добавлением 1/10 по объему ЗМ ацетата натрия (рН 5,0) в течение 30 минут на -70°C. Далее осадившуюся ДНК откручивают на центрифуге при 13400 об/мин в течение 7 минут, промывают 70% этанолом, центрифугируют еще 2 минуты при 13400 об/мин и высушивают на вакуумной сушке.
Полученную смесь расщепленных гена и плазмиды лигируют в течение 1 часа при 20°C. Состав реакционной смеси лигирования: 10х буфер для лигирования (Fermentas (Литва); конечная концентрация в смеси: 40 mM Tris-HCl, 10 mM MgCl2, 10 mM DTT, 2,5 mМ АТР (рН 7.8 при 25°C)) - 2 мкл, рестриктная смесь pSX50 rest и MAD4K-IFNальфа2b - 10 мкл, Т4-лигаза - 1 мкл (5 ед.акт.), mQ H2O - 7 мкл. Полученную лигазную смесь осаждают 2,5 объемами 96% этанола с добавлением 1/10 по объему З М ацетата натрия (рН 5,0) в течение 30 минут на -70°C. Далее осажденную ДНК центрифугируют при 13400 об/мин в течение 7 мин, промывают 70% этанолом, центрифугируют еще 2 минуты при 13400 об/мин и высушивают на вакуумной сушке. Далее лигазной смесью трансформируют компетентные клетки E.coli BL21 и рассевают на чашке Петри со средой LB с агаром, содержащей 50 мкг/мл канамицина сульфата. Трансформацию проводят химическим методом: лигазную смесь добавляют в компетентные клетки, 30 минут инкубируют на ледяной бане, далее 2 минуты при 42°C, потом добавляют по 1 мл среды LB, 30 минут инкубируют при 37°C и рассевают клетки по чашке. Чашки инкубируют при 37°C в течение ночи.
На следующий день с чашек отбирают клоны на скрининг. Скрининг осуществляют с помощью ПЦР с использованием праймеров Psx1 (5'-TAACTAGTACGCAAGTTCACG-3') и Psx2 (5'-AGACCGCTTCTGCGTTCTG-3'). Состав реакционной смеси: 10х буфер для ПЦР (конечная концентрация в смеси: 75 mМ Tris-HCl (рН 8.8 при 25°C), 20 mM (NH4)2SO4, 0.01% (v/v) Tween 20) - 2 мкл, 25 mM MgCl2 (конечная концентрация - 2.5 mM) - 2 мкл, 1,25 mM dNTP (конечная концентрация - 0.125 mM) - 2 мкл, праймеры - по 5 pmol на реакцию каждого, клетки с колонии - 1 мкл на реакцию, Taq-полимераза - 5 ед.акт. на реакцию, mQ Н2О - до 20 мкл. ПЦР-положительные клоны рассевают на чашке Петри со средой LB с агаром, содержащей 50 мкг/мл канамицина сульфата. На следующий день моноклоны с чашки пересевают в пробирки с жидкой средой LB и культивируют в течение ночи при 37°C. Из полученной культуры выделяют плазмиду с помощью набора для выделения (Fermentas, Литва). В результате получают плазмиду pSX51.
Пример 2. Получение штамма E.coli ВКПМ В-10390 - продуцента предшественника безметионинового интерферона-альфа2b человека.
Полученную плазмиду pSX51 секвенируют на участках, содержащих ген MAD4K-IFNaльфa2b. Реакцию секвенирования проводят на амплификаторе Eppendorf (Германия) по следующей программе: предварительная денатурация 94°C - 2 мин, 25 циклов (денатурация 94°C - 10 сек, отжиг праймеров 60°C - 10 сек, элонгация 72°C - 20 секунд), заключительная элонгация 72°C - 5 минут. Секвенирование проводят с помощью следующих праймеров: Psx1, Psx2, IFinF (5'-GACCCTCCTAGACAAATTCTAC-3'), IFinRev (5'-GGTCATTCAGCTGCTGGTAG-3'), Is1 (5'-CATCAAGGTACGACGGCTAC-3'), Is2 (5'-TCAGAGCAGAAATCATGAGATC-3'). Состав реакционной смеси: десятикратный буфер для секвенирования - 1 мкл, праймер - по 10 pmol на реакцию, плазмида - 200 нг на реакцию, радиоактивная метка (альфа32Р-аАТР, активность 250 mkKu) - 1 мкл, дидезоксирибонуклеозидтрифосфаты-терминаторы - 2 мкл (свой в каждую реакцию), Taq-полимераза - 1 мкл (10 единиц активности), mQ Н2О - до 8 мкл. Остановку реакции осуществляют добавлением реагента StopSolution. Далее продукты реакции секвенирования прогревают до 95°C и наносят на 5% полиакриламидный гель с мочевиной. Электорофорез проводят 4-5 часов. После этого гель вымачивают 20 минут в 10% уксусной кислоте, переносят на лист 3 мм ватмана и высушивают на гель-драйере. Далее гель закладывают в кассету с рентгеновской пленкой и оставляют на ночь в полной темноте. На следующий день пленку проявляют, оценку последовательности нуклеотидов проводят в программе VectorNTI 8.0 (Invitrogen, США). Плазмидой с выверенной нуклеотидной последовательностью трансформируют штамм E.coli BL21. Трансформацию проводят химическим методом: плазмиду в количестве 200 нг добавляют в компетентные клетки, смесь 30 минут инкубируют на ледяной бане, далее инкубируют 2 минуты при 42°C, потом добавляют по 1 мл среды LB, 30 минут инкубируют при 37°C и рассевают клетки по чашке Петри со средой LB с агаром, содержащей 50 мкг/мл канамицина сульфата. Чашки инкубируют при 37°C в течение ночи.
В результате получают штамм E.coli ВКПМ В-10390 - продуцент предшественника безметионинового интерферона-альфа2b человека.
Пример 3. Ферментация штамма E.coli ВКПМ В-10390 и получение безметионинового интерферона-альфа2b человека.
Для препаративной наработки MAD4K-интерферона-альфа2b клетки штамма E.coli ВКПМ В-10390 выращивают на агаризованной LB-среде с канамицином (40 мкг/мл) при 37°C в течение 12-14 часов, затем используют выросшую биомассу для получения посевного материала. Для этого клетки переносят в колбу Эрленмейера на 750 мл со 100 мл среды М9, содержащей ImM MgSO4×7H2O, 1% кислотного гидролизата казеина, 1% глюкозы и 40 мкг/мл канамицина. Культуру выращивают на качалке при интенсивном перемешивании (240 об/мин) при 37°C до оптической плотности 2.4-2.6 (измеренной при длине волны 600 нм). Основное культивирование проводят в ферментерах объемом 3000 мл на среде М9, содержащей ImM MgSO4×7H2O, 1% кислотного гидролизата казеина, 1% глюкозы и 40 мкг/мл канамицина. Ферментацию проводят в условиях термо- и рН-статирования, доза засева 2%, добавляют канамицин - 40 мкг/мл, содержание растворенного кислорода в среде поддерживают на уровне 5%, в качестве источника углерода используют глюкозу в дробной подаче в количестве 1-2 г/л/час, поддержание рН 7.0-7.2 достигают автоматической подтитровкой аммиачной водой. Культуру наращивают в течение 2 часов при температуре 28°C и далее 12-14 часов при температуре 38°C.
Биомассу получают центрифугированием культуральной жидкости при 5000 об/мин при температуре 4°C в течение 10 минут. Полученную биомассу подвергают обработке ультразвуковым излучением до раздробления клеточных стенок и мембран, регистрируемого визуально. Полученную суспензию центрифугируют 20 минут на 13400 об/мин, полученный осадок многократно промывают 1% Triton X-100, получая в итоге фракцию телец включения. 100 мг телец включения растворяют в 1,5 мл 8 М раствора гуанидина-HCl. Через 30 мин к пробам добавляют 120 мкл 0,5 М раствора дитиоэритритола (DTE). Через 4 часа инкубирования при комнатной температуре пробы центрифугируют 10 мин при 20000 об/мин. Затем 1,5 мл полученного супернатанта вносят в 300 мл ренатурационного буфера (20 мМ Tris-HCl рН 8,0; 0,2 М Urea; 20 мМ NaCl, 0,1% Triton X-l 14; 0,2 мМ DTE). Частичную ренатурацию (без замыкания дисульфидных связей Cys 1-Cys 98) осуществляют в течение 10 часов при температуре 4°C.
Для проведения гидролиза предшественника безметионинового интерферона-альфа2b человека (MAD4K-интерферона-альфа2b) энтеропептидазой рН ренатурационного раствора доводят до 4,8 путем добавления 1 М раствора уксусной кислоты, вносят растворы CaCl2 и энтеропептидазы (конечные концентрации 2 мМ и 0,2 U/мл соответственно) и реакционную смесь выдерживают 16 часов при температуре 15°C. Останавливают энтеропептидазную реакцию добавлением в реакционную смесь 8 М раствора мочевины до конечной концентрации 1 М. Для осуществления полной ренатурации полученного безметионинового интерферона-альфа2b в реакционную смесь вносят 100 мМ растворы цистина и цистеина (конечная концентрация 1 мМ) и доводят рН до 8,0 с помощью 1М раствора NaOH. Пробы помещают на 24 часа в холодильник на 4°C, после чего доводят рН до 4,5 уксусной кислотой, центрифугируют 20 мин при 5000 об/мин при температуре 4°С и переходят к стадии хроматографической очистки.
Поскольку в ходе энтеропептидазной реакции 10%-20% MAD4K-интерферона-альфа2b остаются не гидролизованными, разделение MAD4K-интерферона-альфа2b и безметионинового интерферона-альфа2b человека осуществляют путем ионообменной хроматографии реакционной смеси на КМ-сефарозе. Колонку с КМ-Сефарозой (0,5 см × 6,0 см) предварительно промывают 0,2 М NaOH (10 мл); 50 мМ Na-ацетатным буфером рН 5,5, содержащим 1 М NaCl и 1 мМ ЭДТА (10 мл); 50 мМ Na-ацетатным буфером рН 4,5, содержащим 1 мМ ЭДТА (20 мл). Нанесение исследуемых проб на колонку осуществляют при температуре не выше 16°C. Скорость нанесения 1 мл/мин. После прохождения образца колонку промывают 40 мл 50 мМ Na-ацетатного буфера рН 4,5 и 20 мл 50 мМ MES буфера рН 5,0. Элюирование исследуемых веществ осуществляют градиентом рН: в качестве буфера А используют 50 мМ MES-Na рН 5,0, буфером Б служит 50 мМ MES-Na рН 7,0 (все буферы содержат 1 мМ ЭДТА).
В результате получают интерферон-альфа2b человека без N-концевого метионина (безметиониновый интерферон-альфа2b человека), что подтверждают хроматографическим и электрофоретическим методами.
Пример 4. Конструирование гена MAH6D4K-IFNальфа2b и создание плазмиды pIAH-417
Конструирование плазмиды pIAH-417 проводят согласно примеру 1. Отличия заключаются в использовании других праймеров и другого вектора-реципиента для клонирования. Для создания гена MAH6D4K-IFNaльфa2b используют праймеры HIST7 (5'-GCGACCATGGCGCCATCATCATCACCATCACGATGATGATGATAAATGTGATCTGC-3') и IFN-R. В качестве матрицы для наработки нового гена используют плазмиду pSX51. После наработки с помощью ПЦР гена MAH6D4K-IFNальфа2b, его клонируют по сайтам NcoI и BamHI в вектор pET16b (Novagen, США), несущий индуцибельный промотер поздних генов фага Т7.
Пример 5. Получение штамма Е.coli ВКПМ В-10391 - продуцента предшественника безметионинового интерферона-альфа2b человека.
Получение штамма E.coli ВКПМ В-10391 проводят согласно примеру 2 за несколькими исключениями: 1) секвенирование проводят с помощью следующих праймеров: Т7 (5'-TAATACGACTCACTATAGGGG-3'), T7-t (5'-GCTAGTTATTGCTCAGCGGT-3'), IFinF, IFinRev, Is1 и Is2; 2) плазмидой pIAH-417 трансформируют клетки штамма E.coli/BL21DE3, несущего в своем геноме ген РНК-полимеразы фага Т7.
Пример 6. Ферментация штамма E.coli ВКПМ В-10391 и получение безметионинового интерферона-альфа2b человека
Ферментацию штамма E.coli ВКПМ В-10391 проводят согласно примеру 3, за следующими исключениями: 1) ферментацию проводят в среде LB/M9, содержащей 0,2% фруктозы исходно и 150 мкг/мл ампициллина при температуре 37°C; 2) для наработки предшественника безметионинового интерферона-альфа2b человека проводят индукцию Т7-промотера лактозой в количестве 20 г на 1 л культуральной среды; индукцию проводят по достижении плотности бактериальной культуры 15 опт.ед.
Этапы получения очищенного интерферона-альфа2b человека без N-концевого метионина совпадают с таковыми для штамма E.coli ВКПМ В-10390 согласно примеру 3. В качестве дополнительного этапа очистки от негидролизованной формы проводят хроматографическую очистку на Ni-NTA-агарозе [протокол QIAGEN, A handbook for high level expression and purification of 6xHis-tagged proteins, 5th Edition, 2003].
В результате получают интерферон-альфа2b человека без N-концевого метионина (безметиониновый интерферон-альфа2b человека), что подтверждают хроматографическим и электрофоретическим методами.
Способ получения безметионинового интерферона-альфа2b человека, включающий микробиологический синтез белка-предшественника путем культивирования бактерий Escherichia coli, содержащих плазмиды с геном интерферона-альфа2b человека и нуклеотидной последовательностью, кодирующей сайт протеолиза энтеропептидазой Asp-Asp-Asp-Asp-Lys, расположенный перед нуклеотидной последовательностью, кодирующей зрелую часть интерферона-альфа2b человека, с последующим выделением телец включения синтезированного предшественника, частичную ренатурацию выделенного предшественника в присутствии препятствующего замыканию дисульфидных связей дитиоэритритола, гидролиз предшественника ферментом энтеропептидазой с образованием безметионинового интерферона-альфа2b человека, а после завершения реакции гидролиза предшественника полную ренатурацию интерферона-альфа2b человека в присутствии пары соединений цистин и цистеин и очистку полученного безметионинового интерферона-альфа2b человека методом хроматографии на КМ-сефарозе.