Способ изготовления срезов из свежезамороженной ткани лимфатических узлов
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к медицинской диагностике, и может использоваться в диагностике онкогематологических заболеваний. Для получения срезов замораживают биопсийный материал в форме пластинки в n-гексане, охлажденном до температуры -95°С, и изготовливают на криостате срезы толщиной не более 7 мкм. Срез переносится на предметное стекло, помещается в спирто-альдегидный раствор при комнатной температуре (20-25°С) на 3 мин, затем отмывается проточной водой от фиксатора в течение 30 с, окрашивается гистологическими красителями и заключается под покровное стекло обычным образом. Полученные таким способом препараты полностью сохраняют структуру тканей и отдельных клеток и позволяют описывать лимфатические опухоли в соответствии с существующими классификациями. Способ может быть использован при проведении срочных гистологических исследований (интраоперационные биопсии), поскольку позволяет получить заключение в течение 20 мин. Использование способа позволяет сократить трудозатраты на проведение гистологического исследования, необходимого для диагностики, по сравнению со стандартным способом, не ухудшает качество выполняемой работы, и значительно ускоряет выдачу заключений. 3 ил.
Реферат
Изобретение относится к области медицинской диагностики и может использоваться в диагностике опухолевых заболеваний.
Стандартное исследование строения опухолевой ткани в диагностических целях проводится на срезах, полученных из биопсированного материала, зафиксированного раствором формалина, обезвоженного и залитого в парафин или другие синтетические среды (например, парапласт, гистопласт и др.). Процесс обработки ткани, завершающийся изготовлением срезов из парафиновых блоков, длительный и занимает более 42 часов [1].
Для ускорения получения срезов используются разные подходы. Один из таких подходов - это обработка ткани в условиях вакуума, позволяющая сократить время обезвоживания и пропитывания материала [2]. Другой подход - микроволновое воздействие на ткань. Оно способно значительно сократить время на этапе фиксации и обезвоживания ткани [3]. Применяется также сочетание двух этих способов [4].
На базе описанных способов разработаны установки, позволяющие изготавливать парафиновые блоки и получать из них срезы за 4-5 часов, однако в широкой практике данные методы распространения не получили.
В патологоанатомической практике наряду с плановыми проводятся срочные гистологические исследования. Это, прежде всего, интраоперационные биопсии, позволяющие в затруднительных случаях решать вопрос об объеме хирургического вмешательства. Время, затрачиваемое на получение заключения в этих случаях, должно составлять не более 20 мин. Парафиновые срезы не удовлетворяют данному требованию. Для быстрого получения гистологического препарата в биопсийной диагностике применяют быстрое замораживание ткани с последующим изготовлением срезов с помощью криостата или замораживающей приставки к микротому. Такие срезы полезны для решения вопроса о наличии или отсутствии опухолевого роста для солидных опухолей (рак), а также позволяют определить природу удаленного хирургом образования (паращитовидная железа, лимфатический узел, жировая клетчатка, метастаз и т.д.) [5]. Эти срезы не применяются для верификации окончательного диагноза по причине большой (>10 мкм) толщины срезов и искаженности тонкой структуры тканей и клеток в результате образования относительно больших кристаллов льда [6, 7].
О способе.
Для исследования строения лимфатических узлов пригодны только срезы толщиной менее 7 мкм с максимальной степенью сохранности ткани и структуры отдельных клеток, так как анализ патологического состояния лимфоузла (реактивные изменения, лимфома, метастаз) проводится на уровне деталей клеточного строения.
Для получения качественного замороженного среза необходимым условием является быстрое замораживание ткани, при котором вода не кристаллизуется, а переходит в состояние аморфного льда [8].
Скорость замораживания, в первую очередь, ограничивается скоростью теплопереноса. Ткань биопсийного материала сама по себе обладает низкой теплопроводностью. Поэтому быстро и равномерно охладить образец большого объема без повреждений невозможно. Для обеспечения максимальной скорости охлаждения биоптат следует замораживать в жидкой среде. Эта жидкость (хладагент) должна иметь точку плавления ниже температуры инициации кристаллизации воды - 70°С [9]. Этому требованию удовлетворяет ряд алканов - это пентан, 2-метилбутан (изопентан), n-гексан, гептан.
Как было отмечено выше, наиболее близким техническим решением вопроса о значительном ускорении получения среза является способ замораживания ткани в изопентане [8]. Однако в изопентане замораживают сравнительно небольшие кусочки ткани (менее 1 см3), объем которых может быть недостаточен для диагностических исследований. Использование же замороженного биоптата в форме пластинки, обеспечивающей большую площадь поверхности ткани при минимальном объеме, оказывается недопустимым из-за растрескивания ее в изопентане.
Решение проблемы найдено в замораживании образца биоптата в форме пластинки не более 3 мм и использовании в качестве замораживающей среды n-гексана. В этом случае пластинка не растрескивается. Поэтому при разработке авторами способа была избрана форма биоптата в виде пластинки. В результате были получены срезы тощиной менее 7 мкм высокого качества из быстрозамороженного материала, позволяющие проводить микроскопические исследования биопсийного материала в рамках и плановой, и цитобиопсий. Кроме того, применение описанного способа при плановых биопсиях заметно уменьшает трудозатраты и сокращает время на изготовление гистологических срезов.
Поставленная в работе цель, таким образом, достигается путем замораживания ткани в n-гексане, охлажденном до температуры плавления (-95°С), в форме пластинки толщиной не более 3 мм и изготовлением из нее в криостате срезов толщиной менее 7 мкм по стандартной методике, с последующей быстрой фиксацией и окраской.
Техническое описание способа.
Изготовление срезов из свежезамороженной ткани лимфатического узла включает в себя 3 шага:
- получение блока замороженной ткани в форме пластинки толщиной не более 3 мм с минимумом кристалликов льда;
- получение среза толщиной менее 7 мкм из блока и быструю фиксацию среза на предметном стекле, окрашивание стандартным красителем (гематоксилин-эозин, азур-эозин и т.п.);
- заключение под покровное стекло. В результате получается препарат длительного хранения (постоянный препарат).
Замораживание биоптата. Пластиковый стакан, объемом не менее 50 мл, заполняется n-гексаном, не менее 30 мл, и затем для увеличения теплоизоляции помещается в подставку из пенопласта с толщиной стенки не менее 4 см. В стакан добавляется жидкий азот для доведения n-гексана до кашеобразного состояния (смесь жидкого и твердого вещества). Из биоптата, доставленного из операционной, вырезается пластинка ткани толщиной 2-3 мм, которая быстро погружается в стакан с охлажденным n-гексаном. Далее стакан с материалом переносится в рабочую камеру криостата (температура камеры - 20°С) и через 30 с. замороженный кусочек вынимается из стакана и перемещается на фильтровальную бумагу в рабочей зоне камеры криостата, для удаления излишков n-гексана.
Изготовление среза толщиной менее 7 мкм из замороженной пластинки производится стандартным методом. Срез переносится на предметное стекло и немедленно помещается в спиртоальдегидный раствор при комнатной температуре (20-25°С) на 3 мин, затем отмывается проточной водой от фиксатора в течение 30 с и окрашивается гистологическими красителями обычным образом. Окрашенные срезы заключаются под покровное стекло в водорастворимую среду, либо обезвоживаются в органической среде, и заключаются в синтетическую органическую среду. Готовые срезы просматриваются в световой микроскоп.
Полученные таким способом срезы позволяют изучать общий рисунок тканей биоптата, а также детали клеточного строения, позволяющие выявлять отдельные опухолевые клетки в составе лимфоидной ткани.
Примеры конкретного выполнения исследований по описанному способу.
Пример 1. Пациент Г.
В ГНЦ РАМН пациенту была выполнена торакоскопическая цитобиопсия новообразования средостения. Из одного фрагмента биоптата были изготовлены замороженные срезы по описанному выше способу. Целью цитобиопсии являлось установление дифференциального диагноза между лимфомой и опухолью нелимфоидного происхождения.
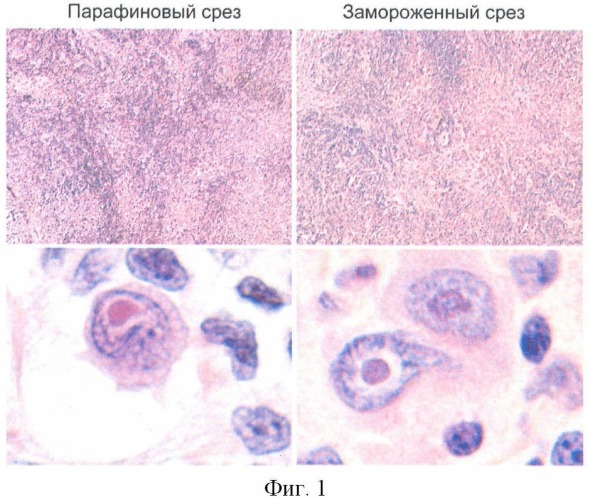
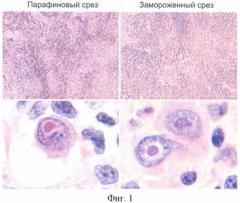
На замороженном срезе была представлена соединительная ткань, на фоне которой определялись участки лимфоидной ткани, состоящей из малых лимфоцитов, пролимфоцитов, а также крупных клеток атипичного вида. Большинство этих клеток имели большие ядра, в которых присутствовали округлые ядрышки крупного размера (сопоставимые с размером ядра малого лимфоцита). По описанию они полностью соответствовали клеткам Ходжкина и Березовского-Штернберга, наблюдаемым при лимфогранулематозе (лимфоме Ходжкина по классификации ВОЗ) (фиг.1). Таким образом, на замороженном срезе был установлен диагноз лимфогранулематоза.
Время, затраченное на постановку диагноза лимфогрануломатоза по замороженному срезу, составило 20 мин.
Эта же биопсия, но другой фрагмент ткани, поместили в 4% раствор формалина для последующего изготовления парафиновых срезов по стандартной методике.
При гистологическом исследовании на парафиновом срезе присутствовала соединительная ткань с участками лимфоидной ткани, представленной малыми лимфоцитами и пролимфоцитами. На фоне определялись типичные клетки Ходжкина и Березовского-Штернберга.
Время, затраченное на получение диагноза лимфогранулематоза по парафиновому срезу, составило 42 часа.
Пример 2. Пациент И.
У пациента были увеличены шейные и подмышечные лимфатические узлы. В клиническом анализе крови лейкоцитов - 14,5 тыс., лимфоцитов - 71,5%. Для постановки диагноза была выполнена биопсия шейного лимфатического узла.
Было проведено гистологическое исследование на замороженном срезе, полученном по описанному выше способу. Для замораживания использовалась часть биопсийного материала. Другая его часть направлялась на дополнительные исследования.
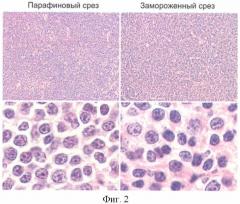
По замороженному срезу определяли тип опухоли и предполагаемый диагноз. На малом увеличении рисунок, характерный для нормальной ткани лимфоузла, был стерт (фиг.2). Вместо этого наблюдалось диффузное разрастание лимфоидных клеток с небольшим количеством сосудов. На большем увеличении клетки имели однотипное строение. Все они были мелкие, с узкой цитоплазмой и округлыми темными ядрами. Ядерный хроматин упакован в крупные «глыбки». Ядрышки в большинстве таких ядер не визуализировались. Встречались немногочисленные пролимфоциты.
По данному описанию ткани предположили диагноз зрелоклеточной лимфомы с низким пролиферативным потенциалом из возможных форм: В-клеточный хронический лимфолейкоз (В-ХЛЛ), лимфома из клеток мантийной зоны, лимфома из клеток маргинальной зоны. С помощью исследований, уточняющих диагноз, в лимфатическом узле был установлен диагноз В-ХЛЛ.
Время, затраченное на постановку предварительного диагноза по замороженному срезу, составило 30 минут. Для уточнения диагноза суммарное затраченное время составило 24 часа.
Из части лимфоузла были изготовлены парафиновые срезы по стандартной методике. На полученном срезе при малом увеличении картина полностью соответствовала наблюдаемой на замороженном срезе (фиг.2). При большом увеличении в структуре лимфоидных клеток не наблюдалось значительных расхождений с замороженным срезом. Отличием являлось наличие промежутков между клетками. На замороженном же срезе клетки плотно прилегали друг к другу. Предварительный диагноз, поставленный по парафиновому срезу, идентичен диагнозу, поставленному по замороженному срезу.
При изготовлении парафинового среза предварительный диагноз был установлен через 42 часа после взятия биопсии.
Пример 3. Пациент Н.
У пациента в течение двух месяцев наблюдалась генерализованная лимфаденопатия. Для верификации диагноза была выполнена биопсия лимфатического узла шейной области.
Для постановки диагноза было проведено гистологическое исследование на замороженном срезе.
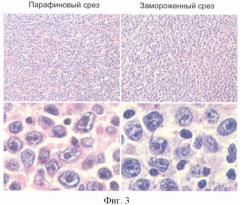
Из биопсийного материала были изготовлены замороженные срезы описанным выше способом. По замороженному срезу устанавливали предварительный диагноз. На замороженном срезе при малом увеличении элементы капсулы и краевого синуса не визуализировались (фиг.3). Имела место умеренная сосудистая гиперплазия паренхимы. Структуры, свойственные нормальному лимфатическому узлу, на срезе отсутствовали - вся площадь среза была заполнена диффузным пролифератом из крупных и среднего размера атипичных лимфоидных клеток с довольно широкой цитоплазмой и округлыми светлыми ядрами. В большей части описываемых клеток определялись крупные ядрышки, округлые, представленные в количестве 1-2 на ядро. Одиночные ядрышки были расположены центрально. Хроматин большинства ядер имел гранулярную или зернистую структуру (мелкие гранулы). Присутствовала примесь малых лимфоцитов, лежащих диффузно между патологическими клетками. Встречались единичные макрофаги. Среди крупных клеток выявлялись фигуры митоза и апоптоза. По данным этого исследования предположили диагноз: крупноклеточная лимфоидная опухоль.
По результатам проведенных исследований был установлен окончательный диагноз ДБККЛ (диффузная В-крупноклеточная лимфома).
В этом случае время, затраченное на постановку предварительного диагноза по замороженному срезу, составило 25 мин. Суммарное время, затраченное на постановку диагноза ДБККЛ, составило 24 часа.
Часть биоптата была использована для приготовления парафиновых срезов по стандартной методике. На парафиновом срезе при малом увеличении, так же как на замороженном срезе, наблюдалась картина диффузного роста лимфоидной ткани. При большом увеличении были выявлены средние и крупные клетки атипичного вида и малые лимфоциты. По структуре патологические клетки выглядели так же, как на замороженном срезе, но с следующими отличиями:
(1) Цитоплазма имела более яркую розовую окраску;
(2) Хроматин этих клеток по структуре отличался большим разнообразием: ядра с одиночными ядрышками содержали хроматин в виде тяжей и гранул;
(3) На замороженном же срезе большинство крупных клеток содержали только гранулы хроматина.
Указанные различия не оказали влияния на постановку диагноза крупноклеточной лимфомы, т.к. основные признаки данного заболевания, такие как диффузный рост ткани, полиморфизм патологических клеток, особенности строения их ядрышек, наличие большого количества клеток в митозе, оказались достаточными для диагностики на замороженном срезе.
Время, затраченное на получение предварительного диагноза по парафиновому срезу, составило 42 часа. Последующие дополнительные исследования заняли бы еще 8-24 часов.
Заключение.
В период с 2003 по настоящее время выполнены исследования с замороженными срезами более 500 биоптатов (лимфатических узлов).
Время, необходимое на получение точного диагностического заключения, составляет не более 24 часов. В случае парафиновых срезов - от 50 часов до нескольких суток.
Предлагаемый способ сокращает трудозатраты на постановку предварительного диагноза, необходимого для направления поиска точного диагноза, по сравнению со стандартным способом, не ухудшает качество выполняемой работы, увеличивает производительность труда в области диагностики лимфопролиферативных заболеваний, и значительно ускоряет выдачу заключения.
Ускоренное (замораживанием) получение среза позволяет уже в цитодиагностике дать точный диагноз в отличие от парафинового среза.
Список литературы.
1. Ю.А.Криволапов, Е.Е.Леенман. Морфологическая диагностика лимфом, стр.6-9, 2006.
2. Krivonosov L.K. Simple method of embedding in paraffin under vacuum Arkh Patol.; 40(11):75-76, 1978.
3. Anthony S-Y Leong, M.D, Microwave thechnology for light microscopy and ultrastructural studies, first edition, 2005.
4. Kok L.P., Boon ME Nonchemical dehydration of fixed tissue combining microwaves and vacuum, Eur JMorphol; 32(1):86-94, Mar, 1994.
5. M.A.Пальцев, И.А.Казанцева, О.В.Зайратьянц, Л.В.Кактурский. Порядок патологоанатомического исследования биопсийного (диагностического и операционного) материала Федеральная служба по надзору в сфере здравоохранения и социального развития. Система добровольной сертификации процессов выполнения патологоанатомических исследований и патологоанатомических услуг в здравоохранении 291-297, Москва, 2006.
6. Juan Lechago MD. The frozen section Pathology in the trenches. Arch PatholLabMed-Vol 129, Desember, 2005.
7. Edvard B. Desciak, Mary E. Maloney. Artifacts in frozen section preparation J Dermatol Surg 26:5; May, 2000.
8. A.H.Зинкин, Н.Г.Зингилевская, Б.Б.Мусельян. Криовоздействие в оториноларингологии (методические рекомендации), механизм действия низких температур на биоткани. Краснодар, 1997.
9. D.A.Davis, D.M. Pellowski, and С.William Hanke. Preparation of Frozen Sections Dermatol Surg; 30: 1479-1485, 2004.
Способ изготовления срезов из свежезамороженной ткани лимфатических узлов, включающий замораживание биопсийного материала лимфатического узла, получение среза для исследования, его фиксацию, промывку, окрашивание, заключение под покровное стекло с помощью водорастворимой среды или через обезвоживание, отличающийся тем, что проводят замораживание пластинки биопсийного материала толщиной не более 3 мм в охлажденном до -95°С n-гексане и получают для исследования срез толщиной менее 7 мкм.