Устройство мониторинга образования тромба и способ мониторинга образования тромба
Иллюстрации
Показать всеГруппа изобретений относится к мониторингу образования тромба и может быть использована для оценки эффективности антитромботического лекарственного средства. Устройство мониторинга образования тромба содержит: камеру образования тромба, по меньшей мере, в части которой размещен материал, вызывающий образование тромба; впускную трубку, соединенную с камерой образования тромба, через которую кровь течет в камеру образования тромба; контейнер для подачи крови, соединенный с впускной трубкой; питающий насос для контейнера; датчик давления для измерения давления, приложенного к контейнеру. Способ мониторинга образования тромба заключается в том, что кровь после введения антикоагулянта направляют из контейнера в камеру образования тромба путем надавливания на жидкость, размещенную на слое крови и имеющую плотность меньше, чем слой крови, при этом осуществляют антикоагуляционную обработку крови или стимулируют свертывание крови и определяют давление, приложенное к контейнеру, при этом материал, вызывающий образование тромба, размещен, по меньшей мере, в части камеры образования тромба. Группа изобретений позволяет проводить всестороннюю оценку свертывания крови и образования тромбоцитарного тромба в среде, эквивалентной кровотоку, для оценки эффективности антитромботического лекарственного препарата. 2 н. и 9 з.п. ф-лы, 15 ил.
Реферат
Область техники
Настоящее изобретение относится к способу мониторинга эффективности антитромботического лекарственного средства, введенного пациенту или подобному индивидууму, и, в частности, к устройству и способу общей оценки свертываемости крови и образования тромбоцитарного тромба в среде, эквивалентной кровотоку, с цельной кровью или плазмой, содержащей тромбоциты.
Предшествующий уровень техники
Например, атеротромбоз (такой как при инфаркте миокарда) вызывает серьезное образование тромба, так что атероматозная бляшка разрушается на участке артериосклероза, тромбоциты сцепляются с коллагеном, включающим тканевые факторы, контактирующие с кровотоком. Далее происходят сложные процессы агрегации тромбоцитов, активации системы свертывания крови и им подобные, приводя к образованию тромба, вызывающего серьезную обструкцию сосуда. Сердечное заболевание, такое как инфаркт миокарда, представляет собой тяжелое заболевание, и оно является второй по частоте ведущей причиной общей смертности в Японии.
Однако образование тромба происходит только в атеросклеротической области, приводя к инфаркту миокарда, а выраженная тенденция к образованию тромбов во всем организме не наблюдается. Исследования in vitro не подходят для оценки тенденции к образованию тромбов и мониторинга антитромботического эффекта при антитромботической терапии. Таким образом, важно производить общую оценку свертывания крови и состояния тромбоцитов (сцепления и агглютинации) в присутствии кровотока.
До настоящего времени, свертываемость крови оценивали определением частичного активированного тромбопластинового времени (АРТТ), тромбопластинового времени (РТ) с использованием плазмы. АРТТ главным образом отражает эндогенное свертывание, а РТ главным образом отражает экзогенное свертывание. Исследование тромбоцитов крови проводится путем использования обогащенной тромбоцитами плазмы и добавления активирующего тромбоциты вещества, такого как ADP (аденозиндифосфат) или коллаген, для оценки посредством этого свертываемости тромбоцитов в результате изменения их скорости проникновения или подобных явлений. Кроме того, время свертывания цельной крови можно определить по времени образования сгустка цельной крови, времени образования сгустка цельной крови после повторного добавления кальция и тому подобного.
Далее, в устройствах обследования, использующих цельную кровь, применяется тромбокластограмма, которая контролирует активацию факторов свертывания, агглютинацию тромбоцитов и им подобные показатели.
Однако тромб растет в крови in vivo. Напротив, указанный выше способ исследования или ему подобные производит определение in vitro, т.е. в состоянии, закрытом для кровотока. Таким образом, нельзя наблюдать рост тромба in vivo.
В качестве предложений по решению указанных выше проблем в патентом документе JP 2004-251630 А и непатентных документах Blood 1990; 75, стр.390-398; Blood, 1999; август, 1:94(3), стр.968-75, раскрыт способ, включающий пропускание крови с введенным в нее антитромботическим лекарственным средством через коллаген и мониторинг с помощью конфокального микроскопа сцепления или агглютинации тромбоцитов, меченных флюоресцентной меткой.
Однако в способе, описанном в указанном патентном документе, наблюдение проводится в присутствии противосвертывающего лекарственного средства. Таким образом, мониторингом морфологического изменения в тромбоцитах оценивается тот факт, что в системе свертывания крови не происходит образования тромба, вызванного сцеплением или агглютинацией тромбоцитов, или способность генерирования тромба уменьшена. Следовательно, такая оценка не отражает связь активации тромбоцитов с системой свертывания крови. Поэтому указанное изобретение приемлемо для оценки эффективности антитромбоцитарного лекарственного средства, но оно не способно контролировать сам тромб и весь процесс формирования тромба. Кроме того, флюоресцентный микроскоп является дорогостоящим, поэтому его едва ли можно использовать для общих исследований.
Кроме того, в патентном документе JP 2006-145345 А, текучесть крови после введения антикоагулянта определяется пропусканием крови через силиконовую камеру, подобную мелкой расческе. Аналогичным образом в этом способе также используется кровь после введения антикоагулянта, так что влияние системы свертывания определить невозможно. Кроме того, вязкость в данном способе имеет большую индивидуальную вариабельность, так что трудно оценить воздействие медикаментозной терапии, используя указанную систему.
Тромбоцит активируется системой свертывания, в то время как система свертывания стимулируется активированными тромбоцитами. Другими словами, введение антикоагулянтов также ингибирует активацию тромбоцитов, так что нельзя наблюдать эффективность антитромботического лекарственного средства. Кроме того, если не проводится какая-либо антикоагуляционная терапия, то кровь быстро сворачивается, так что ее нельзя использовать при исследовании.
Краткое изложение существа изобретения
Задачей настоящего изобретения является создание устройства и способа общей оценки образования тромбов из-за свертывания крови и образования тромбоцитарного тромба в условиях среды, эквивалентной кровотоку, при потоке цельной крови или плазмы, содержащей тромбоциты (в описании настоящего изобретения они могут совместно именоваться «кровью»), при мониторинге эффективности антитромботического лекарственного средства, введенного пациенту или подобному индивидууму.
Для решения указанной выше задачи согласно настоящему изобретению предложено устройство для мониторинга образования тромба, которое контролирует образование тромба путем пропускания крови после введения антикоагулянта через канал, который имитирует кровеносный сосуд, в то же время проводя антикоагуляционную обработку, или стимулируя свертывание крови, причем устройство содержит: камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал; впускную трубку, которая соединена с камерой образования тромба и через которую кровь течет в камеру образования тромба; и трубку для лекарственного средства, которая соединена с впускной трубкой и через которую подается лекарственное средство, которое стимулирует свертываемость крови (далее именуемое «стимулятором свертывания»), или лекарственное средство, которое осуществляет антикоагуляционное действие. В настоящем изобретении термин «мониторинг» означает не только визуальную оценку образования тромба, визуализацию, но также оценку степени образования тромба в переводе на цифровую характеристику путем определения давления или подобного показателя.
Кроме того, согласно настоящему изобретению предложено устройство для мониторинга образования тромба, которое содержит камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал, впускную трубку, которая соединена с камерой образования тромба и через которую кровь течет в камеру образования тромба, и впускную трубку для ингибитора образования тромба, которая соединена с камерой образования тромба, и где происходит смешивание ингибитора образования тромба с кровью после пропускания через камеру образования тромба.
В этом случае устройство мониторинга образования тромба предпочтительно размещено на подложке.
Устройство для мониторинга образования тромба согласно настоящему изобретению предпочтительно содержит насос для создания избыточного давления во впускной трубке и/или трубке для лекарственного средства или насос для аспирации содержимого выпускной трубки, которая соединена с камерой образования тромба и предназначена для удаления крови из камеры образования тромба.
Устройство мониторинга образования тромба согласно настоящему изобретению предпочтительно содержит устройство измерения давления и камеру для получения изображений, а также камеру образования тромба.
Кроме того, вызывающий образование тромба материал содержит тканевой фактор (тканевой тромбопластин).
Далее, согласно настоящему изобретению предложен способ мониторинга образования тромба, содержащий следующие этапы: направление крови после введения антикоагулянта в камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал, и обеспечивающий одновременно антикоагуляционную обработку или стимулирование свертывания крови, для контроля, посредством этого, образования тромба. В настоящем изобретении признак «направление крови» и «обеспечение одновременно антикоагуляционной обработки или стимулирование свертывания крови» может представлять собой состояние, при котором в канале происходит реакция, обеспечивающая антикоагуляцию, или реакция, стимулирующая свертывание, и включает состояние, при котором обеспечивается протекание препарата, высвобождающего средство, осуществляющее антикоагуляционное действие, или средства, стимулирующего свертывание, при смешивании с кровью в канале, или состояние, при котором обеспечивается быстрое протекание препарата, высвобождающего средство, осуществляющее антикоагуляционное действие, или средства, стимулирующего свертывание, после смешивания с кровью.
В способе мониторинга образования тромба согласно настоящему изобретению предпочтительно, чтобы антикоагуляционная обработка представляла собой обработку веществами, образующими хелаты кальция, такие как лимонная кислота, и антикоагуляционная обработка осуществлялась донором свободного кальция.
В способе мониторинга образования тромба согласно настоящему изобретению предпочтительно, чтобы антикоагуляционная обработка представляла собой обработку аптамером тромбина, и антикоагуляционная обработка осуществлялась антисмысловой ДНК аптамера тромбина.
В способе мониторинга образования тромба согласно настоящему изобретению предпочтительно контролировать образование тромба подачей обработанной антикоагулянтом крови в камеру образования тромба, в то же время стимулируя свертывание крови без осуществления антикоагуляционной обработки. В этом случае средство для стимуляции свертывания крови предпочтительно представляет собой добавление тканевого тромбопластина.
Кроме того, в способе мониторинга образования тромба согласно настоящему изобретению кровь, свертываемость которой была снижена одним или более антикоагуляционными средствами, предпочтительно перестают подвергать антикоагуляционной обработке, по меньшей мере, одним видом средства, осуществляющего антикоагулционную обработку, которая соответствует использованному средству антикоагуляционной обработки. В этом случае предпочтительно, чтобы средства антикоагуляционной обработки представляли собой фактор, ингибирующий фазу контакта, и вещество, образующее хелат кальция, а средство, осуществляющее антикоагуляционную обработку, представляло собой донор свободного кальция. Далее, также предпочтительно, чтобы средства антикоагуляционной обработки представляли собой фактор, ингибирующий фазу контакта, и гепарин, а средство, осуществляющее антикоагуляционную обработку, представляло собой гепариназу. Также предпочтительно, чтобы средства антикоагуляционной обработки представляли собой фактор, ингибирующий фазу контакта, такой как фактор свертываемости крови XII, калликреин или ему подобный, и аптамер тромбина, а средство, осуществляющее антикоагуляционную обработку, представляло собой антисмысловую ДНК аптамера тромбина. Ингибитор фактора свертываемости крови XII представляет собой предпочтительно ингибитор трипсина, полученный из маиса.
В способе мониторинга образования тромба согласно настоящему изобретению предпочтительно определить давление во время притока и/или оттока крови из камеры образования тромба.
В способе мониторинга образования тромба согласно настоящему изобретению вызывающий образование тромба материал предпочтительно включает коллаген и тканевой фактор.
Устройство мониторинга образования тромба по п.1 формулы настоящего изобретения содержит камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал, впускную трубку, которая соединена с камерой образования тромба и через которую кровь течет в камеру образования тромба, и трубку для лекарственного средства, которая соединена с впускной трубкой и через которую подается лекарственное средство, осуществляющее антикоагуляционную обработку, или лекарственное средство, которое стимулирует свертываемость крови. Поэтому кровь, которая обработана антикоагулянтом для предотвращения свертывания крови, взятой у пациента после введения ему антикоагулянта, в канале, проходящем в камеру образования тромба, можно контролировать путем преднамеренного образования тромба в камере образования тромба. Таким образом, эффективность антитромботического средства можно специально контролировать в среде, аналогичной внутренней среде тела человека. Кроме того, средство антикоагуляционной обработки можно применять во время взятия проб крови. Поэтому преимущество состоит в том, что образцы после взятия образцов крови можно хранить в течение определенного периода времени, а время исследования можно выбирать случайным образом.
В соответствии с п.2 устройство мониторинга образования тромба согласно настоящему изобретению содержит камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал, впускную трубку, которая соединена с камерой образования тромба и через которую кровь течет в камеру образования тромба, и впуск для ингибитора образования тромба, который соединен с камерой образования тромба и смешивает ингибитор образования тромба с кровью после пропускания через камеру образования тромба. Поэтому можно проводить наблюдение за тромбом так, как описано выше. Кроме того, свертывание крови не происходит ниже по потоку в камере образования тромба, и поэтому можно предотвратить влияние на определение давления и более тонко контролировать изменения давления.
Небольшое количество крови можно контролировать, когда устройство для мониторинга образования тромба согласно настоящему изобретению сформировано на подложке. Кроме того, устройство снабжено насосом для создания избыточного давления во впускной трубке и/или трубке лекарственного средства, или насосом для аспирации (отсоса) содержимого выпускной трубки, которая соединена с камерой образования тромба и предназначена для удаления крови из камеры образования тромба. Поэтому кровь и лекарственное средство для стимуляции свертывания крови могут стабильно течь в течение заданного периода времени при заданном давлении или заданной скорости потока.
Если устройство для мониторинга образования тромба согласно настоящему изобретению содержит устройство для измерения давления, то степень образования тромба можно переводить в цифры, так что можно выполнять количественную оценку.
Устройство можно легко установить, когда материал, вызывающий образование тромба, содержит коллаген. Образование тромба можно эффективно вызвать, когда вызывающий образование тромба материал дополнительно содержит тканевой фактор, такой как тканевой тромбопластин, вместе с коллагеном.
Если устройство для мониторинга образования тромба согласно настоящему изобретению содержит камеру для получения изображения камеры образования тромба, то появление тромба можно наблюдать в виде изображения, и затем изображение может храниться.
Далее, в соответствии с п.9 формулы настоящего изобретения способ мониторинга образования тромба содержит этапы: направление крови после введения антикоагулянта в камеру образования тромба, по меньшей мере, в части которой размещен вызывающий образование тромба материал, проводя при этом антикоагуляционную обработку или стимулируя свертывание крови. Таким образом, образование тромба на вызывающем образование тромба материале можно контролировать при стимуляции свертывания крови путем пропускания крови, которая была получена антикоагуляционной обработкой крови, взятой после введения пациенту антитромботического лекарственного средства для предотвращения свертывания. Поэтому эффективность антитромботического лекарственного средства можно точно контролировать в среде, аналогичной внутренней среде тела человека. Кроме того, антикоагуляционное средство можно применять для взятия проб крови. Поэтому имеется преимущество в том, что образцы после взятия проб крови можно хранить в течение определенного периода времени, и время исследования можно выбрать случайным образом. Если антикоагуляционная обработка представляет собой обработку веществом, образующим хелат кальция, таким как лимонная кислота, и антикоагуляционная обработка осуществляется донором свободного кальция, то легко можно получить реагент, и, таким образом, оно предпочтительно. Если антикоагуляционная обработка представляет собой обработку аптамером тромбина, и антикоагуляционная обработка осуществляется антисмысловой ДНК аптамера тромбина, то можно проводить исследование, в то же время отражая физиологическую концентрацию ионов кальция в крови.
Кроме того, в соответствии с п.12 формулы настоящего изобретения можно также контролировать образование тромба пропусканием крови после антикоагуляционной обработки в камеру образования тромба без проведения антикоагуляционной обработки, в то же время стимулируя свертываемость крови. Поэтому образование тромба можно наблюдать при небольшом количестве крови и можно уменьшить дискомфорт пациента. Кроме того, в этом случае не всегда требуется трубка для лекарственного средства, так что устройство мониторинга образования тромба можно упростить. В случае, если тканевой тромбопластин используется в качестве средства, стимулирующего свертываемость крови, то свертываемость крови можно стимулировать активацией свертывающей системы альтернативным путем, который избегает активацию фактора XII и активацию калликреина для контроля образования тромба в камере образования тромба.
Кроме того, образование тромба можно контролировать простой операцией воздействия на кровь, подвергнутую антикоагуляционной обработке с использованием одного или нескольких видов антикоагуляционных средств, по меньшей мере, одним видом осуществляющего антикоагуляционную обработку средства, соответствующего использованному средству антикоагуляционной обработки. В этом случае, когда антикоагуляционная обработка проводится ингибитором фактора контактной фазы и агентом, образующим хелат кальция, и антикоагуляционная обработка осуществляется донором свободного кальция, или когда антикоагуляционная обработка проводится ингибитором фактора контактной фазы и гепарином, и антикоагуляционная обработка проводится гепариназой, то антикоагуляционнная обработка, оказывающая эффект во время мониторинга формирования тромба, представляет собой антикоагуяционную обработку ингибитором фактора контактной фазы, поэтому мониторинг образования тромба можно осуществлять в более физиологичных условиях, в частности отражая двухвалентный ион металла, связанный с тромбом, такого как кальция или магния. В этом случае, когда антикоагуляционная обработка проводится ингибитором фактора контактной фазы, таким как фактор XII свертывания крови или калликреин и аптамер тромбина, а затем антикоагуляционная обработка проводится антисмысловой ДНК аптамера ингибирования тромбина, то кровь можно хранить в течение длительного периода. Кроме того, антикоагуляционную обработку можно эффективно проводить, когда в качестве ингибитора фактора XII свертывания крови используется ингибитор трипсина, полученный из маиса.
Если в способе мониторинга образования тромба согласно настоящему изобретению выполняется измерение давления во время притока и/или выпуска крови из камеры образования тромба, то степень образования тромба можно переводить в цифры, так что можно легко выполнять количественную оценку с использованием очень простого устройства.
Кроме того, если материал, вызывающий образование тромба, содержит коллаген и тканевой фактор, то устройство можно легко установить и можно эффективно вызвать образование тромба.
Краткое описание чертежей
В дальнейшем изобретение поясняется описанием предпочтительных вариантов воплощения со ссылками на сопроводительные чертежи, на которых:
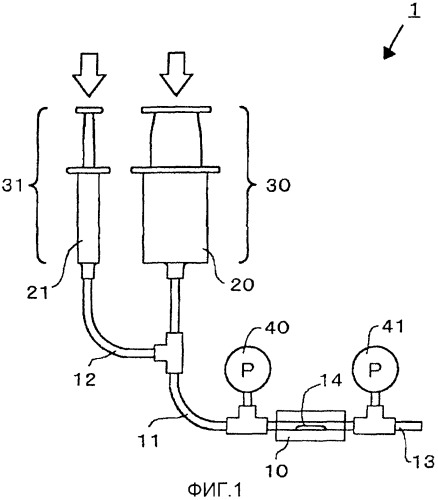
фиг.1 изображает схему устройства мониторинга образования тромба согласно первому варианту осуществления изобретения;
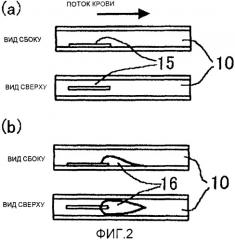
фиг.2(а) - схему установки вызывающего образование тромба материала 15 в примерах 3, 5 и 6 согласно изобретению;
фиг.2(b) - схему образования тромба в примерах 3, 5 и 6 согласно изобретению;
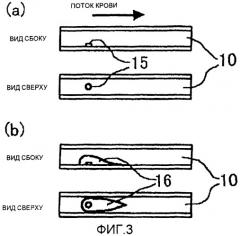
фиг.3(а) - схему установки вызывающего образование тромба материала 15 в примере 4 согласно изобретению;
фиг.3(b) - схему образования тромба в примере 4 согласно изобретению;
фиг.4 - схему основной части устройства мониторинга образования тромба (основной корпус микрочипа) согласно второму варианту осуществления изобретения;
фиг.5 - схему основной части устройства мониторинга образования тромба (крышка микрочипа) согласно второму варианту осуществления изобретения;
фиг.6 - схему образования тромба в примере 7 согласно второму варианту осуществления изобретения;
фиг.7 - схему основной части устройства мониторинга образования тромба (основной корпус микрочипа) согласно второму варианту осуществления изобретения;
фиг.8 - схему основной части устройства мониторинга образования тромба (крышка микрочипа) согласно второму варианту осуществления изобретения;
фиг.9 - схемы основных частей устройства мониторинга образования тромба согласно третьему варианту осуществления изобретения; фиг.9(А) - вся схема, фиг.9(В) - основной корпус микрочипа, и фиг.9(С) - крышка микрочипа согласно изобретению;
фиг.10 - схему системы мониторинга образования тромба, содержащей устройство для мониторинга образования тромба согласно изобретению;
фиг.11(А) - форму волн тромбоэластограммы свертывания при добавлении 10 мкМ каждого из аптамеров к экзоциту I и экзоциту II в кровь после выдержки при комнатной температуре в течение 15 мин и добавлении 40 мкМ каждого из антисмысловых ДНК обоих аптамеров согласно изобретению;
фиг.11(В) - форму волн тромбоэластограммы крови непосредственно после взятия проб крови согласно изобретению;
фиг.12 - схему устройства согласно четвертому варианту осуществления настоящего изобретения; фиг.12(А) - полный чертеж, фиг.12(В) - крышка микрочипа, и фиг.12(С) - подложку микрочипа согласно изобретению;
фиг.13 - диаграммы измерений давлений примера 17 (контроль), примера 18 (гепарин) и примера 19 (Reopro) согласно изобретению;
фиг.14 - диаграммы измерений давлений при добавлении гепарина в количестве 0 (контроль), 0,2, 0,5 и 1 ЕД/мл гепарина согласно изобретению;
фиг.15 - диаграммы измерений давлений при добавлении гепарина в количестве 0 (контроль), 2, 5 и 10 мкг/мл согласно изобретению.
Описание предпочтительных вариантов осуществления изобретения
На фиг.1 представлена схема первого варианта осуществления устройства мониторинга образования тромба по настоящему изобретению.
Устройство мониторинга образования тромба согласно настоящему варианту осуществления содержит камеру 10 образования тромба; впускную трубку 11, которая соединена с камерой образования тромба и через которую кровь течет в камеру образования тромба, и трубку для лекарственного средства 12, которая соединена с выпускной трубкой и через которую подается лекарственное средство, осуществляющее антикоагуляционную обработку или стимулирующее свертывание крови.
Камера 10 образования тромба имеет по существу цилиндрическую форму и содержит материал, который вызывает образование тромба в части ее внутренней полости. Камера может быть изготовлена из прозрачного стекла, термопластической смолы или подобного материала. Примеры материала, который вызывает образование тромба, включают коллаген, vWF (фактор фон Виллебранда), ранее полученный тромб и материалы на волокнистой основе из шелка, хлопка или им подобной ткани. Эти материалы можно использовать отдельно или в комбинации двух или более из них. Коллаген особенно предпочтителен, потому что его можно легко получить, с ним легко манипулировать, и он может быть предоставлен в виде модели, аналогичной кровеносному сосуду. Коллаген может включать тканевой фактор. Материал, вызывающий образование тромба, из коллагена или vWF предпочтительно представлен в виде покрытия внутренней поверхности камеры образования тромба 10 для предотвращения вытекания вызывающего образование тромба материала вместе с потоком крови. Покрытие можно легко нанести, например как описано в документе JP 05-260950 A или в документе Blood 1995 April 1; 85(7): 1826-35, растворением коллагена в кислотном растворе и погружением в него подложки, имеющей гидрофильность, такую же, как у стекла или полистирола, с последующим промыванием и сушкой для покрытия поверхности материала.
Далее, предпочтительно, чтобы материал, вызывающий образование тромба, в виде волокнистого материала или ранее полученного тромба мог быть в состоянии, пригодном для фиксации внутри камеры образования тромба 10. Далее, путем импрегнации коллагеном гигроскопичного тонкого волокнистого материала, такого как хлопок, неплетеная ткань или трикотажная ткань, и их сушки можно получить вызывающий образование тромба материал с более высокой способностью вызывать образование тромба. Кроме того, подложка может погружаться в раствор коллагена, содержащий тканевой тромбопластин, и затем сушиться для дополнительного усиления ее способности вызывать образование тромба.
Вызывающий образование тромба материал можно выбрать в зависимости от внутреннего диаметра камеры образования тромба 10 и объекта мониторинга. Если в качестве модели представлен атероматоз, вызывающий инфаркт миокарда, то предпочтительно, чтобы содержался один коллаген, или содержался и коллаген, и тканевой тромбопластин. Кроме того, предпочтительнее, чтобы в канале можно было сформировать суженную часть в камере образования тромба для воздействия напряжения сдвига на камеру образования тромба. Далее, в случае изучения образования тромба при инфаркте миокарда и инфаркте мозга сердечного происхождения или тому подобного состояния, при котором тромб может переноситься из другой части тела с кровотоком и прикрепляться, вызывая окклюзию кровеносного сосуда, в другой части тела, предпочтительно, чтобы предварительно произошло сцепление небольшой части тромба с камерой образования тромба 10, представленной в виде материала, вызывающего образование тромба, с последующим мониторингом роста тромба, образованного на нем. В случае изучения тромбоза кровеносного капилляра, внутренний просвет канала в камере образования тромба может быть разделен на множество каналов, каждый из которых имеет диаметр от 10 до 30 мкм. Если камера образования тромба 10 имеет суженную часть диаметром 100 мкм или менее, то канал может подвергаться окклюзии небольшим тромбом, образованным в такой суженной части. Поэтому нет необходимости в использовании дополнительного материала, вызывающего образование тромба, так что образование тромба можно контролировать средством, стимулирующим свертывание крови, или антикоагулянтом. Поэтому настоящее изобретение содержит эту суженную часть в качестве материала, вызывающего образование тромба.
Материал, вызывающий образование тромба, может представлять собой только покрытие коллагеном или vWF. Камера 10 образования тромба в части покрытия может быть предпочтительно сужена и представлена для части 14, так что можно контролировать агрегацию тромбоцитов, вызванную напряжением сдвига. В случае покрытия коллагеном в качестве материала, вызывающего образования тромба, предпочтительно, чтобы для получения высокой способности сцепления с поверхностью, по меньшей мере, часть подложки была изготовлена из стекла или пластика. Кроме того, часть, на которой предстоит поместить камеру 10 образования тромба, или часть камеры 10 образования тромба, где находится материал, вызывающий образование тромба, может быть изготовлена в виде съемной кассеты. Этот вариант предпочтительнее, потому что полученный тромб можно легко отмыть или наблюдать, или материал, вызывающий образование тромба, можно легко заменить новым материалом. В этом случае кассета может образовывать герметичное для жидкости соединение кольцевым уплотнителем из силиконовой резины или подобного материала. Предпочтительно, конец кассеты, противоположный ее концу, соединенному с впускной трубкой 11 камеры 10 образования тромба, может быть соединен с выпускной трубкой 13, которая обеспечивает возможность выпуска крови. Предпочтительно, выпускная трубка 13 может быть разделена цилиндрической бобиной, и ее наконечник может быть снабжен манометром 41, например манометром диафрагмального типа. С другой стороны, наконечник выпускной трубки 13 предпочтительно соединен с контейнером для хранения (не показан).
Впускная трубка 11, соединенная с камерой 10 образования тромба, может быть изготовлена с использованием прозрачного стекла, термопластичной смолы или подобного материала. Конец впускной трубки 11, противоположный ее другому концу, соединяющемуся с камерой 10 образования тромба, соединен со шприцем 20, который подает кровь. Шприц 20 соединен с насосом 30 и сдавливающим средством (не показано), так что поршень шприца 20 надавливается при заданном давлении. Насос может представлять собой обычный насос, имеющийся в продаже. Альтернативно, насос может представлять собой шприцевый насос, изготовленный экструзией шприца воздухом при постоянном давлении, или переворачиванием шприца, так что поршень находится сверху, и воздействуя на поршень своим весом.
Впускная трубка 11 может быть предпочтительно разделена цилиндрической бобиной, и ее конец предпочтительно снабжен манометром 40, таким как манометр диафрагмального типа, в части впускной трубки 11 около камеры 10 образования тромба.
Кровь в шприце 20 подвергается антикоагуляционной обработке. Примеры средства антикоагуляционной обработки включают цитрат натрия или цитрат калия, оксалат натрия или оксалат калия, цитратно-декстрозный раствор (ACD) и этилендиаминтетраацетат (EDTA). Такое средство антикоагуляционной обработки можно использовать в форме порошка, лиофилизированного продукта или раствора, такого как водный раствор. Среди этих антикоагуляционных средств в целом предпочтителен 3,2% цитрат натрия, потому что он доступен. В этом случае один объем средства антикоагуляционной обработки предпочтительно смешивается с 9 объемами крови.
Цельная кровь или плазма без средства антикоагуляционной обработки сворачивается в пределах нескольких минут. Свертывание можно уменьшить или устранить добавлением вещества, образующего хелат кальция, такого как цитрат. В частности, сообщалось, что цитрат может ингибировать агглютинацию и функции протромбиназы и экзогенной и эндогенной теназы.
Обработанную цитратом кровь можно хранить в жидкой форме в течение заданного периода времени (например, от нескольких часов до нескольких дней) и перерабатывать в препараты крови, такие как продукт цитофереза, плазму, обогащенную тромбоцитами, и плазму с низким содержанием тромбоцитов. Содержащую цитрат плазму можно хранить примерно при -70°С или ниже в течение длительного периода времени (от нескольких месяцев до нескольких лет). В настоящем изобретении можно также использовать цельную кровь и плазму и, в этом случае, можно предпочтительно снова добавлять кальций или подобные вещества.
Однако цельная кровь или плазма с вновь добавленным кальцием спонтанно сворачивается ввиду контактной активации в любом из большинства контейнеров для хранения. В этом случае контактная активация может происходить в пределах около 2-4 мин. С учетом этого в настоящем изобретении антикоагуляционное средство, такое как кальций, можно добавить непосредственно после мониторинга образования тромба во вновь приготовленную обработкой цитратом кровь после взятия пробы крови и замораживания для хранения и последующего размораживания, или в содержащую тромбоциты плазму.
Другие антикоагуляционные средства могут включать гепарин, гирудин, гирулог (пептид С-концевой области гирудина), апротинин, антитромбиновое антитело, аптамер тромбина, ингибитор трипсина, полученный из маиса (1977, J. Biol. Chem 252, 8105). Эти материалы ингибируют свертывание крови путем ингибирования каскада свертывания в результате ингибирования фактора свертываемости крови и поэтому иногда в описании настоящего изобретения будут именоваться как «ингибиторы факторов свертывания».
Образец крови для мониторинга можно взять любым способом, таким как способ, при котором ингибитор факторов свертывания предварительно помещается в шприц или вакуумный сосуд для взятия крови, и затем набирается кровь, или способ, при котором ингибитор факторов свертывания быстро добавляется в кровь непосредственно после взятия пробы крови для получения посредством этого крови, подвергнутой антикоагуляционной обработке.
Далее, кровь собирается в вакуумный сосуд для взятия крови, содержащий ингибитор факторов свертывания, такой как гепарин, и затем для разрушения гепарина добавляются гепариназа и средство антикоагуляционной обработки, подходящее для мониторинга, так что гепарин замещается средством антикоагуляционной обработки, подходящим для цели мониторинга. Кроме того, кровь собирается в вакуумный сосуд для взятия крови, содержащий лимонную кислоту, и затем добавляют хлорид кальция и ингибитор фактора свертывания, подходящий для цели мониторинга, такой как ингибитор трипсина, полученный из маиса, или аптамер тромбина. Поэтому кровь, подвергнутую антикоагуляционной обработке, можно собирать в зависимости от цели мониторинга.
Трубка для лекарственного средства 12, соединенная с камерой 10 образования тромба, может быть изготовлена из прозрачного стекла, термопластичной смолы или подобных материалов. Конец трубки для лекарственного средства 12, который противоположен ее другой стороне, соединяющейся с камерой 10 образования тромба, соединен со шприцем 21 для подачи лекарственного средства, осуществляющего антикоагуляционную обработку, или лекарственного средства, стимулирующего свертывание крови. Шприц 21 может быть соединен с насосом 31 и сдавливающим средством (не показано), так что поршень шприца 21 может надавливаться при заданном давлении. Насос может представлять собой обычный насос, имеющийся в продаже. Альтернативно, насос может представлять собой шприцевый насос, изготовленный экструзией шприца воздухом при заданном давлении, или переворачиванием шприца, так что поршень находится сверху, и воздействуя на поршень грузом. Трубка для лекарственного средства 12 заполняется средством, осуществляющим антикоагуляционную обработку, или средством, стимулирующим свертывание крови, как описано ниже.
Для проведения мониторинга тромба устройством мониторинга образования тромба согласно настоящему изобретению шприц 20 заполняют цельной кровью или плазмой, содержащей тромбоциты, и подвергают антикоагуляционной обработке цитратом натрия (раствором А). Шприц 21 заполнят лекарственным средством, которое обеспечивает антикоагуляционную обработку, таким как раствор хлорида кальция (раствор В). Раствор А и раствор В подают во впускную трубку 11 насосами 30 и 31 соответственно так, чтобы раствор В мог достичь концентрации от 5 до 20 ммоль, при которой можно инициировать каскад свертывания раствора А. В последующем, раствор А и раствор В смешиваются во впускной трубке 11, так что смесь направляется в камеру 10 образования тромба. Затем коллаген или подобное вещество, способное вызвать образование тромба, предварительно наносится на часть внутренней поверхности камеры 10 образования тромба для формирования материа