Оптимизированный слитый белок taci-fc
Иллюстрации
Показать всеНастоящее изобретение относится к оптимизированному слитому белку для блокирования BLyS или APRIL, который содержит внеклеточную область N-концевого усеченного TACI (трансмембранного активатора и CAML-партнера) и Fc последовательность IgG. Участок TACI слитого белка содержит последовательность аминоконцевой области внеклеточной области, начиная от 13-го аминокислотного остатка, полную последовательность цистеинобогащенной области и частичную последовательность стеблевой области из TACI и получен из нативной последовательности TACI между 12-й и 120-й аминокислотами. Участок Fc иммуноглобулина IgG слитого белка содержит шарнирную область, область СН2 и область СНЗ. Участок TACI и участок Fc слиты либо непосредственно, либо через линкерную последовательность. Кроме того, предлагаются последовательность ДНК, кодирующая слитый белок, вектор экспрессии, клетка-хозяин, фармацевтическая композиция, содержащая слитый белок, и применение слитого белка для блокирования BLyS или APRIL. Полученный слитый белок не деградирует в процессе экспрессии, обладает высокой биологической активностью и высоким уровнем экспрессии. Слитый белок по настоящему изобретению может использоваться при лечении заболеваний, связанных с аномальными иммунологическими функциями и при лечении заболеваний, вызываемых аномальной пролиферацией В-лимфоцитов. 6 н. и 4 з.п. ф-лы, 6 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к получению оптимизированного слитого белка, в частности слитого белка TACI-Fc, посредством использования технологии генетической рекомбинации, и к его применению для лечения иммунологических заболеваний.
Уровень техники
Процесс развития и дифференциации лимфоцитов жестко контролируется различными цитокинами. Стимуляторы B-лимфоцитов (BLyS или так называемые BAFF, TNSF13B, THANK, TALL-1, zTNF4) и лиганд, индуцирующий пролиферацию (APRIL), представляют собой цитокины, которые играют важную роль при регуляции иммунной реакции in vivo (Schneider, 2005, Current Opinion in Immunology, 17:282-289; Seyler et al., 2005, The Journal of Clinical Investigation, 115:3083-3092). Они стимулируют развитие и пролиферацию B-лимфоцитов c увеличением экспрессии различных иммуноглобулинов в крови. BLyS и APRIL также имеют главные регуляторные воздействия на созревание T-лимфоцитов и, таким образом, на клеточный иммунитет (Wang et al., 2001, Nature Immunology, 2:632-637).
BLyS и APRIL регулируют иммунную реакцию лимфоцитов через рецепторы на клеточной поверхности лимфоцитов. Они связываются с рецепторами клеточных мембран TACI (трансмембранный активатор и CAML-партнер) и BCMA (антиген созревания В-лимфоцитов). В дополнение к этому, BLyS может также связываться с другим рецептором, BAFF-R. B-лимфоцит экспрессирует TACI, BCMA и BAFF-R. Зрелый T-лимфоцит экспрессирует TACT. BLyS и APRIL регулируют активацию, пролиферацию и развитие лимфоцитов через трансдукцию сигналов, опосредуемую этими рецепторами, и таким образом усиливают иммунную реакцию. В дополнение к этому, в опухолях, полученных из лимфоцитов, BLyS и APRIL также облегчают пролиферацию клеток опухоли и подавляют апоптоз, тем самым ускоряя развитие опухоли.
Избыточная экспрессия BLyS и APRIL представляет собой один из факторов патогенеза при многих аутоиммунных заболеваний, которые включают, без ограничения, системную красную волчанку (SLE), ревматоидный артрит (RA), синдром Шегрена и тому подобное. В клинических исследованиях показано, что концентрация BLyS часто положительно коррелирует с тяжестью аутоиммунных заболеваний. По этой причине ингибирование BLyS и APRIL становится потенциально эффективным средством для лечения связанных с ними аутоиммунных заболеваний. В то же время, поскольку BLyS и APRIL могут ускорять развитие опухолей B-лимфоцитов, ингибирование BLyS и APRIL может также использоваться для лечения опухолей B-лимфоцитов, таких как хроническая лимфоцитная лейкемия, множественная миелома, лимфома B-лимфоцитов и тому подобное.
Поскольку TACI имеет высокое сродство как к BLyS, так и к APRIL, является возможным использование растворимого TACI (внеклеточного участка TACI) для предотвращения взаимодействия BLyS или APRIL с их мембранными рецепторами (TACI, BCMA, BAFF-R), тем самым блокируя биологическую активность BLyS или APRIL и излечивая аутоиммунные заболевания или опухоли.
В исследованиях показано, что слитый белок из внеклеточного участка TACI и фрагмента Fc IgG (TACI-Fc) может эффективно ингибировать развитие заболевания, вызванного BLyS (Gross et al., 2001, Immunity, 15:289-302). Однако в исследованиях также показано, что слитый белок TACI-Fc, сконструированный посредством использования внеклеточного участка нативного TACI, может легко деградироваться, когда он экспрессируется в клетках, и получаемые при этом продукты часто являются гетерогенными. По этой причине TACI-Fc слитый белок из нативного TACI с фрагментом Fc не является пригодным для промышленного получения. Настоящее изобретение имеет целью усовершенствование слитого белка TACI-Fc посредством технологии генной инженерии для того, чтобы разработать фармацевтическую композицию, применимую для промышленного получения.
Сущность изобретения
Настоящее изобретение относится к способам конструирования и получения белкового лекарственного средства, которое блокирует BLyS и APRIL, к способу его получения и к его использованию для лечения заболеваний.
В настоящем изобретении предложены несколько слитых белков, которые получают посредством слияния фрагмента TACI с фрагментом Fc иммуноглобулина и которые могут блокировать пролиферацию B-лимфоцитов, структура слитого белка отличается тем, что:
участок TACI слитого белка содержит частичную последовательность аминоконцевой области внеклеточной области, полную последовательность цистеинобогащенной области и частичную последовательность стеблевой области от TACI; в то время как иммуноглобулин Fc в слитом белке содержит шарнирную область, область CH2 и область CH3; последовательность TACI и последовательность Fc сливают непосредственно или через линкерную последовательность;
где фрагмент TACI может быть выбран из группы, состоящей из положений от 13 до 108 или от 13 до 118 в последовательности аминокислот TACI, и указанная линкерная последовательность может представлять собой 9Gly, и
фрагмент Fc иммуноглобулина может быть получен из Fc иммуноглобулина человека или животного и может представлять собой полноразмерный Fc или его частичную последовательность; и в дополнение к этому Fc может быть получен из IgG, IgM, IgD и IgA, каждый из которых включает все изотипы, соответственно, такие как IgG1, IgG2, IgG3 и IgG4, а предпочтительно IgG1; и
где указанный фрагмент TACI может быть выбран из группы, состоящей из последовательности TACI человека и животных.
В частности, предпочтительный слитый белок по настоящему изобретению может представлять собой:
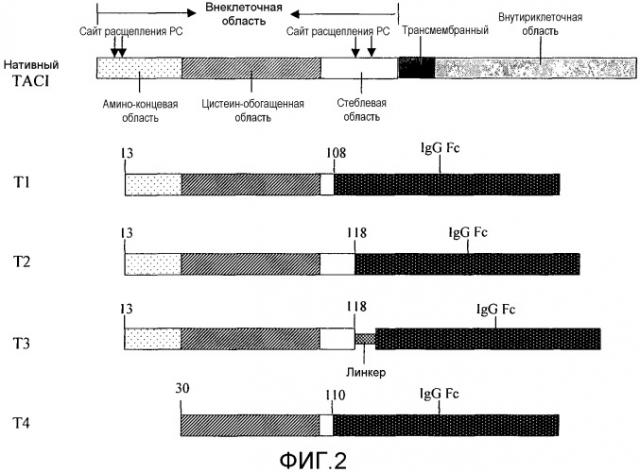
a. слитый белок T1: который получают посредством слияния 13-й - 108-й аминокислот TACI и Fc иммуноглобулина IgG1 (SEQ ID NO:1),
b. слитый белок T2: который получают посредством слияния 13-й - 118-й аминокислот TACI и Fc иммуноглобулина IgG1 (SEQ ID NO:2), и
c. слитый белок T3: который получают посредством слияния 13-й - 118-й аминокислот TACI, линкерной последовательности 9Gly и Fc иммуноглобулина IgG1 (SEQ ID NO:3); и
где TACI выбирают из группы, состоящей из последовательности внеклеточных областей для TACI (трансмембранного активатора и CAML-партнера) человека и животных.
Настоящее изобретение также относится к последовательности ДНК, которая кодирует белок по настоящему изобретению.
Указанная последовательность ДНК представлена в SEQ ID NO:5-7.
Слитый белок TACI-Fc с нативной последовательностью TACI не является применимым для промышленного получения из-за легкой деградации белка. PCT/US2002/015910 описывает, что слияние фрагмента TACI, в котором осуществляют делецию полной аминоконцевой области и частичной последовательности стеблевой области, с фрагментом Fc может предотвращать белковую деградацию слитого белка. Однако сообщается, что удаление аминоконцевой области значительно понижает биологическую активность TACI (Wu et al., 2000, The Journal of Biological Chemistry, 275:35478-35485).
Ключ к настоящему изобретению лежит в том, что искусственные нейронные сети системы компьютерного программного обеспечения для пропротеин конвертазы (PC) используют для анализа последовательности аминокислот внеклеточной области TACI. Результат анализа показывает, что последовательность внеклеточной области TACI содержит два сайта расщепления PC (9-я и 135-я аминокислоты) и два дополнительных сайта (12-я и 120-я аминокислоты), имеющих показатель, близкий к пороговому значению для сайта расщепления PC. Предполагается, что эти сайты расщепления PC по существу могут быть ответственными за деградацию TACI в процессе экспрессии. На основании этого открытия авторы удалили указанные сайты расщепления PC при оптимизации молекулы TACI и слили фрагменты TACI без сайтов расщепления PC с Fc. Эксперимент авторов изобретения показал, что новый слитый белок эффективно предотвращает деградацию TACI во время экспрессии. Усеченная последовательность TACI, а также другие способы могут использоваться для удаления этих сайтов расщепления PC. Например, сайт-направленный мутагенез ДНК может использоваться для удаления этих сайтов расщепления РС. Таким образом, могут быть выбраны различные способы оптимизации для достижения одной и той же цели. Оптимизированный слитый белок TACI-Fc по настоящему изобретению сохраняет большую часть остатков в аминоконцевой области и длинную последовательность аминокислот в стеблевой области молекулы TACI. Оптимизированный слитый белок TACI-Fc преодолевает проблему деградации белка. По сравнению со слиянием TACI-Fc, при котором удаляют всю N-концевую область, оптимизированные слитые белки TACI-Fc по настоящему изобретению показывают более высокую биологическую активность и уровень экспрессии белка.
Конструирование слитых белков по настоящему изобретению основывается на обычной молекулярной технологии клонирования, и конкретные экспериментальные протоколы могут быть найдены в различных лабораторных руководствах, таких как 2-я и 3-я версии Molecular Cloning: A Laboratory Manual.
Способ синтеза PCR используют для клонирования ДНК, кодирующей упомянутый выше слитый белок, в вектор. Вектор для экспрессирования слитого белка может представлять собой плазмиду, используемую обычно в молекулярной биологии. Сигнальная пептидная последовательность включается в переднюю часть аминоконца слитого белка, чтобы обеспечить секрецию белка из клетки. Векторная последовательность содержит промотор для запуска экспрессии гена, старт- и стоп-сигналы для трансляции белка, а также последовательность полиаденилирования (polyA). Вектор может содержать ген устойчивости к антибиотикам для облегчения репликации плазмиды в бактериях. В дополнение к этому вектор может также содержать ген селекции эукариотических клеток для селекции штаммов стабильно трансфицированных клеток.
После конструирования плазмиды последовательность ДНК слитого белка подтверждается секвенированием. Затем соответствующий белок может экспрессироваться посредством трансфекции ДНК плазмиды в клетки. Множество систем экспрессии являются доступными для экспрессии таких слитых белков, они включают, без ограничения, клетки млекопитающих, бактерии, дрожжи, клетки насекомых и тому подобное.
Белки, экспрессируемые в клетках млекопитающих, гликозилируются в процессе пост-трансляционной модификации. Последовательности аминокислот слитых белков TACI-Fc по настоящему изобретению содержат гликозилированные аминокислоты; так что клетки млекопитающих являются наиболее предпочтительными для экспрессии этих белков. Имеются различные клетки млекопитающих, пригодные для крупномасштабной экспрессии белков, такие как клетки CHO, клетки SP20, клетки NS0, клетки COS, клетки BHK и клетки PerC6. Множество других клеток также может использоваться для экспрессии и продуцирования этих белков, и, таким образом, они рассматриваются в настоящем изобретении. Плазмида, кодирующая полипептиды, может проникать в клетки посредством трансфекции. Существует множество способов трансфицирования клеток, и они включают (без ограничения) электропорацию и трансфекцию, опосредуемую липосомами или кальцием, и тому подобное.
В дополнение к клеткам млекопитающих другие системы экспрессии также могут использоваться для экспрессии этих слитых белков, такие как бактерии, дрожжи и клетки насекомых, которые также рассматриваются в настоящем изобретении. Выход белка в этих системах экспрессии может быть более высоким, чем в клетках млекопитающих, но белок, продуцируемый в этих системах экспрессии, как правило, не имеет гликозилирования или имеет форму конъюгата с сахаром, которая отличается от клеток млекопитающих.
После экспрессии белка твердофазный иммуноферментный анализ (ELISA) или другие способы могут использоваться для определения концентрации слитых белков в супернатантах культур клеток. Поскольку эти слитые белки содержат фрагмент Fc иммуноглобулина, афинная хроматография на белке A или G может использоваться как начальная стадия очистки для выделения этих слитых белков.
Фундаментальная функция слитого белка TACI-Fc по настоящему изобретению заключается в блокировании BLyS и APRIL, в то время как BLyS и APRIL являются ключевыми факторами для стимулирания развития B-лимфоцитов и созревания T-лимфоцитов. Соответственно, слитый белок TACI-Fc может использоваться при заболеваниях, связанных с аномальными иммуннологическими функциями и при заболеваниях, вызываемых аномальной пролиферацией B-лимфоцитов. Эти заболевания включают (без ограничения) ревматоидный артрит, системную красную волчанку и опухоль из B-лимфоцитов. Слитый белок TACI-Fc может вводиться в виде инъекции в организм человека как очищенный рекомбинантный белок. Альтернативно, последовательность ДНК, кодирующая слитый белок, может вставляться в соответствующий вектор для экспрессии слитого белка в организм человека посредством генной терапии или клеточной терапии. По этой причине имеется множество подходов к использованию слитого белка по настоящему изобретению, которые включают использование не только самого белка, но также и ДНК, которая кодирует слитый белок.
Настоящее изобретение также относится к фармацевтической композиции слитого белка, которая может содержать фармацевтически приемлемый носитель. Фармацевтическая композиция может представлять собой любую форму фармацевтического препарата, предпочтительно препарата для инъекции, включая жидкую форму и лиофилизированную форму. Фармацевтическая композиция может быть получена в соответствии с обычными фармацевтическими технологиями, которые включают смешивание активного ингредиента, то есть слитого белка по настоящему изобретению, с фармацевтически приемлемым носителем для приготовления желаемой лекарственной формы на основе фармацевтической технологии.
Краткое описание чертежей
Фиг.1 показывает анализ последовательности аминокислот TACI с помощью искусственных нейронных сетей для пропротеин конвертазы (PC). Остатки 9-й и 135-й аминокислот во внеклеточной области TACI показаны как сайты расщепления РС. Остатки 12-й и 120-й аминокислот также имеют значение, близкое к порогу для сайта расщепления PC.
Фиг.2 показывает структуры нативного полноразмерного белка TACI и четырех слитых белков TACI-Fc.
Фиг.3 показывает сравнение экспрессии белка из клеток CHO для четырех слитых белков TACI-Fc.
Фиг.4 показывает анализ связывания четырех слитых белков TACI-Fc с BLyS. Результаты показывают, что весь слитый белок может связываться с BLyS, при этом T3 имеет самое высокое сродство к BLyS.
Фиг.5 показывает анализ SDS-PAGE очищенного слитого белка T3. Слитый белок T3, экспрессируемый в высокопроизводительной системе экспрессии CHO, выглядит как одна зона белка в геле, и имеет видимую молекулярную массу примерно 42 кДа, которая согласуется с ожидаемой молекулярной массой гликозилированного слитого белка T3.
Фиг.6 показывает значительное воздействие на аутоиммунные заболевания для слитого белка T3 на модели индуцированного коллагеном артрита у мышей. Развитие артрита у мышей измеряют с помощью клинической балльной оценки артрита. Результаты показывают, что мыши, обработанные слитым белком TACI-Fc T3, имеют значительно более низкие клинические балльные оценки, чем у контрольной группы (P<0,01).
Подробное описание изобретения
В настоящем изобретении представляются следующие примеры для подробного иллюстрирования строения, конструирования и оценки слитых белков TACI-Fc. Однако содержание и использование настоящего изобретения не ограничивается рамками примеров.
Пример 1: Анализ последовательности TACI
Пропротеин конвертаза (PC) может специфично расщеплять полипептиды в клетках. Для многих белков расщепление PC является важной стадией во время пост-трансляционной модификации белка. Семейство PC состоит из ряда ферментов, которые распознают и расщепляют конкретные последовательности аминокислот. Искусственные нейронные сети для PC представляют собой систему компьютерного программного обеспечения, которая использует базу данных для известных сайтов расщепления РС, для предсказания сайтов расщепления РС, имеющихся в последовательности белка. Система может использоваться для анализа любых потенциальных сайтов расщепления РС в белке. Настоящее изобретение анализирует последовательность аминокислот TACI посредством использования искусственной нейронной сети для PC, и обнаружено, что имеется два сайта расщепления РС (9-я и 135-я аминокислоты) во внеклеточной области TACI. В дополнение к этому два дополнительных сайта (12-я и 120-я аминокислоты) имеют балльные оценки, близкие к пороговым значениям, для сайтов расщепления PC (фиг.1). По этой причине является возможным конструирование оптимизированного слитого белка TACI-Fc посредством удаления этих сайтов расщепления РС и слияния последовательности TACI без потенциальных сайтов расщепления РС с Fc, чтобы предотвратить расщепление белка. На основе этих сведений авторы сконструировали несколько слитых белков TACI-Fc, где последовательности TACI получают из нативной последовательности TACI между 12-й и 120-й аминокислотами (фиг.2). Общие характеристики, присущие этим новым слитым белкам TACI-Fc, заключаются в том, что в них: 1) содержится главная последовательность аминоконцевой области TACI, 2) содержится полная последовательность цистеинобогащенной области и 3) содержится частичная последовательность стеблевой области.
Пример 2. Конструирование слитых белков и плазмиды, кодирующей их
Общую РНК выделяют и очищают от мононуклеарных клеток периферической крови человека посредством использования набора для очистки общей РНК Qiagen. кДНК синтезируют из общей РНК с помощью обратной транскриптазы. Затем желаемые фрагменты TACI получают путем амплификации с помощью полимеразной цепной реакции (PCR) с соответствующими праймерами. Фрагмент иммуноглобулина Fc получают с помощью PCR амплификации из клонированной плазмиды IgG1 Fc. Наконец, последовательности TACI и Fc сливают с помощью PCR, и затем успешно конструируют последовательности ДНК слитых белков TACI-Fc.
Реакции PCR включают: 30 циклов денатурации при 95°C в течение 30 секунд; отжиг при 56°C в течение 45 секунд и удлинения при 72°C в течение 2 минут. Продукты PCR TACI и Fc клонируют, соответственно, в плазмиду pCR2.1 посредством использования набора для клонирования TA. Плазмиды трансформируют в E.coli. Белые колонии E.coli повергают селекции и выращивают в среде LB в течение ночи. Затем плазмиды выделяют посредством использования набора для плазмид Qiagen. Последовательности TACI и Fc подтверждают посредством расщепления ферментом рестрикции и секвенирования ДНК. Наконец, TACI и IgG Fc кДНК сливают посредством использования способа PCR с перекрыванием. Фрагменты слияния TACI-Fc вставляют в плазмиду экспрессии млекопитающих, рекомбинантные плазмиды трансформируют в E. coli, производят положительную селекцию колоний и целевые последовательности подтверждают с помощью дигерирования ферментами рестрикции и анализов секвенирования ДНК. Наконец, полученные плазмиды используют для трансфицирования клеток CHO для экспрессии слитых белков.
| Белок T1 | аминокислоты 13-108 TACI+Fc | SEQ ID NO:1 и 5 |
| Белок T2 | аминокислоты 13-118 TACI+Fc | SEQ ID NO:2 и 6 |
| Белок T3 | аминокислоты 13-118 TACI+линкерная последовательность 9Gly+Fc | SEQ ID NO:3 и 7 |
В дополнение к этому это исследование также включает слитый белок T4 для сравнения.
Отличием белка T4 от других трех слитых белков является отсутствие N-концевой области TACI в T4. На самом деле T4 представляет собой белок, слитый между аминокислотными остатками 30-110 TACI и последовательностью Fc (Смотрите SEQ ID NO:4 и 8).
Праймер последовательности для слитого белка T1:
Прямой праймер: AGCCGTGTGGACCAGGAGGAG
Обратный праймер: GAGCTTGTTCTCACAGAAGTATG
Праймер последовательности для слитого белка T2:
Прямой праймер: AGCCGTGTGGACCAGGAGGAG
Обратный праймер: GAGCTCTGGTGGAAGGTTCACTG
Праймер последовательности для слитого белка T3:
Прямой праймер: AGCCGTGTGGACCAGGAGGAG
Обратный праймер:
ACCTCCACCTCCACCTCCACCTCCACCGAGCTCTGGTGGAAGGTTCACTGGGCTCCT
Праймер последовательности для слитого белка T4:
Прямой праймер: GCTATGAGATCCTGCCCCGAAG
Обратный праймер: TGAAGATTTGGGCTCGCTCC
Пример 3: Экспрессия слитых белков TACI-Fc в клетках
Настоящее изобретение иллюстрирует экспрессию слитых белков TACI-Fc, например, в клетках млекопитающих. Четыре слитых белка T1, T2, T3 и T4 клонируют в плазмиду pcDNA3.1 (Invitrogen). Сигнальную последовательность пептидов Flt-1 добавляют на 5'-конце каждого слитого белка. Четыре плазмиды TACI-Fc очищают с использованием набора для очистки плазмид ДНК высокой чистоты (QIAGEN). Затем плазмиду ДНК вводят в клетки CHO, соответственно, с помощью набора для трансфицирования FUGEN6 (ROCHE). Транзиентный способ трансфицирования используют для сравнения уровней экспрессии четырех слитых белков TACI-Fc. Клетки CHO культивируют в чашках для клеточных культур в полной среде DMEM с 10% фетальной сывороткой теленка. Когда клетки достигают определенной плотности, к культуре добавляют комплекс плазмиды ДНК с реагентом FUGEN 6 (Roche). После культивирования в течение трех дней супернатанты собирают, и они содержат экспрессируемые слитые белки. Концентрации слитых белков определяют с помощью способа ELISA. Результаты для концентрации белков показаны на фиг.3: T3 имеет самую высокую экспрессию, среди прочих, за ним следует T2. T4 имеет самый низкий уровень экспрессии. Таким образом, с точки зрения экспрессии белка, слитый белок T3 является самой лучшей молекулярной композицией.
Пример 4: Оценка активности связывания слитого белка с BLyS
После экспрессии каждого слитого белка авторы определяют активность его связывания с BLyS в анализе связывания с BLyS. В этом анализе рекомбинантный белок BLyS (R&D Systems) сначала наносят как покрытие на 96-луночные планшеты ELISA. Сайты неспецифичного связывания белка блокируют с помощью блокирующего раствора 2% BSA. Затем слитые белки TACI при различных концентрациях добавляют в соответствующие лунки. Планшеты инкубируют в течение двух часов при 37°C, а затем промывают перед добавлением конъюгата антитела кролика против Ig человека - HRP. Наконец, пероксидазный субстрат используют для проявления цвета. Устройство для считывания планшетов ELISA используют для измерения значения OD (оптической плотности) для каждой лунки 96-луночного планшета, при этом увеличение значения OD указывает на связывание слитого белка с BLyS. Авторы обнаружили, что T3 имеет самое лучшее связывание с BlyS, T1 и T2 имеют умеренное связывание и T4 имеет самое низкое связывание (фиг.4). Таким образом, с точки зрения как экспрессии белка, так и активности связывания с BLyS, слитый белок T3 является самой лучшей молекулярной композицией.
Пример 5: Установление линий клеток с высокой экспрессией
После определения того, что слитый белок T3 представляет собой самую лучшую молекулярную композицию, авторы установили стабильный и имеющий высокую экспрессию штамм клеток CHO посредством использования стабильного трансфицирования и амплификации генов. Ген, кодирующий слитый белок T3, клонируют в плазмиду, содержащую ген DHFR. ДНК плазмиды с высокой чистотой очищают посредством использования набора для очистки плазмид QIAGEN, и клетки CHO трансфицируют плазмидой с использованием электропорации. Трансфицированные клетки культивируют в среде селекции с получением резистентных клонов. Метотрексат (MTX) добавляют для амплификации гена T3 и получения клонов клеток с высокой экспрессий. Наконец клетки CHO полученного селекцией клона размножают в культуре, и слитый белок продуцируется в крупном масштабе в биореакторе. Концентрацию слитого белка определяют с помощью ELISA. При использовании этого подхода авторы успешно производят слитый белок T3 в крупном масштабе. Выход слитого белка может быть выше, чем 20 пг на клетку в день. Слитый белок T3 может очищаться посредством использования афинной хроматографии на белке A или G.
Пример 7: Электрофоретическая идентификация слитого белка TACI-Fc
В настоящем изобретении экспериментально показано, что не происходит деградации слитого белка во время экспрессии оптимизированного слитого белка. Штамм клеток CHO для высокой экспрессии слитого белка T3 культивируют в колбе для культур клеток. После того как клетки достигают высокой плотности, супернатант культуры клеток собирают и слитый белок очищают посредством использования афинной хроматографии на белке. Очищенный слитый белок смешивают с нагрузочным буфером для SDS-PAGE и кипятят в течение 3 минут. Слитый белок разделяют в полиакриламидном геле и окрашивают с помощью Кумасси ярко-синего. Зоны белка визуализируются после удаления красителя из геля с помощью метанола. Показано, что белок T3 виден как одна зона в геле (фиг.5), с видимой молекулярной массой примерно 42 кДа, которая согласуется с ожидаемой молекулярной массой гликозилированого слитого белка T3. Важно, что не наблюдается зоны белка при молекулярной массе меньше чем 42 кДа. Этот результат показывает, что оптимизированный слитый белок TACI-Fc по настоящему изобретению может эффективно предотвращать расщепление и деградацию белка в процессе экспрессии, и, таким образом, может использоваться для крупномасштабного промышленного получения.
Пример 8: Терапевтические воздействия оптимизированного слитого белка TACI-Fc на аутоиммунное заболевание
Продемонстрировано на модели индуцированного коллагеном артрита у мышей, что оптимизированный слитый белок TACI-Fc имеет антиаутоиммунную биологическую активность. Мышей DBA/1 в возрасте 8 недель делят на две группы по 10 животных в каждой группе. Каждой мыши делают чрескожную инъекцию 200 мкг бычьего коллагена типа II, смешанного с полным адъювантом Фройнда. Через 21 день каждой мыши делают чрескожную инъекцию белка бычьего коллагена, типа II, смешанного с неполным адъювантом Фройнда. Со дня 24 каждой мыши в исследуемой группе делают подкожную инъекцию 100 мкг слитого белка T3 по три раза в неделю. Мышам в контрольной группе делают инъекцию нормального IgG человека при такой же дозе. Развитие артрита измеряют с использованием клинических балльных оценок артрита. Они показывают, что тяжесть артрита у мышей, обработанных T3, значительно меньше, чем у контрольных мышей, и имеется значимая разница (P<0,01) в клинических балльных оценках между двумя группами (фиг.6).
В итоге оптимизированные слитые белки TACI-Fc по настоящему изобретению предотвращают деградацию белка в процессе экспрессии, имеют более высокую биологическую активность и показывают высокие уровни экспрессии белка, таким образом, они могут использоваться в крупномасштабном промышленном производстве.
1. Слитый белок для блокирования BLyS или APRIL, состоящий из усеченного TACI и Fc иммуноглобулина IgG, отличающийся тем, что участок TACI слитого белка содержит последовательность аминоконцевой области внеклеточной области, начиная от 13-ого аминокислотного остатка, полную последовательность цистеинобогащенной области и частичную последовательность стеблевой области из TACI и получен из нативной последовательности TACI между 12-й и 120-й аминокислотами; участок Fc иммуноглобулина IgG слитого белка содержит шарнирную область, область СН2 и область СНЗ; и участок TACI и участок Fc слиты либо непосредственно, либо через линкерную последовательность.
2. Слитый белок по п.1, отличающийся тем, что участок TACI выбирают из группы, состоящей из 13-й - 108-й аминокислот и 13-й - 118-й аминокислот TACI; линкерная последовательность представляет собой 9Gly.
3. Слитый белок по п.1, отличающийся тем, что участок Fc иммуноглобулина получен из IgGl.
4. Слитый белок по п.1, отличающийся тем, что последовательность аминокислот слитого белка выбрана из последовательностей, представленных в SEQ ID NO: 1-3.
5. Последовательность ДНК, кодирующая слитый белок по п.1, отличающаяся тем, что аминокислотная последовательность слитого белка выбрана из последовательностей, представленных в SEQ ID NO: 1-3.
6. Последовательность ДНК по п.5, отличающаяся тем, что она представляет собой последовательность, представленную в SEQ ID NO: 5-7.
7. Вектор для экспрессии слитого белка по п.1, содержащий последовательность ДНК по п.5.
8. Клетка, содержащая вектор по п.7, которую используют для экспрессии соответствующего слитого белка по п.1 и которая выбрана из эукариотической клетки или прокариотической клетки.
9. Применение слитого белка по п.1 при получении лекарственного средства для блокирования BLyS или APRIL.
10. Фармацевтическая композиция для блокирования BLyS или APRIL, содержащая слитый белок по п.1 и фармацевтически приемлемый носитель.