Способ удаления s-белков с поверхности пурпурных мембран
Иллюстрации
Показать всеИзобретение предназначено для использования в области биотехнологии, электроники, альтернативной энергетики и нанобиофотоники. Предложен способ удаления белковых молекул наружного S-слоя с поверхности пурпурных мембран клеток галобактерий Halobacterium salinarum под действием ультразвука. Способ заключается в том, что суспензию клеток галобактерий подвергают воздействию ультразвука, с частотой 880кГц и плотностью энергии в среде 0,1 Вт/см3 в течение 10 мин при температуре 20°С. Предложенный способ позволяет очищать поверхность пурпурных мембран от связанных с ней белковых комплексов без нарушения целостности мембраны и без применения каких-либо посторонних веществ. 2 ил.
Реферат
Область техники
Изобретение относится к области биотехнологии, электроники, альтернативной энергетики, нанобиофотоники и направлено на создание технологически простого и экономичного способа удаления белковых молекул наружного S-слоя с поверхности пурпурных мембран клеток галобактерий Halobacterium salinarum.
Описание предшествующего уровня техники
Результаты многочисленных и разноплановых исследования пурпурных мембран галобактерий указывают на перспективность их использования для конструирования функциональных элементов биосенсоров, биокомпьютеров и иных нанобиофотонных устройств [1]. В ряде случаев для использования свойств пурпурных мембран требуется получение многослойных ориентированных мембран.
Известны способы удаления молекул наружного S-слоя с поверхности бактериальных клеток химическими или биохимическими методами [2], однако перечисленные методы малопригодны в случае пурпурных мембран клеток галобактерий Н. salinarum, поскольку используемые реактивы обычно нарушают сложную, строго упорядоченную организацию квазикристаллической структуры пурпурных мембран галобактерий. Неверно структурированные пурпурные мембраны хоть и сохраняют некоторую активность, однако обнаруживают существенное снижение биотехнологического потенциала и имеют более узкую область применимости.
Из нехимических способов десорбции белков с поверхности структурных элементов крови (эритроцитов, лимфоцитов) чаще других пользуются ультразвуком, интенсивность которого ниже порога кавитации (0,05-0,3 Вт/см2, 880 кГц, 5-60 мин) [3, 4]. Молекулы антигенов и других биополимеров удалялись с поверхности клеток, что подтверждалось изменениями энзиматической активности поверхности эритроцитов, потерей эритроцитами, а также лимфоцитами и соматическими клетками человека антигенов, адсорбированных на поверхностях внешних мембран. В результате воздействия ультразвуком с интенсивностью 0,05 Вт/см2 (0,88 МГц) на суспензию эритроцитов с концентраций 17000 кл./мм3 в физиологическом растворе в первую же минуту с поверхности каждой клетки десорбируется ~2·10-14 г веществ белковой природы (для сравнения: масса самого эритроцита - 10-10 г). Дальнейшая обработка не приводит к повышению в среде концентрации десорбированного вещества, что свидетельствует о достижении равновесия в процессах десорбции ↔ реадсорбции.
Ультразвуковое воздействие, изменяющее поверхностный белковый состав клеток, повышает их адгезивные свойства, что сопровождается появлением в супернатанте (в жидкости, освобожденной от клеток осаждением в центрифуге) заметных количеств поверхностных гликопротеидов. Однако после прекращения воздействия ультразвуком "смытые" макромолекулы быстро сорбируются на поверхности клеток [3].
Таким образом, ультразвук с интенсивностью ниже порога кавитации (0,3 Вт/см2, 880 кГц) способен десорбировать с поверхности клеток макромолекулы, связанные с мембранами нековалентными связями.
В ультразвуковом поле с интенсивностью, превышающей порог кавитации, возможны разрывы химических связей в компонентах клеточных мембран, твердые поверхности легко очищаются от разнообразных загрязнений [4], в том числе и от прионов [5], а с поверхности клеток HeLa в суспензии при 4-6 Вт/см2, 880 кГц смываются поверхностные слои, отделяются нитевидные образования, в цитоплазматических мембранах возникают дыры [3].
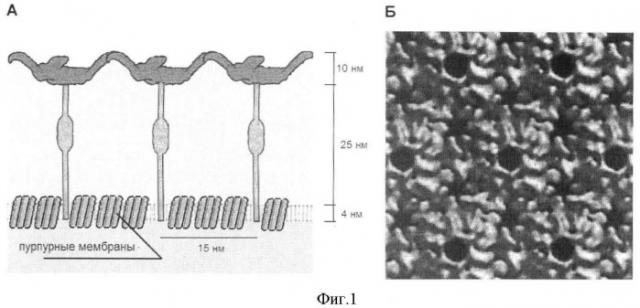
Поверхностные S-белки представляют собой гликопротеидные комплексы, имеющие форму зонтов с длиной ручки порядка 25-30 нм, нековалентно связанной с липидами цитоплазматических мембран (фиг.1). Верхние части зонтов, с характерными размерами порядка 15 нм, нековалентно связаны между собой в отдельных определенных точках и формируют ажурную структуру. Образующиеся в жидкости при ультразвуковой кавитации акустические микропотоки с высокими градиентами скоростей обеспечивают смыв этих молекулярных комплексов с поверхности цитоплазматической мембраны. Масштабы микропотоков уменьшаются с увеличением частоты ультразвука, однако при разрешенных Международной электротехнической комиссией частотах, превышающих 2,4 МГц, резко возрастает порог кавитации и эффективность ультразвуковой кавитации уменьшается. При разрешенных частотах ниже 880 кГц существенно возрастает вероятность нарушения целостности цитоплазматических мембран, что приводит к появлению в суспензии нуклеиновых кислот и других компонентов цитоплазматического содержимого. При получении препаратов пурпурных мембран для обозначенных выше направлений использования следует избегать разрушения клеток, поскольку посторонние вещества в препарате пурпурных мембран снижают их качество. Иными словами, установлены соответствующие поставленным требованиям режимы обработки клеток галобактерий ультразвуком, обеспечивающие как сохранение целостности цитоплазматических мембран, так и удаление поверхностных S-белков.
Таким образом, совокупность отличительных признаков описываемого способа обеспечивает достижение указанного результата.
Цель заявляемого изобретения
Настоящее изобретение направлено на удаление без применения посторонних веществ с поверхности остающихся целыми цитоплазматических мембран галобактерий, связанных с мембранами белковых комплексов, препятствующих созданию многослойных конструкций элементов фоточувствительных нанобиоустройств.
В качестве прототипа выбран патент Koenig D.W., Hoffman D.R., Carney S. Use of sonication to eliminate prions. Patent. IPC8 Class: AA62D302FI, USPC Class: 4352625 [5]. Наиболее близким способом того же назначения к заявляемому изобретению по совокупности существенных признаков является способ десорбции ультразвуком антигенов с поверхности эритроцитов [3], однако данный способ ограничен применением некавитационного ультразвука, поскольку при кавитации в мембранах образуются отверстия, сквозь которые вытекает цитоплазматическое содержимое эритроцитов.
Существенные отличия предлагаемого способа в сравнении с прототипом следующие.
Описание изобретения
Указанный результат достигается тем, что суспензию галобактерий в концентрации 0,5×108 кл./мл помещают в ультразвуковое поле 880 кГц с плотностью энергии 0,1-1,0 Вт/см3 и подвергают обработке в течение 2-60 мин при температуре в интервале 20-45°С.
В результате проведенного анализа уровня техники удаления белковых комплексов с поверхности цитоплазматических мембран галобактерий источник, характеризующийся признаками, тождественными всем существенным признакам заявленного изобретения, не обнаружен, следовательно, заявленное изобретение соответствует условию "новизна".
Дополнительный поиск известных решений показал, что заявленное изобретение не вытекает для специалиста явным образом из известного уровня техники, поскольку предложенный способ обладает комплексом свойств, обеспечивающих удаление связанных водородными связями и гидрофильно-гидрофобными силами взаимодействия белковых комплексов с липидным бислоем цитоплазматических мембран, и при этом не приводящих к нарушению целостности клеток галобактерий. Следовательно, заявленное изобретение соответствует условию "изобретательский уровень".
Сущность изобретение иллюстрируется следующими примерами, подтверждающими возможность его реализации с получением вышеуказанного технического результата.
Пример 1
Суспензию клеток галобактерий Н. salinarum с концентрацией клеток 0,5×108 кл./мл в 4 М растворе хлористого натрия в кювете объемом 5 см3 подвергают действию ультразвука с частотой 880 кГц и плотностью энергии в среде 0,1 Вт/см3 в течение 10 мин при температуре 20°С. Затем клетки осаждают, а в надосадочной жидкости определяют содержание белка (по Лоури) и содержание нуклеиновых кислот (по Спирину). Отсутствие изменения содержания нуклеиновых кислот в среде свидетельствовует о сохраненной целостности цитоплазматических мембран клеток Н. salinarum. Увеличение содержания белка в среде с 4,5 до 5 мг/л свидетельствует об удалении молекул S-белков с поверхности клеток галобактерий. Методом оптической микроскопии выявлены также изменения обычной палочковидной формы клеток галобактерий Н. salinarum на сферическую, что может быть связано с отсутствием поверхностного формообразующего S-слоя белков.
Пример 2
Пример по п.1, отличающийся тем, что суспензию клеток галобактерий H. salinarum подвергают действию ультразвука с частотой 35 кГц. Прямые наблюдения методом оптической микроскопии выявили уменьшение числа клеток в поле зрения микроскопа, изменения в размерах и форме клеток. Содержание нуклеиновых кислот в среде возросло в результате ультразвуковой обработки, что свидетельствует о разрушении мембран части клеток. Содержание белка увеличилось с 4,5 до 5,5 мг/л, что свидетельствует о переходе в среду белка не только с поверхности клеток, но и содержимого цытоплазмы, вытекающего при нарушении целостности клеточных мембран.
Пример 3
Пример по п.1, отличающийся тем, что суспензию клеток галобактерий Н. salinarum подвергают действию ультразвука с частотой 880 кГц и плотностью энергии в среде 0,5 Вт/см3 в течение 2 мин при температуре 45°С. Отсутствие изменения содержания нуклеиновых кислот в среде свидетельствует о сохраненной целостности цитоплазматических мембран клеток Н. salinarum. Содержание белка в среде увеличилось с 4,5 до 5 мг/л, что свидетельствует об удалении молекул S-белков с поверхности клеток галобактерий.
Пример 4
Пример по п.3, отличающийся тем, что суспензию клеток галобактерий Н. salinarum подвергают действию ультразвука с частотой 880 кГц и плотностью энергии в среде 1 Вт/см3 в течение 2 мин при температуре 55°С. Содержание нуклеиновых кислот в среде возросло в результате ультразвуковой обработки, что свидетельствует о разрушении мембран части клеток. Содержание белка увеличилось с 4,5 до 5,5 мг/л, что соответствует переходу в раствор молекул белка не только с поверхности клеток, но и вытекающего из цитоплазмы при нарушении целостности клеточных мембран.
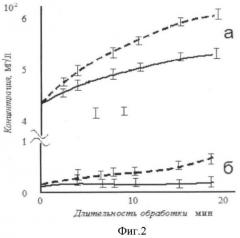
Результаты вышеприведенных, а также ряда аналогичных измерений суммированы на фиг.2.
Исследования показали, что при равной плотности акустической энергии, определяемой калориметрически и по радиационному давлению в рабочем объеме реактора, ультразвук низкой частоты приводит к разрушению клеток в суспензии, сопровождающемуся повышением в среде концентрации как белков, так и нуклеиновых кислот. Воздействие ультразвуком высокой частоты обуславливает увеличение концентрации белка, практически без изменения содержания нуклеиновых кислот, что свидетельствует о десорбции молекул S-белка с поверхности не подвергшихся разрушению клеток. Десорбция S-белков с поверхности цитоплазматических мембран достигается при частоте ультразвука 0,88 МГц, плотности энергии 0,1÷1,0 Вт/см3, температуре 20-45°С для суспензии клеток Н. salinarum с концентрацией 0,5×108 кл./мл в 4 М растворе хлористого натрия.
Таким образом, изложенные выше сведения свидетельствуют о том, что заявленное изобретение, предназначенное для использования в биотехнологии, в частности, для удаления поверхностной компоненты с поверхности клеток галобактерий, обладает заявленными выше свойствами. Для заявленного способа в том виде, как он охарактеризован в изложенной формуле изобретения, подтверждена возможность его осуществления с помощью описанных в заявке средств и методов. Следовательно, заявленное изобретение соответствует условию "промышленная применимость".
Литература
1. Складнев Д.А., Шкарин Н.Ю., Садовников В.П. Перспективы применения фоточувствительного белка бактериородопсина в наносистемах биоэлектронного и оптического назначения. Экологические системы и приборы, 2008, №10, 3-8.
2. Liu Q.P., Sulzenbacher G., Yuan Н., Bennett E.P., Pietz G., Saunders K., Spence J., Nudelman E., Levery S.B., White Т., Neveu J.M., Lane W.S., Bourne Y., Olsson M.L., Henrissat В., Clausen Н. Bacterial glycosidases for the production of universal red blood cells. Nature Biotechnol. 2007, 25, 454-64
3. Акопян В.Б., Ершов Ю.А. Основы взаимодействия ультразвука с «биологическими объектами (ультразвук в медицине, ветеринарии и экспериментальной биологии). - М., Изд-во РГТУ им. Н.Э.Баумана, 2005, 300 с.
4. «Ультразвук» Маленькая энциклопедия. Главн. редак. И.П.Голямина. Изд. «Советская энциклопедия». Москва, 1989, 399.
5. Koenig D.W., Hoffman D.R., Carney S. Use of sonication to eliminate prions. Patent. IPC8 Class: AA62D302FI, USPC Class: 4352625
Краткое описание чертежей
Фиг.1.
Показана схема строения поверхностного S-слоя клеток галобактерий Halobacterium salinarum в двух проекциях. А - внутренняя структура поверхностного S-слоя. Показаны трансмембранные молекулы бактериородопсина, объединенные в пурпурные мембраны, молекулы S-белков, закрепленные участком ножки в липидном бислое цитоплазматической мембраны клетки. Б - внешний вид верхней части S-белков.
Фиг.2.
Зависимость количества нуклеиновых кислот (а) и белка (б), высвобождаемых в процессе обработки клеток галобактерий Н. salinarum ультразвуком с частотой 35 кГц () и 0,88 МГц ().
Способ удаления S-белков с поверхности пурпурных мембран Halobacterium salinarum, отличающийся тем, что суспензию клеток галобактерий с концентрацией 0,5·108 кл./мл в 4 М растворе хлористого натрия в кювете объемом 5 см3 подвергают действию ультразвука с частотой 880 кГц и плотностью энергии в среде 0,1 Вт/см3 в течение 10 мин при температуре 20°С.