Способ получения синтез-газа
Иллюстрации
Показать всеИзобретение относится к области химии и может быть использовано для получения синтез-газа. В реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, подают исходную газовую смесь, содержащую метан и кислород. Катализатором является сложный оксид со слоистой перовскитоподобной структурой, который получают путем механического перемешивания и последующего прокаливания при температуре 1100-1200°С твердой порошкообразной смеси, состоящей из La2O3, Со2О3, SrCO3 или из Nd2O3, Со2О3, СаСО3. Изобретение позволяет упростить способ. 7 з.п. ф-лы, 2 табл.
Реферат
Изобретение относится к области химической технологии, а именно к высокотемпературным каталитическим окислительным способам превращения метана с получением синтез-газа: смеси Н2 и СО, а также к катализаторам и способу их получения для этой цели. Синтез-газ является ценным исходным сырьем для получения экологически чистых моторных топлив по Фишеру-Тропшу, метанола, диметилового эфира, альдегидов, спиртов и других ценных продуктов нефтехимии.
Известен способ окислительного превращения метана в синтез-газ парциальным окислением в присутствии катализатора, содержащего активные компоненты на основе соединений никеля и урана, нанесенные на носитель (Пат. РФ №2350386, 2009). Массовое отношение компонентов катализатора составляет: Ni 7-12%, U 1-50%, остальное - носитель. Катализатор получали методом пропитки носителя - гранулированного в форме колец оксида алюминия смесью растворов нитратов никеля и уранила. После пропитки кольца прокаливают при 750-800°С. Затем горячие кольца снова погружают в раствор активных компонентов и прокаливают. Стадии пропитки и прокаливания повторяют 4 раза. В конце прокаленный катализатор пропитывают 30% раствором гидроксида калия и прокаливают при той же температуре в течение 1 ч. Катализатор объемом 1 см3 помещают в кварцевый реактор, в который подают смесь, содержащую, об.%: метана 20, кислорода 10 и аргона 70. Скорость подачи реакционной смеси составляет 0,833 л/мин, что соответствует объемной скорости 50000 ч-1. Реактор с катализатором помещают в трубчатую печь и нагревают. Максимальная активность достигалась на катализаторе с удельной площадью поверхности 60-80 м2/г при 800°С - конверсия метана составляла 94%, выходы Н2 и СО - 93%.
Недостатками способа являются сложность, связанная с использованием многостадийной процедуры приготовления катализатора, использование в составе катализатора дорогого и экологически опасного компонента - урана, а также сильное разбавление исходной смеси аргоном, что не позволяет получать продукты реакции в чистом виде и требует сложной и дорогостоящей процедуры выделения продуктов реакции.
Известен способ получения синтез-газа парциальным окислением метана в присутствии многокомпонентного катализатора, содержащего сложнокомпонентный носитель и металл VIII группы (Пат. РФ №2333797, 2008). Носитель включает оксиды щелочноземельного металла (магния, кальция, стронция, бария); оксиды элемента из группы скандия, иттрия и лантаноидов; оксид циркония. Лучшие результаты получены на катализаторе Rh/MgO-CeO2-CaO-ZrO2. Носитель готовили прокаливанием смеси Mg(OH)2, ZrO2*8H2O, Се(ОН)4*H2O, СаСО3 при 1100-1200°С и атмосферном давлении в течение 6 часов. Затем носитель пропитывали ацетатом родия, сушили при 50°С 16 часов и снова прокаливали при 950°С в течение 3 часов. Катализатор перед реакцией восстанавливали водородом при 950°С. Газовое сырье, содержащее кислород, метан и аргон в соотношении O2:СН4:Ar 15:30:55 подавали на катализатор в реактор при начальной температуре 650°С. Конверсия метана достигала 80%, селективность по Н2 и по СО - 91,2% и 91,5%, что соответствовало выходам Н2 и СО 73,2 и 72,6% соответственно. Недостатками способа являются использование в составе катализатора дорогостоящего компонента - родия, сложность процедуры приготовления катализатора и использование аргона в качестве разбавителя исходных газов, что требует в дальнейшем дорогостоящей процедуры разделения продуктов реакции.
Наиболее близким к заявляемому по технической сущности и достигаемому эффекту является способ получения синтез-газа парциальным окислением метана кислородом в реакционной смеси с избытком метана в присутствии катализатора - сложнооксидной системы, имеющей, по данным рентгенофазового анализа, кристаллическую структуру перовскита (Пат. РФ №2144844 С1, 2000). Катализатор дополнительно содержит носитель - оксид алюминия. Массовое отношение компонентов катализатора составляет: перовскит состава АВОх от 5 до 40, носитель - Al2O3 от 60 до 95, где А - редкоземельный элемент, В - переходный элемент, который включает 3d элементы IV периода Периодической таблицы, коэффициент х определяется степенью окисления А, В и их содержанием в перовските.
Катализатор готовят в два этапа - приготовление носителя и нанесение активного компонента. Для приготовления Al2O3 в лопастном смесителе смешивают корунд и переосажденный гидроксид алюминия, взятые в соотношении 1:1, в присутствии азотной кислоты в качестве пептизатора. В качестве поверхностно-активного вещества вводят 1% глицерина. Полученную пасту формуют в виде черенков или микроблоков сотовой структуры с помощью шприца и специальной насадки. Далее носитель сушат и прокаливают при 1300°С. Полученный носитель дробят, отсеивают фракцию 0,5-0,25 мм и пропитывают растворами нитратов редкоземельных элементов (например, нитратов La, Ce, Nd) и нитратов переходных элементов (например, нитратов Со, Ni, Mn) или/и растворами - H2PtCl6 H2IrCl6, RhCl3. После пропитки катализатор сушат и прокаливают на воздухе при 900°С 2 часа. Стадии пропитки и прокаливания могут повторяться.
Процесс окисления метана кислородом до синтез-газа проводят в проточном реакторе при температуре 700-850°С, при подаче в реактор газовой смеси состава CH4:О2:N2 (или Не) = 1:2:12 или 1:2:25. Объемная скорость подачи газовой смеси от 25000 до 200000 час-1.
Наибольшая каталитическая активность была достигнута на катализаторе состава 40% LaCo0,96Ir0,04/α-Al2O3. При подаче на приготовленный катализатор газовой смеси, состоящей из метана, кислорода и гелия в соотношении СН4:O2:Не=2:1:12, с объемной скоростью 120000 л/час, при 800°С была достигнута конверсия метана 98%, селективность образования H2 и СО составляла 100%, что соответствовало выходу синтез-газа 98%. На катализаторе 20% NdCoO3/Al2O3 при подаче газовой смеси, состоящей из метана, кислорода и гелия в соотношении СН4:O2:Не=2:1:25, с объемной скоростью 120000 л/час, при 850°С была достигнута конверсия метана 85%, селективностью по H2 85%, по СО 87%, что соответствовало выходам Н2 и СО 72% и 74% соответственно.
Недостатками способа являются: сложная процедура приготовления катализатора; использование в качестве компонентов наиболее активных катализаторов дорогостоящих металлов платиновой группы; проведение процесса при сильном разбавлении метан-кислородной смеси инертными газами - азотом или гелием. Процедура разделения получаемого синтез-газа и разбавителя - инертного газа является очень трудоемким и дорогостоящим процессом, а разбавленный инертным компонентом синтез-газ не пригоден для практического использования.
Задачей изобретения является упрощение способа получения синтез-газа и сокращение затрат на его проведение за счет использования катализатора, получаемого простым одностадийным способом - термообработкой смеси твердых исходных реагентов, а также за счет проведения процесса получения синтез-газа высокотемпературным каталитическим окислительным превращением метана без добавления инертных газов, что позволяет получать синтез-газ, не требующий отделения инертного компонента.
Поставленная задача решается описываемым способом получения синтез-газа высокотемпературным каталитическим окислительным превращением метана, заключающимся в подаче в реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, исходной газовой смеси, содержащей метан и кислород, причем катализатор представляет из себя сложный оксид с слоистой перовскитоподобной структурой, при этом катализатор получают путем механического перемешивания и последующего прокаливания при температуре 1100-1200°С твердой порошкообразной смеси, состоящей из La2O3, Co2O3, SrCO3 или из Nd2O3, Co2O3, СаСО3..
В качестве катализатора предпочтительно использовать сложный оксид со слоистой перовскитоподобной структурой, относящийся к полупроводникам n-типа, обладающий преимущественно электронной проводимостью.
Используемую инертную насадку предпочтительно изготавливают из кварца.
В качестве метана предпочтительно использовать магистральный природный газ.
Целесообразно окислительное превращение метана осуществлять при температуре катализатора 755-965°С, преимущественно 880-930°С.
Желательно использовать исходную газовую смесь с объемным отношением метан: кислород 1,7-2,8:1.
Преимущественно используют скорость подачи в реактор исходной газовой смеси в интервале от 4315-24100 мл/г/ч.
Возможно использовать исходную газовую смесь, дополнительно содержащую углекислый газ при объемном отношении метан:кислород:углекислый газ 4,4-4,6:1,5-1,6:1.
Сущность изобретения заключается в следующем
Способ получения синтез-газа по изобретению относится к процессам высокотемпературного каталитического окислительного превращения метана в смесь СО и Н2. Согласно изобретению процесс осуществляют в вертикальном обогреваемом кварцевом реакторе проточного типа с аксиально расположенным карманом для термопары. В средней части реактора на подложку из кварцевого волокна помещают катализатор, а сверху катализатора - второй слой кварцевого волокна. На карман для термопары надевают кварцевые кольца, заполняющие свободный объем реактора до и после слоя кварцевого волокна и катализатора. Кварцевые волокна и кольца выполняют роль инертной насадки. Процесс может быть проведен в проточном кварцевом U-образном реакторе внутренним диаметром 5 мм, причем катализатор размещают в нижней части реактора, объем реактора до и после катализатора заполняют кварцевой крошкой. Исходное сырье представляет собой смесь метана и молекулярного кислорода в соотношении 1,7-2,8:1, причем возможно использование в качестве исходного сырья смеси магистрального природного газа и технического кислорода, а также добавление в исходную газовую смесь углекислого газа. При этом углекислый газ не является инертным разбавителем, а участвует в превращении метана в синтез-газ.
Исходную сырьевую газовую смесь подают в реактор, в котором она достигает катализатора, и осуществляют нагрев катализатора до температур 755-965°С, которые и поддерживают в течение протекания всего процесса окислительного превращения метана. Подачу сырья в реактор осуществляют со скоростью 4315-24100 мл/г катализатора в час (далее - мл/г/час).
Способ получения катализатора по изобретению характеризуется простотой технологией и доступностью исходных компонентов. В качестве исходного сырья используют смесь следующих элементов: редкоземельных металлов - La или Nd в виде оксидов La2O3 и Nd2O3, щелочноземельных элементов Sr и Са в виде карбонатов SrCO3 и СаСО3, кобальта в виде оксида Co3O4.
Исходные компоненты в стехиметрических количествах, соответствующих формулам LaSrCoO4, NdCaCoO4 или Nd1,25Ca0,75CoO4 перетирают в фарфоровой ступке или планетарной мельнице и образовавшуюся порошкообразную смесь прокаливают при 1100°С, затем снова перетирают и прокаливают при 1200°С.
Образовавшиеся материалы темно-серого или черного цвета охарактеризованы методом рентгенофазового анализа. Показано, что синтезированные материалы являются однофазными и имеют ромбоэдрически искаженную перовскитоподобную структуру. Линий, соответствующих исходным веществам или другим фазам, не обнаруживают. Полученные материалы отличаются друг от друга электрической проводимостью. Кобальтат лантана-стронция LaSrCoO4 относится к полупроводникам с проводимостью р-типа (A.N.Petrov, O.F.Konochuk, A.V.Andreev, V.A.Chrepanov, P.Kofstad "Crystal structure, electrical and magnetic properties of La1-xSrxCoO3-y" // Solid State lonics, 80 (1995), с.189-199), т.е. его электропроводность описывается как миграция электронодефицитных носителей положительного заряда - дырок (р) по кристаллической решетке. В то же время кобальтаты неодима-кальция - NdCaCoO4 или Nd1,25Ca0,75CoO4 относятся к полупроводникам с проводимостью n-типа (Н.Taguchi, H.Kido, K.Tabata "Relationship between crystal structure and electrical property of K2NiF4-type (Ca1-xNd1+x)CoO4-δ" // Physica B, 344 (2004), с.271-277). Его электропроводность описывается как миграция по кристаллической решетке избыточных электронов.
Полученные материалы используют как катализатор либо в виде порошка, либо в виде таблеток при проведении процесса в реакторе большего объема.
Приведенные ниже примеры иллюстрируют изобретение, но не ограничивают его.
Пример 1. Приготовление катализаторов
Для приготовления катализатора LaSrCoO4 (в таблице приведен под номером 1) в качестве исходных компонентов берут следующие соединения: La2O3, SrCO3, CoO4 в стехиометрических количествах, соответствующих формуле LaSrCoO4.
Смесь исходных веществ перемалывают в планетарной мельнице в течение 30 минут. Полученный порошок помещают в тигель и отжигают в муфельной печи при 1100°С в течение 24 часов, еще раз измельчают в планетарной мельнице, прессуют на лабораторном прессе в таблетки диаметром 12 мм и толщиной 3 мм под давлением 3 т/см2. Таблетки отжигают при 1200°С в течение 10 часов и охлаждают до комнатной температуры со скоростью 0,5°/мин. Образовавшийся оксид используют в качестве катализатора окислительного превращения метана. Формула катализатора подтверждена данными иодометрического титрования.
Пример 2. Условия и процедура приготовления катализатора (в таблице приведен под номером 2) аналогичны примеру 1 за исключением использования в исходном сырье иных соединений редкоземельных и щелочноземельных элементов, а именно - Nd2O3 и СаСО3 в стехиометрических количествах, соответствующих формуле NdCaCoO4.
Пример 3. Условия и процедура приготовления катализатора (в таблице приведен под номером 3) аналогичны примеру 2 за исключением использования в исходном сырье иных соотношений Nd2O3 и СаСО3, соответствующих формуле катализатора Nd1,25Ca0,75CoO4.
Примеры 4-23. Окислительное превращение метана в синтез-газ.
В вертикальный обогреваемый кварцевый реактор проточного типа с аксиально расположенным карманом для термопары на подложку из кварцевого волокна помещают 0,1 г катализатора (по примерам 1, 2 и 3) и помещают сверху второй слой кварцевого волокна. На карман для термопары надевают кварцевые кольца, заполняющие свободный объем реактора до и после слоя кварцевого волокна и катализатора. Метан и кислород через расходомеры подают в верхнюю часть реактора, где они образуют гомогенную смесь. Поток гомогенной метанкислородной смеси в реакторе достигает слоя катализатора, и катализатор в токе этой смеси нагревают до необходимой температуры.
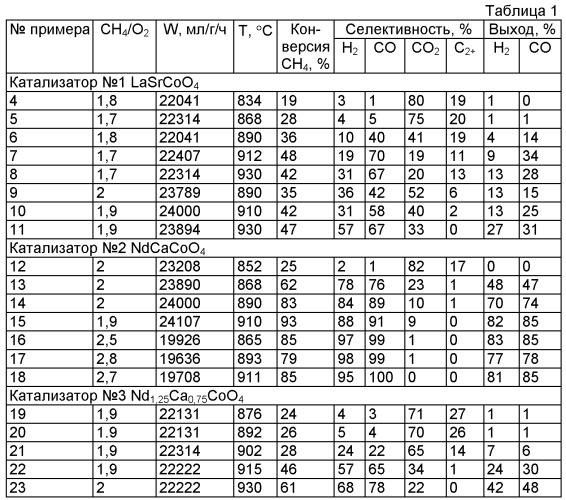
Газовую смесь, образовавшуюся в результате реакции на катализаторе, охлаждают в конденсаторе для отделения воды, и часть смеси направляют в газовый хроматограф для определения состава продуктов реакции. Результаты экспериментов по получению синтез-газа по примерам 4-23 приведены в таблице 1.
Примеры 24-26. Процесс окислительного превращения метана на катализаторе №2 проводят аналогично примерам 4-23, за исключением того, что в реактор подают смесь метана с кислородом, дополнительно содержащую углекислый газ, а процесс проводят в проточном кварцевом U-образном реакторе внутренним диаметром 5 мм, катализатор в количестве 0,53 г размещают в нижней части реактора, объем реактора до и после катализатора заполняют кварцевой крошкой. Результаты экспериментов по получению синтез-газа по примерам 24-26 приведены в таблице 1.
Анализ реакционной газовой смеси, выходящей из реактора, показал, что помимо целевых продуктов - смеси Н2 и СО, она может включать в свой состав непрореагировавшие метан и кислород, а также воду, диоксид углерода, С2-С3 углеводороды (этилен, этан, пропилен, пропан). При этом воду отделяют от газов в конденсаторе, а остальные компоненты определяют газохроматографическим методом.
Результаты проведения процесса получения синтез-газа на разных катализаторах при варьировании значений температуры в слое катализатора, мольного отношения метан:кислород, скорости подачи метан-кислородной смеси {W) приведены в таблице 1. Данные по проведению способа получения синтез-газа при добавлении углекислого газа представлены в таблице 2. В таблицах 1 и 2 в качестве показателей эффективности способа приведены данные по конверсии (степени превращения) метана, селективности образования продуктов реакции (в расчете на превращенный метан), выходу целевых продуктов и производительности катализатора.
Конверсию метана расчитывают умножением количества превращенного метана в молях на 100% и делением на количество поданного метана в молях. Выход целевых продуктов и селективность их образования определяют исходя из того, что согласно химической формуле метана СН4 один моль метана теоретически может быть превращен не более чем в один моль монооксида углерода СО и не более чем в два моля водорода Н2 при отсутствии других продуктов. Поэтому выход монооксида углерода рассчитывают путем умножения количества образовавшегося СО в молях на 100%, и деления на количество поданного метана в молях. Выход водорода рассчитывают путем умножения количества образовавшегося Н2 в молях на 100%, и деления на удвоенное количество поданного метана в молях. Селективность по СО (или CO2) рассчитывают путем умножения количества образовавшегося СО (или СО2) в молях на 100% и деления на количество превращенного метана в молях. Селективность по Н2 рассчитывают путем умножения количества образовавшегося Н2 в молях на 100% и деления на удвоенное количество превращенного метана в молях.
Согласно экспериментальным данным, приведенным в таблице 1, способ по изобретению обеспечивает конверсию метана до 93%, селективность образования Н2 до 98%, СО до 100%, выход Н2 до 83%, СО до 85%. Данный способ обеспечивает высокие выходы синтез-газа состава 2Н2: 1СО, оптимального для получения продуктов нефтехимии, без разбавления исходной метан-кислородной смеси инертными газами и без использования катализаторов, содержащих дорогостоящие или экологически вредные компоненты и получаемых сложными многостадийными способами.
Наиболее эффективным является катализатор состава NdCaCoO3,96, относящийся к полупроводникам n-типа и имеющий слоистую перовскитоподобную структуру. Катализатор состава Nd1,25Ca0,75CoO4,04, содержащий избыточный кислород в кристаллической решетке, является менее эффективным, еще менее эффективен катализатор LaSrCoO4, имеющий такую же структуру, но относящийся к полупроводникам р-типа.
Увеличение значений температуры в слое катализатора с 755 до 860-964°С способствует росту конверсии метана, селективности по водороду и выходу синтез-газа. Проведение процесса предпочтительно осуществлять при температуре в слое катализатора не ниже 890°С.
Катализатор №2 NdCaCoO3,96 проявляет также активность в получении синтез-газа из метан-кислородной смеси, дополнительно содержащей диоксид углерода (углекислый газ). Добавление углекислого газа позволяет получать газовую смесь, менее опасную с точки зрения пожароопасности. Из таблицы 2 видно, что при добавлении углекислого газа конверсия метана достигает 81%, при этом углекислый газ также превращается в синтез-газ, конверсия CO2 достигает 61%. Селективность образования СО и Н2 достигает соответственно 100 и 88%, а выходы СО и H2 - соответственно 81 и 72%.
1. Способ получения синтез-газа высокотемпературным каталитическим окислительным превращением метана, заключающийся в подаче в реактор, в который помещен катализатор, а свободный объем которого заполнен инертной насадкой, исходной газовой смеси, содержащей метан и кислород, причем катализатор представляет из себя сложный оксид со слоистой перовскитоподобной структурой, при этом катализатор получают путем механического перемешивания и последующего прокаливания при температуре 1100-1200°С твердой порошкообразной смеси, состоящей из La2O3, Co2O3, SrCO3 или из Nd2O3, Со2О3, СаСО3.
2. Способ по п.1, отличающийся тем, что в качестве катализатора используют сложный оксид со слоистой перовскитоподобной структурой, относящийся к полупроводникам n-типа, обладающий преимущественно электронной проводимостью.
3. Способ по п.1, отличающийся тем, что инертную насадку изготавливают из кварца.
4. Способ по п.1, отличающийся тем, что в качестве метана используют магистральный природный газ.
5. Способ по п.1, отличающийся тем, что окислительное превращение метана осуществляют при температуре катализатора 755-965°С, преимущественно 880-930°С.
6. Способ по п.1, отличающийся тем, что используют исходную газовую смесь с объемным отношением метан:кислород 1,7-2,8:1.
7. Способ по п.1, отличающийся тем, что преимущественно используют скорость подачи в реактор исходной газовой смеси в интервале от 4315-24100 мл/г/ч.
8. Способ по п.1, отличающийся тем, что используют исходную газовую смесь, дополнительно содержащую углекислый газ при объемном отношении метан:кислород:углекислый газ 4,4-4,6:1,5-1,6:1.