Применение замещенных 1-(2-феноксиэтил)-1,2,4-триазолов в качестве нематоцидных средств и нематоцидная композиция на их основе
Иллюстрации
Показать всеИзобретение относится к применению замещенных 1-(2-феноксиэтил)-1,2,4-триазолов общей формулы I
где R=H, Hal, Alk, AlkO, перфторалкил, нитро и n - целое число от 0 до 5, в качестве нематоцидов и нематоцидной композиции на основе указанных выше соединений.
Соединения обладают высокой активностью и в составе нематоцидной композиции могут быть использованы в качестве сельскохозяйственных, медицинских или ветеринарных нематоцидов. 2 н.п. ф-лы, 2 табл.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к замещенным 1-(2-феноксиэтил)-1,2,4-триазолам общей формулы I
где R, одинаковые или разные, означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, цианогруппу, n означает целое число от 0 до 5,
применению этих соединений в качестве нематоцидных средств и нематоцидным композициям на их основе.
Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, медицинских или ветеринарных нематоцидов в композициях с другими активными и вспомогательными соединениями для борьбы нематодами - вредителями сельскохозяйственных культур, животных или человека.
Некоторые соединения общей формулы I включены, например, в каталоги новых соединений: «ChemDiv., Inc. Product Library», опубликованном 25.04.2003, «Pharma library Collection», опубл. 15.05.2005, и «ChemBridge Corporation», опубл. 18.06.2004, однако ни способ получения, ни свойства указанных соединений не описаны, нет и данных по биологической активности этих классов соединений.
Известны многие продукты с азольными циклами, в частности N-алкил-N-(феноксиэтил)карбамоилазолы с фунгицидной активностью общей формулы II, где Z означает СН или N [патент Великобритании №1469772, МКИ2 C07D 233/56, опубл. 06.04.1977].
Известны азолилалкоксиметиланилиды с гербицидной активностью общей формулы III, где R1 и R2 означают алкильную группу с числом атомов углерода от 1 до 4, Z означает метиленовую или этиленовую группу, незамещенную или замещенную одной или двумя метильными группами, А означает пиразолильные, триазольные или имидазольные фрагменты, незамещенные или содержащие такие заместители в кольце, как галоген, метильная группа или метоксигруппа [патент США №4336061, МКИ3 A01N 43/50, опубл. 22.06.1982], которые обладают гербицидной активностью.
Известны феноксиалкилимидазолы общей формулы IV, где R означает водород или алкильную группу с числом n от 1 до 9 и m от 0 до 8, Z означает атомы О, S или NH-группу [патент США №4632934, МКИ4 C07D 233/54, опубл. 13.12.1986], которые ингибируют тромбоксансинтазу и за счет этого находят применение как антигипертензивные, противовоспалительные, противотромботические средства. [Cross Р.Е., Dickinson R.P., Parry M.J., Randall M.J. Selective tromboxane synthetase Inhibitors. I. l-[(Aryloxy)alkyl]-1H-imidazoles. // J. Med. Chem. - 1985. - Vol.28. - P. 1427-32.]
Наиболее близкими к заявленным замещенным 1-(2-феноксиэтил)-1,2,4-триазолам по структуре и по способу получения являются имидазолсодержащие фунгициды общей формулы V, где R1 и R2 означают фенильную, фенилалкильную, фенилалкенильную группу с такими заместителями в фенильном кольце, как алкильная группа с числом атомов углерода от 1 до 4, галоген, трифторметильная группа, или R1 и R2 означают алкильную, циклогексильную, циклогексилалкильную группу, Х означает атомы кислорода или серы, n означает целое число от 1 до 8 при условии, что n не равен 1, когда R1 означает фенильную группу [патент США №4045568, МКИ2 А61К 31/415, опубл. 30.08.1977], которые обладают антимикотической, антибактериальной и антипротозойной активностью. Соединения общей формулы V получают реакцией хлоралкилимидазолов с фенолами или тиофенолами в ацетоне при нагревании с последующим выделением методом колоночной хроматографии.
Наиболее близким по биологической активности к заявленным замещенным 1-(2-феноксиэтил)-1,2,4-триазолам является 3-окси-2-нафтоат (2-фенокси)этилдиметил-бензиламмония (VI) (препарат нафтамон), применяемый в качестве антигельминтного средства с противонематодным действием [патент США №2918401, A41D 27/02, опубл. 22.12.1959; М.В. Рубцов, А.Г. Байчиков. Синтетические химико-фармацевтические препараты. - М.: Медицина, 1971. С.86].
Техническая задача, решаемая данным изобретением, состоит в увеличении эффективности средств борьбы с вредоносными нематодами и расширении ассортимента нематоцидных препаратов. Поставленная задача решается применением соединений общей формулы I в качестве нематоцидных средств и нематоцидных композиций на их основе.
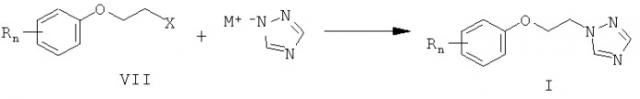
Согласно настоящему изобретению замещенные 1-(2-феноксиэтил)-1,2,4-триазолы формулы I получают взаимодействием замещенных 2-галогенэтоксибензолов (VII) с 1,2,4-триазолатом щелочного металла или с 1,2,4-триазолом в среде полярного апротонного растворителя, например ацетонитрила, ацетона, метилэтилкетона, тетрагидрофурана, диметилформамида, диметилсульфоксида, N-метилпирролидона, или в алифатических или циклоалифатических спиртах при температуре от 60 до 180°С.
В приведенной схеме R и n имеют те же значения, что и в формуле I, X означает хлор, бром, мезильную или тозильную группу, а М означает щелочной метал, например, натрий, калий и т.п.
Замещенные 2-галогенэтоксибензолы (VII) и 2-феноксиэтилсульфонаты получают взаимодействием фенолов (VIII) с 1,2-дигалогенэтанами или соответственно с дитозиловым эфиром этиленгликоля в присутствии оснований, например водного раствора гидроксида натрия или карбоната калия при нагревании [Hey P., Willey G.L. Choline 2,6-xylyl ether bromide; an active quaternary local anaestetic. // Brit. J. Pharmacol. Chemather. - 1954. - Vol.9, N 4. - P.471-5.]. Взаимодействие также проводят в спирте с предварительно полученным фенолятом натрия [Genzer J.D., Huttrer С.Р., van Wesem G.C. Phenoxy- and Benzyloxyalkyi Thiocyanates. // J. Am. Chem. Soc. - 1951. - Vol.73, N 7. - P. 3159-62].
В приведенной схеме R и n имеют те же значения, что и в формуле I, X означает хлор, бром, мезил или тозил; В означает основание.
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества могут включать в свой состав наполнители, растворители, поверхностно-активные вещества, умягчители воды, синергические добавки и др. Известен препарат гетерофос, который применяют в виде 7.5%-ных гранул для защиты картофеля от нематоды и сахарной свеклы от корневой тли. [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н.Мельников, К.В.Новожилов, С.Р.Белан. - М.: Химия, 1995, с.24, с.347]
В связи с этим техническим результатом изобретения также является разработка нематоцидных композиций, состоящих из замещенных 1-(2-феноксиэтил)-1,2,4-триазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными для сельскохозяйственных культур, человека или животных нематодами.
Способ получения замещенных 1-(2-феноксиэтил)-1,2,4-триазолов общей формулы I, их применение в качестве нематоцидов, а также в качестве составной части нематоцидных композиций можно проиллюстрировать следующими примерами.
Пример 1. (2-Бромэтокси)бензол.
К смеси 18.8 г (0.2 моля) фенола 1а, 75,2 г (0.4 моля) 1,2-дибромэтана и 48 мл воды, нагретой до кипения на масляной бане, добавляют по каплям в течение 0.5 ч 31 мл 23%-ного водного раствора NaOH и кипятят при перемешивании 3 ч. После охлаждения отделяют органический слой, экстрагируют водный слой хлороформом (2х30 мл), объединяют органические слои, промывают 5%-ным раствором NaOH, водой, сушат над MgSO4, растворитель удаляют в вакууме. Остаток перегоняют в вакууме, собирая фракцию с т.кип.128-131°С (18 торр), получают 15.7 г (39%) (2-бромэтокси)бензола с т.пл. 33-34°С. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 3.66 (т, 2 Н, CH2Br, J=6.3), 4.32 (т, 2 Н, СН2O, J=6.3), 6.96 (т, 3 Н, 3СН аром., J=7.7), 7.31 (д, 2 Н, 2СН аром., J=8.6). ИК-спектр, ν, см-1: 1265(Саr-O), 1095, 1040, 1020 (Сalk-O).
Последующие, нижеупомянутые в примерах 2 и 3 соединения получают аналогично способу, приведенному в примере 1.
Пример 2. 1-(2-Бромэтокси)-3,4-дихлорбензол, выход 59.1%, т.кип.160-161°С (8 торр), nD 18=1.5823. Найдено (%): Вr 29.78. C8H7BrCl2O. Вычислено (%): Вr 29.60. ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 3.76 (т, 2 Н, CH2 Вr, J=6.6), 4.38 (т, 2 Н, СH2О, J=6.6), 6.94 (дд, 1 Н, 1СН аром., J=9.8, 3.2), 7.14 (д, 1 Н, 1СН аром., J=3.2) 7.41 (д, 1 Н, 1СН аром., J=9.8). ИК-спектр, ν, см-1: 1290, 1260, 1225 (Car-O), 1075, 1015 (Calk-O).
Пример 3. 1-(2-Бромэтокси)-3-трифторметилбензол, выход 46.7%, т.кип. 116-122°С (14 торр), nD 23=1.4864. Найдено (%): Вr 29.91. C9H8BrF3O. Вычислено (%): Вr 29.70. Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 3.67 (т, 2 Н, CH2Br, J=6.1), 4.35 (т, 2 Н, СН2O, J=6.1), 7.03-7.19 (м, 2 Н, 2СН аром.), 7.26 (д, 1 Н, 1 СН аром., J=7.5), 7.43 (т, 1 Н, 1СН аром., J=7.7). ИК-спектр, ν,см-1: 1334, 1166, 1126 (C-F), 1280, 1226 (Car-O), 1096, 1066, 1020 (Calk-O).
Пример 4. 1-(2-Феноксиэтил)-1,2,4-триазол (1).
К раствору этилата натрия, полученному из 0.47 г (20.4 ммоль) натрия и 20 мл этанола, прибавляют 1.52 г (22 ммоль) 1,2,4-триазола и упаривают досуха на роторно-пленочном испарителе в вакууме водоструйного насоса. К полученному триазолату натрия прибавляют 20 мл ацетонитрила и при перемешивании добавляют по каплям раствор 4.02 г (20 ммоль) 2-бромэтоксибензола в 15 мл ацетонитрила и кипятят при перемешивании 6 ч, охлаждают, отфильтровывают осадок NaBr, фильтрат упаривают. Остаток растворяют в хлористом метилене (30 мл), промывают водой, рассолом и сушат над MgSO4. Удаляют растворитель и оставшееся масло кристаллизуют из смеси изооктан -этилацетат (4:1), получают 2.46 г (65%) (2-феноксиэтил)-1,2,4-триазола 1 с т.пл. 77-78°С. Найдено (%):С 63.52; Н 5.90; N 22.35. C10H11N3O. Вычислено (%): С 63.48; Н 5.86; N 22.21.
Пример 5. 1-[2-(4-Нитрофенокси)этил]-1,2,4-триазол (19).
К раствору этилата натрия, полученному из 0.46 г (20 ммоль) натрия и 20 мл этанола, прибавляют 1.52 г (22 ммоль) 1,2,4-триазола и упаривают досуха на роторно-пленочном испарителе в вакууме водоструйного насоса. К полученному триазолату натрия прибавляют 20 мл тетрагидрофурана и при перемешивании присыпают порциями 4.92 г (20 ммоль) 2-бромэтокси-4-нитробензола и кипятят при перемешивании 3 ч, охлаждают, отфильтровывают осадок NaBr, фильтрат упаривают. Остаток растворяют в абсолютном этаноле, отфильтровывают от осадка, упаривают и перекристаллизовывают из смеси смеси гексан - этилацетат (4:1), получают 4.17 г (89%) 1-[2-(4-нитрофенокси)этил]-1,2,4-триазола (19) с т.пл. 112-113°С.
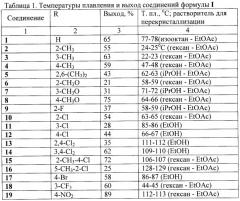
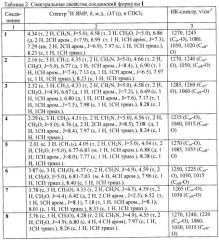
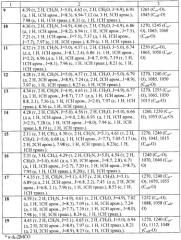
Данные о температурах плавления полученных продуктов и выходе приведены в таблице 1, спектральные характеристики - в таблице 2. 1Н ЯМР-спектры записаны на приборе «Bruker AC-200» (рабочая частота 200 МГц), в качестве растворителя использовали CDCl3. ИК-спектры твердых соединений регистрировали в вазелиновом масле, жидких и низкоплавких - в пленке на приборе «Specord M80».
Пример 6. Композиция концентрата эмульсии.
Действующее вещество (замещенный 1-(2-феноксиэтил)
-1,2,4-триазол общей формулы I) 80 г
Алкилбензолсульфокислоты кальциевая соль (АБСК) 20 г
Оксиэтилированный октилфенол (ОП-7) 80 г
Циклогексанон 300 г
Ксилол 150 г
Нефтяной сольвент 370 г.
Пример 7. Исследования на нематоцидную активность проводили в экспериментах in vitro. Тест-объектами служили взрослые особи нематод Cephalobus nanus de Man (фитогельминт ризосферы хлопчатника), Aphelenchus akenae Bast (гнилостная нематода пшеницы), Aphelenchoudes besseyi Kristy (рисовая нематода). Для сравнения использовали промышленный нематоцид - гетерофос (S-пропил-О-фенил-О-этилтиофосфат). Нематод помещали в 0.1, 0.01 или 0.001% водную эмульсию изучаемых веществ. Через сутки проводили учет гибели нематод в сравнении с контрольными (помещенными в воду) нематодами. Приведены данные испытаний на биологическую активность соединений 9, 11, 13 и 14, однако все полученные соединения формулы I проявляют нематоцидную активность.
| Соединение | % гибели нематод в 0.1%-ном растворе |
| 9 | 100 |
| 11 | 100 |
| 13 | 100 |
| 14 | 70 |
| Эталон | 100* |
| * в концентрации 0.001% |
Применение соединений общей формулы I в композициях с другими активными и вспомогательными соединениями для борьбы с нематодами - вредителями сельскохозяйственных культур - позволяет расширить сравнительно узкий ассортимент нематоцидных препаратов. Можно ожидать, что по отношению к замещенным 1-(2-феноксиэтил)-1,2,4-триазолам, как к веществам с большей гидролитической устойчивостью, в отличие от фосфорорганических препаратов будут медленнее возникать резистентные расы вредителей.
1. Применение замещенных 1-(2-феноксиэтил)-1,2,4-триазолов общей формулы I, где R одинаковые или разные и означают атом водорода, галогена, алкильную группу с числом атомов углерода от 1 до 4, алкоксигруппу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, нитрогруппу, n означает целое число от 0 до 5, в качестве нематоцидных средств.
2. Нематоцидная композиция, содержащая активное соединение в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве активного соединения используют замещенные 1-(2-феноксиэтил)-1,2,4-триазолы I по п.1.