Способ моделирования пароксизмального расстройства
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к способам моделирования судорожных состояний, и может быть использовано, как для исследования механизмов развития пароксизмальных состояний с прогредиентным течением (эпилепсия), так и для скрининга (отбора) новых препаратов, обладающих потенциальной противоэпилептической активностью. Для этого крысам проводят дробные инъекции конвульсанта 1,5-пентаметилентетразола (пентилентетразола) с интервалом в 15 минут из расчета 10 мг/кг в объеме 0,1 мл раствора на 100 г массы тела до развития первого генерализованного судорожного припадка. После этого подсчитывают пороговую дозу конвульсанта, отражающую базовый уровень возбудимости ЦНС для каждого животного. При проведении повторных сеансов учитывают динамику изменения исходной дозы пентилентетразола, при этом интервал между сеансами титрования пентилентетразола может составлять от 24 и более 168 часов. Способ обеспечивает высокую точность оценки изменения порога развития судорог за счет того, что выраженность моделируемого прогредиентного состояния может быть измерена на любом этапе постановки хронического исследования без применения специальных методов обследования, например ЭЭГ-мониторинга. 1 табл, 2 ил.
Реферат
Изобретение относится к медицине, а именно к способам моделирования судорожных состояний, и может быть использовано, как для исследования механизмов развития пароксизмальных состояний с прогредиентным течением (эпилепсия), так и для скрининга (отбора) новых препаратов, обладающих потенциальной противоэпилептической активностью.
Разработка современных противоэпилептических препаратов на доклиническом этапе требует изучения их специфической активности на адекватных моделях эпилептической болезни. Несмотря на значительные успехи эпилептологии, поиск моделей этого заболевания остается по-прежнему актуальным. Например, классические модели для отбора противосудорожных препаратов далеко не всегда могут выявлять терапевтическую активность у новых противоэпилептических средств.
Наиболее перспективной может быть модель эпилепсии, учитывающая по возможности, с одной стороны, спонтанность формирования эпилептических припадков, а с другой, прогредиентный характер течения патологии. Подобная сочетаемость патологических признаков трудно совместима с точностью измерения тяжести патологических признаков.
В настоящее время, предпочтение отдается моделям заболевания, в основе которых лежат генетические нарушения, приводящие к изменениям функционирования нейрохимических и нейрофизиологических параметров активности отдельных нейронов и регионов мозга (формирование эпилептогенного очага). К подобным моделям можно отнести светочувствительные и аудиогенные судороги у животных. Электрофизиологические корреляты таких судорог формируются в соответствующих специфических областях коры мозга и в случае длительного/мощного воздействия патологического фактора эпилептиформные разряды генерализуются, приводя к развитию поведенческого судорожного припадка.
В данных моделях присутствуют оба патологических фактора, но выраженность прогредиентности оказывается трудно предсказуемой, поскольку в механизмах формирования таких патологических изменений важное значение имеет чувствительность периферических рецепторов к восприятию аудио и фотораздражения, а также механизмы проведения патологических разрядов в ЦНС. В связи с этим пороговые величины стимула для формирования судорог могут у отдельных животных значительно различаться.
Другие модели эпилепсии имеющие большее прогностическое значение для изучения патогенеза и отбора новых препаратов, относятся к классу моделей «разжигания/раскачки» (kindling) [Шандра А.А., Годлевский Л.С., Брусенцов А.И. Киндлинг и эпилептическая активность.- Одесса: Акстро Принт, 1999. - 274 с.]. Основу формирования пароксизмальных состояний при этом определяет физический или химический фактор, дозируемый в режиме подпороговой стимуляции. Продолжительное предъявление таких стимулов приводит к тому, что с течением времени чувствительность к повреждающим факторам возрастает и понижаются пороги возникновения судорог.В конце концов, по прошествии некоторого периода времени судорожные приступы начинают развиваться сами по себе уже при отсутствии повреждающего фактора. Хотя эта модель эпилептической болезни также несет вышеперечисленные недостатки, но имеет преимущество в том, что вариативность судорожных проявлений может быть значительно менее выражена, чем в вышеописанных моделях, поскольку патологическая стимуляция четко дозируется (сила электрического тока, доза антиконвульсанта).
Идеальны могут быть генетические модели, где в основе инициации судорог лежат механизмы нарушения нейрохимических процессов в ЦНС, спровоцированные поломками генетического аппарата. Однако регистрация пароксизмальной активности в таких моделях достаточно сложна и требует определенных ухищрений (ЭЭГ-мониторинг), поскольку вероятность появления припадков в течение регистрируемого периода непредсказуема.
Другие модели эпилепсии максимальный электрошок, химические генерализованные судороги, локальные очаговые химические судороги в настоящее время имеют меньшее прогностическое значение для оценки противоэпилептической активности препаратов, поскольку трудоемки и/или требуют наличия специального оборудования.
Наиболее близким по технической сущности и достигаемому результату является способ моделирования пароксизмального расстройства путем проведения дробных инъекций пентилентетразола 1,5-пентаметилентетразола-коразола) [Шандра А.А., Годлевский Л.С., Гнатковский В.В. Системные механизмы фармакологической резистентности судорожной активности // Архив клин. и экспер. медицины. - 2002. - Т.11, №1. - С.108-114.].
Недостатками известного способа является его недостаточная точность, обусловленная тем, что выраженность моделируемого пароксизмального расстройства не может быть точно измерена на любом этапе постановки хронического исследования без применения специальных методов обследования (ЭЭГ мониторинга).
Технический результат, на достижение которого направлено настоящее изобретение, заключается в повышении точности способа моделирования пароксизмального судорожного расстройства, за счет того, что выраженность моделируемого прогредиентного состояния может быть точно измерена на любом этапе постановки хронического исследования без применения специальных методов обследования (ЭЭГ мониторинга).
Указанный технический результат достигается тем, что в способе моделирования пароксизмального судорожного расстройства путем проведения дробных инъекций пентилентетразола, согласно изобретению, крысам с интервалом в 15 мин проводят подкожные инъекции пентилентетразола из расчета 10 мг/кг в объеме 0,1 мл раствора на 100 г массы тела до развития генерализованного судорожного припадка, после чего подсчитывают пороговую дозу конвульсанта, отражающую базовый уровень возбудимости ЦНС для каждого животного, при проведении повторных сеансов учитывают динамику изменения исходной дозы пентилентетразола, при этом интервал между сеансами титрования пентилентетразола может составлять от 24 и более 168 часов, а первый сеанс титрования проводят до введения препарата.
В предложенном способе моделирования прогредиентного пароксизмального судорожного расстройства учитывают дозу пентилентетразола, необходимую для формирования первого/одного генерализованного судорожного припадка. О динамике прогредиентности при хроническом расстройстве судят по изменению дозы пентилентетразола относительно данных ее исходного измерения. Раствор пентилентетразола вводят крысам подкожно так, чтобы доза вводимого на инъекцию конвульсанта составляла 10 мг/кг в объеме 0,1 мл на 100 грамм массы тела животного. Инъекции повторяют через 15-минутный интервал в ходе одного экспериментального дня (сеанса) до появления генерализованных судорог, что является критерием к прекращению дальнейших введений конвульсанта в этот день. В дальнейшем, указанный режим проведения опыта диктуется целью исследования, в зависимости от которой, либо сеанс повторяется на следующий день, либо через день, либо через несколько дней (недель), что позволяет достигать разной скорости прогредиентности. Каждый опытный день заканчивается подсчетом общей (суммарной) дозы конвульсанта, необходимой для развития однократных генерализованных судорог у каждого животного. Величина судорожной дозы пентилентетразола, зарегистрированная в первый день, является контрольной для каждого животного (случай-контроль) при проведении хронического эксперимента, что позволяет индивидуализировать оценку измерения пароксизмальной активности в каждом конкретном случае (для каждого животного).
Способ осуществляют следующим образом:
В наших исследованиях было использовано 70 белых беспородных крыс-самцов, массой 200-300 г, которые в соответствии с задачами были поделены на группы, в соответствии с разной стратегией постановки эксперимента (схемы - А, Б, В).
Условия введения пентилентетразола (коразола) были стандартизованы во всех экспериментальных схемах. Пентилентетразол вводили подкожно в объеме 0,1 мл на 100 г массы тела, в дозе 10 мг/кг массы крысы, повторно, с интервалом в 15 мин до появления генерализованных судорог. Каждую серию опыта заканчивали, высчитывая для каждого животного минимальную дозу пентилентетразола, вызывающую развитие судорог, в дальнейшем, определяли среднюю конвульсиогенную дозу препарата в каждой подопытной группе крыс.
Схема А (случай-контроль)
Всех испытуемых животных поделили на группы:
1.) сеансы "титрования 1,5-пентаметилентетразола" (до развития судорог) проводили каждые сутки в течение 6 дней с интервалом между отдельными опытами 24 часа;
2.) то же, но интервал между отдельными опытами составлял 72 часа;
3.) то же, что и в п.1, но "титрование 1,5-пентаметилентетразола" проводили 1 раз в неделю в течение месяца (интервал 168 часов).
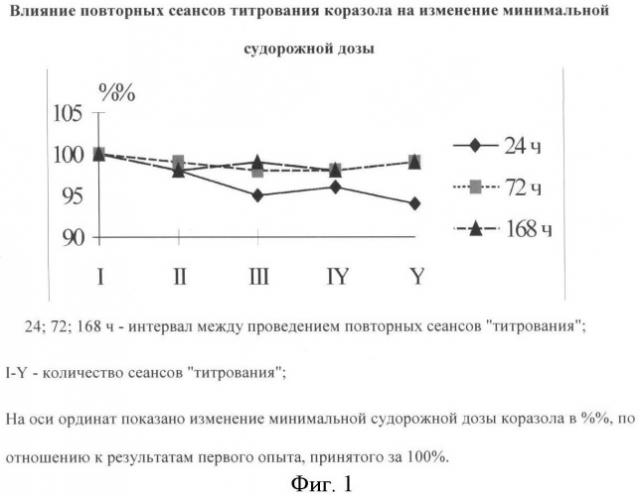
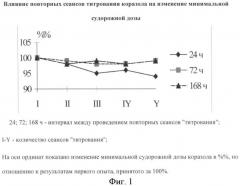
Результаты определения порога развития судорог в указанных группах крыс отражены на фиг.1.
Представленные данные свидетельствуют о том, что выраженное снижение дозы 1,5-пентаметилентетразола, приводящее к развитию судорог, наблюдали только в первой группе крыс. По-видимому, повторные серии "титрований", повторяющиеся с интервалом в 24 часа, формируют состояние, аналогичное химической раскачке (kindling) [Шандра А.А., Годлевский Л.С., Брусенцов А.И. Киндлинг и эпилептическая активность. - Одесса: Акстро Принт, 1999. - 274 с.]. Необходимо так же подчеркнуть, что в данной постановке опыта мы с течением времени также регистрировали трансформацию поведенческого ответа животных в ответ на введение повторных доз конвульсанта. Так, с третьего дня инъекций 1,5-пентаметилентетразола, животные начинали реагировать уже на дозу 20-30 мг/кг, хотя судорожная доза пентилентетразола в это время даже увеличилась, по сравнению с результатами первого введения. Поведенчески сенситивность проявлялась подергиваниями отдельных частей тела, генерализованными вздрагиваниями крыс, иногда отмечали элементы стереотипного поведения (животные в это время не реагировали на внешние звуковые сигналы). Описанные поведенческие феномены отсутствовали в первые два дня дробного введения конвульсанта. К концу эксперимента у всех подопытных животных первой группы доза 1,5-пентаметилентетразола, вызывающая развитие генерализованных клонико-тонических судорог, снизилась на 10 мг. Подобной зависимости мы не наблюдали в группах 2 и 3, в которых "титрование" проводили через 72 и 168 часов соответственно.
Схема Б (сравнительное исследование с низкой прогредиентностью для выявления просудорожных воздействий):
1.) сеансы "титрования 1,5-пентаметилентетразола" (до развития судорог) проводили один раз в 7 дней с интервалом между опытами 168 часа, животные получали стандартный лабораторный корм;
2.) сеансы "титрования 1,5-пентаметилентетразола" (до развития судорог) проводили один раз в 7 дней с интервалом между опытами 168 часов, однако в течение месяца экспериментальные животные находились на диете, обогащенной возбуждающими аминокислотами (ВАК: глутаматом и аспартатом).
В Таблице 1 представлены результаты, отражающие изменение порога возбудимости ЦНС у крыс, которые в течение двух недель находились на пище, обогащенной ВАК.
Результаты этих экспериментов показали, что ежедневная добавка в пищу ВАК повышала чувствительность крыс к судорожному действию 1,5-пентаметилентетразола.
Потому что в контрольной группе в данной постановке опыта мы не наблюдали снижения дозы конвульсанта в течение трех недель, тогда как у подопытных крыс уже с 7 дня потребления ВАК минимальная судорожная доза пентилентетразола была существенно ниже. Выравнивание доз пентилентетразола в подопытной и контрольной группах через четыре недели обусловлено тем, что, начиная с 15 дня, подопытные животные вновь переходили на питание стандартным лабораторным кормом. Увеличение функциональной активности системы ВАК для развития эпилепсии хорошо известно.
Схема В (сравнительное исследование с высокой прогредиентностью для изучения противосудорожных влияний):
1.) сеансы дробного введения пентилентетразола (до развития судорог) проводили каждый день в течение 6 дней (интервал между опытами 24 часа), животные через рот получали дистиллированную воду;
2.) сеансы дробного введения пентилентетразола (до развития судорог) проводили каждый день в течение 6 дней (интервал между опытами 24 часа), животные через рот получали верапамил в дозе 25 мг/кг;
3.) сеансы дробного введения пентилентетразола (до развития судорог) проводили каждый день в течение 6 дней (интервал между опытами 24 часа), животные через рот получали дильтиазем в дозе 20 мг/кг;
4.) сеансы дробного введения пентилентетразола (до развития судорог) проводили каждый день в течение 6 дней (интервал между опытами 24 часа), животные через рот получали диазепам в дозе 0,5 мг/кг.
Результаты, отражающие изменение судорожной дозы пентилентетразола при повторных инъекциях, свидетельствуют о том, что с течением времени повышается чувствительность животных к судорожному действию конвульсанта. Достоверное снижение минимальной судорожной дозы агента до 80,57 мг/кг отмечали уже со второго дня эксперимента. Исходная доза пентилентетразола в контрольной группе крыс была 67,33±2,48 мг/кг, а к концу эксперимента составляла 58,64±1,53 мг/кг (Р<0,01). Таким образом, повторное введение пентилентетразола вызывало повышение чувствительности ЦНС к судорожному воздействию.
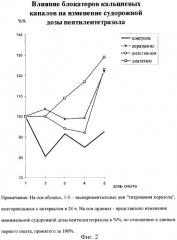
Влияние БКК на судорожный эффект пентилентетразола в нашей постановке опыта представлен на фиг.2.
Все препараты при повторных инъекциях повышали пороговую дозу конвульсанта, необходимую для развития судорог: верапамил (25 мг/кг) до 105,8%, дильтиазем (20 мг/кг) - 102%, диазепам (0,5 мг/кг) - 113%, в контрольной группе (животные получали через рот дистиллированную воду) эта величина соответствовала 87,1%. Итак, все испытуемые блокаторы кальциевых каналов, также как и диазепам, понижали чувствительность крыс к судорожному действию пентилентетразола. Препараты назначали через рот один раз в день сразу после проведения сеанса определения судорожной дозы 1,5-пентаметилентетразола. Диазепам (0,5 мг/кг) назначали по той же схеме. Такая методика постановки эксперимента позволила исключить острое влияние препаратов на развитие 1,5-пентаметилентетразоловых судорог и динамически оценивать изменение порога развития судорог в течение пяти дней.
Таким образом, представленные результаты свидетельствуют о том, что БКК, хотя и в меньшей мере, чем диазепам, но также снижают уровень возбудимости ЦНС.
Блокаторы кальциевых каналов рассматриваются исследователями как потенциальные противоэпилептические средства [Крыжановский Г.Н., Карпова М.Н., Панков О.Ю. // Влияние органических кальциевых антагонистов и магния на развитие коразолового киндлинга. - Бюлл. Эксп. Биол. и Мед. - 1990. - № 1. - С.53-54], что подтвердилось и в нашем исследовании с использованием предлагаемой модели.
Таким образом, предложенный способ позволяет точно и неограниченное время регистрировать изменение порога развития пентилентетразоловых судорог. При изучении противосудорожной/противоэпилептической активности новых препаратов. Причем первый сеанс "титрования" рекомендуется проводить до введения испытуемого препарата (подопытной группе) или его растворителя (контрольным животным). Это позволяет выявить исходный уровень возбудимости ЦНС, что поможет в дальнейшем установить динамику изменений судорожной реакции в каждом конкретном случае.
Настоящая постановка эксперимента необходима особенно тогда, когда по задачам исследования требуется оценивать влияние испытуемого препарата на животных с низким порогом развития судорог. Такие условия, на наш взгляд, наиболее адекватно отражают патогенез эпилепсии, при которой с течением времени порог возбудимости ЦНС постепенно понижается. Нужно подчеркнуть, что в день "титрования" пентилентетразола вводить исследуемый препарат необходимо после проведения опыта для того, чтобы исключить острый противосудорожный эффект тестируемого вещества.
Предлагаемый способ моделирования пароксизмального судорожного расстройства путем проведения дробных инъекций пентилентетразола позволяет с высокой степенью точности оценивать в течение времени изменение порога возбудимости ЦНС (по изменению судорожной дозы пентилентетразола) при испытании новых противосудорожных/противоэпилептических средств. Представлена конкретная схема постановки эксперимента, которая отражает основные этапы доклинического исследования потенциальных противоэпилептических препаратов. Например, в ряде случаев может быть оправдано многократное изменение интервалов между отдельными сеансами "титрования 1,5-пентаметилентетразола" в течение одного эксперимента или введение испытуемого антиконвульсанта с последующей его отменой в ходе проведения одного опыта. Это позволит оценить действие исследуемого препарата, как в условиях естественной, так и в условиях повышенной возбудимости ЦНС.
Предложенный способ моделирования пароксизмального судорожного расстройства путем проведения дробных инъекций пентилентетразола дает возможность точно количественно измерять уровень возбудимости ЦНС при вариации проведения исследования в зависимости от условий и задач эксперимента, позволяя варьировать сенсибилизацией животных к стимулирующему действию 1,5-пентаметилентетразола. Однако, в отличие от известного способа "химической раскачки", суть которого состоит в том, что введение 1,5-пентаметилентетразола [Шандра А.А., Годлевский Л.С., Брусенцов А.И. Киндлинг и эпилептическая активность. - Одесса: Акстро Принт, 1999. - 274 с.] повторяется многократно через равные промежутки времени, метод в нашей модификации позволяет регистрировать динамику изменения судорожной реакции, позволяя оценивать изменение чувствительности (возбудимости) ЦНС и по желанию исследователя, изменяя интенсивность "раскачки" путем вариации времени проведения повторных сеансов дробного введения пентилентетразола.
Таким образом, предложенный способ моделирования пароксизмального судорожного расстройства путем проведения дробных инъекций пентилентетразола пригоден для изучения активности новых противосудорожных/противоэпилептических средств, поскольку позволяет с высокой точностью оценивать изменения порога развития судорог.
| Таблица 1 | ||||
| Влияние диеты, обогащенной ВАК, на изменение минимальной судорожной дозы коразола | ||||
| Группа | 7 день | 14 день | 21 день | 28 день |
| Контрольные | 58,1±4,2 | 59,0±3,2 | 61,5±5,4 | 52,1±4,1 |
| Подопытные | 52,5±3,2 | 51,0±2,1** | 54,3±1,8* | 51,2±3,2 |
| Примечание - цифры показывают изменение минимальной судорожной дозы пентилентетразола | ||||
| ** - Р<0,01; * - Р<0,05 |
Способ моделирования пароксизмального судорожного расстройства путем проведения дробных инъекций пентилентетразола, отличающийся тем, что крысам с интервалом в 15 мин проводят подкожные инъекции 1,5-пентаметилентетразола из расчета 10 мг/кг в объеме 0,1 мл раствора на 100 г массы тела до развития первого генерализованного судорожного припадка, после чего подсчитывают пороговую дозу конвульсанта, отражающую базовый уровень возбудимости ЦНС для каждого животного, при проведении повторных сеансов учитывают динамику изменения исходной дозы пентилентетразола, при этом интервал между сеансами титрования пентилентетразола может составлять от 24 и более 168 ч.