Трансплантация нервных клеток для лечения нейродегенеративных состояний
Иллюстрации
Показать всеЗаявленная группа изобретений относится к медицине, а именно к нейрохирургии и биотехнологии, и может быть использована для культивирования нервных стволовых клеток млекопитающего, исключая эмбриональные клетки человека, и для лечения спастичности, ригидности, спинного мозга или амниотрофического состояния у субъекта, нуждающегося в таком лечении. Для культивирования указанных клеток предварительно инкубируют в культуральном сосуде раствор, содержащий поли-D-лизин в концентрации от 0,1 мкг/мл до 1 мг/мл в течение от 5 минут до 3 часов. Затем ополаскивают и высушивают культуральный сосуд. Высевают нервные стволовые клетки в указанный культуральный сосуд при отсутствии сыворотки. Затем добавляют раствор фибронектина и, по меньшей мере, одного митогена в культуральный сосуд и культивируют нервные стволовые клетки при отсутствии сыворотки. Далее пассируют культивируемые нервные стволовые клетки до слияния. Для лечения указанных состояний концентрируют нервные стволовые клетки, культивированные заявленным способом. Вводят терапевтически эффективное количество указанных концентрированных нервных стволовых клеток в область ткани центральной нервной системы пациента с пониженным уровнем ГАМК-продуцирующих или глицин-продуцирующих нейронов. Заявленная группа изобретений обеспечивает эффективный способ культивирования нервных стволовых клеток млекопитающего, исключая эмбриональные клетки человека, позволяющий достичь in vitro более высокой степени нейрональной дифференцировки до уровня, достаточного для лечения заявленных состояний, и улучшения выживания in vivo таких клеток, а также эффективное лечение спастичности, ригидности или амниотрофического состояния у субъекта за счет введения ему в ткани центральной нервной системы с пониженным уровнем ГАМК-продуцирующих или глицин-продуцирующих нейронов клеток, способных дифференцироваться в достаточное количество ГАМК-продуцирующих или глицин-продуцирующих нейронов в указанной ткани. 2 н. и 23 з.п. ф-лы, 10 ил.
Реферат
Описанные способы относятся к способам лечения заболеваний посредством трансплантации клеток, которые являются единственно благоприятными для указанных способов лечения. В частности, описанные способы представляют собой способы лечения нейродегенеративных состояний с использованием нервных стволовых клеток (NSC).
Нейродегенеративные расстройства характеризуются состояниями с повреждением нейронов в результате заболевания, наследственных состояний или повреждения, такого как травматическое или ишемическое повреждение спинного или головного мозга.
Спинномозговая цепь, которая управляет сокращением скелетной мускулатуры конечностей, включает в себя возбуждающие двигательные нейроны и ингибирующие ГАМК-эргические (т.е. продуцирующие ГАМК) и глицинергические (т.е. продуцирующие глицин) вставочные нейроны. Двигательный нейрон представляет собой нерв, который происходит из переднего рога серого вещества спинного мозга. Аксон двигательного нейрона исходит из сегмента спинного мозга в качестве эфферентного двигательного волокна, которое иннервирует мышечные волокна. Импульсы, которые проводит двигательный нейрон, стимулируют сокращение мышечных волокон. ГАМК, гамма-аминомасляная кислота, представляет собой натуральный метаболит нервной системы млекопитающих, который действует как нейромедиатор, ингибирующий или ослабляющий проведение нервом электрического потенциала. Утрата ГАМК-эргических вставочных нейронов приводит к дисрегуляции ингибирующей тональности вызванных двигательным нейроном мышечных сокращений. В отсутствие контроля, осуществляемого ингибирующими вставочными нейронами в отношении возбуждающих нейронов, наблюдается перевозбуждение возбуждающих нейронов, приводящее к спастическому неконтролируемому сокращению или неконтролируемой ригидности мышц конечностей. Утрата двигательных нейронов приводит к вялой параплегии, при которой субъекты не могут сокращать мышцы и вследствие этого не способны двигаться.
Одним из случаев, при котором ГАМК-эргические вставочные нейроны спинного мозга повреждаются, является осложнение, связанное с преходящим пережатием нисходящей грудной или торакоабдоминальной аорты. Указанное пережатие является необходимым этапом при оперативных вмешательствах на сосудах для устранения аневризм грудной или торакоабдоминальной аорты. Во время пережатия часть спинного мозга лишается кровоснабжения и может становиться ишемической. В зависимости от продолжительности ишемии последующая нейродегенеративная дисфункция может выражаться нейродегенеративно, как парапарез или как полностью развившаяся спастическая или вялая параплегия.
В то время как механизм, приводящий к индуцированной ишемией дегенерации нейронов, известен лишь отчасти и может включать в себя избыточное высвобождение/активность возбуждающих аминокислот, простагландинов и/или кислородных свободных радикалов, популяция нейронов спинного мозга, которую поражает преходящий ишемический инсульт, хорошо известна. Например, гистопатологический анализ спинного мозга, взятого от животных с полностью развившейся спастической параплегией, показывает селективную утрату малых ингибирующих нейронов; однако альфа-мотонейроны персистируют в ранее ишемических спинальных сегментах. Описана сходная патология нейронов спинного мозга у людей с ишемическим повреждением спинного мозга.
Напротив, у животных с вялой параплегией наблюдаются паннекротические нейродегенеративные изменения, поражающие как малые ингибирующие и возбуждающие вставочные нейроны, так и вентральные двигательные нейроны. В течение периода нейрональной дегенерации после спинальной ишемии также наблюдается вызванная повреждением активация локальной микроглии и воспалительные изменения, такие как инфильтрация макрофагами, как при очаговой или глобальной ишемии головного мозга. В зависимости от распространенности повреждения воспалительные изменения обычно достигают пика между двумя и семью днями после ишемического инсульта, а затем наблюдается постепенное исчезновение элементов воспаления в течение двух-четырех недель постишемического периода.
В последние два-три десятилетия прилагались значительные усилия для того, чтобы на экспериментальных животных оценить терапевтический потенциал трансплантации в спинной мозг ряда материалов. Так, клеточные линии или остро выделенную ткань спинного мозга плода доставляли в поврежденные области, а также использовали прямую спинальную генную терапию для облегчения нейродегенеративной дисфункции на нескольких моделях повреждения спинного мозга, включая механическое травматическое повреждение, химическое повреждение спинного мозга, или на генетически измененных животных с прогрессивной α-мотонейрональной дегенерацией (ALS-трансгенные мыши или крысы).
В целом, исследования демонстрируют долгосрочное выживание и сохранение нейрональных фенотипов в трансплантатах, полученных из фетальной ткани, но не из клеток-предшественников нейронов, которые размножались in vitro. Фактически были продемонстрированы лишь ограниченная нейрональная дифференцировка и созревание клеток-предшественников нейронов, размножавшихся in vitro и трансплантированных в механически или химически поврежденный спинной мозг. Клетки дифференцировались, главным образом, в клеточные типы, не относящиеся к нейронам. В то время как механизм указанной, преимущественно не являющейся нейрональной, дифференцировки не вполне понятен, существует гипотеза о том, что имеет место, вероятно, локальное высвобождение провоспалительных цитокинов (таких как TNFα и TGFβ) на участке ранее имевшегося повреждения.
Нейродегенерация представляет собой особенно проблематичное биологическое окружение для клеточной терапии, а сигналы гибели клеток, имеющие место при установившемся нейродегенеративном заболевании (Rothstein et аl., 1992; Howland et al., 2002; Turner et al., 2005), могут быть не совместимыми с выживанием трансплантата. Помимо этого, спинной мозг взрослого организма рассматривается как утративший клетки и/или сигналы, обеспечивающие регенерацию (Park et al., 2002), и большинство исследований трансплантации NSC показали слабую или ограниченную дифференцировку (Сао et al., 2002; Yan et al., 2004).
Одной из главных проблем клеточной терапии является низкая выживаемость трансплантированных клеток (менее 5%). Все трансплантированные клетки в настоящее время погибают в значительных количествах вскоре после инъекции in vivo. Так, с целью доставки эффективной дозы клеток конечную дозу необходимо инъецировать по меньшей мере 20 раз. Это, в свою очередь, требует гораздо больших масштабов производства клеток, что создает дополнительные регуляторные и экономические препятствия. Кроме того, выживаемость указанных клеток in vivo невозможно было сохранить. Неспособность продемонстрировать воспроизводимое введение эффективных доз клеточной терапии препятствует получению разрешения применять указанную терапию от правительства и других регулирующих органов, таких как Управление по контролю за продуктами и лекарствами США.
Дополнительные проблемы возникают при лечении нейродегенеративных заболеваний и состояний, которые захватывают большую область тела, ткани или органа, такую как нервная система в целом, а не единичный локализованный участок. Например, в случае ALS нейродегенерация включает в себя медленную гибель двигательных нейронов на всем протяжении спинного мозга, а также нейронов двигательной коры. Подобно этому, при большинстве лизосомальных заболеваний нейрональная деструкция захватывает большинство областей головного и спинного мозга. Болезнь Альцгеймера захватывает большую часть головного мозга. Даже при более локализованных нейродегенеративных заболеваниях, таких как болезнь Паркинсона и болезнь Хантингтона, пораженная область полосатого тела является достаточно большой, гораздо больше, чем область трансплантации, которая может быть достигнута хирургическим путем. Таким образом, клеточная терапия при нейродегенеративных заболеваниях, как ожидается, потребует осуществления более обширных процедур трансплантации.
Таким образом, существует потребность в улучшенных способах лечения нейродегенеративных состояний. Существует потребность также в улучшенных способах культивирования и трансплантации нервных стволовых клеток, исключая эмбриональные клетки человека, и недифференцированных клеток-предшественников нейронов, которые после трансплантации будут преодолевать все ранее наблюдавшиеся ограничения и приносить функциональную пользу. Таким образом, данный способ лечения нейродегенеративных состояний, in vivo, обеспечивает надежную дифференцировку нервных клеток, длительное выживание нейронов при различных дегенеративных состояниях и созревание в терапевтически важные субпопуляции нейронов в тканях взрослого организма, которые не имеют стимулов для развития, и создает широкий терапевтический интервал по сравнению с локализацией самих клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Описанные способы включают способы лечения нейродегенеративных состояний. В частности, описанные способы включают трансплантацию субъекту, который в этом нуждается, NSC, недифференцированных клеток-предшественников нейронов или клеток-предшественников нейронов, которые размножались in vitro таким образом, что клетки могут улучшить нейродегенеративное состояние. В одном варианте осуществления настоящего изобретения описанные способы включают идентификацию, выделение, размножение и подготовку донорских клеток для использования в качестве лечения нейродегенеративного состояния. Донорские клетки, предназначенные для трансплантации, можно подвергать селекции на предмет соответствия элементам или отсутствия элементов, которые вносят свой вклад в состояние, его симптомы и/или его эффекты.
Клетки описанных способов включают в себя клетки, которые после трансплантации генерируют нейроны в количестве, достаточном для того, чтобы интегрироваться в нейронную инфраструктуру для улучшения болезненного статуса или состояния. В одном варианте осуществления настоящего изобретения описанные способы включают в себя лечение нейродегенеративных заболеваний или состояний посредством трансплантации мультипотентных недифференцированных клеток-предшественников нейронов или нервных стволовых клеток, которые были выделены из центральной нервной системы млекопитающего и были размножены in vitro. Например, трансплантация размноженных нервных стволовых клеток может использоваться для улучшения функции ходьбы у субъекта, страдающего различными формами миелопатии с симптомами спастичности, ригидности, припадков, паралича или любой другой гиперактивности мышц.
Способ лечения может включать в себя доставку в поврежденную нервную область, посредством трансплантации, подходящего количества NSC, которые могут дифференцироваться в достаточное количество ГАМК-продуцирующих нейронов и/или глицин-продуцирующих нейронов, для ослабления дефектных нервных цепей, включая гиперактивные нейрональные цепи.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя восстановление двигательной функции при заболевании двигательных нейронов. Подходящее количество или терапевтически эффективное количество NSC или недифференцированных клеток-предшественников нейронов, которые способны дифференцироваться в двигательные нейроны, могут доставляться по меньшей мере в одну область нейродегенерации, такую как дегенеративный спинной мозг, для восстановления двигательной функции. NSC оказывают свое терапевтическое действие путем замены дегенерировавших нервно-мышечных синапсов.
В сочетании или альтернативно, NSC оказывают свое терапевтическое действие путем экспрессии и высвобождения трофических молекул, которые защищают нейроны дегенерирующей ткани таким образом, что большее их количество выживает в течение более длительного периода времени. Полученные из NSC нейроны можно направить в вентральные корешки, чтобы иннервировать мышцы, и в данном случае NSC участвуют в экстенсивных реципрокных связях с двигательными нейронами хозяина у субъектов с дегенеративным заболеванием двигательных нейронов. Таким образом, в одном варианте осуществления настоящего изобретения NSC из фетального спинного мозга можно трансплантировать в поясничный отдел спинного мозга, где указанные клетки могут претерпевать дифференцировку в нейроны, которые образовывают синаптические контакты с нейронами хозяина и экпрессируют и высвобождают факторы роста двигательных нейронов.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя получение нервных стволовых клеток или недифференцированных клеток-предшественников нейронов, которые интегрируются в ткань хозяина и поставляют один или более факторов роста нейронам хозяина, защищая их, таким образом, от дегенеративных влияний, присутствующих в ткани. Способы включают в себя введение достаточного количества NSC или недифференцированных клеток-предшественников нейронов в область спинного мозга таким образом, чтобы NSC секретировали эффективное количество по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя создание способа применения экспериментальных животных в качестве модели для доклинической оценки стволовых клеток для замещения клеток при нейродегенеративных состояниях.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя повышение эффективности дифференцировки трансплантированных NSC в нейроны. Способ включает в себя размножение в высокой степени обогащенных NSC или недифференцированных клеток-предшественников нейронов в их недифференцированном состоянии таким образом, чтобы после трансплантации достаточное количество, такое как 20%, клеток в трансплантате в дальнейшем превратилось в нейроны.
В одном варианте осуществления настоящего изобретения описанные способы включают в себя увеличение количества дифференцированных клеток без увеличения количества NSC или недифференцированных клеток-предшественников нейронов, предназначенных для трансплантации. В одном варианте осуществления настоящего изобретения способ включает в себя получение размноженной донорской популяции таким образом, чтобы после трансплантации NSC или недифференцированные клетки-предшественники нейронов продолжали делиться in vivo до десяти раз, не образуя опухоли и эффективно увеличивая общее количество доставленных клеток.
Клетки описанных способов можно выделять или получить из фетальных, неонатальных, ювенильных, взрослых или посмертных тканей млекопитающего, не относящегося к человеку. Клетки описанных способов можно выделять или получить из центральной нервной системы, крови или любого другого подходящего источника стволовых клеток, которые дифференцируются в нейроны. Клетки можно также получить из эмбриональных стволовых клеток. Например, в одном варианте осуществления настоящего изобретения клетки включают в себя нейроэпителиальные клетки, выделенные из развивающегося фетального спинного мозга. В некоторых случаях клетки-предшественники нейронов могут представлять собой недифференцированные клетки-предшественники нейронов, выделенные из специфических субобластей центральной нервной системы.
Согласно описанным способам нервные стволовые клетки размножают в культуре. В одном варианте осуществления настоящего изобретения клетки-предшественники нейронов могут представлять собой мультипотентные NSC, способные размножаться в культуре и после дифференцировки генерировать как нейроны, так и глию.
К моменту трансплантации клетки могут быть недифференцированными, преддифференцированными или полностью дифференцированными. В одном варианте осуществления настоящего изобретения клетки являются индуцированными для дифференцировки в нейрональную линию. Клетки описанных способов могут претерпевать нейрональную дифференцировку in situ в присутствии провоспалительных цитокинов и других факторов окружающей среды, существующих в поврежденной ткани.
Используя настоящие способы, можно лечить нервные цепи путем трансплантации или введения клеток в соответствующие области для облегчения заболевания, расстройства или состояния. Обычно имеет место трансплантация в нервную ткань или в ткани, не являющиеся нервными тканями, которые способствуют выживанию трансплантированных клеток. Трансплантаты NSC, используемые в описанных способах, хорошо выживают в нейродегенеративной окружающей среде, где NSC могут оказывать мощное клиническое действие в форме задержки возникновения и прогрессирования нейродегенеративных состояний или заболевания.
В некоторых случаях может иметь место трансплантация в отдаленные области тела, и клетки могут мигрировать в предназначенное для них место. Соответственно, описанные способы могут также включать в себя частичную трансплантацию NSC. Используемый в настоящем документе термин «частичная трансплантация» может относиться к имплантации размножившихся NSC лишь в часть области или в менее чем целую область нейродегенерации. Например, осуществляется частичная трансплантация NSC в поясничные сегменты спинного мозга. По крайней мере часть влияния NSC на дегенерирующие двигательные нейроны включает доставку нейротрофических агентов и трофических цитокинов к дегенерирующим двигательным нейронам хозяина посредством классических клеточных механизмов. С этой целью NSC, частично трансплантируемые в поясничные сегменты спинного мозга с использованием описанных способов, как было показано на трансгенных животных, служивших моделью заболевания двигательных нейронов, выживают, претерпевают экстенсивную нейрональную дифференцировку, способствуют выживанию и функционированию двигательных нейронов в непосредственной области трансплантации, а также в областях, отдаленных от области трансплантации.
Соответственно, описанные способы относятся к способу лечения спастичности, ригидности или состояний гиперактивности мышц. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки у млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ включает в себя также концентрирование размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения состояния вызваны травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения нервную стволовую клетку выделяют из источника, выбранного из группы, состоящей из центральной нервной системы, периферической нервной системы, костного мозга, периферической крови, крови пуповины и по меньшей мере одного эмбриона.
В одном варианте осуществления настоящего изобретения гестационный возраст развивающегося млекопитающего составляет от приблизительно 6,5 до приблизительно 20 недель.
В одном варианте осуществления настоящего изобретения нервную стволовую клетку выделяют из фетального спинного мозга млекопитающего, не являющегося человеком.
В одном варианте осуществления настоящего изобретения размножение нервной стволовой клетки включает в себя культивирование нервной стволовой клетки в отсутствие сыворотки.
В одном варианте осуществления настоящего изобретения размножение нервной стволовой клетки включает в себя воздействие на нервную стволовую клетку по меньшей мере одним фактором роста.
В одном варианте осуществления настоящего изобретения фактор роста выбран из группы, состоящей из bFGF, EGF, TGF-альфа, aFGF и их комбинаций.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 ГАМК-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 глицин-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения по меньшей мере 40% размноженной популяции способно генерировать нейроны в спинном мозге.
В одном варианте осуществления настоящего изобретения введение терапевтически эффективного количества размноженной популяции включает инъецирование по меньшей мере части терапевтически эффективного количества во множество областей спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения по меньшей мере 30% размноженной популяции способно дифференцироваться в нейроны in vitro.
В другом варианте осуществления настоящего изобретения получена нервная стволовая клетка. Нервная стволовая клетка способна лечить спастичность, ригидность или состояния гиперактивности мышц. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения хронической боли. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения хроническая боль вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 ГАМК-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 глицин-продуцирующих нейронов in vivo.
В одном варианте осуществления настоящего изобретения по меньшей мере 40% размноженной популяции способно генерировать нейроны в спинном мозге.
В одном варианте осуществления настоящего изобретения введение терапевтически эффективного количества размноженной популяции включает инъецирование по меньшей мере части терапевтически эффективного количества во множество областей спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения области включают в себя дорсальный рог.
В одном варианте осуществления настоящего изобретения области включают в себя интратекальное пространство.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка. Нервная стволовая клетка способна лечить хроническую боль. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения дегенерации двигательных нейронов. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В одном варианте осуществления настоящего изобретения дегенерация двигательных нейронов вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много клеток по меньшей мере одного нейронального подтипа, в которой нейрональный подтип продуцирует фактор роста, эффективный для улучшения двигательного дефицита.
В одном варианте осуществления настоящего изобретения размноженная популяция включает количество нервных стволовых клеток, способных дифференцироваться в нейроны, достаточное для секреции терапевтически эффективного количества по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много двигательных нейронов.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка, способная лечить сирингомиелию. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции по меньшей мере в одну область спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в спинном мозге реципиента.
В другом варианте осуществления описанных способов описан способ лечения сирингомиелии. Способ включает в себя выделение по меньшей мере одной нервной стволовой клетки от млекопитающего и размножение in vitro нервной стволовой клетки до состояния размноженной популяции. Способ также включает в себя концентрацию размноженной популяции и внедрение терапевтически эффективного количества размноженной популяции в патологическую полость спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в патологической полости спинного мозга реципиента.
В одном варианте осуществления настоящего изобретения сирингомиелия вызвана травматическим повреждением спинного мозга, ишемическим повреждением спинного мозга, травматическим повреждением головного мозга, инсультом, рассеянным склерозом, церебральным параличом, эпилепсией, болезнью Хантингтона, боковым амиотрофическим склерозом, хронической ишемией, наследственными состояниями или любой их комбинацией.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много клеток по меньшей мере одного нейронального подтипа, в которой нейрональный подтип продуцирует фактор роста, эффективный для облегчения сирингомиелии.
В одном варианте осуществления настоящего изобретения способ включает в себя выделение нервной стволовой клетки из области, содержащей много двигательных нейронов.
В одном варианте осуществления настоящего изобретения размноженная популяция включает количество нервных стволовых клеток, способных дифференцироваться в нейроны, достаточное для секреции терапевтически эффективного количества по меньшей мере одного фактора роста.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции способно генерировать по меньшей мере 1000 нейронов.
В одном варианте осуществления настоящего изобретения по меньшей мере 100000 нервных стволовых клеток размноженной популяции внедряют в патологическую полость спинного мозга реципиента.
В еще одном варианте осуществления настоящего изобретения получена нервная стволовая клетка, способная лечить сирингомиелию. Нервную стволовую клетку выделяют от млекопитающего и размножают in vitro до состояния размноженной популяции. Размноженную популяцию, включающую стволовые клетки, концентрируют и внедряют терапевтически эффективное количество размноженной популяции в патологическую полость спинного мозга реципиента. По меньшей мере 20% размноженной популяции способны генерировать нейроны в патологической полости спинного мозга реципиента.
В дополнительном варианте осуществления описанных способов описан способ размножения in vitro по меньшей мере одной нервной стволовой клетки до состояния размноженной популяции нервных стволовых клеток. Каждое размножение нервных стволовых клеток превышает тридцать клеточных удвоений без дифференцировки. Способ включает в себя разъединение нервных стволовых клеток от ткани центральной нервной системы и внесение по меньшей мере одного внеклеточного белка в культуральный сосуд. Внеклеточный белок включает по меньшей мере приблизительно 10 мкг/мл поли-D-лизина и приблизительно 1 мг/мл фибронектина. Способ включает в себя также культивирование диссоциированных нервных стволовых клеток в культуральном сосуде в отсутствие сыворотки и добавление в культуральный сосуд по меньшей мере одного фактора роста. Фактор роста выбран из группы, состоящей из bFGF, EGF, TGF-альфа, aFGF и их комбинаций. Способ включает в себя также пассирование культивированных клеток до слияния.
В одном варианте осуществления настоящего изобретения размноженные нервные стволовые клетки способны дифференцироваться в нейроны.
В одном варианте осуществления настоящего изобретения размножение нервных стволовых клеток включает в себя добавление фибронектина в культуральную среду в качестве растворимого фактора.
В одном варианте осуществления настоящего изобретения диссоциация клеток и пассирование клеток включают в себя ферментативную диссоциацию.
В одном варианте осуществления настоящего изобретения ферментативная диссоциация включает в себя воздействие на клетки трипсином.
В одном варианте осуществления настоящего изобретения терапевтически эффективное количество размноженной популяции внедряют по меньшей мере в одну область нервной системы реципиента для лечения нейродегенеративного состояния.
Таким образом, преимуществом описанных способов перед существующими фармакологическими стратегиями является создание способа для облегчения способности трансплантированных NSC секретировать трофические молекулы, которые могут быть доставлены к дегенерирующим двигательным нейронам в условиях оптимальной биодоступности.
Еще одним преимуществом настоящего изобретения является создание способа культивирования и размножения NSC из фетального спинного мозга млекопитающего для облегчения успешного приживления трансплантированных NSC в поясничный отдел спинного мозга.
Еще одно преимущество описанных способов включает создание способа достижения более высокой доли нейрональной дифференцировки популяции NSC.
Другое преимущество описанных способов включает достижение клинических эффектов от частичной трансплантации NSC.
Другие признаки и преимущества описанных способов описаны и будут очевидны из следующего подробного описания изобретения и чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
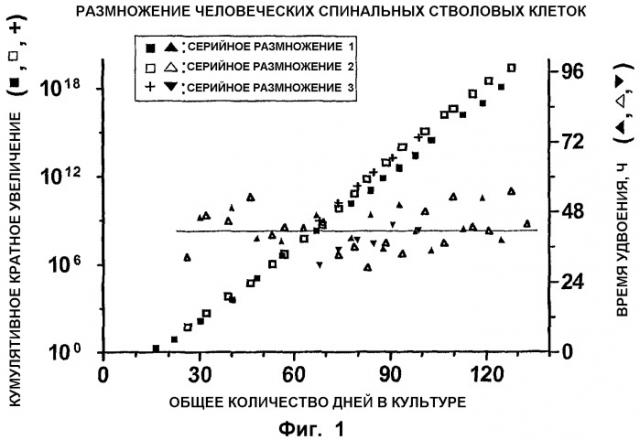
ФИГ.1. Размножение спинальных стволовых клеток. Линию спинальных недифференцированных клеток-предшественников (известных также как NSC) выделяли из ткани спинного мозга 7-8-дневных post mortem (погибших) эмбрионов и производили серийное пассирование в течение приблизительно 130 дней общего культурального периода. При каждом пассаже количество собранных клеток делили на исходное количество клеток при посеве для получения кратного увеличения количества клеток. Кумулятивное кратное увеличение (левая ось Y) получали умножением кратного увеличения при каждом пассаже. Время удвоения (правая ось Y) количества клеток при каждом пассаже рассчитывали делением кратного увеличения количества клеток на каждый культуральный период (ось X). Указанный процесс повторяли три раза (серийное размножение 1, 2 и 3).
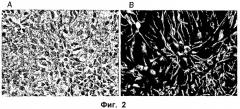
ФИГ.2. Морфология размноженных спинальных стволовых клеток. (А) Фазово-контрастная фотография фиксированной, неокрашенной, размножающейся культуры, объектив 20х. (В) Окрашивание антинестиновыми антителами.
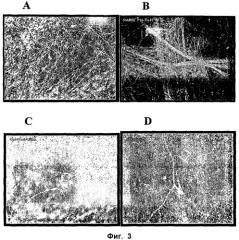
ФИГ.3. Определение характеристик дифференцированных культур, полученных из размноженных спинальных стволовых клеток. Размножившиеся клетки пассажа 15-16 дифференцировались приблизительно за 14 дней в культуре, были фиксированы и окрашены с использованием различных специфичных для нейронов антител. (А) Тау и МАР2; (В) тубулин бета типа 3; (С) ГАМК; (D) ацетилхолинтрансфераза.
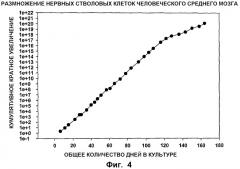
ФИГ.4. Размножение стволовых клеток среднего мозга. Линию недифференцированных клеток-предшественников среднего мозга (известных также как NSC) выделяли из ткани среднего мозга 7-8-дневных погибших (post mortem) эмбрионов и производили серийное пассирование в течение приблизительно 170 дней общего культурального периода. При каждом пассаже количество собранных клеток делили на исходное количество клеток при посеве для получения кратного увеличения количества клеток. Кумулятивное кратное увеличение (ось Y) получали умножением кратного увеличения при каждом пассаже.
ФИГ.5. Захват дофамина размноженными стволовыми клетками среднего мозга. Активность транспорта дофамина (DAT) в живых клетках определяли в линии стволовых клеток среднего мозга и в одной ее клональной сублинии, которые дифференцировались в течение 22 или 44 дней во время исследования. Клетки инкубировали с радиоактивно меченным дофамином в присутствии (+) или отсутствие (-) ингибитора DAT номифензина (10 мкМ). Клетки промывали для удаления неинкорпорированного дофамина и лизировали с получением сцинтилляционного коктейля. Затем определяли общую радиоактивность клеток имп/мин (dpm) с использованием сцинтилляционного счетчика.
ФИГ.6. Влияние экзогенных факторов на индукцию нейрональной дифференцировки и дофаминергической дифференцировки линий стволовых клеток среднего мозга. Сохраненные в замороженном состоянии нервные стволовые клетки из двух линий стволовых клеток среднего мозга (527RMB и 796RMB) оттаивали и засевали с плотностью 40 000 клеток на лунку в 4-камерные предметные стекла в присутствии bFGF и позволяли пролиферировать в течение 6 дней. Затем bFGF удаляли и клеткам позволяли дифференцироваться в течение дополнительных 8 дней. Клетки разделяли на четыре группы в зависимости от сроков и продолжительности экспозиции в кондиционированной среде для клеток Сертоли (SCCM, в разведении 1:1, в N2). Одну группу подвергали воздействию SCCM во время пролиферации и дифференцировки (условие 1); вторую подвергали воздействию только во время пролиферации (условие 2); третью подвергали воздействию только во время дифференцировки (условие 3); а четвертую не подвергали воздействию SCCM (контроль). Среды меняли через день, а митоген добавляли ежедневно во время пролиферативной фаз