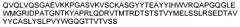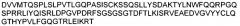Способы лечения глазных болезней
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к офтальмологии, и может быть использована для лечения возрастной макулярной дегенерации. Для этого вводят эффективное количество антитела, которое специфично связывается с пептидом Аβ1-40, или антитела, которое специфично связывается с эпитопом на Аβ1-40 и Aβ1-42. Введение антител позволяет восстановить функции сетчатки. 2 н. и 11 з.п.ф-лы, 9 табл., 14 ил.
Реферат
Настоящая заявка притязает на приоритет на основании заявки на выдачу патента США № 12/041581, поданной 3 марта 2008, которая притязает на приоритет на основании предварительной заявки на выдачу патента США № 60/894181, поданной 9 марта 2007, содержания которых включены в настоящее описание в виде ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам применения антител к бета-амилоидному пептиду для лечения и/или профилактики глазных болезней, таких как возрастная макулярная дегенерация, а также другие патологии глаз, такие как глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки.
УРОВЕНЬ ТЕХНИКИ
Наиболее распространенной причиной снижения наилучшей корригированной остроты зрения у людей после 65 лет в США является заболевание сетчатки, известное как возрастная макулярная дегенерация (ВМД). По мере прогрессирования ВМД заболевание характеризуется утратой острого центрального зрения. Область глаза, поражаемая ВМД, представляет собой макулу - небольшую область в центре сетчатки, состоящую, главным образом, их фоторецепторных клеток. Так называемая «сухая» ВМД (также называемая «географической атрофией»), на долю которой приходится 85-90% пациентов с ВМД, включает в себя изменения в распределении пигментации глаза, утрату фоторецепторов и снижение функции сетчатки вследствие общей атрофии клеток. Так называемая «влажная» ВМД включает в себя пролиферацию аномальных хориоидальных сосудов, приводящую к сгусткам или рубцам в субретинальном пространстве. Таким образом, появление влажной ВМД происходит вследствие образования аномальной хориоидальной неоваскулярной сети (хориоидальной неоваскуляризации, ХНВ) под невральной сетчаткой. Новообразованные кровеносные сосуды очень сильно просачиваются. Это приводит к накоплению субретинальной жидкости и крови, что ведет к потере остроты зрения. В итоге имеет место общая потеря функциональной сетчатки в пораженной области, так как образуется большой дисковидный рубец, охватывающий хориоид и сетчатку. В то время как при сухой ВМД пациенты могут сохранять зрение пониженного качества, влажная ВМД часто приводит к слепоте (Hamdi and Kenney, Age-related Macular degeneration - a new viewpoint, Frontiers in Bioscience, e305-314, May 2003). ХНВ возникает не только при влажной ВМД, но также при других патологиях глаза, таких как глаукома, диабетическая ретинопатия (включая диабетический макулярный отек), разрывы в оболочке Бруха, миопическая дегенерация, глазные опухоли и другие родственные дегенеративные заболевания сетчатки.
ВМД является распространенным заболеванием, патогенез которого несомненно является многофакторным, при этом генетические факторы и факторы окружающей среды играют роль в его появлении и прогрессировании. В различных проведенных исследованиях было определено несколько факторов риска развития ВМД, таких как курение, возраст, семейный анамнез (Milton, Am. J. Ophthalmol. 88, 269 (1979); Mitchell et al., Ophthalmology 102, 1450-1460 (1995); Smith et al., Ophthalmology 108, 697-704 (2001)), пол (в 7 раз более высокая вероятность у женщин: Klein et al., Ophthalmology 99, 933-943 (1992) и раса (люди с белой кожей являются наиболее чувствительными). Дополнительные факторы риска могут включать характеристики глаз, такие как дальнозоркость (гиперметропия) и светлые глаза, а также сердечно-сосудистое заболевание и гипертония. Доказательство участия генетического компонента в прогрессировании заболевания также представлено в литературе (смотри Hamdi and Kenney выше).
В настоящее время нет общепринятых животных моделей для исследования ВМД. В начальных исследованиях, описанных в публикации Malek et al. PNAS 102, 11900-5 (2005), получена животная модель, имеющая три фактора риска, которые при объединении соответствовали морфологическим признакам ВМД человека. Важно, что разработка такой модели на мышах позволила тестировать новые молекулярные механизмы и терапевтические мишени ВМД. Сохраняется необходимость в идентификации новых мишеней и терапевтических средств, позволяющих лечить и/или предотвращать глазные болезни, такие как возрастная макулярная дегенерация (как влажная, так и сухая), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение раскрывает новые терапевтические мишени, вовлеченные в патогенез глазных болезней. В частности, настоящее изобретение раскрывает способы лечения глазной болезни, включающие в себя введение субъекту эффективного количества ингибитора β-амилоидного (Aβ) пептида. Ингибитор Aβ может быть введен субъектам, страдающим от глазных болезней, таких как возрастная макулярная дегенерация (как влажная, так и сухая ВМД), глаукома, диабетическая ретинопатия (включая диабетический отек желтого пятна), хориоидальная неоваскулярная мембрана (ХНВ), увеит, миопическая дегенерация, глазные опухоли, окклюзия центральной вены сетчатки, покраснение радужки, неоваскуляризация глаз, центральная серозная ретинопатия, болезни поверхности глаза, такие как синдром сухого глаза, окклюзия центральной артерии сетчатки, кистозный макулярный отек и любое другое дегенеративное заболевание сетчатки. В одном варианте ингибитор представляет собой антитело, антисмысловую молекулу, молекулу миРНК, рибозим или низкомолекулярное соединение.
В одном варианте настоящее изобретение относится к способу лечения субъекта, страдающего от возрастной макулярной дегенерации, включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора β-амилоидного (Aβ)-пептида. Другой вариант осуществления настоящего изобретения относится к способу лечения субъекта, страдающего от возрастной макулярной дегенерации (ВМД), включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора Aβ.
Дополнительный вариант осуществления настоящего изобретения относится к применению терапевтически эффективного количества ингибитора Aβ для получения лекарственного средства для стимуляции выздоровления пациента, страдающего от ВМД. В одном аспекте настоящего варианта антитело содержит Fc-область, обладающую нарушенной эффекторной функцией. В следующем аспекте настоящего варианта осуществления заболевание представляет собой ВМД, включая как сухую, так и влажную ВМД.
Изобретение также относится к способам лечения или профилактики заболеваний, связанных с отложением амилоида Aβ, включающим в себя введение субъекту эффективной дозы фармацевтической композиции, содержащей антитело, которое специфично связывается с Aβ-пептидом или агрегированной формой Aβ-пептида. В следующем аспекте настоящего варианта осуществления антитело содержит Fc-область, имеющую изменение по сравнению с встречающейся в природе Fc-областью, при этом изменение приводит к ухудшению эффекторной функции. В некоторых вариантах введение антитела меньше вызывает микрокровотечений в головном мозге, чем введение антитела без изменения.
Антитело и полипептид, используемые в способах согласно изобретению, специфично связываются с Aβ-пептидом или агрегированной формой Aβ-пептида. В одном варианте антитело или полипептид имеют нарушенную эффекторную функцию. В некоторых вариантах антитело или полипептид не являются F(ab')2-фрагментом. В некоторых вариантах антитело или полипептид не являются Fab-фрагментом. В некоторых вариантах антитело или полипептид не являются одноцепочечным антителом scFv.
Полипептиды, которые специфично связываются с Aβ-пептидом или агрегированной формой Aβ-пептида и содержат константную область тяжелой цепи, имеющую нарушенную эффекторную функцию, также могут быть использованы для любого из способов, описанных в настоящей публикации. В некоторых вариантах полипептид содержит последовательность (например, одну или несколько CDR), полученную из антитела 9TL, 6G или их вариантов, показанных в таблице 3 или таблице 8.
В некоторых вариантах антитело или полипептид содержит константную область тяжелой цепи, имеющую нарушенную эффекторную функцию, при этом константная область тяжелой цепи содержит Fc-область. В некоторых вариантах N-гликозилирование в Fc-области удалено. В некоторых вариантах Fc-область содержит мутацию в последовательности, узнаваемой при N-гликозилировании, в силу чего Fc-область антитела или полипептид не N-гликозилируются. В некоторых вариантах Fc-область пегилирована. В некоторых вариантах константная область тяжелой цепи антитела или полипептида представляет собой константную область тяжелой цепи IgG2a человека, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа). В некоторых вариантах антитело или полипептид содержит константную область IgG4, содержащую следующие мутации: E233F234L235 → P233V234A235.
В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 1-16 Aβ-пептида. В некоторых вариантах антитело или полипептид специфично связывается с N-концом Aβ-пептида. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 16-28 Aβ-пептида. В некоторых вариантах антитело специфично связывается с эпитопом с C-концевой стороны Aβ-пептида, таким как эпитоп, начинающийся с аминокислоты 25 или далее. Антитело может специфично связываться с любым из Aβ-пептидов 1-37, 1-38, 1-39, 1-40, 1-41, 1-42, 1-43. В некоторых вариантах антитело может специфично связываться с имеющей свободный C-конец аминокислотой укороченного на C-конце Aβ-пептида, например Aβ 1-37, 1-38, 1-39, 1-40, 1-41, 1-42, 1-43. В одном варианте антитело или полипептид специфично связывается с эпитопом пептида Aβ1-40. В следующем аспекте настоящего варианта антитело или полипептид специфично связывается с эпитопом пептида Aβ1-42. В еще одном аспекте настоящего варианта антитело или полипептид специфично связывается с эпитопом пептида Aβ1-43 пептид. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-40 пептида Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-42 пептида Aβ1-42. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в пределах остатков 28-43 пептида Aβ1-43. В некоторых вариантах антитело или полипептид специфично связывается с Aβ-пептидом, не связываясь с полноразмерным белком предшественника амилоида (APP). В некоторых вариантах антитело или полипептид специфично связывается с агрегированной формой Aβ, не связываясь с растворимой формой. В некоторых вариантах антитело или полипептид специфично связывается с растворимой формой Aβ, не связываясь с агрегированной формой. В некоторых вариантах антитело или полипептид специфично связывается как с агрегированной формой, так и с растворимыми формами Aβ.
В некоторых вариантах антитело или полипептид специфично связывается с C-концевым пептидом 33-40 Aβ1-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 35-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 36-40. В некоторых вариантах антитело или полипептид специфично связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 39 и/или 40. В некоторых вариантах антитело или полипептид специфично связывается с Aβ1-40, но специфично не связывается с Aβ1-42 и/или Aβ1-43. В некоторых вариантах антитело содержит вариабельную область антитела 9TL или антитела, полученного из 9TL, описанного в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 9TL, 6G и/или антитела или полипептида, полученного из 9TL или 6G, с соответствующим Aβ-пептидом.
В некоторых вариантах антитело или полипептид связывается с Aβ1-40 с более высокой аффинностью, чем в случае его связывания с Aβ1-42 и Aβ1-43. В следующем аспекте настоящего варианта антитело не является антителом 2294. В некоторых вариантах антитело связывается с эпитопом в Aβ1-40, который включает в себя аминокислоты 25-34 и 40. В некоторых вариантах антитело содержит вариабельную область антитела 6G или антитела, полученного из 6G, описанного в настоящей публикации. В некоторых вариантах антитело или полипептид конкурентно ингибирует связывание антитела 6G и/или антитела или полипептида, полученного из 6G, с Aβ.
В некоторых вариантах антитело или полипептид связывается с Aβ-пептидом с аффинностью связывания (KD) примерно 100 нМ или меньше, или 20 нМ или меньше, или 2 нМ или меньше. В одном аспекте настоящего варианта антитело или полипептид связывается с пептидом Aβ1-40 с KD примерно 100 нМ или меньше, 50 нМ или меньше или 2 нМ или меньше. В следующем аспекте настоящего варианта антитело или полипептид также связывается с пептидом Aβ1-42 с KD, составляющей примерно 100 нМ или меньше, 50 нМ или меньше, или 2 нМ или меньше.
Введение антитела или полипептида, который специфично связывается с пептидом Aβ, может быть осуществлено любыми способами, известными в данной области, включая: внутривенное, подкожное, ингаляционное, внутриартериальное, внутримышечное, внутрисердечное, внутрижелудочковое, парентеральное, интратекальное и внутрибрюшинное введение. Введение может быть осуществлено с помощью инъекции и/или системно, например внутривенно, или локально. В общем, указанное также применимо к полипептидам и полинуклеотидам согласно изобретению.
Изобретение также относится к способам лечения глазной болезни посредством введения фармацевтической композиции, содержащей эффективное количество любого из антител или полипептидов, которые специфично связываются с пептидом Aβ или агрегированной формой пептида Aβ и имеют нарушенную эффекторную функцию, или полинуклеотидов, кодирующих антитела или полипептиды, и фармацевтически приемлемый эксципиент.
Изобретение также относится к наборам и композициям, содержащим любую одну или несколько композиций, содержащих эффективное количество любого из антител или полипептидов, которые специфично связываются с пептидом Aβ или агрегированной формой пептида Aβ, или полинуклеотидов, кодирующих антитела или полипептиды. Указанные наборы, как правило, находящиеся в подходящей упаковке и снабженные соответствующими инструкциями, применимы для любого из способов, описанных в настоящей публикации.
Изобретение также относится к способу получения терапевтического гуманизированного антитела для лечения заболевания, связанного с амилоидными отложениями пептида Aβ в головном мозге человека, включающему в себя отбор первого гуманизированного антитела, которое специфично связывается с пептидом Aβ; и изменение Fc-области антитела, чтобы получить терапевтическое гуманизированное антитело, имеющее нарушенную эффекторную функцию по сравнению с первым гуманизированным антителом.
Другой вариант осуществления настоящего изобретения относится к способу профилактики или восстановления функции сетчатки у субъекта, включающему в себя введение субъекту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора Aβ. В одном варианте ингибитор представляет собой антитело, антисмысловую молекулу, молекулу миРНК, рибозим или низкомолекулярное соединение.
Другой вариант осуществления настоящего изобретения относится к способу профилактики или восстановления остроты зрения у субъекта, включающему в себя введение терапевтически эффективного количества ингибитора Aβ.
В одном аспекте приведенных выше вариантов указанные выше способы применяют для субъектов, которые не подвергаются также лечению в связи с болезнью Альцгеймера, синдромом Дауна или церебральной амилоидной ангиопатией.
В указанных выше способах согласно изобретению применяют ингибитор Aβ, который представляет собой антитело. В одном аспекте изобретение, раскрытое в настоящем описании, относится к антителам, которые связываются с C-концом пептида Aβ1-40 (SEQ ID NO: 15, показанная в таблице 4). Соответственно в одном аспекте способы включают в себя лечение антителом 9TL (взаимозаменяемо называемым «9TL»), которое продуцируется экспрессирующими векторами, имеющими номера доступа ATCC. PTA-6124 и PTA-6125. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи 9TL показаны на фигуре 1. Части антитела 9TL в виде определяющих комплементарных областей (CDR) (включая CDR согласно Chothia и Kabat) также показаны на фигуре 1. Понятно, что ссылка на любую часть или полную область 9TL охватывает последовательности, продуцируемые экспрессирующими векторами, имеющими номера доступа ATCC PTA-6124 и PTA-6125, и/или последовательности, изображенные на фигуре 1.
В другом аспекте изобретение включает в себя введение вариантов антитела 9TL с аминокислотными последовательностями, изображенными в таблице 3.
В другом аспекте изобретение включает в себя введение антитела, содержащего фрагмент или область антитела 9TL, или его вариантов, показанных в таблице 3. В одном варианте фрагмент представляет собой легкую цепь антитела 9TL. В другом варианте фрагмент представляет собой тяжелую цепь антитела 9TL. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи, показанных на фигуре 1. В еще одном варианте фрагмент содержит одну или несколько CDR из легкой цепи и/или тяжелой цепи антитела 9TL.
В другом аспекте изобретение включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько CDR антитела 9TL или его вариантов, показанных в таблице 3; b) CDR H3 из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; c) CDR L3 из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; d) три CDR из легкой цепи антитела 9TL или его вариантов, показанных в таблице 3; e) три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3; f) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 9TL или его вариантов, показанных в таблице 3. Изобретение, кроме того, относится к введению полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну из несколько из следующих частей: a) одну или несколько (одну, две, три, четыре, пять или шесть) CDR, полученных из антитела 9TL или его вариантов, показанных в таблице 3; b) CDR, полученную из CDR H3 из тяжелой цепи антитела 9TL; и/или c) CDR, полученную из CDR L3 из легкой цепи антитела 9TL. В некоторых вариантах CDR представляет собой CDR, показанную на фигуре 1. В некоторых вариантах одна или несколько CDR, полученных из антитела 9TL или его вариантов, показанных в таблице 3, по меньшей мере примерно на 85%, по меньшей мере примерно на 86%, по меньшей мере примерно на 87%, по меньшей мере примерно на 88%, по меньшей мере примерно на 89%, по меньшей мере примерно на 90%, по меньшей мере примерно на 91%, по меньшей мере примерно на 92%, по меньшей мере примерно на 93%, по меньшей мере примерно на 94%, по меньшей мере примерно на 95%, по меньшей мере примерно на 96%, по меньшей мере примерно на 97%, по меньшей мере примерно на 98% или по меньшей мере примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 9TL или его вариантов.
В другом аспекте изобретение включает в себя введение антитела 6G (взаимозаменяемо называемого «6G»). Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи 6G показаны на фигуре 8. Части антитела 6G в виде определяющих комплементарность областей (CDR) (включая CDR Chothia и Kabat) также показаны на фигуре 8.
В другом аспекте изобретение включает в себя введение вариантов антитела 6G с аминокислотными последовательностями, изображенными в таблице 8.
В другом аспекте изобретение включает в себя введение антитела, содержащего фрагмент или область антитела 6G или его вариантов, показанных в таблице 8. В одном варианте фрагмент представляет собой легкую цепь антитела 6G. В другом варианте фрагмент представляет собой тяжелую цепь антитела 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи, показанных на фигуре 8. В еще одном варианте фрагмент содержит одну или несколько CDR из легкой цепи и/или тяжелой цепи антитела 6G.
В другом аспекте изобретение включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько CDR антитела 6G или его вариантов, показанных в таблице 8; b) CDR H3 из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; c) CDR L3 из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; d) три CDR из легкой цепи антитела 6G или его вариантов, показанных в таблице 8; e) три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8; f) три CDR из легкой цепи и три CDR из тяжелой цепи антитела 6G или его вариантов, показанных в таблице 8. Изобретение, кроме того, включает в себя введение полипептидов (которые могут представлять собой антитело или не являются антителом), содержащих любую одну или несколько из следующих частей: a) одну или несколько (одну, две, три, четыре, пять или шесть) CDR, полученных из антитела 6G или его вариантов, показанных в таблице 8; b) CDR, полученную из CDR H3 из тяжелой цепи антитела 6G; и/или c) CDR, полученную из CDR L3 из легкой цепи антитела 6G. В некоторых вариантах CDR представляет собой CDR, показанную на фигуре 8. В некоторых вариантах одна или несколько CDR, полученных из антитела 6G или его вариантов, показанных в таблице 8, по меньшей мере, примерно на 85%, по меньшей мере, примерно на 86%, по меньшей мере, примерно на 87%, по меньшей мере, примерно на 88%, по меньшей мере, примерно на 89%, по меньшей мере, примерно на 90%, по меньшей мере, примерно на 91%, по меньшей мере, примерно на 92%, по меньшей мере, примерно на 93%, по меньшей мере, примерно на 94%, по меньшей мере, примерно на 95%, по меньшей мере, примерно на 96%, по меньшей мере, примерно на 97%, по меньшей мере, примерно на 98% или, по меньшей мере, примерно на 99% идентичны, по меньшей мере одной, по меньшей мере двум, по меньшей мере трем, по меньшей мере четырем, по меньшей мере пяти или по меньшей мере шести CDR 6G или его вариантов.
В следующем аспекте изобретение включает в себя введение антитела, содержащего вариабельную область тяжелой цепи, содержащую три CDR из вариабельной области тяжелой цепи антитела 6G, показанной в последовательности SEQ ID NO: 26, и вариабельную области легкой цепи, содержащую три CDR из вариабельной области легкой цепи антитела 6G, показанной в последовательности SEQ ID NO: 27. В другом аспекте изобретение включает в себя введение антитела, содержащего вариабельную область тяжелой цепи, содержащую три CDR, показанных в последовательностях SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30, и вариабельную область легкой цепи, содержащую три CDR, показанных в последовательностях SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33. В еще одном аспекте изобретение относится к вариабельной области тяжелой цепи, содержащей аминокислотную последовательность, показанную в SEQ ID NO: 26, и вариабельной области легкой цепи, содержащей аминокислотную последовательность, показанную в SEQ ID NO: 27. В еще одном аспекте изобретение относится к аминокислотной последовательности тяжелой цепи, показанной в SEQ ID NO: 36, и аминокислотной последовательности легкой цепи, показанной в SEQ ID NO: 37.
В некоторых вариантах CDR представляют собой CDR согласно Kabat. В других вариантах CDR представляют собой CDR согласно Chothia. В других вариантах CDR представляют собой сочетание CDR согласно Kabat и Chothia (также называемые «комбинированными CDR» или «расширенными CDR»). Другими словами, в случае любого данного варианта, содержащего более одной CDR, CDR могут быть CDR согласно Kabat, согласно Chothia и/или являются их сочетанием.
В некоторых вариантах полипептид (такой как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 5, где L1 означает L, V или I; где Y2 означает Y или W; где S3 означает S, T или G; где L4 означает L, R, A, V, S, T, Q или E; где V6 означает V, I, T, P, C, Q, S, N или F и где Y7 означает Y, H, F, W, S, I, V или A. В некоторых вариантах аминокислотная последовательность представляет собой CDR3 в вариабельной области тяжелой цепи. Для удобства в настоящем описании «означает» в контексте или по отношению к аминокислоте относится к выбору аминокислоты (аминокислот) для данного положения, имея в виду положение в последовательности. Например, «L1 означает L, V или I» относится к аминокислоте L в положении 1 в последовательности SEQ ID NO: 5, которая может быть заменена V или I.
В некоторых вариантах полипептид (такой, как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 6, где Y8 означает Y, A или H; где A11 означает A или S и где K12 означает K или A. В некоторых вариантах аминокислотная последовательность представляет собой CDR1 в вариабельной области легкой цепи.
В некоторых вариантах полипептид (такой, как антитело) содержит аминокислотную последовательность, показанную в SEQ ID NO: 8, где L1 означает L, M, N, C, F, V, K, S, Q, G, S; где G3 означает G, S или T; где T4 означает T или S; где H5 означает H или L; где Y6 означает Y, P, A, W, Q, M, S или E; где V8 означает V, L, K, H, T, A, E или M и где L9 означает L, I, T, S или V. В некоторых вариантах аминокислотная последовательность представляет собой CDR3 в вариабельной области легкой цепи.
В некоторых вариантах полипептид (такой, как антитело) содержит вариабельную область тяжелой цепи, содержащую (a) область CDR1, показанную в SEQ ID NO: 3; (b) область CDR2, показанную в SEQ ID NO: 4; и (c) область CDR3, показанную в SEQ ID NO: 5, где L1 означает L, V или I; где Y2 означает Y или W; где S3 означает S, T или G; где L4 означает L, R, A, V, S, T, Q или E; где V6 означает V, I, T, P, C, Q, S, N или F и где Y7 означает Y, H, F, W, S, I, V или A.
В некоторых вариантах полипептид (такой, как антитело) содержит вариабельную область легкой цепи, содержащую (a) область CDR1, показанную в SEQ ID NO: 6, где Y8 означает Y, A или H; где A11 означает A или S; где K12 означает K или A; (b) область CDR2, показанную в SEQ ID NO: 7; и (c) область CDR3, показанную в SEQ ID NO: 8, где L1 означает L, M, N, C, F, V, K, S, Q, G, S; где G3 означает G, S или T; где T4 означает T или S; где H5 означает H или L; где Y6 означает Y, P, A, W, Q, M, S или E; где V8 означает V, L, K, H, T, A, E или M и где L9 означает L, I, T, S или V.
В некоторых вариантах антитело согласно изобретению является человеческим антителом. В других вариантах антитело согласно изобретению является гуманизированным антителом. В некоторых вариантах антитело является моноклональным. В некоторых вариантах антитело (или полипептид) является изолированным. В некоторых вариантах антитело (или полипептид) является по существу очищенным.
Константная область тяжелой цепи антител может быть константной областью из любого типа, такого как IgG, IgM, IgD, IgA и IgE; и любого изотипа, такого как IgG1, IgG2, IgG3 и IgG4.
В некоторых вариантах антитело содержит модифицированную константную область, такую как константная область, которая иммунологически инертна (включая частично иммунологически инертную, и термин используют взаимозаменяемо с термином «имеющая нарушенную эффекторную функцию»), например не запускает опосредованный комплементом лизис, не стимулирует зависимую от антител опосредованную клетками цитотоксичность (ADCC) или не активирует микроглию. В некоторых вариантах константную область модифицируют, как описано в Eur. J. Immunol. (1999) 29: 2613-2624; заявке PCT № PCT/GB99/01441 и/или заявке на выдачу патента Великобритании № 9809951.8. В других вариантах антитело содержит константную область тяжелой цепи IgG2a человека, содержащую следующие мутации: A330P331 → S330S331 (нумерация аминокислот в соответствии с последовательностью IgG2 дикого типа). Eur. J. Immunol. (1999) 29: 2613-2624. В некоторых вариантах антитело содержит константную область IgG4, содержащую следующие мутации: E233F234L235 → P233V234A235. Что касается N-связанного гликозилирования, то в следующих вариантах константная область не гликозилирована. В некоторых вариантах константная область не гликозилирована в результате N-связанного гликозилирования благодаря мутации остатка, с которым связывается олигосахарид (такого как Asn297), и/или фланкирующих остатков, которые являются частью последовательности узнавания при N-гликозилировании в константной области. В некоторых вариантах константная область не гликозилирована в результате N-связанного гликозилирования. Константная область может не иметь N-связанного гликозилирования либо под действием ферментов, либо в результате экспрессии в клетке-хозяине, дефицитной по гликозилированию.
В другом аспекте изобретение относится к полинуклеотиду (который может быть изолированным), содержащему полинуклеотид, кодирующий фрагмент или область антитела 9TL или 6G или их вариантов, показанных в таблице 3 и таблице 8. В одном варианте фрагмент представляет собой легкую цепь антитела 9TL или 6G. В другом варианте фрагмент представляет собой тяжелую цепь антитела 9TL или 6G. В еще одном варианте фрагмент содержит одну или несколько вариабельных областей из легкой цепи и/или тяжелой цепи антитела 9TL или 6G. В еще одном варианте фрагмент содержит одну или несколько (т.н. одну, две, три, четыре, пять, шесть) определяющих комплементарность областей (CDR) из легкой цепи и/или тяжелой цепи антитела 9TL или 6G.
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ИЗОБРАЖЕНИЙ НА ФИГУРАХ
На фигуре 1 показана аминокислотная последовательность вариабельной области тяжелой цепи (SEQ ID NO: 1) и вариабельной области легкой цепи (SEQ ID NO: 2) антитела 9TL. CDR согласно определению Kabat показаны жирным шрифтом, а CDR согласно определению Chothia подчеркнуты. Аминокислотные остатки вариабельной области тяжелой цепи и легкой цепи пронумерованы последовательно.
На фигуре 2 показано картирование эпитопов антитела 9TL способом, основанным на конкуренции пептидов. Пептид Aβ1-40 иммобилизовали на чипе SA. Моноклональное антитело 2289 и Fab-фрагмент 9TL (50 нМ каждого), каждое из которых предварительно инкубировали в течение 1 часа с 10 мкМ различных пептидов (аминокислоты 28-40, 1-40, 1-28, 28-42, 22-35, 1-16, 1-43, 33-40, 1-38 или 17-40 Aβ) или без пептида, затем подавали на чип. Измеряли связывание Fab-фрагмента антитела с иммобилизованным пептидом Aβ1-40.
Фигура 3 представляет собой график, на котором показано картирование эпитопов антитела 2H6 способом, основанным на конкуренции пептидов. Пептид Aβ1-40 иммобилизовали на чипе SA. Моноклональное антитело 2289, 2286 или 2H6 (100 нМ каждого), каждое из которых предварительно инкубировали в течение 1 часа с 16 мкм разных пептидов (аминокислоты 1-16, 1-28, 1-38, 1-40, 1-42, 1-43, 17-40, 17-42, 22-35, 25-35 или 33-40 Aβ) или без пептида, подавали на чип. Измеряли связывание антитела с иммобилизованным пептидом Aβ1-40.
Фигура 4 представляет собой график, на котором показано связывание антитела 2H6, 2286, и 2289 с разными C-концевыми вариантами пептида Aβ. Варианты GST-Aβ (M35A, V36A, G37A, G38A, V39A, или V40A) или пептид GST-Aβ 1-39, 1-41, 1-40, 1-42 иммобилизовали на планшете для ELISA. Моноклональное антитело 2286, 2H6, или 2289 (0,3 нМ каждого mAb) инкубировали с каждым из иммобилизованных пептидов и их связывание регистрировали при последующей инкубации с биотинилированным антителом против IgG мыши (H+L) и затем со стрептавидином-HRP.
На фигуре 5 показан график интенсивности a- и b-волн (A) и электроретинограммы образца (B), полученного от стареющих мышей с изоформой аполипопротеина E4 (APOE4) на нормальной диете по сравнению с диетой с высоким содержанием жира и холестерина.
На фигуре 6 показан график интенсивности только b-волн у мышей APOE4, отложенный против данных из предыдущих исследований животных, находящихся на нормальной диете. Кривая R2 показывает защиту или восстановление функции сетчатки в случае обработки ВМД-подобных мышей (E4-HFC-R2) анти-Aβ-антителом.
На фигуре 7 показана общая иммуногистохимия Aβ в головном мозге ВМД-подобной (APOE4) мыши. На предметном стекле A (ВМД-подобная мышь, обработанная анти-Aβ-антителом) показан негативный результат определения амилоида. На предметных стеклах B, C и D (ВМД-подобная мышь, обработанная с использованием инъекции наполнителя) показан позитивный результат определения амилоида. Предметное стекло E для позитивного контрольного образца, взятого из головного мозга мыши в случае мышиной модели с полученным из тромбоцитов APP (pdAPP, мутантный (V717F) APP человека под контролем промотора тромбоцитарного фактора роста (Games, D. et al, Nature 373: 523-527 (1995)).
На фигуре 8 показана аминокислотная последовательность вариабельной области тяжелой цепи (SEQ ID NO: 1) и вариабельной области легкой цепи (SEQ ID NO: 27) антитела 6G. CDR согласно определению Kabat показаны жирным шрифтом, а CDR согласно определению Chothia подчеркнуты. Аминокислотные остатки вариабельной области тяжелой цепи и легкой цепи пронумерованы последовательно.
На фигуре 9 показано картирование эпитопов антитела 6G, осуществляемое с помощью ELISA. Пептиды Aβ (1-16, 1-28, 17-40, 17-42, 22-35, 28-40, 28-42, 1-38, 1-40, 1-42, 1-43 и 33-40) иммобилизовали на чашках для ELISA. Моноклональное антитело 6G (20 нМ) инкубировали в течение 1 часа с разными иммобилизованными пептидами. Антитело 6G, связанное с иммобилизованными пептидами Aβ, измеряли, используя второе антитело козы против цепи каппа человека, конъюгированное с HRP.
На фигуре 10 показано картирование эпитопов антитела 6G с помощью ELISA. Различные пептиды Aβ иммобилизовали на чашках для ELISA. Антитело 6G инкубировали в течение 1 часа с различными иммобилизованными пептидами. Антитело 6G, связанное с иммобилизованными пептидами Aβ, измеряли, используя второе антитело козы против цепи каппа человека, конъюгированное с HRP. «NB» означает, что связывание не выявлено.
Фигура 11 представляет собой схематичный график, показывающий эпитоп, с которым антитело 6G связывается на Aβ. Показаны относительные положения Aβ в белке-предшественнике амилоида (APP) и часть APP в клеточной мембране. «CT99» относится к C-концевым 99 аминокислотам APP.
На фигуре 12 представлена фотография, показывающая иммунное окрашивание клеток, экспрессирующих APP, моноклональным антителом, направленным к Aβ1-16 (m2324), и антителом 6G. На верхних панелях показаны клетки, видимые в флуоресцентном микроскопе, после инкубации клеток с m2324 или 6G (5 мкг/мл каждого), и связывание выявляли с помощью второго конъюгированного с Cy3 антитела козы против Ig мыши или Ig человека. На нижних панелях показаны клетки, наблюдаемые под микроскопом.
Фигура 13 представляет собой график интенсивности только b-волн для пяти исследуемых групп мышей APOE4: контрольные мыши APOE4 на обычной диете; контрольные мыши APOE4 на диете с высоким содержанием жира и холестерина («HFC») (ВМД-подобная модель); мыши APOE4-HFC, обработанные 7G10; мыши APOE4-HFC, обработанные 2H6; и мыши APOE4-HFC, обработанные 6G.
Фигура 14 представляет собой график интенсивности только b-волн для трех исследованных групп мышей APOE4: контрольные мыши APOE4 на обычной диете; контрольные мыши APOE4-HFC и мыши APOE4-HFC, обработанные 6G.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Мышиная модель ВМД способствовала проверке гипотезы о том, что без какой-либо связи с теорией нарушение регуляции транспорта липидов и амилоидные отложения могут вносить вклад в патогенез наблюдаемых изменений сетчатки при возрастной макулярной дегенерации, глаукоме, диабетической ретинопати