Полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, полинуклеотид, кодирующий его, композиция и набор, содержащие данный полипептид
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению ингибиторов адгезии и/или агрегации тромбоцитов, и может быть использовано в медицине. Рекомбинантным путем с использованием матрицы кДНК слюнной железы Anopheles stephensi получают полипептид, который используют в составе фармацевтической композиции и в наборах для скрининга ингибиторов адгезии или агрегации тромбоцитов. Изобретение позволяет получить полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов. 6 н. и 4 з.п. ф-лы, 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к полипептиду, обладающему ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, или фармацевтической композиции, например ингибирующей агрегацию тромбоцитов композиции, содержащей в качестве активного компонента экспрессированный продукт (рекомбинантный полипептид), экспрессируемый кодирующим указанный полипептид полинуклеотидом.
Кроме того, настоящее изобретение относится к полипептиду, обладающему способностью связываться с коллагеном, или фармацевтической композиции, содержащей в качестве активного компонента указанный полипептид.
Настоящее изобретение также относится к способу скринирования соединения (например, агониста), содействующего ингибиторной активности в отношении агрегации тромбоцитов, в качестве активного компонента фармацевтической композиции. Кроме того, настоящее изобретение относится к новому полипептиду, обладающему ингибиторной активностью в отношении агрегации тромбоцитов, и к кодирующему его полинуклеотиду.
УРОВЕНЬ ТЕХНИКИ
Тромбоциты агрегируют вследствие повреждения эндотелиальных клеток сосудов и различных других факторов. Окклюзия тромбоцитарным тромбом коронарного сосуда, церебрального сосуда или периферического сосуда является причиной инфаркта миокарда, инфаркта головного мозга или хронической обструкции артерий соответственно. Примеры тромботических заболеваний, которые следуют за такой активацией (стимуляцией агрегации) тромбоцитов, включают склероз артерий, ишемический инфаркт головного мозга, ишемические заболевания сердца, в том числе инфаркт миокарда и стенокардия, хроническую обструкцию артерий и тромбоз вен.
Ингибирующие агрегацию тромбоцитов лекарственные средства используют в качестве лекарственных средств для профилактики ишемических нарушений, сопровождающих вышеуказанные различные заболевания в виде осложнений, и в качестве лекарственных средств для профилактики патологических состояний после гипертензии, легочной гипертезии, инфаркта головного мозга, инфаркта легкого и субарахноидального кровоизлияния. Кроме того, вышеуказанные лекарственные средства используют для профилактики образования тромбов при чрескожной транслюминальной коронарной ангиопластике (ЧТКА) и размещении стента, а также используют в качестве агентов для профилактики рестеноза после размещения стента путем включения с помощью нанесения на стент или заделывания в него такого лекарственного средства, ингибирующего агрегацию тромбоцитов.
Между тем, комар прокалывает кожу с помощью челюстей ротового аппарата, выполняющих функцию иглы, достигающих периферического кровеносного сосуда во время сосания крови, и для обнаружения периферического кровеносного сосуда часто повторяет поведение в виде прокалывания и извлечения челюстей, на которое делается ссылка как на «зондирование». Полагают, что одновременно комар секретирует слюну, содержащую содействующее вазодилатации вещество, для облегчения обнаружения кровеносного сосуда. Вследствие вышеуказанного зондирования периферический кровеносный сосуд часто повреждается, становясь застойным. Как правило, при повреждении кровеносного сосуда коллаген ткани под эндотелием сосудов становится незащищенным, из разрушенных клеток высвобождается аденозиндифосфат (АДФ), и активируются факторы свертывания с образованием тромбина. Тромбин сильно активирует тромбоциты с индуцированием адгезии тромбоцитов, агрегации тромбоцитов и высвобождением гранул и, в конечном счете, приводит к образованию стойкого тромба посредством свертывания крови с образованием фибрина (механизма гемостаза). Известно, что слюна комара содержит вещество, которое ингибирует такой механизм гемостаза (см. непатентный документ 1).
Самым изученным белком слюнной железы комара является апираза. Этот фермент является ингибирующим агрегацию тромбоцитов веществом, впервые идентифицированным в слюне Aedes aegypti. Приводя к разложению АДФ, высвобождаемого из поврежденных эндотелиальных клеток сосудов, эритроцитов и адгезированных тромбоцитов, до АМФ (аденозинмонофосфата), апираза ингибирует агрегацию тромбоцитов и проявляет антигемостатическое действие. Для объяснения поведения различных являющихся вампирами насекомых помимо комара, по-видимому, является существенным анализ функции веществ их слюны.
Предсказывается, что ряд веществ слюны вовлечен в ингибирование агрегации тромбоцитов, и сообщалось, например, о ингибиторной активности в отношении агрегации тромбоцитов белка, полученного из Triatoma infestans (патентные документы 1 и 2).
Среди получаемых из слюнной железы белков Anopheles stephensi идентифицировали белок, обладающий ингибиторной активностью в отношении свертывания крови, но не был идентифицирован белок, обладающий ингибиторной активностью в отношении агрегации тромбоцитов (см. патентный документ 3).
Кроме того, сообщалось о 33 новых белках при клонировании библиотеки кДНК слюнной железы Anopheles stephensi, но в сообщении не описывается белок, обладающий ингибиторной активностью в отношении агрегации тромбоцитов (см. непатентный документ 2).
Авторы настоящего изобретения ранее сообщали о белке (ААРР), имеющем GE (Gly Glu)-богатую последовательность, клонированную из слюнной железы Anopheles stephensi (см. непатентный документ 3). Белок кодируется открытой рамкой считывания (ORF) из 810 п.о. и является белком с М.м. 28,5 кДа, состоящим, по расчетам, из 269 аминокислотных остатков. Впоследствии обнаружено, что этот белок схож с антигеном с М.м. 30 кДа (номер доступа в GenBank - AY226454), раскрытым в непатентном документе 2, однако в непатентных документах 2 и 3 не описываются эффекты и функции белка.
[Патентный документ 1] JP 2004-121091-A
[Патентный документ 2] JP 2004-121086-A
[Патентный документ 3] JP 2003-116573-A
[Непатентный документ 1] Riberio, J.M., J. Exp. Biol., 108, 1-7 (1984)
[Непатентный документ 2] Valenzuela, J.G., et al., "Exploring the salivary gland transcriptome and proteome of the Anopheles stephensi mosquito", Insect Biochemistry
[Непатентный документ 3] Hiroyuki Watanabe et al., Medical Entomology and Zoology 55 Suppl., pp 41, 19 (2004).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящим изобретением обеспечивается новая фармацевтическая композиция, в частности ингибитор агрегации тромбоцитов и/или ингибитор адгезии тромбоцитов.
Настоящим изобретением, кроме того, обеспечивается новая фармацевтическая композиция, содержащая в качестве активного компонента белок, обладающий способностью связываться с коллагеном.
Настоящим изобретением также обеспечивается способ скринирования вещества, такого как агонист, с помощью которого определяется ингибиторная активность в отношении агрегации тромбоцитов и/или ингибиторная активность в отношении адгезии тромбоцитов вещества.
В результате дополнительного обширного исследования, в дополнение к изучению белка (ААРР), о котором ранее сообщалось авторами настоящего изобретения, последние обнаружили новый белок, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, в слюнной железе Anopheles stephensi, успешно выделили и идентифицировали ДНК, кодирующую этот белок, и недавно обнаружили, что белок обладает ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
Настоящее изобретение характеризуется признаками, содержащимися в следующих пунктах 1-14.
Пункт 1. Фармацевтическая композиция, содержащая в качестве активного компонента по меньшей мере один из следующих полипептидов (а)-(d):
(а) полипептид, включающий аминокислотную последовательность SEQ ID NO: 1;
(b) полипептид, включающий аминокислотную последовательность, включающую одну или несколько делеций, вставок, замен или добавлений аминокислот в аминокислотной последовательности вышеуказанного полипептида (а), и обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов;
(с) полипептид, включающий аминокислотную последовательность SEQ ID NO: 3; и
(d) полипептид, включающий аминокислотную последовательность, включающую одну или несколько делеций, вставок, замен или добавлений аминокислот в аминокислотной последовательности вышеуказанного полипептида (c), и обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
Пункт 2. Фармацевтическая композиция, содержащая в качестве активного компонента экспрессированный продукт, который экспрессируется по меньшей мере одним из следующих полинуклеотидов (е)-(j):
(е) полинуклеотидом, включающим ДНК-последовательность SEQ ID NO: 2 или ее комплемент;
(f) полинуклеотидом, который гибридизуется в жестких условиях с вышеуказанным полинуклеотидом (е) и способен экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов;
(g) полинуклеотидом, включающим ДНК-последовательность, гомологичную вышеуказанному полинуклеотиду (е) на 80% или больше, и способным экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов;
(h) полинуклеотидом, включающим ДНК-последовательность SEQ ID NO: 4 или ее комплемент;
(i) полинуклеотидом, который гибридизуется в жестких условиях с вышеуказанным полинуклеотидом (h) и способен экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов;
(j) полинуклеотидом, включающим ДНК-последовательность, гомологичную вышеуказанному полинуклеотиду (h) на 80% или больше, и способным экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
Пункт 3. Фармацевтическая композиция в соответствии с пунктом 1 или 2, в которой указанной ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов является ингибиторная активность в отношении агрегации тромбоцитов, индуцированной коллагеном, и/или ингибиторная активность в отношении адгезии тромбоцитов к коллагену.
Пункт 4. Фармацевтическая композиция в соответствии с пунктом 1 или 2, обладающая способностью связываться с коллагеном.
Пункт 5. Ингибитор агрегации тромбоцитов и/или ингибитор адгезии тромбоцитов, содержащий полипептид, описанный в пункте 1, или экспрессированный продукт, который экспрессируется полинуклеотидом, описанным в пункте 2.
Пункт 6. Способ скринирования агониста ингибиторной активности в отношении агрегации тромбоцитов и/или ингибиторной активности в отношении адгезии тромбоцитов, в котором уровень ингибиторной активности в отношении агрегации тромбоцитов и/или ингибиторной активности в отношении адгезии тромбоцитов полипептида, описанного в пункте 1, измеряют в присутствии или отсутствие исследуемого вещества, и величину, измеренную в присутствии исследуемого вещества, сравнивают с величиной, измеренной в отсутствии исследуемого вещества, для отбора исследуемого вещества, которое увеличивает ингибиторный эффект, в качестве агониста.
Пункт 7. Способ скринирования агониста ингибиторной активности в отношении агрегации тромбоцитов и/или ингибиторной активности в отношении адгезии тромбоцитов, в котором уровень ингибиторной активности экспрессированного продукта, который экспрессируется описанным в пункте 2 полинуклеотидом, измеряют в присутствии или отсутствие исследуемого вещества, и величину, измеренную в присутствии исследуемого вещества, сравнивают с величиной, измеренной в отсутствии исследуемого вещества, для отбора исследуемого вещества, которое увеличивает ингибиторную активность в отношении агрегации тромбоцитов и/или ингибиторную активность в отношении адгезии тромбоцитов, в качестве агониста.
Пункт 8. Способ скринирования вещества-кандидата, являющегося агонистом ингибиторной активности в отношении агрегации тромбоцитов и/или ингибиторной активности в отношении адгезии тромбоцитов полипептида, описанного в пункте 1, или экспрессированного продукта, описанного в пункте 2, который включает следующие стадии (1)-(4):
(1) стадию приготовления культуральной среды, содержащей клетку, трансформированную экспрессирующим вектором, который экспрессирует описанный в пункте 1 полипептид, или клетку, включающую описанный в пункте 2 экспрессированный продукт, и богатую в отношении тромбоцитов плазму;
(2) стадию добавления агрегирующего тромбоциты агента в культуральную среду вышеуказанной стадии (1) для индуцирования агрегации тромбоцитов в присутствии или отсутствие исследуемого вещества;
(3) стадию измерения уровня агрегации тромбоцитов в присутствии или отсутствие исследуемого вещества на вышеуказанной стадии (2); и
(4) стадию отбора исследуемого вещества в качестве вещества-кандидата, когда величина, измеренная в присутствии исследуемого вещества, больше величины, измеренной в отсутствии исследуемого вещества.
Пункт 9. Набор для скрининга агониста полипептида, описанного в пункте 1, или экспрессированного продукта, который экспрессируется описанным в пункте 2 полинуклеотидом, отличающийся тем, что в качестве компонентов он содержит богатую в отношении тромбоцитов плазму, один из полипептидов, описанных в пункте 1, и экспрессированный продукт, описанный в пункте 2, и агент, агрегирующий тромбоциты.
Пункт 10. Выделенный полипептид, включающий аминокислотную последовательность SEQ ID NO: 1.
Пункт 11. Выделенный полипептид, включающий аминокислотную последовательность SEQ ID NO: 3.
Пункт 12. Выделенный полипептид, включающий аминокислотную последовательность SEQ ID NO: 5.
Пункт 13. Полинуклеотид, включающий ДНК-последовательность SEQ ID NO: 2 или ее комплемент.
Пункт 14. Полинуклеотид, включающий ДНК-последовательность SEQ ID NO: 4 или ее комплемент.
Пункт 15. Полинуклеотид, включающий ДНК-последовательность SEQ ID NO: 6 или ее комплемент.
На вышеуказанный по меньшей мере один полипептид (белок) (а)-(d) иногда дается ниже ссылка в виде "SY-001". На экспрессированный продукт вышеуказанного по меньшей мере одного полинуклеотида (е)-(j) иногда дается ниже ссылка в виде "экспрессированный продукт настоящего изобретения".
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
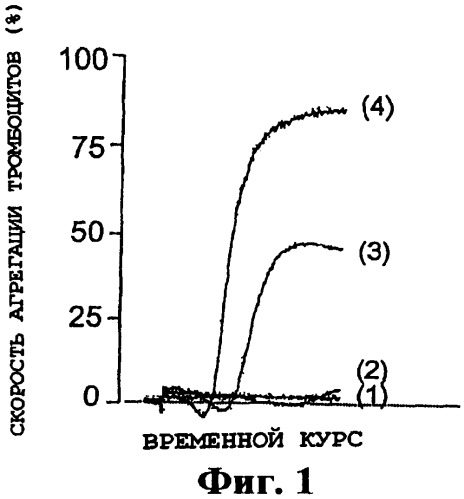
На фиг.1 демонстрируется ингибиторная активность SY-001, продуцированного в примере 1, 3(1), в отношении агрегации тромбоцитов, индуцированной коллагеном.
На фиг.2 демонстрируется ингибиторная активность SY-001, продуцированного в примере 1, 3(2), в отношении агрегации тромбоцитов, индуцированной коллагеном.
На фиг.3 демонстрируется ингибиторная активность в отношении агрегации тромбоцитов SY-001, продуцированного в примерах 1 и 3, который ингибирует адгезию тромбоцитов к коллагену.
На фиг.4 демонстрируется, что SY-001, продуцированный в примерах 1 и 3, обладает способностью связываться с коллагеном.
ЛУЧШИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Представленные здесь сокращения аминокислот, пептидов, последовательностей оснований и нуклеиновых кислот находятся в соответствии с биологической номенклатурой IUPAC-IUB, Eur. J. Biochem., 138: 9 (1984), определенной IUPAC-IUB, "Guideline for preparing specifications comprising base sequences and amino acid sequences" (Патентное ведомство), и обычно используемыми в данной области техники обозначениями.
Полинуклеотид (молекула ДНК) здесь включает не только двухцепочечную ДНК, но также одноцепочечную ДНК, в том числе смысловые цепи и антисмысловые цепи, которые их составляют, и не ограничивается своей длиной. Следовательно, кодирующий SY-001 полинуклеотид включает двухцепочечную ДНК, в том числе геномную ДНК, и одноцепочечную ДНК (смысловую цепь), в том числе кДНК, и одноцепочечную ДНК (антисмысловую цепь), имеющую последовательность, комплементарную смысловой цепи, и их синтетические ДНК-фрагменты, если не упоминается иное.
Полинуклеотид (молекула ДНК) здесь не определяется функциональным районом и может включать по меньшей мере один из следующих районов: супрессирирующий экспрессию район, кодирующий район, лидерную последовательность, экзон и интрон.
Полинуклеотид также включает РНК и ДНК. Полипептид, включающий определенную аминокислотную последовательность, и полинуклеотид, включающий определенную ДНК-последовательность, включают их фрагменты, гомологи, производные и мутанты.
Мутанты полинуклеотида (мутантная ДНК) включают встречающиеся в природе аллельные мутанты, не встречающиеся в природе мутанты и мутанты, имеющие делецию, замену, добавление и вставку. Но эти мутанты кодируют полипептид, обладающий по существу той же самой функцией, что и функция полипептида, кодируемого полинуклеотидом до мутации.
Мутация полипептида (модификация аминокислотной последовательности) необязательно происходит посредством встречающейся в природе, например, мутации или посттрансляционной модификации и может быть мутацией, искусственно произведенной при использовании встречающегося в природе белка (например, SY-001). Вышеуказанные мутанты полипептида включают аллельные варианты, гомологи и встречающиеся в природе мутанты, гомологичные полипептиду до мутации по меньшей мере на 80%, предпочтительно на 95% и более предпочтительно на 99%.
Гомологию полипептида или полинуклеотида можно проанализировать при измерении с использованием программы FASTA (Clustal, V., Methods Mol. Biol., 25, 307-318 (1994)). В качестве примера наиболее предпочтительного и простого метода анализа гомологи можно привести метод, при котором последовательность хранят на носителе (например, гибком диске, компакт-диске, накопителе на жестком диске, накопителе на диске для внешней связи, цифровом видео-диске и т.п.), способном считываться компьютером, и затем базы данных известных последовательностей подвергают поиску в соответствии с хорошо известной процедурой поиска с использованием сохраненной последовательности. Конкретные примеры баз данных известных последовательностей включают следующее:
- База данных ДНК Японии (DDBJ) (http://www/ddbj,nig.ac.jp/);
- Genebank (http://www.ncbi.nlm.nih.gov/web/Genebank./Index.htlm); и
- База данных последовательностей нуклеиновых кислот Европейской лаборатории молекулярной биологии (EMBL) (http://ebi.ac/uk/ebi docs/embl db.html).
Большинство алгоритмов поиска для анализа гомологии доступны квалифицированным в данной области техники специалистам. Один их пример включает программу, на которую дается ссылка в виде программы BLAST. В этой программе существует 5 BLAST-процедур. Среди них три (BLASTN, BLASTX и TBLASTX) предназначены для проверки нуклеотидной последовательности. Остающиеся две процедуры предназначены для проверки последовательности белка (Coulson, Trends in Biotechnology, 12: 76-80 (1994); Birren, et al., Genome Analysis, 1: 543-559 (1997)).
Кроме того, для анализа идентифицированной последовательности в данной области техники имеются дополнительные программы, например программа выравнивания последовательностей и программа для идентификации более отдаленных последовательностей.
Мутантная ДНК является молчащей (нет изменения аминокислотного остатка, кодируемого мутированной последовательностью нуклеиновой кислоты) или консервативной в отношении кодируемой ее аминокислоты. Примеры консервативных аминокислотных замен показаны ниже.
| Первоначальный аминокислотный остаток | Консервативный замещенный аминокислотный остаток |
| AlaArgAsnAspCysGlnGluGlyHisIleLeuLysMetPheSerThrTrpTyrVal | SerLysGln или HisGluSerAsnAspProAsn или GlnLeu или ValIle или ValArg, Asn или GluLeu или IleMet, Leu или TyrThrSerTyrTrp или PheIle или Leu |
Как правило, один или более кодонов, кодирующих остаток Cys, влияют на образование дисульфидной связи конкретного полипептида.
Замена аминокислотного остатка, которая, как обычно считают, влияет на свойства белка, включает следующие замены:
(a) замену гидрофобного остатка гидрофобным остатком, например замена Leu, Ile, Phe, Val или Ala остатком Ser или Thr;
(b) замену аминокислотного остатка, отличного от Cys и Pro, остатком Cys или Pro;
(c) замену остатка, имеющего несущую положительный заряд боковую цепь, например Lys, Arg или His, несущим отрицательный заряд остатком, например Glu или Asp; и
(d) замену аминокислотного остатка, имеющего чрезвычайно большую боковую цепь, например Phe, аминокислотным остатком, не имеющим боковой цепи, например Gly.
(1) SY-001
SY-001 включает аминокислотную последовательность SEQ ID NO: 1 или 3 или аминокислотную последовательность, имеющую одну или несколько делеций, вставок, замен или добавлений аминокислот в аминокислотной последовательности SEQ ID NO: 1 или 3, и обладает ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, которая ингибирует адгезию тромбоцитов к коллагену и/или способность связываться с коллагеном.
SY-001 может быть полипептидом, экспрессируемым в системе экспрессии белков с использованием Escherichia coli или в системе экспрессии белков с использованием бакуловируса (AcNPV), продемонстрированных в описываемых позже примерах, с помощью метода рекомбинации генов, или полипептидом, получаемым химическим синтезом.
В качестве одного конкретного примера аминокислотной последовательности SY-001 можно привести одну из SEQ ID NO: 1 или 3. Аминокислотная последовательность SY-001 не ограничивается одной из SEQ ID NO: 1 или 3 и может быть последовательностями, имеющими с ними определенную гомологию, (гомологичными последовательностями). Гомологичные последовательности могут включать полипептиды, включающие аминокислотную последовательность, имеющую одну или несколько делеций, вставок, замен или добавлений аминокислот в аминокислотной последовательности SEQ ID NO: 1 или 3, и обладающие ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, которая ингибирует адгезию тромбоцитов к коллагену и/или способность связываться с коллагеном.
Ингибиторная активность в отношении агрегации тромбоцитов, которой обладает SY-001, включает эффекты ингибирования или блокирования состояния, при котором в кровеносном сосуде человека (в частности, в коронарной артерии, аорте и церебральной артерии) увеличивается содержание вещества, индуцирующего агрегацию тромбоцитов, или в кровеносном сосуде облегчается агрегационная способность тромбоцитов, или состояния, при котором при повреждении кровеносного сосуда тромбоциты чрезмерно агрегируют в месте повреждения.
Ингибиторную активность в отношении агрегации тромбоцитов можно обнаружить по ингибированию (супрессии) агрегации тромбоцитов, индуцированной агрегирующим тромбоциты агентом, в богатой в отношении тромбоцитов плазме (PRP) при добавлении SY-001 в плазму в эксперименте in vitro.
Более подробно, ингибиторную активность в отношении агрегации тромбоцитов SY-001 можно определить с помощью следующего способа. Т.е. сначала с помощью центрифугирования из цельной крови человека готовят PRP. Впоследствии эту приготовленную PRP предварительно инкубируют с раствором, например раствором PBS, содержащим SY-001, и для агрегации тромбоцитов к этому раствору далее добавляют агент, агрегирующий тромбоциты. Примеры агрегирующего тромбоциты агента включают АДФ (аденозиндифосфат), коллаген, CRP (родственный коллагену пептид), конвульксин, TRAP (пептид-активатор рецептора тромбина), эпинефрин, арахидоновая кислота, U-46619 (аналог тромбоксана А2, аналог TXA2) и А23187 (кальциевый ионофор). Скорость агрегации тромбоцитов в полученном в результате растворе измеряют с использованием турбидиметрического тромбоагрегометра с пропусканием света (MCM HEMA TRACER 313M, поставляемого MC Medical), и скорость ингибирования с помощью SY-001 агрегации тромбоцитов рассчитывают из полученной величины измерения на основе величины в контроле, не содержащем SY-001. Таким образом, можно обнаружить ингибиторную активность в отношении агрегации тромбоцитов SY-001.
Можно также определить ингибиторную активность в отношении адгезии тромбоцитов SY-001 с помощью следующего метода.
Раствор PBS, содержащий SY-001 в установленных концентрациях, добавляют в лунки 96-луночного планшета, покрытые раствором коллагена, и инкубируют в течение 30 минут при комнатной температуре. После инкубации в лунку добавляют суспензию тромбоцитов и инкубируют в течение 45 минут при комнатной температуре. После инкубации инкубационный раствор удаляют из лунки с помощью пипетки, и лунку промывают PBS.
В лунку добавляют раствор PBS, содержащий 1% SDS, и после покачивания и перемешивания лунку подвергают воздушной сушке. Затем в лунку добавляют дистиллированную воду, количество белка в каждой лунку измеряют с использованием набора для анализа белка Dc (BIO-RAD Laboratories). Скорость ингибирования адгезии тромбоцитов с помощью SY-001 рассчитывают из полученной величины измерения на основе величины в контроле, не содержащем SY-001, и ингибиторную активность в отношении адгезии тромбоцитов SY-001 рассчитывают из кривой адгезии тромбоцитов. Таким образом, можно обнаружить ингибиторную активность в отношении адгезии тромбоцитов SY-001, которая ингибируют адгезию тромбоцитов к коллагену.
Можно также определить способность SY-001 связываться с коллагеном с помощью следующего способа.
В каждую лунку 96-луночного планшета с или без покрытия коллагеном добавляют 300 мкл блокирующего раствора и инкубируют в течение 1 часа. После удаления из каждой лунки инкубационного раствора в каждую лунку добавляют 100 мкл раствора, содержащего SY-001 в установленных концентрациях, и инкубируют в течение 1 часа при комнатной температуре. После удаления из каждой лунки инкубационного раствора в каждую лунку затем добавляют 200 мкл 2% сахарозы и инкубируют в течение 5 минут при комнатной температуре. После удаления из каждой лунки инкубационного раствора лунки высушивают, в каждую лунку добавляют 100 мкл воссозданного раствора никель-HRP (KPP: Kirkegaard&Perry Laborator, Ltd) и инкубируют в течение 30 минут при комнатной температуре. После промывки буфером для промывок в каждую лунку добавляют 100 мкл субстрата для пероксидазы ABTS (KPL Ltd.), и 96-луночный планшет осторожно покачивают.
После завершения реакции в каждую лунку добавляют 100 мкл 1% SDS и затем лунку измеряют с использованием считывающего устройства Micro Plate Reader с вариацией абсорбции при 405-410 нм.
Способность SY-001 при установленных концентрациях связываться с коллагеном рассчитывают из полученной величины OD (оптической плотности) на основе величины в контроле, не содержащем SY-001, и способность SY-001 связываться с коллагеном рассчитывают из кривой связывания коллагена. Таким образом, можно обнаружить способность SY-001 связываться с коллагеном.
Можно также определить антитромбоцитарную активность, которой обладает SY-001, с помощью следующего способа. Т.е. PRP готовят с помощью центрифугирования из цельной крови, получаемой путем взятия с помощью шприца с антикоагулянтом образца крови у здорового донора. Затем полученную PRP разводят соответствующим буфером, например Tyrode-Hepes (134 мМ NaCl, 0,34 мМ Na2HPO4, 2,9 мМ KCl, 12 мМ NaHCO3, 20 мМ Hepes, 5 мМ глюкозы, 1 мМ MgCl2, pH 7,3), и к этому серийному разведению добавляют SY-001 в установленных концентрациях и предварительно инкубируют. К этому раствору добавляют флуоресцентно меченное антитело против селектина Р, антитело (поставляемое Becton Dickinson), которое узнает РАС-1 (комплекс GPIIb/GPIIIa), фибриноген и аннексин V, и впоследствии для активации тромбоцитов добавляют агрегирующий тромбоциты агент, например АДФ, коллаген или TRAP. Следовательно, для оценки активности (ингибиторной активности в отношении активации) SY-001 в отношении активации тромбоцитов измеряют интенсивность флуоресценции активированных тромбоцитов с помощью проточной цитометрии. Эта ингибиторная активность в отношении активации тромбоцитов является ингибиторной активностью в отношении активации тромбоцитов.
В вышеуказанном методе при использовании флуоресцентно меченных антител, узнающих тромбоцит и лейкоцит, можно также оценить эффект соединения на взаимодействие тромбоцита и лейкоцита (тромбоцит-лейкоцит адгезию).
В отношении подробностей способа измерения ингибиторной активности SY-001 в отношении агрегации тромбоцитов, в котором используется турбидиметрический тромбоагрегометр с пропусканием света, в настоящем изобретении приводится ссылка, например, на Born, G.V.R., "Aggregation of blood platelets by adenosine diphosphate and its reversal", Nature, 1962, 194, 927-8 и Sudo, T., et al., "Potent effects of novel anti-platelet aggregatory cilostamide analogues on recombinant cyclic nucleotide phosphodiesterase isozyme activity", Biochem. Pharmacol., 2000, 59, 347-56. В отношении измерения активации тромбоцитов в настоящем изобретении приводится ссылка, например, на Ito, H., et al., "Cilostazol inhibits platelet-leukocyte interaction by suppression of platelet activation", Platelets, 2004, 15, 293-301.
Следовательно, существует вероятность использования SY-001, имеющего ингибиторную активность в отношении агрегации тромбоцитов и/или ингибиторную активность в отношении адгезии тромбоцитов, в качестве терапевтического агента против распространения или для профилактики связанных с кровью заболеваний и их осложнений, оказывая действие на кровь и кровеносный сосуд являющихся млекопитающими животных с ингибированием или предотвращением образования тромба или эмбола.
Соответственно предполагается эффективное использование SY-001, имеющего ингибиторную активность в отношении агрегации тромбоцитов и/или ингибиторную активность в отношении адгезии тромбоцитов, в качестве терапевтического агента или профилактического агента для патологических состояний после заболеваний и их осложнений, например инфаркта миокарда, эмболии сосудов головного мозга, хронической обструкции артерий, склероза артерий, ишемического инфаркта головного мозга, стенокардии, тромбоза вен, гипертензии, легочной гипертезии, инфаркта головного мозга, инфаркта легкого, сердечной недостаточности, нефрита, почечной недостаточности и субарахноидального кровоизлияния, вызванных образованием тромба или эмбола.
Также предполагается эффективное использование SY-001, имеющего ингибиторную активность в отношении агрегации тромбоцитов и/или ингибиторную активность в отношении адгезии тромбоцитов, для профилактики образования тромба при ЧТКА и размещении стента и в качестве агента, предотвращающего рестеноз после размещения стента путем включения с помощью нанесения на стент или заделывания в него самого лекарственного средства, содержащего SY-001.
Степень и положение модификации, т.е. "делеции, вставки, замены или добавления" аминокислотных остатков, в SY-001, представленного в виде вышеуказанного полипептида (b) и (d), особенно не ограничивается при условии, что полипептид (эквивалентный полипептид), включающий модифицированную аминокислотную последовательность, имеет по существу ту же самую активность, что и активность полипептида, включающего аминокислотную последовательность SEQ ID NO: 1 или 3. Предпочтительно, чтобы указанная модификация обычно затрагивала приблизительно от одного до нескольких аминокислотных остатков.
В настоящем изобретении "делеции, вставки, замены или добавления множества аминокислотных остатков" относятся к тому, что делетируются, вставляются, замещаются или добавляются 2 или более и 20 или менее аминокислот. Предпочтительно множество аминокислот составляют 2 или более и 10 или менее аминокислот, более предпочтительно 2 или более и 7 или менее и еще более предпочтительно 2 или более и 5 или менее. Эта модифицированная аминокислотная последовательность гомологична аминокислотной последовательности SEQ ID NO: 1 или 3, например, на приблизительно 70% или более, предпочтительно на приблизительно 80% или более, более предпочтительно на приблизительно 95% или более и еще более предпочтительно на приблизительно 98% или более.
Конкретные примеры полипептида (SY-001), являющегося активным компонентом фармацевтической композиции настоящего изобретения, продемонстрированы в описываемых позже примерах.
SY-001 обладает присущей ему ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
SY-001 также обладает присущей ему способностью связываться с коллагеном.
Следовательно, фармацевтическая композиция настоящего изобретения, содержащая в качестве активного компонента SY-001, применима в качестве терапевтического агента или профилактического агента для патологического состояния после заболеваний и их осложнений, например острого коронарного синдрома, инфаркта миокарда, эмболии сосудов головного мозга, хронической обструкции артерий, склероза артерий, ишемического инфаркта головного мозга, стенокардии, тромбоза вен, гипертензии, легочной гипертезии, инфаркта головного мозга, инфаркта легкого, сердечной недостаточности, нефрита, почечной недостаточности и субарахноидального кровоизлияния, вызванных образованием тромба или эмбола. Фармацевтическая композиция настоящего изобретения также применима для профилактики образования тромба при ЧТКА и размещении стента и в качестве агента, предотвращающего рестеноз после размещения стенда с помощью нанесения на стент или заделывания в него фармацевтической композиции.
(2) Полинуклеотид (ДНК-молекула), кодирующая SY-001
Один конкретный пример полинуклеотида, кодирующего SY-001 (на который иногда дается ссылка в виде "ДНК-молекула SY-001"), может включать полинуклеотид (ДНК-молекулу), включающую ДНК-последовательность SEQ ID NO: 2, или 4, или ее комплемент.
Другой пример ДНК-молекулы SY-001 включает полинуклеотид, гибридизующийся в жестких условиях с полинуклеотидом, включающим комплемент ДНК-последовательности SEQ ID NO: 2 или 4, и способный экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
"Жесткими условиями" здесь могут являться условия, при которых гибридизация происходит в 2×SSC, содержащем 0,1% SDS, при 50°С и не прекращается после отмывки в 1×SSC, содержащем 0,1% SDS, при 60°С.
Кроме того, другой пример ДНК-молекулы (полинуклеотида) SY-001 включает полинуклеотид, включающий ДНК-последовательность, гомологичную наиболее близкородственной последовательности среди полинуклеотидов, включающих ДНК-последовательность SEQ ID NO: 2 или 4 или ее комплемент, на 80% или более, предпочтительно на 95% или более и более предпочтительно на 98% или более, и способный экспрессировать полипептид, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов.
Существенным требованием для ДНК-молекул (на которые иногда дается ссылка в виде модифицированные ДНК-молекулы), способных экспрессировать обладающие требуемыми эффектами полипептиды, продемонстрированные в качестве других примеров, является то, чтобы полипептид с аминокислотной последовательностью, кодируемой такой ДНК-молекулой, мог проявлять ингибиторную активность в отношении агрегации тромбоцитов и/или ингибиторную активность в отношении адгезии тромбоцитов (в частности, ингибиторную активность в отношении агрегации тромбоцитов, индуцированной коллагеном, и/или ингибиторную активность в отношении адгезии тромбоцитов к коллагену). Другими словами, требование состоит в том, чтобы трансформант, трансформированный рекомбинантным экспрессирующим вектором, в который встроен полинуклеотид (модифицированная ДНК-молекула), мог экспрессировать белок, обладающий ингибиторной активностью в отношении агрегации тромбоцитов и/или ингибиторной активностью в отношении адгезии тромбоцитов, в качестве его экспрессируемого продукта.
Вышеуказанная модифицированная ДНК-молекула включает ДНК-молекулы, включающие ДНК-последовательности, кодирующие аминокислотные последовательности SEQ ID NO: 1 или 3, в частности аминокислотные последовательности (модифицированные аминокислотные последовательности), имеющие одну или несколько делеций, вставок, замен или добавлений аминокислот, и ДНК-последовательности, кодирующие ее комплемент. Модифицированные ДНК могут быть последовательностями, которые могут использоваться для о