Олигорибонуклеотиды и способы их применения для лечения острой почечной недостаточности и других заболеваний
Иллюстрации
Показать всеДанное изобретение относится к соединению в виде двухцепочечной РНК, которое вызывает отрицательную регуляцию экспрессии гена р53 человека. Соединение имеет структуру: 5'ugaagggugaaauauucuc-Z3' 3'Z'-acuucccacuuuauaagag5', где составляющие его рибонуклеотиды могут быть как 2'-O-Ме-модифицированными по сахарному остатку, так и немодифицированными. A Z и Z', если присутствует, означает dTdT, который ковалентно присоединен на 3'-конце цепи. Настоящее изобретение также относится к фармацевтической композиции, содержащей это соединение и фармацевтически приемлемый носитель. Полученное соединение или фармацевтическая композиция могут использоваться для лечения пациента, страдающего от острой почечной недостаточности или ишемического-реперфузионного повреждения, вызванных хирургическим вмешательством, или для лечения пациента, страдающего от индуцированной цисплатином глухоты. Также введение данного соединения способствует улучшению выживаемости трансплантированной ткани после трансплантации у пациента. 10 н. и 8 з.п. ф-лы, 7 ил., 5 табл.
Реферат
На протяжении этой заявки цитируются различные патентные и научные публикации. Раскрытия этих публикаций в их полном виде включены тем самым в качестве ссылки в эту заявку для более полного описания состояния области, к которой относится это изобретение.
Уровень техники
siPHK и интерференция РНК
Интерференция РНК (PHKi) является феноменом, включающим в себя зависимый от двухцепочечной (дц) РНК геноспецифический посттранскрипционный сайленсинг генов. Первоначально попытки исследования этого феномена и манипуляции клетками млекопитающих экспериментально были тщетными вследствие активного неспецифического антивирусного защитного механизма, который активировался длинными молекулами дцРНК; см. Gil et al. 2000, Apoptosis, 5:107-114. Позднее было обнаружено, что синтетические дуплексы, состоящие из 21 нуклеотида РНК, могли опосредовать геноспецифическую PHKi в клетках млекопитающих без стимуляции общих антивирусных защитных механизмов (см. Elbashir et al. Nature 2001, 411:494-498 и Caplen et al. Proc. Natl. Acad. Sci. 2001, 98:9742-9747). В результате малые интерферирующие РНК (siPHK), которые являются короткими двухцепочечными РНК, стали мощными инструментами в попытке понимания функции генов.
Таким образом, интерференцией РНК (PHKi) называют процесс последовательность-специфического посттранскрипционного сайленсинга генов у млекопитающих, опосредованный малыми интерферирующими РНК (siPHK) (Fire et al., 1998, Nature 391, 806) или микроРНК (miRNA) (Ambros V. Nature 431:7006, 350-355 (2004); и Bartel DP. Cell. 2004 Jan 23; 116(2):281-97 MicroRNAs: genomics, biogenesis, mechanism, and function). Соответствующий процесс у растений называют обычно специфическим посттранскрипционным сайленсингом генов или РНК-сайленсингом, а у грибов называют также подавлением. siPHK является двухцепочечной молекулой РНК, которая осуществляет отрицательную регуляцию или производит сайленсинг (предотвращает экспрессию) гена/мРНК ее эндогенной (клеточной) копии. Интерференция РНК основана на способности молекул дцРНК вступать в специфический белковый комплекс, который затем нацеливается на комплементарную клеточную РНК и подвергает ее специфической деградации. Таким образом, реакция интерференции РНК имеет в своей основе эндонуклеазный комплекс, содержащий siPHK, обычно называемый РНК-индуцируемым комплексом сайленсинга (RISC), который опосредует расщепление одноцепочечной РНК, имеющей последовательность, комплементарную антисмысловой цепи этого siPHK-дуплекса. Расщепление РНК-мишени может иметь место в середине района, комплементарного антисмысловой цепи siPHK-дуплекса (Elbashir et al. 2001, Genes Dev., 15, 188). Более подробно, более длинные дцРНК расщепляются на короткие (17-29 п.н.) дцРНК-фрагменты (также называемые короткими ингибирующими РНК - “siPHK”) РНКазами типа III (DICER, DROSHA, etc., Bernstein et al., Nature, 2001, v.409, p.363-6; Lee et al., Nature, 2003, 425, p.415-9). Белковый комплекс RISC узнает эти фрагменты и комплементарную мРНК. Весь процесс достигает кульминации при расщеплении мРНК-мишени под действием эндонуклеазы (McManus & Sharp, Nature Rev Genet, 2002, v.3, p.737-47; Paddison & Hannon, Curr. Opin. Mol. Ther. 2003 Jun; 5(3):217-24). В отношении информации об этих терминах и предлагаемых механизмах см. Bernstein E., Denli AM. Hannon GJ: 2001 The rest is silence. RNA. I; 7(11): 1509-21; Nishikura K.: 2001 A short primer on RNAi: RNA-directed RNA polymerase acts as a key catalyst. Cell. I 16; 107(4): 415-8 и РСТ публикацию WO 01/36646 (Glover et al.).
Отбор и синтез siPHK, соответствующих известным генам, описаны в обширной литературе; см., например, Chalk AM, Wahlestedt C, Sonnhammer EL. 2004 Improved and automated prediction of effective siRNA Biochem. Biophys, Res. Commun. Jun 18; 319(1): 264-74; Sioud M, Leirdal M., 2004, Potential design rules and enzymatic synthesis of siRNAs, Methods Mol. Biol.; 252:457-69; Levenkova N, Gu Q, Rux JJ. 2004, Gene specific siRNA selector Bioinformatics. I 12; 20(3): 430-2 и Ui-Tei K, Naito Y, Takahashi F, Haraguchi T, Ohki-Hamazaki H, Juni A, Ueda R, Saigo K., Guidelines for the selection of higly effective siRNA sequences for mammalian and chick RNA interference Nucleic Acids Res. 2004 I 9; 32(3):936-48. См. также Liu Y, Braasch DA, Nulf CJ, Corey DR. Efficient and isoform-selective inhibition of cellular gene expression by peptide nucleic acids, Biochemistry, 2004 I 24; 43(7):192-7. См. также РСТ публикации WO 2004/015107 (Atugen) и WO 02/44321 (Tuschl et al.), а также Chiu YL, Rana TM. siRNA function in RNAi: a chemical modification analysis, RNA 2003 Sep; 9(9):1034-48 и I патент №5898031 и 6107094 (Crooke) в отношении получения модифицированных/более стабильных siPHK.
Несколько групп исследователей описали получение векторов на основе ДНК, способных генерировать siPHK в клетках. Этот способ обычно включает в себя транскрипцию коротких шпилечных РНК, которые подвергаются эффективному процессингу с образованием siPHK в клетках. Paddison et al. PNAS 2002, 99:1443-1448; Paddison et al. Genes & Dev 2002, 16:948-958; Sui et al. PNAS 2002, 8:5515-5520; и Brummelkamp et al. Science 2002, 296:550-553. В этих сообщениях описаны способы получения siPHK, способных специфически нацеливаться на многочисленные эндогенно и экзогенно экспрессируемые гены.
Недавно siPHK успешно использовали для ингибирования в организме приматов; подробнее см. Tolentino et al., Retina 24(1) February 2004 I 132-138.
Ген и полипептид р53
Ген р53 человека является хорошо известным и в высокой степени исследованным геном. Полипептид р53 играет ключевую роль в клеточных механизмах стрессовых реакций посредством превращения различных стимулов, например разрушающих ДНК условий, таких как гамма-излучение, нарушение регуляции транскрипции или репликации и неопластической трансформации, в сигнал для остановки клеточного роста или апоптоза (Gottlieb et al., 1996, Biochem. Biophys. Acta, 1287, p.77). Полипептид р53 является существенным для индукции запрограммированной смерти клеток или «апоптоза» в качестве реакции на такие стимулы.
Большинство противораковых терапий повреждают или убивают также и нормальные клетки, которые содержат нативный р53, вызывая тяжелые побочные эффекты, ассоциированные с повреждением или смертью здоровых клеток. Поскольку такие побочные эффекты в высокой степени определяются р53-опосредованной смертью нормальных клеток, в качестве терапевтической стратегии во избежание этих тяжелых токсичных событий была предложена временная супрессия р53 во время острой фазы противораковой терапии. Это было описано в Патенте США №6593353 и в Komarov PG et al., 1999, A chemical inhibitor of p53 that protects mice from the side effects of cancer therapy, Science, 285(5434):1651, 1653. Было показано, что р53 участвует в индуцированной химиотерапией и облучением алопеции (Botcharev et al., 2000, p53 is essential for Chemotherapy-induced Hair Loss, Cancer Research, 60, 5002-5006).
Алопеция
Недавно были получены разительные успехи в понимании молекул и путей, регулирующих образование волосяных фолликулов и рост волос. Химиотерапия нарушает пролиферацию кератиноцитов матрикса в волосяной луковице, которые образуют волосяной стержень. Это заставляет волосяные фолликулы входить в стадию дистрофической регрессии, при которой целостность волосяного стержня оказывается нарушенной, и затем этот волос разрывается и выпадает. Поскольку более чем 90% фолликулов волосистой части головы в любой момент находятся в стадии роста, эти волосы быстро выпадают после химиотерапии, и, следовательно, такая алопеция является быстрой и обширной (George Cotsarelis and Sarah E. Millar, 2001, Towards a molecular understanding of hair loss and its treatment, TRENDS in Molecular Medicine Vol.7, №7). Химиотерапевтическими лекарственными средствами, которые с наибольшей вероятностью вызывают выпадение волос, являются цисплатин, цитарабин, циклофосфамид, доксорубицин, эпирубицин, этопозид, ифосфамид и винкристин. Индуцированная облучением общая алопеция наблюдается фактически у 100% пациентов, которые получают облучение всего головного мозга (WBR), в частности, 3000 рад и более.
Выпадение волос является одним из наиболее нежелательных побочных действий химиотерапии среди пациентов с раком, хотя выпавшие волосы со временем снова вырастают после химиотерапии. С точки зрения пациента, выпадение волос (алопеция) стоит на втором месте только после тошноты в качестве вызывающего беспокойство побочного действия химиотерапии. Приблизительно 75% пациентов оценивают индуцированное химиотерапией выпадение волос как событие, вызывающее такое же или большее расстройство, что и вызванная раком боль.
Таким образом, хотя нарушение роста волос не представляет угрозу жизни, его огромное влияние на социальные взаимодействия и на психологическое благополучие пациентов является несомненным. Эта потребность в способах лечения выпадения волос питает мультимиллиардную (в долларах) промышленность. Несмотря на это, большинство продаваемых в настоящее время продуктов неэффективно, что подтверждается тем фактом, что Управление по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA) одобрило только два способа лечения выпадения волос. Ни одна из известных терапий и ни одно из известных лекарственных средств не является эффективным в отношении индуцируемой лечением рака алопеции.
Острая почечная недостаточность (ОПН) (ARF)
ОПН является клиническим синдромом, характеризующимся быстрым ухудшением почечной функции, развивающимся в течение нескольких дней. Основным признаком ОПН является резкое уменьшение скорости клубочковой фильтрации (GFR), приводящее к удерживанию азотистых продуктов выделения (мочевины, креатинина). В общей мировой популяции ежегодно имеют место 170-200 случаев тяжелой ОПН на миллион населения. К настоящему времени не существует специфической терапии для установленной ОПН. Было обнаружено, что несколько лекарственных средств ослабляют токсическую и ишемическую экспериментальную ОПН, о чем судили по более низким уровням сывороточного креатинина, уменьшению гистологического повреждения и более быстрому восстановлению почечной функции на моделях различных животных. Они включают в себя антиоксиданты, блокаторы кальциевых каналов, мочегонные средства, вазоактивные вещества, гормоны роста, противовоспалительные агенты и другие. Однако лекарственные средства, которые исследовались в клинических испытаниях, не обнаруживали преимущества, и их использование в клинической ОПН не было одобрено.
У большинства госпитализированных пациентов ОПН вызывала острый некроз почечных канальцев (ATN), который происходит в результате ишемического и/или нефротоксического повреждений. Почечная гипоперфузия вызывается гиповолемическим, кардиогенным и септическим шоком, введением вазоконстрикторных лекарственных средств или реноваскулярным повреждением. Нефротоксины включают в себя экзогенные токсины, такие как контрастные вещества и аминогликозиды, а также эндогенный токсин, такой как миоглобин. Однако недавние исследования подтверждают, что апоптоз в почечных тканях в большинстве случаев ОПН человека является сильно выраженным. Основным сайтом апоптотической смерти клеток является дистальный нефрон. Во время начальной фазы ишемического повреждения потеря целостности актинового цитоскелета приводит к уплощению эпителия с потерей щеточной каемки, потерей фокальных клеточных контактов и к последующему высвобождению клетки из выстилающего субстрата. Было сделано предположение, что апоптотическая смерть канальцевых клеток может быть более прогностической в отношении функциональных изменений, чем некротическая смерть клеток (Komarov et al. Science, 1999 Sep. 10; 285(5434):1733-7); см. также (Supavekin et al. Kidney Int. 2003 May; 63(5):1714-24).
Таким образом, в настоящее время нет удовлетворительных способов терапии для предупреждения и/или лечения токсической алопеции и острой почечной недостаточности и нет удовлетворительного способа терапии многих других заболеваний и нарушений, которые сопровождаются повышенным уровнем полипептида р53, и, следовательно, существует потребность в развитии новых соединений для этой цели.
Сущность изобретения
Данное изобретение обеспечивает новые двухцепочечные олигорибонуклеотиды, которые ингибируют ген р53. Данное изобретение обеспечивает также фармацевтическую композицию, содержащую один или несколько таких олигорибонуклеотидов, и вектор, способный экспрессировать этот олигорибонуклеотид. Данное изобретение обеспечивает также способ лечения пациента, страдающего от заболевания, в котором временное (обратимое) ингибирование активности р53 является полезным, предусматривающий введение этому пациенту одного или нескольких олигорибонуклеотидов, обычно в виде фармацевтической композиции, в терапевтически эффективной дозе таким образом, чтобы посредством этого лечить этого пациента. Данное изобретение рассматривает также лечение других нарушений, которые сопровождаются повышенным уровнем полипептида р53. Поскольку долгосрочная инактивация р53 может значительно увеличивать риск рака, предпочтительно, чтобы ингибирование р53 с использованием молекул согласно изобретению было временным (транзиторным).
В одном предпочтительном варианте осуществления описанные здесь новые молекулы siPHK могут быть использованы в лечении опухолей в случаях, когда временная супрессия р53 с использованием siPHK р53 могла бы быть полезной вместе с общепринятой химиотерапией (как описано здесь) или лучевой терапией (радиотерапией). Например, описанные здесь новые молекулы siPHK будут защищать нормальные р53-содержащие клетки от индуцированного химиотерапией или лучевой терапией апоптоза. Описанные здесь новые молекулы siPHK могут быть также использованы для ингибирования экспрессии р53 в конкретных раковых клетках в случаях, когда ингибирование р53 потенцирует апоптотическую клеточную смерть этих клеток. Конкретно, лучевая терапия и химиотерапия могут вызывать тяжелые побочные действия, такие как тяжелое повреждение лимфоидной и гемопоэтической системы и кишечного эпителия, которые ограничивают эффективность этих терапий, и могут вызывать выпадение волос, которое вызывает психологическое расстройство. Эти побочные действия обусловлены р53-опосредованным апоптозом. Таким образом, для элиминации или уменьшения вредных побочных действий, ассоциированных с лечением рака, была бы полезна индукция временного ингибирования активности р53 в нормальных клетках с использованием молекул siPHK согласно изобретению с защитой посредством этого нормальной ткани.
В другом предпочтительном варианте осуществления описанные здесь новые молекулы siPHK могут быть использованы в лечении острой почечной недостаточности (ОПН), которая характеризуется быстрым нарушением почечной функции, ассоциированным с апопототической смертью клеток в почечной ткани.
Описанные здесь новые молекулы siPHK могут быть также использованы в других состояниях, в которых р53 активируется как следствие различных стрессов, связанных с повреждениями, такими как ожог, гипертермия (перегревание организма), гипоксия, связанная с блокированным кровоснабжением, таким как в случае инфаркта миокарда, и ишемия. Временное ингибирование р53 с использованием молекул siPHK согласно изобретению может быть терапевтически эффективным в уменьшении или элиминации р53-зависимой смерти нейронов в центральной нервной системе, т.е. при повреждении головного мозга и спинного мозга, консервировании тканей и органов перед трансплантацией, подготовке хозяина для пересадки костного мозга и в уменьшении или элиминации нейронного повреждения во время припадка.
р53 играет также роль в старении клеток. В частности, морфологические и физиологические изменения нормальных тканей, связанные со старением, могут быть связаны с активностью р53. Известно, что старые клетки, которые накапливаются в тканях с течением времени, поддерживают очень высокие уровни р53-зависимой транскрипции. р53-зависимая секреция ингибиторов факторов роста накапливается в стареющей ткани. Таким образом, описанные здесь молекулы siPHK могут быть также использованы в супрессии старения тканей.
Краткое описание чертежей
Фиг.1. На этой фигуре представлена нуклеотидная последовательность гена р53 человека SEQ ID NO:1.
Фиг.2. На этой фигуре представлена аминокислотная последовательность полипептида р53 человека SEQ ID NO:2.
Фиг.3. На этой фигуре показаны результаты Вестерн-блота, демонстрирующие действие различных siPHK р53 человека на экспрессию р53.
Фиг.4. На этой фигуре показаны результаты Вестерн-блота, демонстрирующие действие различных siPHK р53 мыши на экспрессию р53.
Фиг.5. На этой фигуре показан уровень сывороточного креатинина как показатель острой почечной недостаточности у животных, которые были подвергнуты билатеральному пережиманию почечных артерий и были обработаны соединением siPHK р53 или контролем, как указано.
Фиг.6. На этой фигуре показана степень некроза канальцев в почечной ткани у животных, которые были подвергнуты билатеральному пережиманию почечных артерий и были обработаны соединением siPHK р53.
Фиг.7. Эта фигура демонстрирует, что обработка siPHK р53 вызывает отрицательную регуляцию экспрессии про-апоптотического гена Puma в кортикальном компартменте почки у животного, подвергнутого ишемическому/реперфузионному повреждению почки.
Подробное описание изобретения
Данное изобретение относится, в общем, к соединениям, которые вызывают отрицательную регуляцию экспрессии гена р53, конкретно, к новым малым интерферирующим РНК (siPHK) и к применению этих новых siPHK в лечении различных заболеваний и медицинских состояний, в частности алопеции или острой почечной недостаточности или нарушения, сопровождающегося повышенным уровнем полипептида р53.
Авторы согласно изобретению обнаружили, что полезно индуцировать временное ингибирование р53 для лечения указанных заболеваний или нарушений. Способы, молекулы и композиции, которые ингибируют р53, обсуждаются здесь подробно, и любые из указанных молекул и/или композиций могут быть с пользой использованы в лечении пациента, страдающего от любого из указанных состояний.
Данное изобретение обеспечивает способы и композиции для ингибирования экспрессии гена р53-мишени in vivo. Обычно этот способ включает в себя введение олигорибонуклеотидов, таких как малые интерферирующие РНК (т.е. siPHK), которые нацелены на конкретную мРНК р53 и гибридизуются или взаимодействуют с этой мРНК в биологических условиях (внутри клетки), или материала нуклеиновой кислоты, который может продуцировать siPHK в клетке, в количестве, достаточном для отрицательной регуляции экспрессии гена-мишени по механизму интерференции РНК. В частности, рассматриваемый способ может быть использован для ингибирования экспрессии гена р53 для лечения заболевания.
Согласно данному изобретению, молекулы siPHK или ингибиторы гена р53 могут быть использованы в качестве лекарственных средств для лечения различных патологий, в частности алопеции и острой почечной недостаточности, или других нарушений, сопровождающихся повышенным уровнем полипептида р53. Поскольку долгосрочная инактивация р53 может значительно увеличивать риск рака, предпочтительно, чтобы ингибирование р53 с использованием молекул согласно изобретению было временным/обратимым.
Данное изобретение связано с двухцепочечными олигорибонуклеотидами (siPHK), которые вызывают отрицательную регуляцию экспрессии гена р53. siPHK согласно изобретению является дуплексным олигорибонуклеотидом, в котором смысловая цепь произведена из мРНК-последовательности гена р53, а антисмысловая цепь является комплементарной смысловой цепи. Обычно некоторое отклонение от мРНК-последовательности-мишени допускается без нарушения активности siPHK (см., например, Czauderna et al 2003 Nucleic Acids Research 31(11), 2705-2716). siPHK согласно изобретению ингибирует экспрессию гена на посттранскрипционном уровне, с разрушением или без разрушения мРНК. Не связывая себя теорией, авторы считают, что siPHK может быть нацелена на мРНК для специфического расщепления и деградации и/или может ингибировать трансляцию из мРНК-мишени.
Имеются по меньшей мере четыре варианта полипептидов р53 (см. Bourdon et al. Genes Dev., 2005; 19:2122-2137). Последовательность, приведенная на фиг.1, является нуклеотидной последовательностью gi-8400737. Соответствующая полипептидная последовательность имеет 393 аминокислоты; см. фиг.2. Все варианты и любые другие подобные минорные варианты включены в определение полипептида р53 и в определение генов р53, кодирующих их.
В данном контексте термин «ген р53» определяется как любой гомолог гена р53, имеющий предпочтительно 90% гомологию, более предпочтительно, 95% гомологию и даже более предпочтительно, 98% гомологию с кодирующим аминокислоты районом SEQ ID NO:1 или последовательностями нуклеиновых кислот, которые связываются с геном р53 в условиях гибридизации высокой жесткости, которые хорошо известны в данной области (например, см. Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1988), обновленные в 1995 и 1998 годах.
В данном контексте термин «р53» или «полипептид р53» определяется как любой гомолог полипептида р53, имеющий предпочтительно 90% гомологию, более предпочтительно, 95% гомологию и даже более предпочтительно, 98% гомологию с SEQ ID NO:2, в виде полноразмерной последовательности или ее фрагмента или домена, в виде мутанта или полипептида, кодируемого последовательностью нуклеиновой кислоты сплайсингового варианта, в виде химеры с другими полипептидами, при условии, что любая последовательность из вышеуказанных последовательностей имеет ту же самую или по существу ту же самую биологическую функцию, что и полипептид р53.
Обычно siPHK, используемые в данном изобретении, содержат рибонуклеиновую кислоту, содержащую двухцепочечную структуру, причем эта двухцепочечная структура содержит первую цепь и вторую цепь, причем первая цепь содержит первый сегмент смежных нуклеотидов, и причем указанный первый сегмент является по меньшей мере частично комплементарным нуклеиновой кислоте-мишени, а второй сегмент является по меньшей мере частично идентичным нуклеиновой кислоте-мишени, причем указанная первая цепь и/или указанная вторая цепь содержит множество групп модифицированных нуклеотидов, имеющих модификацию в положении 2', причем в этой цепи каждая группа модифицированных нуклеотидов фланкирована на одной или на обеих сторонах фланкирующей группой нуклеотидов, причем эти фланкирующие нуклеотиды, образующие фланкирующую группу нуклеотидов, являются либо немодифицированными нуклеотидами, либо нуклеотидами, имеющими модификацию, отличающуюся от модификации вышеупомянутых модифицированных нуклеотидов. Кроме того, указанная первая цепь и/или указанная вторая цепь может содержать указанное множество модифицированных нуклеотидов и может содержать указанное множество групп модифицированных нуклеотидов.
Группа модифицированных нуклеотидов и/или группа фланкирующих нуклеотидов может содержать некоторое количество нуклеотидов, причем это количество нуклеотидов выбрано из группы, состоящей из 1-10 нуклеотидов. В связи с любыми указанными здесь диапазонами должно быть понятно, что каждый диапазон включает в себя любое отдельное целое число между соответствующими числами, используемыми для определения диапазона, в том числе указанные два числа, ограничивающие указанный диапазон. Таким образом, в данном случае эта группа содержит один нуклеотид, два нуклеотида, три нуклеотида, четыре нуклеотида, пять нуклеотидов, шесть нуклеотидов, семь нуклеотидов, восемь нуклеотидов, девять нуклеотидов и десять нуклеотидов.
Распределение модифицированных нуклеотидов указанной первой цепи может быть смещено на один или несколько нуклеотидов относительно распределения модифицированных нуклеотидов второй цепи.
Обсуждаемые выше модификации могут быть выбраны из группы, состоящей из амино, фтора, метокси, алкокси, алкила, амино, фтора, хлора, брома, CN, CF, имидазола, карбоксилата, тиоата, низшего С1-С10 алкила, замещенного низшего алкила, алкарила, или аралкила, OCF3, OCN, O-, S- или N-алкила; O-, S- или N-алкенила; SOCH3; SO2CH3; ONO2; NO2, N3; гетероциклоалкила; гетероциклоалкарила; аминоалкиламино; полиалкиламино или замещенного силила, как, среди прочих, описано в Европейских патентах ЕРО 586520 В1 или ЕРО 618925 В1.
Двухцепочечная структура siPHK может быть затуплена на одной стороне или на обеих сторонах. Более конкретно, эта двухцепочечная структура может быть затуплена на стороне двухцепочечной структуры, которая ограничена 5'-концом первой цепи и 3'-концом второй цепи, или эта двухцепочечная структура может быть затуплена на стороне двухцепочечной структуры, которая ограничена 3'-концом первой цепи и 5'-концом второй цепи.
Кроме того, по меньшей мере одна из этих двух цепей может иметь выступ по меньшей мере одного нуклеотида на 5'-конце; этот выступ может состоять из по меньшей мере одного дезоксирибонуклеотида. По меньшей мере одна из этих цепей может также необязательно иметь выступ из по меньшей мере одного нуклеотида на 3'-конце.
Длина двухцепочечной структуры этой siPHK обычно равна приблизительно 17-21, и более предпочтительно, 18-19 оснований. Кроме того, длина указанной первой цепи и/или длина указанной второй цепи может независимо друг от друга быть выбрана из группы, содержащей диапазоны приблизительно в 15 оснований - приблизительно в 23 основания, в 17 оснований - 21 основание и в 18 или 19 оснований.
Кроме того, комплементарность между указанной первой цепью и нуклеиновой кислотой-мишенью может быть абсолютной, или дуплекс, образованный между первой цепью и нуклеиновой кислотой-мишенью, может содержать по меньшей мере 15 нуклеотидов, где имеется одно ошибочное спаривание или два ошибочных спаривания между указанной первой цепью и нуклеиновой кислотой-мишенью, образующими указанную двухцепочечную структуру.
В некоторых случаях как первая цепь, так и вторая цепь, каждая, содержат по меньшей мере одну группу модифицированных нуклеотидов и по меньшей мере одну фланкирующую группу нуклеотидов, причем каждая группа модифицированных нуклеотидов содержит по меньшей мере один нуклеотид и каждая фланкирующая группа нуклеотидов содержит по меньшей мере один нуклеотид, причем каждая группа модифицированных нуклеотидов первой цепи сопоставляется с фланкирующей группой нуклеотидов на второй цепи, причем наиболее концевой 5'-нуклеотид первой цепи является нуклеотидом группы модифицированных нуклеотидов, а наиболее 3'-концевой нуклеотид второй цепи является нуклеотидом фланкирующей группы нуклеотидов. Каждая группа модифицированных нуклеотидов может состоять из единственного нуклеотида и/или каждая фланкирующая группа нуклеотидов может состоять из единственного нуклеотида.
Кроме того, может быть так, что на первой цепи нуклеотид, образующий фланкирующую группу нуклеотидов, является немодифицированным нуклеотидом, который расположен в 3'-направлении относительно нуклеотида, образующего группу модифицированных нуклеотидов, а на второй цепи нуклеотид, образующий группу модифицированных нуклеотидов, является модифицированным нуклеотидом, который расположен в 5'-направлении относительно нуклеотида, образующего фланкирующую группу нуклеотидов.
Кроме того, первая цепь siPHK может содержать восемь-двенадцать, предпочтительно девять-одиннадцать, групп модифицированных нуклеотидов, а вторая цепь может содержать семь-одиннадцать, предпочтительно восемь-десять, групп модифицированных нуклеотидов.
Первая цепь и вторая цепь могут быть связаны структурой петли, которая может состоять из полимера, не являющегося нуклеиновой кислотой, такого как, помимо прочего, полиэтиленгликоль. Альтернативно, эта структура петли может состоять из нуклеиновой кислоты.
Кроме того, 5'-конец первой цепи siPHK может быть связан с 3'-концом второй цепи или 3'-конец первой цепи может быть связан с 5'-концом второй цепи, причем указанная связь осуществляется через представляющий собой нуклеиновую кислоту линкер, обычно имеющий длину 10-2000 нуклеооснований.
В частности, данное изобретение обеспечивает соединение, имеющее структуру А:
5'(N)x - Z 3' (антисмысловая цепь)
3'Z' -(N')y 5' (смысловая цепь)
где каждый N и N' означает рибонуклеотид, который может быть модифицированным или немодифицированным по его сахарному остатку, а (N)x и (N')y означает олигомер, в котором каждый последовательный N или N' соединен с последующим N или N' ковалентной связью;
где каждый из x и y означает целое число 19-40;
где каждый из Z и Z' может присутствовать или отсутствовать, но, если присутствует, означает dTdT и является ковалентно присоединенным на 3'-конце цепи, в которой он присутствует; и
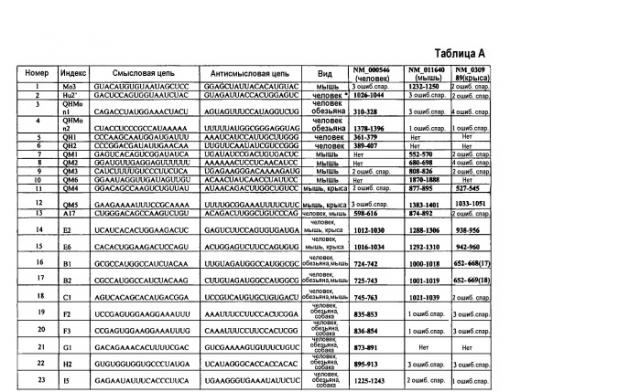
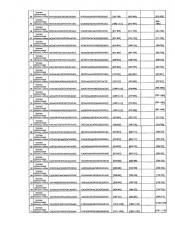
где последовательность (N)x содержит антисмысловую последовательность относительно мРНК р53, в частности, любой из антисмысловых последовательностей, представленных в любой из таблиц А, В и С.
Специалистам с квалификацией в данной области будет легко понятно, что соединения согласно изобретению состоят из множества нуклеотидов, которые связаны ковалентными связями. Каждая такая ковалентная связь может быть фосфодиэфирной связью, фосфотиоатной связью или комбинацией из обеих, вдоль длины нуклеотидной последовательности отдельной цепи. Другие возможные модификации скелета описаны, помимо прочего, в патентах США с номерами 5587361; 6242589; 6277967; 6326358; 5399676; 5489677 и 5596086.
В конкретных вариантах осуществления х и y равны предпочтительно целому числу приблизительно 19 - приблизительно 27, наиболее предпочтительно, приблизительно 19 - приблизительно 23. В конкретном варианте осуществления соединения согласно изобретению х может быть равен y (т.е. х=y) и в предпочтительных вариантах осуществления х=y=19 или х=y=21. В особенно предпочтительном варианте осуществления х=y=19.
В одном из воплощений соединения согласно изобретению и Z, и Z' отсутствуют; в другом варианте один из Z или Z' присутствует.
В одном из воплощений соединения согласно изобретению все рибонуклеотиды согласно соединению являются немодифицированными по их сахарным остаткам.
В предпочтительных вариантах воплощения соединения согласно изобретению по меньшей мере один рибонуклеотид модифицирован по его сахарному остатку, предпочтительно в положении 2'. Эта модификация в положении 2' приводит к присутствию группы, которая предпочтительно выбрана из группы, состоящей из амино, фтора, метокси, алкокси и алкильной групп. В наиболее предпочтительном в настоящее время варианте осуществления эта группа в положении 2' является метокси (2'-О-метилом).
В предпочтительных вариантах осуществления данного изобретения антисимметричные рибонуклеотиды модифицированы как в антисмысловой, так и в смысловой цепях согласно соединению. В частности, siPHK, используемая в примерах, была модифицирована таким образом, что 2'-О-Ме-группа присутствовала на первом, третьем, пятом, седьмом, девятом, одиннадцатом, тринадцатом, пятнадцатом, семнадцатом и девятнадцатом нуклеотиде антисмысловой цепи, причем та же самая модификация, т.е. 2'-О-Ме-группа, присутствовала на втором, четвертом, шестом, восьмом, десятом, двенадцатом, четырнадцатом, шестнадцатом и восемнадцатом нуклеотиде смысловой цепи. Кроме того, следует отметить, что в случае конкретных нуклеиновых кислот согласно изобретению первый сегмент является идентичным первой цепи, а второй сегмент является идентичным второй цепи, и эти нуклеиновые кислоты также являются затупленными.
В особенно предпочтительном варианте осуществления последовательность siPHK является последовательностью 15 в таблице А.
Согласно одному предпочтительному варианту осуществления согласно изобретению, обе антисмысловая и смысловая цепи молекулы siPHK являются фосфорилированными только на 3'-конце, но не на 5'-конце. Согласно другому предпочтительному варианту осуществления согласно изобретению, обе - антисмысловая и смысловая - цепи являются нефосфорилированными на 3'-конце, а также на 5'-конце. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения, 1-ый нуклеотид в положении 5' является специфически модифицированным во избежание любой возможности 5'-фосфорилирования in vivo.
В другом варианте воплощения соединения согласно изобретению, рибонуклеотиды на 5'- и 3'-концах антисмысловой цепи являются модифицированными по их сахарным остаткам, а рибонуклеотиды на 5'- и 3'-концах смысловой цепи являются немодифицированными по их сахарным остаткам.
Кроме того, изобретение связано с вектором, способным экспрессировать любой из вышеуказанных олигорибонуклеотидов в немодифицированной форме в клетке, после чего может быть произведена подходящая модификация.
Изобретение связано также с композицией, содержащей одно или несколько соединений согласно изобретению в носителе, предпочтительно фармацевтически приемлемом носителе. Эта композиция может содержать смесь двух или более различных siPHK.
Настоящее изобретение связано также с композицией, которая содержит вышеуказанное соединение согласно изобретению, ковалентно или нековалентно связанное с одним или несколькими соединениями согласно изобретению, в количестве, эффективном для ингибирования р53 человека, и носитель. Эта композиция может внутриклеточно подвергаться процессингу под действием эндогенных клеточных комплексов, с образованием одного или нескольких олигорибонуклеотидов согласно изобретению.
Настоящее изобретение связано также с композицией, содержащей носитель и одно или несколько соединений согласно изобретению в количестве, эффективном для отрицательной регуляции экспрессии в клетке р53 человека, причем это соединение содержит последовательность, по существу комплементарную последовательности (N)x.
Кроме того, данное изобретение связано со способом отрицательной регуляции экспрессии гена р53 по меньшей мере на 50% в сравнении с контролем, предусматривающим контактирование мРНК-транскрипта гена р53 с одним или несколькими соединениями согласно изобретению.
В одном варианте осуществления указанный олигорибонуклеотид отрицательно регулирует р53, причем такая отрицательная регуляция выбрана из группы, состоящей из отрицательной регуляции функции р53, отрицательной регуляции полипептида р53 и отрицательной регуляции экспрессии мРНК р53.
В одном варианте осуществления соединение вызывает отрицательную регуляцию полипептида р53, причем эта отрицательная регуляция р53 выбрана из группы, состоящей из отрицательной регуляции функции р53 (которая может быть испытана ферментативным анализом или, помимо прочего, анализом связывания с известным взаимодействующим агентом нативного гена/полипептида, отрицательной регуляции белка р53 (которая может, помимо прочего, быть испытана методом Вестерн-блоттинга, ELISA или иммунопреципитации) и отрицательной регуляции экспрессии мРНК р53 (которая может быть, помимо прочего, испытана методом Нозерн-блоттинга, количественной ОТ-ПЦР, гибридизации in situ или гибридизации микромассива (биочипа)).
Данное изобретение обеспечивает также способ лечения пациента, страдающего от заболевания, сопровождающегося повышенным уровнем полипептида р53, предусматривающий введение пациенту композиции согласно изобретению в терапевтически эффективной для лечения дозе. Предпочтительно, данное изобретение обеспечивает способ лечения пациента, страдающего от заболевания, при котором полезно временное ингибирование р53. В одном предпочтительном варианте осуществления, композиции согласно изобретению используют для лечения опухолей вместе с общепринятой химиотерапией или лучевой терапией для предупреждения алопеции, связанной с химиотерапией или лучевой терапией. В другом предпочтительном варианте осуществления, композиции согласно изобретению используют для лечения острой почечной недостаточности. Еще в одном предпочтительном варианте осуществления, композиции согласно изобретению используют в состояниях, при которых р53 активируется как следствие различных стрессов, ассоциированных с повреждениями, такими как ожог, гипертермия (перегревание организма), гипоксия, ассоциированная с блокированным кровоснабжением, например, при инфаркте миокарда, инсульте и ишемии. Временное (обратимое) ингибирование р53 с использованием молекул siPHK согласно изобретению может быть терапевтически эффективным в уменьшении или элиминации р53-зависимой смерти нейронов в центральной нервной системе, т.е. в повреждении головного мозга и спинного мозга, в консервировании ткани и органа перед трансплантацией, подготовке хозяина для пересадки костного мозга, уменьшении или элиминации нейронного повреждения во время припадка и в супрессии старения тканей.
Данное изобретение обеспечивает также применение терапевтически эффективной дозы одного или нескольких соединений согласно изобретению для приготовления композиции для лечения забо