Рекомбинантная плазмидная днк pzen16 для переноса и экспрессии генов в мицелиальном грибе acremonium chrysogenum
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, а именно к рекомбинантной плазмидной ДНК pZEN16 для переноса и гетерологичной экспрессии генов в Acremonium chrysogenum. Предложенное изобретение может быть использовано в микробиологической промышленности для получения рекомбинантных штаммов грибов Acremonium chrysogenum - суперпродуцентов цефалоспорина С. Плазмида содержит кассету экспрессии, состоящую из промотора гена глицеральдегид фосфат дегидрогеназы Aspergillus nidulans, терминатора гена фосфоглицерат киназы Saccharomyces cerevisiae, разделенных участком полилинкера. В качестве доминантного селективного маркера содержит ген гигромицин-В фосфотрансферазы Escherichia coli под контролем промотора trpC Aspergillus nidulans, определяющего устойчивость к гигромицину рекомбинантных штаммов мицелиальных грибов, трансформированных плазмидой pZEN16 и ее производными. Предложенное изобретение позволяет получать универсальный вектор для агробактериальной трансформации Acremonium chrysogenum, который позволяет осуществлять конститутивную экспрессию целевых генов, отвечающих за биосинтез и транспорт цефалоспорина С. 1 ил.
Реферат
Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в микробиологической промышленности для получения рекомбинантных штаммов грибов Acremonium chrysogenum - суперпродуцентов цефалоспорина С.
Предлагается:
- рекомбинантная ДНК pZEN16, сконструированная на основе бинарного вектора рСАМВ1А1300, несущая кассету экспрессии целевых генов, которая состоит из промотора гена глицеральдегид фосфат дегидрогеназы Aspergillus nidulans (gpdA), терминатора гена фосфоглицерат киназы Saccharomyces cerevisiae (PGK1), разделенных участком полилинкера, содержит в качестве доминантного селективного маркера ген гигромицин-В фосфотрансферазы Escherichia coli (hph) под контролем промотора trpC A. nidulans, определяющего устойчивость к гигромицину рекомбинатных штаммов A.chrysogenum, трансформированных плазмидой pZEN16 и ее производными.
Уровень техники
Цефалоспорины - обширный класс антибиотиков с мощным бактерицидным действием, низкой токсичностью, широким терапевтическим диапазоном [1]. Исходным субстратом для получения полусинтетических цефалоспоринов является цефалоспорин С (цефС), продуцируемый аскомицетом A.chrysogenum.
На протяжении последних тридцати лет был достигнут значительный прогресс в селекции промышленных штаммов A.chrysogenum - суперпродуцентов цефС, изучении биохимических путей биосинтеза пенициллинов и цефалоспоринов у Penicillium chrysogenum и A.chrysogenum, соответственно, идентификации генов, контролирующих биосинтез этих бета-лактамов и характера их регуляции [2, 3].
Эти успехи, а также разработка методов генетического манипулирования с Р.chrysogenum и A.chrysogenum открыли путь усовершенствованных промышленных штаммов этих грибов с использованием технологий рекомбинантных ДНК [4].
Рекомбинантные штаммы A.chrysogenum достаточно широко используются для изучения различных аспектов биосинтеза цефС [5] и создания более эффективных продуцентов [6, 7]. Следует отметить, что методы генно-инженерных манипуляций с A.chrysogenum, несмотря на многолетние исследования этого важного промышленного микроорганизма, нельзя признать достаточно эффективными. В отличие от A.nidulans, Neurospora crassa, P.chrysogenum для A.chrysogenum не разработаны приемы ауксотрофной комплементации, а набор доступных селективных маркеров ограничен несколькими генами устойчивости к антибиотикам.
Распространенным приемом получения рекомбинантных штаммов многих грибов, в том числе A.chrysogenum [8], является протопластная трансформация. Общими недостатками методов протопластной трансформации грибов являются трудоемкость и значительное количество артефактов (перестройки трансформирующей ДНК, многокопийная интеграция и т.д.).
Перспективной альтернативой протопластной трансформации грибов является трансформация, опосредованная Agrobacterium tumefaciens (Agrobacterium tumefaciens-mediated transformation, или АТМТ). Помимо технической простоты, АТМТ отличается значительной эффективностью, повышенной частотой гомологичной рекомбинации и высоким выходом однокопийных интегрантов [9]. На протяжении последних лет АТМТ была с успехом использована для трансформации спор, гиф и даже плодовых тел самых разных грибов.
К настоящему времени известны различные бинарные векторы для агробактериальной трансформации A.chrysogenum, несущие гены устойчивости к антибиотикам генитицину и флеомицину под контролем промоторов trpC A.nidulans, TEF1 Ashbya gossypii, TEF1 S.cerevisiae, с помощью которых удается осуществлять генетичекую трансформацию штаммов A.chrysogenum как дикого типа, так и промышенного штамма - суперпродуцента цефалоспорина С [10].
Недостатками известных векторов для агробактериальной трансформации A.chrysogenum являются их низкая копийность, большой размер, ограниченный диапазон клеток-хозяев, что существенно затрудняет их использование для дальнейших генетических манипуляций с A.chrysogenum.
В настоящем изобретении была поставлена задача получения удобного универсального вектора для агробактериальной трансформации A.chrysogenum, позволяющего осуществлять конститутивную экспрессию целевых генов у этих мицелиальных грибов.
Раскрытие изобретения
Поставленная цель получения нового вектора для переноса и экспрессии генов в A.chrysogenum с использованием методов агробактериальной трансформации была достигнута за счет того, что сконструирована рекомбинантная ДНК pZEN16, несущая кассету экспрессии, состоящую из промотора гена gdpA A.nidulans, терминатора гена PGK1 S.cerevisiae, разделенных участком полилинкера, маркерный ген hph E.coli под контролем промотора trpC A.nidulans для селекции гигромицин-устойчивых трансформантов мицелиальных грибов, встроенных в состав бинарного вектора рСАМВ1А1300.
Выбор промотора gpdA в качестве последовательности инициации транскрипции в составе «кассеты экспрессии» вектора pZEN16 обусловлен тем, что данный промотор обеспечивает высокую конститутивную экспрессию гетерологичных генов в A.chrysogenum, P.chrysogenum и многих других видах мицелиальных грибов [11]. Выбор 3'-нетранслируемой последовательности гена PGK1 S.cerevisiae в качестве терминатора транскрипции связан с тем, что эта последовательность содержит консервативные для многих видов грибов участки терминации транскрипции и полиаденилирования мРНК. Выбор гена hph в качестве доминантного селективного маркера для трансформации A.chrysogenum обусловлен тем, что уровень чувствительности многих видов грибов к данному антибиотику находится в относительно низких пределах его концентраций по сравнению с антибиотиками генитицином и флеомицином [8, 9]. Выбор промотора trpC A.nidulans для экспрессии гена hph в клетках A.chrysogenum обусловлен тем, что данная последовательность способна направлять транскрипцию гетерологичных генов в А.chrysogenum и многих других видах промышленно важных мицелиальных грибов [8]. Выбор плазмиды рСАМВ1А1300 в качестве вектора-носителя плазмиды pZEN16 обусловлен тем, что по сравнению с другими распространенными бинарными векторами, способными реплицироваться в клетках A.tumefaciens и E.coli, плазмиды серии pCAMBIA обладают меньшим размером, что упрощает процедуры получения новых рекомбинатных плазмид на их основе, повышенной копийностью и стабильностью в клетках E.coli и A.tumefaciens [12], что позволяет использовать производные от pCAMBIA вектора для проведения как агробактериальной, так и протопластной трансформации грибов.
Нуклеотидную последовательность, кодирующую промотор gdpA (SEQ ID №1), получили из коммерческой плазмиды pBARGPEl [13].
Нуклеотидную последовательность терминатора PGK1 (SEQ ID №5) получали методом полимеразной цепной реакции (ПЦР) с использованием в качестве матрицы полазмидной ДНК Yep40AB, обспечивающей экспрессию и секрецию эпидермального фактора роста человека в клетках дрожжей [14], а в качестве праймеров - синтетических олигонуклеотидов с нуклеотидными последовательностями SEQ ID №4 (праймер tPGK_F) и SEQ ID №5 (праймер tPGK_R).
Нуклеотидную последовательность гена hph под контролем промотора trpC A.nidulans получали из коммерческой плазмиды рСВ1003 [15].
В ходе конструирования вектора pZEN16 была создана промежуточная плазмида pZENll, несущая «кассету экспрессии» с промотором gdpA A.nidulans и терминатором PGK1 S.cerevisiae.
Для проверки способности плазмиды pZenl6 направлять экспрессию гетерологичных генов в A.chrysogenum проведено конструирование тестерной плазмиды pZenl6Z, производной от pZenl6, содержащей ген устойчивости к зеоцину Sh-ble из Streptoalloteichus hindustanus под контролем промотора gpdA A.nidulans плазмиды pZenl6.
С использованием плазмид pZenl6 и pZenl6Z проведена агробактериальная трансформация реципиентного штамма A.chrysogenum ATCC11550. Полученные гигромицин-устойчивые трансформанты охарактеризованы методом ПЦР и таким образом получено доказательство переноса гетерологичных генов в A.chrysogenum с помощью плазмиды pZenl6 и ее производных. Трансформанты A.chrysogenum, полученные с использованием плазмиды pZenl6Z, обладают дополнительной устойчивостью к зеоцину, что доказывает способность плазмиды pZenl6 направлять экспрессию чужеродных генов в A.chrysogenum.
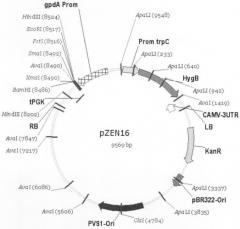
Таким образом, объектом настоящего изобретения является рекомбинантная плазмидная ДНК pZEN16, сконструированная на основе бинарного вектора рСАМВ1А1300, несущая кассету экспрессии целевых генов для A.chryogenum, которая состоит из промотора гена глицеральдегид фосфат дегидрогеназы A.nidulans (gpdA), терминатора гена фосфоглицерат киназы S.cerevisiae (PGK1), разделенных участком полилинкера, содержащего уникальные сайты рестрикции для эндонуклеаз EcoRI, PstI, KpnI, ApaI, SmaI, BamHI.
Плазмида pZEN16 несет маркерный ген аминогликозидфосфотрансферазы, определяющий устойчивость к канамицину штаммов E.coli и A.tumefaciens, трансформированных данной плазмидой и ее производными. Репликация плазмиды pZEN16 в клетках E.coli осуществляется под контролем репликона pBR322. В клетках A.tumefaciens репликация плазмиды pZEN16 осуществляется под контролем репликона PVS-1. Плазмида pZEN16 содержит в качестве доминантного селективного маркера ген hph E.coli под контролем промотора trpC A.nidulans, определяющего устойчивость к гигромицину рекомбинатных штаммов мицелиальных грибов, трансформированных плазмидой pZEN16 и ее производными.
Рекомбинантная плазмидная ДНК pZEN16 характеризуется нуклеотидной последовательностью SEQ ID №11.
Краткое описание чертежей
На чертеже проиллюстрированы физическая и генетическая карты вектора pZEN16.
Обозначено положение промотора trpC A.nidulans, гена устойчивости к гигромицину (HygB), терминатора CAMV, «правой» и «левой» границ Т-ДНК (RB и LB), гена устойчивости к канамицину (KanR), участков начала репликации pBR322 и pVS-1, терминатора PGK1, полилинкера и промотора gpdA A.nidulans.
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [16, 17]. Конструирование вектора pZEN16 проводят в несколько стадий.
Пример 1. Конструирование плазмиды с «кассетой экспрессии» гетерологичных генов для A.chrysogenum.
А) Конструирование промежуточной плазмиды pZEN11.
В качестве источника промотора гена gddA A.nidulans используют плазмиду pBARGPEl[13]. Для получения фрагмента, кодирующего промоторную последовательность gpdA A.nidulans (SEQ ID №1), 5 мкг плазмиды pBARGPEl гидролизуют совместно рестриктазами NdeI/HindIII и выделяют из агарозного геля с помощью набора MinElute Gel Extraction Kit (Qiagen, США) NdeI/HindIII фрагмент размером 1030 п.н. Выделенный фрагмент лигируют с NdeI/HindIII вектором pTagCFP-N («Евроген», Москва), выделенным из агарозного геля. Используют следующие условия лигирования: 1 мкл вектора (20 нг/мкл), 1 мкл фрагмента (50 нг/мкл), 2 мкл 5-кратного лигазного буфера (Gibco-BRL), 5 мкл воды и 1 мкл Т4 ДНК лигазы (1 ед/мкл, Сибэнзим). Смесь инкубируют в течение 14 часов при 12°С, затем прогревают 15 мин при 65°С, охлаждают во льду и 5 мкл смеси используют для трансформации компетентных клеток штамма XLl-Blue recAl endAl gyrA96 thi-1 hsdR17 supE44 relAl lac [F'proAB laclgZ□M15 Tn10(Tetr)] (Stratagene, США).
Из полученных канамицин-устойчивых трансформантов выделяют препараты плазмидной ДНК с использованием набора Wizard MiniPreps Kit (Promega, США). Полученные образцы ДНК анализируют совместным гидролизом рестриктазами NdeI/HindIII и отбирают «положительные» клоны, содержащие NdeI/HindII фрагменты размером 100 и 4300 п.н. Несколько «положительных» клонов проверяют секвенированием с использованием праймера SeqCFP (SEQ ID №2) и сравнивают полученную последовательность с последовательностью gpdA промотора A-nidulans [18, Номер доступа в Genbank EMEGPDA]. Отобранную таким образом плазмиду обозначают pZEN11.
Б) Конструирование промежуточной плазмиды pZEN12.
Для введения в состав «кассеты экспрессии» последовательности терминатора транскрипции в плазмиду pZEN11 клонируют последовательность терминатора гена PGK1 S.cerevisiae. Для получения последовательности tPGK (SEQ ID №3) на матрице плазмиды Yep40AB [14] проводят ПЦР с праймерами tPGK_F (SEQ ID №4) и tPGK_R (SEQ ID №5) и получают фрагмент размером 285 п.н. Выделенный из агарозного геля фрагмент гидролизуют рестриктазой ВаmHI и клонируют в HindIII «тупой» ВаmHI вектор pZEN11. Полученные канамицин-устойчивые трансформанты штамма E.coli XL1 анализируют методом ПЦР-скрининга с использованием праймеров gpdA_F (SEQ ID №6) и tPGK_R и идентифицируют клон, образующий при ПЦР фрагмент размером 700 п.н. Из отобранных «положительных» клонов выделяют плазмидную ДНК, которую секвенируют с использованием праймера gpdA_F. Полученную последовательность сравнивают с последовательностью терминатора гена PGK S.cerevisiae [19, Номер доступа в Genbank YSCPGK] и отбирают плазмиду со вставкой последовательности терминатора PGK1 S.cerevisiae без ПЦР-мутаций. Полученную плазмиду обозначают pZEN12.
Пример 2. Конструирование вектора pZEN16
Конструирование плазмиды pZEN16 проводят в две стадии.
А) Конструирование промежуточной плазмиды pZEN14
Ген hph E.coli в составе плазмиды pCAMBIA1300 (Номер доступа в Genbank AF234296) находится под контролем промотора 35S вируса мозаики цветной капусты. Для замены этого промотора на промотор trpC A-nidulans, функционирующий в клетках грибов на матрице плазмиды рСВ1003 [15] с использованием праймеров HyglF (SEQ ID №7) и HyglR (SEQ ID №8), получают ПЦР фрагмент размером 470 п.н., который после выделения из агарозного геля и гидролиза рестриктазами BglII/AatII клонируют в ВаmHIАаtII вектор pCAMBIA1300. Селекцию «положительных» клонов среди полученных канамицин-устойчивых трансформантов штамма E.coli XL1 проводят с использованием ПЦР-скрининга с парой праймеров HyglR (SEQ ID №8) и Uni46 (SEQ ID №9) по образованию фрагмента размером 530 п.н. Выделенные из отобранных клонов препараты плазмидной ДНК секвенируют с праймера Uni46 и идентифицируют клон, содержащий нужную вставку без ПЦР-мутаций. Полученную плазмиду обозначают pZEN14.
Б) Конструирование плазмиды pZEN16
Для переноса «кассеты экспрессии» из плазмиды pZEN12 в вектор pZEN14 получают фрагмент ДНК, включающий промотор gpdA A.nidulans и терминатор PGK1 S.cerevisiae, разделенные участком полилинкера с помощью ПЦР-амплификации на матрице плазмиды pZEN12 с использованием праймеров gpdAU (SEQ ID №10) и tPGK_R (SEQ ID №5) и Pfu-полимеразы. Выделенный ПЦР-фрагмент гидролизуют рестриктазой SpeI и клонируют в HindIII «тупой»/XbaI вектор pZEN14. Селекцию нужных клонов проводят методом ПЦР-скрининга с использованием праймеров gdpA_F (SEQ ID №6) и tPGK_R (SEQ ID №5) по образованию фрагмента размером 600 п.н.
Условия проведения ПЦР: 94°С, 5 мин - (первичная денатурация), 94°С, 30 сек - денатурация; 50°С, 30 сек - отжиг; 72°С, 30 сек - элонгация, 30 циклов.
Отобранные положительные клоны секвенируют и отбирают клон, содержащий нужную плазмиду без ПЦР-мутаций, которую обозначают pZEN16.
Рекомбинантная плазмидная ДНК pZEN16 характеризуется нуклеотидной последовательностью SEQ ID №11.
Размер плазмиды pZEN16 составляет 9,57 т.п.о. Плазмида pZEN16 состоит из следующих элементов:
- фрагмента ДНК бинарного бактериального вектора рСАМВIА1300 размером 6, 3 т.п.о., ограниченного левой и правой границами Т-ДНК, включающего бактериальный ген KanR, область начала репликации плазмиды pBR322, область начала репликации плазмиды pVS-1,
- фрагмента ДНК размером 0,29 т.п.о., содержащего область терминации транскрипции гена PGK1 Saccharomyces cerevisiae,
- полилинкера, содержащего уникальные сайты распознавания для рестриктаз BamHI, SmaI, ApaI, KpnI, PstI, EcoRI,
- фрагмента ДНК размером 0,75 т.п.о., содержащего промотор гена gdpA A. nidulans,
- фрагмента ДНК размером 0,36 т.п.о., содержащего промотор гена trpC A.nidulans,
- фрагмента ДНК размером 1,04 т.п.о., содержащего бактериальный ген HygB, фрагмента размером 0,2 т.п.о., содержащего область терминации транскрипции гена 35S вируса CaMV.
Физическая и генетическая карты плазмиды pZEN16 приведены на чертеже.
Пример 3. Конструирование тестерной плазмиды pZenl6Z.
Для проверки способности плазмиды pZenl6 направлять экспрессию гетерологичных генов в A.chrysogenum проводят конструирование тестерной плазмиды pZenl6Z, производной от pZenl6, содержащей ген устойчивости к зеоцину Sh-ble из Streptoalloteichus hindustanus под контролем промотора gpdA A.nidulans плазмиды pZen16.
Для получения гена Sh-ble на матрице плазмиды pZEM6 [10] проводят ПЦР с использованием праймеров ZeoF (SEQ ID №12) и ZeoR (SEQ ID №13), полученный 390 пн фрагмент гидролизуют рестриктазами EcoRI/BamHI и встраивают в EcoRI/BamHi вектор pZEN16. Селекцию нужных клонов проводят методом ПЦР-скрининга с использованием праймеров gdpA_F (SEQ ID №6) и ZeoR по образованию фрагмента размером 450 п.н.
Отобранные положительные клоны секвенируют и отбирают клон, содержащий нужную плазмиду без ПЦР-мутаций, которую обозначают pZEN16Z.
Пример 4. Получение «донорных» штаммов A.tumefaciens для проведения агробактериальной трансформации A.chrysogenum.
Для осуществления переноса и экспрессии гетерологичных генов в A.chrysogenum с помощью плазмиды pZenl6 и ее производных методом агробактериальной трансформации сначала методом электропорации [20] получают рекомбинатные штаммы A.tumefaciens, содержащие нужные плазмиды.
Для приготовления электрокомпетентных клеток штамма A.tumefaciens AGL1 [21] изолированную колонию штамма агробактерий помещают в 20 мл среды LB (5 г/л дрожжевого экстракта, 10 г/л бактопептона, 10 г/л хлорида натрия) и инкубируют ночь на качалке при 28°С и 150 об/мин. Полученной ночной культурой (1 мл) инокулируют 100 мл свежей среды LB, содержащей 10 мг/мл рифампицина. Выращивают при 28°С на качалке и 200 об/мин до оптической плотности OD600 от 0.5 до 0.9. Культуру охлаждают на льду в течение 15 мин и осаждают центрифугированием в стерильных 50 мл пробирках «Фалкон» при 4000хg в течение 10 мин при 4°С. Полученный осадок клеток дважды промывают 10 мл холодной деионизованной воды и центрифугируют при 4000xg в течение 10 мин при 4°С, супернатант удаляют. Осадок суспендируют в 2 мл холодного 10% глицерина. Центрифугируют при 4000xg в течение 10 мин при 4°С; супернатант удаляют. Клетки суспендируют в 200-300 мкл холодного 10% глицерина, аликвоты клеток по 50 мкл разливают в 1,5 мл микроцентрифужные пробирки, замораживают в жидком азоте и хранят при -70°С.
Для проведения трансформации аликвоты клеток смешивают с 1 мкл растворов плазмидной ДНК pZENl6 и pZENl6Z, содержащего 10-100 пг ДНК, полученные суспензии помещают в охлажденную кювету от электропоратора Eppendorf с диаметром щели 0,1 мм и подвергают электропорации в следующих условиях: напряжение - 1.8 кB, сопротивление 200 Ω, емкость 25 µF. В кюветы немедленно добавляют 800 мкл среды LB, предварительно прогретой до 28°С, переносят содержимое в 1,5 мл микроцентрифужные пробирки и инкубируют 3 часа при 28°С. Высевают 100 мкл суспензии клеток на чашки со средой LB, содержащей 50 мкг/мл канамицина, и инкубируют при 28°С в течение 48 часов до появления колоний. С помощью стерильной зубочистки часть биомассы отдельных полученных колоний помещают в 25 мкл смеси для ПЦР, содержащей праймеры HyglF (SEQ ID №7) и Hyg 1R (SEQ ID №8), и проводят ПЦР в условиях, описанных в Примере 2.
Полученную смесь анализируют электрофорезом в 1,5% агарозном геле и идентифицируют фрагмент размером 470 п.н. Отобранные штаммы обозначают как AGLl/pZenl6 и AGLl/pZenl6Z, высевают на чашки с твердой средой LB, содержащей 10 мкг/мл рифампицина и 50 мкг/мл канамицина с образованием отдельных колоний, и используют для проведения трансформации A.chrysogenum.
Пример 5. Подготовка культур A. chrysogenum и A. tumefaciens к трансформации.
А) Подготовка реципиентной культуры штамма A. chrysogenum ATCC11550.
Штамм A. chrysogenum ATCC11550, выращенный на картофельно-глюкозном агаре, высевают в 20 мл посевной среды с 28 г/л дрожжевого экстракта, 16 г/л пептона, 9,2 г/л мальт-экстракта, 4 г/л мела, 2 г/л соевого масла, рН 7,3. Клетки выращивают в 200 мл колбе Эрленмейра на качалке при 200 об/мин при 25°С в течение 48 часов. Выросшую культуру центрифугируют при 4000хg в течение 10 мин при 4°С, супернатант удаляют, осадок клеток суспендируют в 10 мл стерильной водопроводной воды и хранят при 4°С в течение 2 суток до проведения трансформации.
Б) Подготовка донорных культур агробактерий
Штаммы A.tumefaciens AGLl/pZenl6, AGLl/pZenl6 и AGLI (отрицательный контроль), выращенные на твердой среде LB, высевают в 10 мл среды LB с добавлением необходимых антибиотиков и культивируют на качалке при 28°С при 200 об/мин до оптической плотности OD600~0.5-0.9. Клетки осаждают центрифугированием при 4000xg в течение 10 мин при комнатной температуре, еупернатант отбрасывают, а клетки суспендируют в 2 мл среды IM следующего состава:
1 мМ калий-фосфатный буфер, рН 4,8, 0,06% MgSO4·7H2O, 0,03% NaCl, 10 мг/л CaCl2, 1 мг/л FeSO4, 500 мг/л Н3ВО3, ZnSO4·7Н2O, CuSO4·5Н2O, MnSO4·Н2О и Na2MoO4·2Н2O (каждого), 400 мг/л NH4NO3, 0,5% глицерина, 40 мМ MES рН 5,5, 0,02% глюкозы.
Полученную суспензию переносят в 2 мл микроцентрифужную пробирку и центрифугируют при 4000xg 5 мин при комнатной температуре. Клетки промывают в 500 мкл среды IM и суспендируют осадок в 150 мкл среды IM. Клеточную суспензию разводят до оптической плотности OD600=0.15 в среде IM с добавлением 200 µМ ацетосирингона. Клетки выращивают 8-12 часов при интенсивной аэрации в 100 мл колбе Эрленмейра при 28°С до OD600=0.3.
Пример 6. Кокультивирование A. chrysogenum и A. tumefaciens.
Для приготовления смесей клеток грибов и агробактерий для трансформации к 100 мкл суспензии мицелия A.chrysogenum ATCC11550, полученной как описано в примере 5(А), добавляют (в отдельных пробирках) по 100 мкл клеток штаммов AG11, AGLl/pZenl6 и AGLl/pZenl6Z, выращенных на IM среде с ацетосирингоном (Пример 5(Б). Полученные смеси высевают на поверхность целлофановых дисков, помещенных на чашки Петри (диаметр=90 мм) с твердой средой IM, содержащей 200 µM ацетосирингона. Чашки инкубируют 60 часов при 23°С до образования видимого плотного слоя мицелия.
Пример 6. Селекция трансформантов.
После кокультивирования с помощью стерильного пинцета переносят целлофановые диски с культурами с чашек Петри с IM средой на селективные чашки Петри с картофельно-глюкозным агаром с 200 µМ цефотаксима и 50 мкг/мл гигромицина В (PDA+Cf+Hyg).
На 5-7 день на чашках с культурами A.chrysogenum ATCC11550+AGLl/pZenl6Z ATCC11550+AGLl/pZenl6 наблюдают образование от 2 до 8 видимых колоний трансформантов. На чашках с культурами A.chrysogenum ATCC11550+AGL1 (отрицательный контроль) колонии отсутствуют.
Колонии переносят на свежие чашки PDA+Cf+Hyg, выращивают в течение недели, повторяют процедуру два раза.
Пример 7. Анализ трансформантов.
Для подтверждения факта переноса в ходе проведенной трансформации участка плазмиды pZenl6 между «левой» и «правой» границами Т-ДНК с геном hph в геном A.chrysogenum ATCC11550 проводят ПЦР-анализ полученных гигромицин-устойчивых штаммов A.chrysogenum.
Для выделения геномной ДНК 200-300 мкл мицелия полученных трансформантов переносят в 2 мл микроцентрифужную пробирку и лиофилизуют. Высохший мицелий измельчают и суспендируют в 700 мкл буфера, содержащего 10 mM Tris-HCl, 100 mМ EDTA, 0.5% SDS, рН 8. Смесь инкубируют 30 мин при 65°С и экстрагируют 1 раз фенолом, насыщенным 100 mM Tris-HCl, рН 8 и 1 раз - фенол-хлороформом. К полученным после центрифугирования и разделения фаз водным экстрактам добавляют 10 мкл раствора РНКазы А (10 мг в мл в 50 мМ ацетате натрия, рН 4,5), инкубируют 30 мин при 37°С. Смесь экстрагируют последовательно фенолом, фенол-хлороформом и хлороформом, добавляют к водной фазе 100 мкл 3М ацетата натрия, рН 6 и осаждают нуклеиновые кислоты 3 объемами холодного этанола. Осадок растворяют в 100 мкл ТЕ-буфера.
Полученные образцы анализируют методом ПЦР для подтверждения факта переноса гетерологичного гена hph в геном A.chrysogenum.
Для этого по 1 мкл ДНК, выделенной из каждого из независимых трансформантов, а также 1 мкл препарата суммарной ДНК штамма AGl1/pZenl6 (100 нг/мкл) используют в качестве матрицы для проведения ПНР-реакций с тремя парами праймеров:
1) VirF (SEQ ID №16) и VirR (SEQ ID №17) - специфичны к участку гена VirB области Ti-плазмиды штамма AGL1- отрицательный контроль, проверка на контаминацию культурой агробактерий.
2) nptIIIF (SEQ ID №18) и nptIIIR (SEQ ID №19) - специфичны к гену KanR плазмиды pZenl6 - отрицательный контроль, проверка на контаминацию плазмидной ДНК.
3) HyglF (SEQ ID №7) HyglR (SEQ ID №8) - специфичны к гену hph плазмиды pZenl6 -положительный контроль, проверка на перенос гена hph в геном A.chrysognum.
Полученные смеси анализируют электрофорезом в 1% агарозном геле и идентифицируют фрагменты размером 470 пн (праймеры HyglF/HyglR), 250 пн (праймеры nptIII F/nptIII R), 300 пн (праймеры VirF/VirR). Наличие в исследуемых образцах фрагмента 470 пн при осутствии фрагментов 300 пн и 250 пн интерпретируют как доказательство переноса участка плазмиды pZenl6 между «левой» и «правой» границами Т-ДНК с геном hph в геном A.chrysogenum ATCC11550.
Для доказательства способности плазмиды pZenl6 направлять экспрессию гетерологичных генов в A.chrysogenum анализируют устойчивость к зеоцину трансформантов, полученных с использованием штаммов AGLl/pZenl6Z и AGLl/pZenl6. Гигромицин-устойчивые колонии переносят на чашки PDA+Cf+Hyg, содержащие 10 мкг/мл зеоцина. Через неделю на чашках с культурами ATCC11550+AGLl/pZenl6Z отмечают рост колоний, при этом на чашках с культурами ATCC11550+AGLl/pZenl6 рост отсутствует. Эти факты интерпретируют как доказательство экспрессии гетерологичного гена ShBle под контролем промотора gpdA A.nidulans плазмиды pZenl6Z (производной от pZenl6) в трансформантах A.chrysogenum.
Рекомбинантная плазмидная ДНК pZEN16 для переноса и гетерологичной экспрессии генов в Acremonium chrysogenum, представленная нуклеотидной последовательностью SEQ ID №11 и имеющая размер 9,57 т.п.о. с молекулярной массой 5,913 мДа, физическая и генетическая карта которой приведена на фиг.1, состоящая из следующих элементов:- фрагмента ДНК бинарного бактериального вектора рСАМВ1А1300 размером 6,3 т.п.о., ограниченного левой и правой границами Т-ДНК, включающего бактериальный ген KanR, область начала репликации плазмиды pBR322, область начала репликации плазмиды pVS-1, фрагмента ДНК размером 0,29 т.п.о., содержащего область терминации транскрипции гена PGK1 Saccharomyces cerevisiae, полилинкера, содержащего уникальные сайты распознавания для рестриктаз BamHI, SmaI, ApaI, KpnI, PstI, EcoRI, фрагмента ДНК размером 0,75 т.п.о., содержащего промотор гена gdpA Aspergillus nidulans, фрагмента ДНК размером 0,36 т.п.о., содержащего промотор гена trpC A.mdulans, фрагмента ДНК размером 1,04 т.п.о., содержащего ген hph Escherichia coli, фрагмента размером 0,2 т.п.о., содержащего область терминации транскрипции гена 35S вируса CaMV.