Способ in vitro определения прогноза развития заболевания у больного раком и способ in vitro мониторинга эффекта терапии, назначаемой больному раком
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к способам in vitro определения стадии или тяжести заболевания раком у больного или контролирования эффекта терапии, назначаемой больному раком, и может быть использовано в медицине. Способ определения прогноза развития заболевания у больного раком предусматривает оценку уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, и сравнение полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани. По повышенным уровням экспрессии гена холинкиназы альфа дифференцируют больных с худшим прогнозом развития заболевания. Способ in vitro мониторинга эффекта противораковой терапии осуществляют путем оценки уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, которому вводится противоопухолевый агент, и сравнения полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани. При этом эффективная терапия снижает уровни экспрессии гена холинкиназы альфа или вызывает реверсирование эффектов высокой экспрессии указанного гена. Изобретение позволяет эффективно определять прогноз развития заболевания у больного раком или проводить мониторинг эффекта противораковой терапии у пациента. 2 н. и 4 з.п. ф-лы, 27 ил., 3 табл.
Реферат
Область техники
Настоящее изобретение относится к способу идентификации и оценки эффективности соединений для лечения ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок, с целью разработки новых медицинских продуктов, а также к агентам, ингибирующим экспрессию и/или активность белка холинкиназы альфа и/или эффекты такой экспрессии.
Уровень техники
Холинкиназа (также известная как CK, CHK и ChoK) является начальным ферментом пути Кеннеди или пути синтеза фосфатидилхолина (РС) и фосфорилирует холин, превращая его в фосфорилхолин (PCho), в присутствии магния (Mg2+) и при участии аденозин-5'-трифосфата (АТФ) в качестве донора фосфатной группы. Опосредованная различными онкогенами трансформация индуцирует высокие уровни активности холинкиназы, вызывающие аномальное повышение внутриклеточных уровней продуктов холинкиназы, PCho, что служит косвенной поддержкой роли холинкиназы в образовании опухолей у человека. Однако существуют альтернативные механизмы образования PCho, которые не вызывают активацию холинкиназы и могли бы служить объяснением высоких уровней этого метаболита в опухолевых клетках.
Хотя засвидетельствовано, что активность фермента холинкиназы в опухолях и трансформированных клетках увеличивается, недостаточно продемонстрировано то, связано ли такое увеличение с канцерогенным процессом, поскольку не установлена ясная причинно-следственная связь между увеличением активности холинкиназы и опухолевой трансформацией. С другой стороны, до сих пор не идентифицирована молекула, ответственная за данный эффект.
Приблизительно 200 последовательностей генов, кодирующих полипептиды с первичной структурой, гомологичной холинкиназе, идентифицировано и обозначено как холинкиназа альфа а, холинкиназа альфа b, холинкиназа альфа 3, холинкиназа бета 1, холинкиназа бета 2, холинкиназа СКВ-1, холин/этаноламинкиназа, подобная холинкиназе этаноламинкиназа, Cots, Duff227, Cog3173 CPT1B, SF1, SHOX2, FHOD2, FLJ12242, KRT5, FBL, ARL6IP4 и т.п. (см. http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi#219541) как у человека, так и у других млекопитающих и грызунов (крыс, мышей, коров, морских свинок, кроликов, обезьян). На самом деле с 1982 года биохимически засвидетельствовано, что в различных тканях, выделенных из организма крыс, мышей и человека, существует по меньшей мере три изофермента с холинкиназной активностью, проявляющих различные физико-химические свойства.
По меньшей мере три гена, кодирующих белки с продемонстрированной холинкиназой активностью, недавно идентифицировано в геноме человека и обозначено как ck-альфа, ck-бета и HCEKV (заявка на патент США №2003186241), а также идентифицировано несколько генов, кодирующих белки, гомологичные на 30-65% белкам, кодируемым генами ck, таких как, например, гены CAI16602, CHKL, CAI16600, CAI16599, CAH56371, CAI16603, BAA91793, CAI16598, описанные на сайте htth://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi, и гены CPT1B, EKI2, SF1, SHOX2, FHOD2, FLJ12242, KRT5, FBL, ARI61pS, TOMM40, MLL, описанные на сайте http://www.ebi.ac.uk/cgi-bin/sumtab?tool=asdblast&jobid=blast-20050412-18072127. Очень уместная здесь характеристика различных изоферментов холинкиназы заключается в том, что они имеют различные биохимические свойства, и существуют значительные вариации в их сродстве к субстрату - холину или донору фосфата - АТФ, и даже вариации в их активной форме, которая может быть представлена в виде димеров или тетрамеров. Следовательно, необходимо определить, существует ли прямая связь между каким-либо из различных идентифицированных изоферментов холинкиназы и онкогенной способностью, приписанной их сверхэкспрессии в опухолях человека.
С другой стороны, как было установлено, ингибирование холинкиназы является новой и эффективной противоопухолевой стратегией для трансформированных онкогенами клеток, экстраполированной in vivo на голых мышей. Недавно опубликовано сообщение об увеличении активности холинкиназы в нескольких карциномах молочной железы человека, и наблюдалось, что изменение холинкиназы является частым событием в некоторых опухолях человека, таких как опухоли легкого, толстой и прямой кишок, а также предстательной железы.
Несмотря на корреляцию между теми или иными параметрами в настоящее время нет свидетельства, несомненно доказывающего, что сверхэкспрессия холинкиназы обладает онкогенной и опухолевой активностью в клетках человека. Засвидетельствовано, что ингибиторы холинкиназной активности, такие как гемихолиний-3 [Cuadrado A., Carnero A., Dolfi F., Jimenez B. and Lacal J.C. Oncogene 8, 2959-2968 (1993); Jimenez B., del Peso L., Montaner S., Esteve P. and Lacal J.C. J. Cell Biochem. 57, 141-149 (1995); Hernandez-Alcoceba R., Saniger L., Campos J., Nufiez M.C., Khaless F., Gallo M.A., Espinosa A., Lacal J.C. Oncogene, 15, 2289-2301 (1997)] или метиленхиноны с низкой токсичностью, описанные в заявке на патент Испании №200503263, обладают противоопухолевой активностью. Однако в вышеуказанных документах, как и в остальном предшествующем уровне техники, не было убедительно засвидетельствовано, что различные изоферменты с продемонстрированной холинкиназой активностью (ck-альфа, ck-бета, HCEKV и т.п.), идентифицированные в тканях человека, могли бы отвечать за обнаруженную ферментативную активность, а также нет указания на то, какой из изоферментов чувствителен к ингибированию обладающими противоопухолевой активностью ингибиторами. Такая идентификация изофермента необходима для установления его возможного использования в качестве мишени для лечения рака.
Объект изобретения
Главным объектом настоящего изобретения является способ in vitro обнаружения, идентификации и оценки эффективности соединений для лечения ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок.
Еще один объект настоящего изобретения основан на использовании нуклеотидных или пептидных последовательностей, происходящих из гена холинкиназы альфа, в способе обнаружения, идентификации, разработки и оценки эффективности соединений для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Другим объектом настоящего изобретения является обеспечение агентов, отличающихся тем, что они ингибируют экспрессию и/или активность белка холинкиназы альфа, для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая один или несколько терапевтических агентов вместе с фармацевтически приемлемым наполнителем, для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Также объектом настоящего изобретения является способ in vitro контролирования эффекта терапии, назначаемой больному раком, отличающийся тем, что оценку уровня экспрессии белка холинкиназы альфа в образце ткани, выделенном из больного, которому вводится противоопухолевый агент, осуществляют посредством определения в указанном образце по меньшей мере одного относящегося к белку холинкиназе альфа параметра, который выбирают из группы, состоящей из уровня его информационной РНК, концентрации указанного белка или его ферментативной активности, и сравнения полученной величины с величиной, соответствующей одному или нескольким образцам нормальной нераковой ткани.
Наконец, еще один объект настоящего изобретения представляет собой диагностический набор для осуществления настоящего изобретения.
Описание чертежей
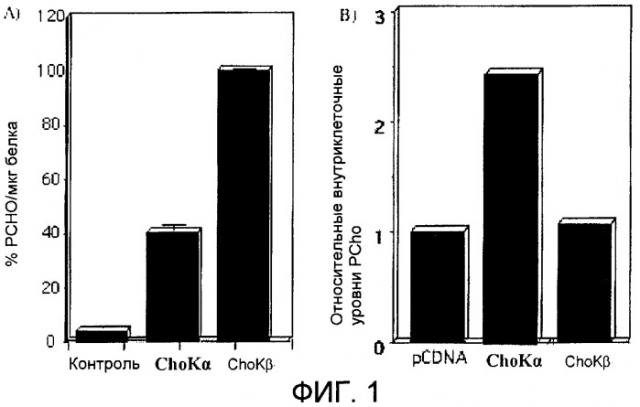
Фиг.1: А) Активность холинкиназы (ChoK) в экстрактах клеток человека HEK293T (эмбриональных почечных клеток человека) после сверхэкспрессии холинкиназы альфа и бета (ex vivo анализ активности холинкиназы). В) Внутриклеточные уровни фосфорилхолина в живых клетках (анализ in vitro активности холинкиназы).
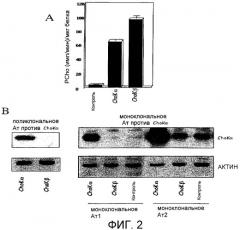
Фиг.2: А) Активность ChoK в экстрактах клеток ChoK293Т человека после сверхэкспрессии холинкиназы альфа и бета. В) Специфичность моноклональных антител против холинкиназы альфа в экстрактах, указанных в А).
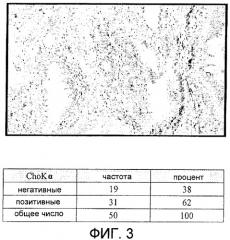
Фиг.3: Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при NSCLC (немелкоклеточном раке легкого).
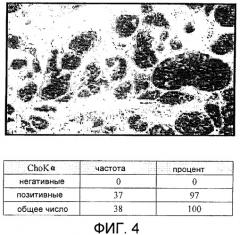
Фиг.4: Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при раке молочной железы.
Фиг.5: А) Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при раке толстой кишки. В) Полип, в котором наблюдается окрашивание, постепенно увеличивающееся от предраковых повреждений к массе опухоли.
Фиг.6: Независимый от прикрепления рост клеток, сверхэкспрессирующих холинкиназу альфа человека. Показаны как количество образованных колоний, так и их относительный размер для двух проанализированных линий клеток, HEK293 и MDCK.
Фиг.7: In vivo онкогенная активность холинкиназы альфа у мышей Nu/Nu.
Фиг.8: Экспрессия и ферментативная активность холинкиназы альфа в опухолях, индуцированных in vivo.
Фиг.9: Специфичность ингибитора MN58b в отношении холинкиназы альфа. Экстракты E.coli, в которой были экспрессированы рекомбинантные белки холинкиназа альфа или холинкиназа бета человека, анализировали в отсутствие (0) или в присутствии увеличивающихся концентраций MN58b.
Фиг.10: Противоопухолевый эффект ингибитора MN58b на опухоли, индуцированные сверхэкспрессией холинкиназы альфа.
Фиг.11: Блокирование экспрессии холинкиназы альфа при использовании миРНК-метода в клетках человека HEK293Т.
Фиг.12: Блокирование экспрессии холинкиназы альфа с помощью миРНК в раковых клетках, происходящих из карциномы молочной железы человека, обнаруживаемой с помощью вестерн-блоттинга А) и В) и по ферментативной активности С).
Фиг.13: Гибель вследствие апоптоза, индуцированного интерференционной РНК, специфичной в отношении холинкиназы альфа, в опухолевых клетках молочной железы человека MDA-MB-231. А) Анализ проточной цитометрией с использованием иодида пропидия. В) Расщепление RARP, ассоциируемого с гибелью клеток вследствие апоптоза.
Фиг.14: Интерференционная РНК, специфичная в отношении холинкиназы альфа, в первичных эпителиальных клетках молочной железы человека HMEC. A) Базальные уровни экспрессии холинкиназы альфа в нормальных клетках HMEC по отношению к опухолевым клеткам MDA-MB-231. В) Подавление холинкиназы альфа в HMEC. С) Подавление холинкиназы альфа не индуцирует гибель клеток в первичных клетках человека HMEC.
Фиг.15: Сверхэкспрессия холинкиназы альфа в раковой ткани молочной железы. Фиг.15а: Информационная РНК, соответствующая холинкиназе альфа, в тканях больных раком молочной железы, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в образце нормальной ткани. Фиг.15b: Средняя величина экспрессии холинкиназы альфа, представленная в виде единиц относительной экспрессии гена, рассчитанной из уровня мРНК с помощью 2-ΔΔct -метода, у индивидуумов без метастазов (первый прямоугольник, обозначенный "нет") или с метастазами (второй прямоугольник, обозначенный "да"). Фиг.15с: Эволюция вероятности выживания без заболевания в соответствии с количеством прошедших месяцев у больных с лимфатическими узлами (нижняя линия, отмеченная серыми линиями +) или без лимфатических узлов (верхняя линия, отмеченная черными линиями +).
Фиг.16: Экспрессия холинкиназы альфа в клеточных линиях, происходящих из рака легкого. Фиг.16а: Информационная РНК, соответствующая холинкиназе альфа, в клеточных линиях, происходящих из рака типа NSCLC (H1299 и H460) или SCLC (H510 и H82), обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных первичных бронхиальных эпителиальных клетках (ВЕС). Фиг.16b: Белок холинкиназа альфа, обнаруженный с помощью иммуноанализа с использованием моноклонального антитела в нормальных бронхиальных эпителиальных клетках (ВЕС) и в клеточных линиях, происходящих из рака легкого, H460, H1299, H510 и H82; сразу под ним представлен сигнал, полученный в тех же самых образцах для тубулина. Фиг.16с: Активность холинкиназы альфа, представленная сигналом радиоактивно меченного PCho, определенного на микрограмм белка через 30 минут образования из меченого холина, в каждой из клеточных линий, указанных под соответствующими прямоугольниками.
Фиг.17: Экспрессия информационной РНК, соответствующей холинкиназе альфа, в тканях опухолей, выделенных от больных раком легкого NSCLC на ранних стадиях, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в образце нормальной ткани.
Фиг.18: Эволюция вероятности выживания больных раком легкого на протяжении времени, представленного месяцами, в том случае, когда экспрессия холинкиназы альфа обнаруживается (пунктирные линии, -+-) или не обнаруживается (непрерывные линии, +). Общая выживаемость больных на стадиях I-IV (диаграмма, расположенная в верней левой части), выживаемость без заболевания на стадиях I-IV (время, проходящее от момента, когда больных оперируют, до момента, когда они переживают рецидив) (диаграмма, расположенная в нижней левой части), выживаемость в случае рака на стадиях IA-IIIA (диаграмма, расположенная в верней правой части) и выживаемость без заболевания в случае стадий IA-IIIA (диаграмма, расположенная в нижней правой части).
Фиг.19: Экспрессия холинкиназы альфа в клеточных линиях, происходящих из рака мочевого пузыря. Фиг.19а: Информационная РНК, соответствующая холинкиназе альфа, в клеточных линиях, происходящих из рака мочевого пузыря, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных иммортализованных клетках мочевого пузыря UrotSa; слева направо прямоугольники, соответствующие линиям HT1376, J82, SW780, TCCSup и UMVC3. Фиг.19b: Белок холинкиназа альфа, обнаруженный с помощью иммуноанализа с использованием моноклонального антитела в нормальных иммортализованных клетках мочевого пузыря (UrotSa) и в клеточных линиях, происходящих из рака мочевого пузыря TCCSup, J82, UMVC3, SW789 и HT1376, а также в отрицательном контроле (клетках НЕК293Т) и положительном контроле (клетках Неk-ChoK, трансфицированных плазмидой, экспрессирующей холинкиназу альфа); сразу под ним представлен сигнал, полученный в тех же самых образцах для тубулина. Фиг.19с: Активность холинкиназы альфа, представленная сигналом радиоактивно меченного PCho, определенного на микрограмм белка через 30 минут образования из меченого холина, в каждой из клеточных линий, указанных под соответствующими прямоугольниками.
Фиг.20: Экспрессия холинкиназы альфа у больных раком мочевого пузыря. Фиг.20а: Средние величины экспрессии, полученные при использовании опухолевых тканей 90 больных с помощью ранжированных микрорядов U133 Plus 2,0 Affymetrix, полученные в различных группах, классифицированных в соответствии с величиной фактора индукции: индукция, составляющая 1-3 раз (первый прямоугольник), индукция, составляющая 3-8 раз (второй прямоугольник), или индукция, составляющая 8-24 раза (третий прямоугольник). Фиг.20b: Информационная РНК, соответствующая холинкиназе альфа, у 20 больных раком мочевого пузыря, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных иммортализованных клетках мочевого пузыря UrotSa; горизонтальная линия представляет собой уровень, с которого начинается ассоциация с худшим прогнозом развития заболевания у больного.
Фиг.21: Связь между экспрессией холинкиназы альфа и наличием узлов и/или метастазов. Фиг.21а: Средние уровни экспрессии холинкиназы альфа у негативных и позитивных больных относительно наличия лимфатических узлов (значения, отмеченные пустыми квадратами, □) или метастазов (значения, отмеченные заполненными кружками, ●), прямые линии соединяют средние величины, соответствующие негативным или позитивным индивидуумам, относительно характеристик, которые, как полагают, помогают увидеть разницу в уровне между группами. Фиг.21b, пропорция больных с метастазами (прямоугольники сплошного темного цвета, ▌) и без метастазов (прямоугольники с отметками в виде прорезей, //) в группах больных, классифицированных в соответствии с уровнем экспрессии холинкиназы альфа: низкой (пара прямоугольников слева), промежуточной (пара прямоугольников, расположенная в середине диаграммы) или высокой (пара прямоугольников, расположенная с правой стороны диаграммы).
Фиг.22: Схема действия конструкции, основанной на том, какая интерференционная РНК синтезируется. Когда репрессор присутствует (левая область "Нет экспрессии"), он связывается с конструкцией и предотвращает синтез РНК); когда присутствует индуктор (доксоциклин), он связывается с репрессором, предотвращая прикрепление последнего к интерференционной конструкции и делая возможным синтез интерференционной РНК (правая область "Экспрессия").
Фиг.23: Пролиферация клеток MDA-MB-231 (верхний ряд чашек) и Ch-ind-1 (нижний ряд чашек) в условиях роста (столбец "Контроль") или в присутствии химического ингибитора холинкиназы альфа MN58b (средний столбец) или RSM936 (правый столбец).
Фиг.24: Поведение клеток MDA-MB-231 (прямоугольники, помеченные "MDA") и Ch-ind-1 (прямоугольники, помеченные "Chind1") в отсутствии ("-") или в присутствии ("+") 10 мкг/мл доксоциклина через 10 дней ("10d") или 20 дней ("20d); А: Эффект генетического ингибирования холинкиназы альфа в соответствии с соотношением между уровнями холинкиназы альфа и GAPDH. В: Эффект на пролиферацию клеток в соответствии с соотношением между уровнями pCNA и GAPDH; С: Жизнеспособность клеток Ch-ind-1 в отсутствие (пунктирная линия) или в присутствии (непрерывная линия) индуктора, установленная на основании величин абсорбции при 500 нм, измеренных в различное время; D: Эффект на индукцию апоптоза в соответствии с соотношением между уровнем деградированного белка PARP и уровнем общего белка PARP (PARPdig/PARP общий).
Фиг.25: Специфичность поликлонального антитела против холинкиназы альфа. А: Иммуноанализ, в котором поликлональная антисыворотка против холинкиназы бета взаимодействует с образцами клеток, трансфицированных пустым вектором (линия, обозначенная "пустой"), вектором для экспрессии холинкиназы альфа (линия, обозначенная "ChoКA"), вектором для экспрессии холинкиназы бета (линия, обозначенная "ChoКВ") и вектором для экспрессии химерного белка, холинкиназы бета зеленого флуоресцирующего белка (линия, обозначенная "ChoKB5'GFP"). Стрелки указывают высоту расположения полосы холинкиназы бета и химерного белка. В: Иммуноанализ, в котором поликлональное антитело против холинкиназы альфа взаимодействует с образцами клеток, трансфицированных пустым вектором (линия, обозначенная "пустой"), вектором для экспрессии холинкиназы альфа (линия, обозначенная "ChoКA"), вектором для экспрессии холинкиназы бета (линия, обозначенная "ChoКВ") и вектором для экспрессии химерного белка, холинкиназы бета зеленого флуоресцирующего белка (линия, обозначенная "ChoKB5'GFP"). Стрелки указывают высоту расположения полосы холинкиназы альфа.
Фиг.26: Сравнение онкогенной способности холинкиназ альфа и бета. Увеличение со временем объема опухоли, измеряемого в см3, в соответствии с указанными на оси Х неделями, проходящими от момента введения мышам клеток, трансфицированных пустым вектором (данные, показанные ромбами, "♦"), вектором для экспрессии холинкиназы альфа (данные, показанные квадратами, "■"), вектором для экспрессии холинкиназы бета (данные, показанные треугольниками, "▲") и вектором для экспрессии холинкиназы альфа + вектором для экспрессии холинкиназы бета (данные, показанные х, "Х").
Фиг.27. Информационная РНК, соответствующая холинкиназе бета, в ткани больных раком легкого, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальной ткани.
Подробное описание изобретения
Для облегчения понимания настоящей заявки на патент значения некоторых терминов и выражений в контексте настоящего изобретения определены ниже.
Термин "субъект" или "индивидуум" относится к членам класса млекопитающих и включает в себя, не ограничиваясь перечисленным, домашних животных, приматов и людей; субъектом предпочтительно является мужчина или женщина любого возраста или расы.
Термин "рак" относится к заболеванию, которое характеризуется аномальным или неконтролируемым ростом клеток, способных вторгаться в смежные ткани и распространяться на отдаленные органы.
Термин "карцинома" относится к ткани, являющейся результатом аномального или неконтролируемого роста клеток.
Термин "рак молочной железы" или "карцинома молочной железы" относится к любому нарушению в виде злокачественной пролиферации клеток молочной железы.
Термин "рак толстой кишки" или "карцинома толстой кишки" относится к любому нарушению в виде злокачественной пролиферации клеток толстой кишки.
Термин "рак прямой кишки" или "карцинома прямой кишки" относится к любому нарушению в виде злокачественной пролиферации клеток прямой кишки.
Термин "опухоль" относится к любому аномальному тканевому образованию, являющемуся результатом доброкачественного (незлокачественного) или злокачественного процесса новообразования.
Термин "ген" относится к молекулярной цепи дезоксирибонуклеотидов, кодирующей белок.
Термин "ДНК" относится к дезоксирибонуклеиновой кислоте. Последовательность ДНК является последовательностью дезоксирибонуклеотидов.
Термин "кДНК" относится к последовательности нуклеотидов, комплементарной последовательности мРНК.
Термин "РНК" относится к рибонуклеиновой кислоте. Последовательность РНК является последовательностью рибонуклеотидов.
Термин "мРНК" относится к информационной рибонуклеиновой кислоте, которая является той фракцией общей РНК, с которой осуществляется трансляция белков.
Термин "мРНК, транскрибированная с" имеет отношение к транскрипции гена (ДНК) в мРНК в качестве первой стадии процесса экспрессии гена и трансляции белка.
Термин "последовательность нуклеотидов" или "нуклеотидная последовательность" без различия относится и к рибонуклеотидной последовательности (РНК), и к дезоксирибонуклеотидной последовательности (ДНК).
Термин "белок" относится к молекулярной цепи аминокислот, присоединенных посредством ковалентных или нековалентных связей. Данный термин включает в себя все формы посттрансляционных модификаций, например гликозилирование, фосфорилирование или ацетилирование.
Термин "пептид" и "полипептид" относится к молекулярной цепи аминокислот, представляющей собой белковый фрагмент. Термины "белок" и "пептид" используются без различия.
Термин "антитело" относится к гликопротеину, проявляющему специфическую активность связывания с молекулой-мишенью, которую называют "антиген". Термин "антитело" включает в себя моноклональные или поликлональные антитела, являющиеся интактными, или их фрагменты, а также он включает в себя антитела человека, гуманизированные антитела и антитела, не происходящие от человека. "Моноклональные антитела" являются гомогенной популяцией высокоспецифических антител, направленных против единственного антигенного сайта или "детерминанты". "Поликлональные антитела" включают гетерогенную популяцию антител, направленных против различных антигенных детерминант.
"Эпитоп" в качестве термина, используемого в настоящем изобретении, относится к антигенной детерминанте белка, которая является аминокислотной последовательностью белка, которую узнает специфическое антитело.
Термин "терапевтическая мишень" относится к нуклеотидной или пептидной последовательности, для которой может предназначаться и клинически применяться лекарственное средство или терапевтическое соединение.
Термин "антагонист" относится к любой молекуле, ингибирующей биологическую активность подвергнутой антагонистическому действию молекулы. Примеры молекул-антагонистов включают в себя среди прочих белки, пептиды, встречающиеся в природе вариации пептидных последовательностей и небольшие органические молекулы (с молекулярной массой, составляющей менее чем 500 Да).
Термин "нормальные ссылочные величины", используемый в настоящем изобретении, относится к уровню определенных белков, мРНК или других метаболитов, присутствующих в организме здорового индивидуума.
Термин "нормальная ткань", используемый в настоящем изобретении, относится к нераковой ткани, в том числе к коммерческим клеточным культурам.
Настоящее изобретение основано на открытии того, что экспрессия белка холинкиназы альфа приводит к увеличению образования опухолей, особенно рака легкого, молочной железы и рака толстой и прямой кишок. А также на неожиданном открытии того, что сверхэкспрессия указанного белка индуцирует образование опухолей in vivo и, следовательно, того, что ингибирование экспрессии и/или активности этого фермента является великолепным способом лечения ракового заболевания, особенно рака легкого, молочной железы и рака толстой и прямой кишок. Следовательно, холинкиназа альфа является хорошей возможной терапевтической мишенью при возникновении опухоли у человека.
В этом отношении настоящим изобретением обеспечивается, во-первых, способ in vitro обнаружения у индивидуума наличия ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанного ракового заболевания у индивидуума или контролирования эффекта терапии, назначаемой страдающему раковым заболеванием индивидууму, включающий:
а) обнаружение и/или количественное определение белка холинкиназы альфа, мРНК гена холинкиназы альфа или соответствующей кДНК в образце указанного индивидуума, и
b) сравнение количества белка холинкиназы альфа, количества мРНК гена холинкиназы альфа или количества соответствующей кДНК, обнаруженного в образце индивидуума, с количеством белка холинкиназы альфа, с количеством мРНК гена холинкиназы альфа или с количеством соответствующей кДНК, обнаруженным в образцах контрольных индивидуумов или в более ранних образцах того же самого индивидуума, или с нормальными ссылочными величинами.
Способ, обеспечиваемый настоящим изобретением, обладает высокой чувствительностью и специфичностью и базируется на субъектах или индивидуумах, у которых диагностированы раковые заболевания, предпочтительно рак легкого, рак молочной железы и рак толстой и прямой кишок, имеющих высокие уровни мРНК, транскрибированной с гена холинкиназы альфа, или высокие концентрации белка, кодируемого геном холинкиназы альфа (белка холинкиназы альфа), по сравнению с соответствующими уровнями в образцах от субъектов, в истории болезни которых нет этих карцином. Однако между экспрессией гена холинкиназы бета у людей и каким-либо из ранее отмеченных типов ракового заболевания корреляции нет.
Предлагаемый способ включает стадию получения образца от индивидуума. Можно работать с различными образцами жидкости, такими как, например, моча, кровь, плазма, сыворотка, плевральная жидкость, асцитическая жидкость, синовиальная жидкость, желчь, желудочный сок, спинномозговая жидкость, фекалии, слюна, жидкости бронхоскопических образцов и т.п. Образец может быть получен любым традиционным методом, предпочтительно хирургической резекцией.
Образцы могут быть получены от субъектов, у которых диагноз поставлен ранее или у которых диагноз не поставлен, страдающих определенным типом ракового заболевания, а также от субъекта, подвергаемого лечению, или субъекта, которого ранее лечили от ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок.
Кроме того, данный способ включает стадию экстракции образца или для получения белкового экстракта из образца, или для получения экстракта общей РНК. Один из этих двух экстрактов является рабочим материалом для следующей стадии. Протоколы для экстрагирования общего белка или общей РНК хорошо известны квалифицированному в данной области специалисту (Chornczynski P. et al., Anal. Biochem., 1987, 162: 156; Chornczynski P., Biotechniques, 1993, 15: 532; Molina M.A. et al., Cancer Res., 1999, 59: 4356-4362).
В рамках настоящего изобретения можно использовать любой традиционный анализ для обнаружения ракового заболевания при условии, что им измеряются in vitro уровни мРНК, транскрибированной с гена холинкиназы альфа, или комплементарной ей кДНК, концентрация белка холинкиназы альфа в образцах, отобранных от подвергаемых анализу индивидуумов или от контрольных индивидуумов.
Следовательно, настоящим изобретением обеспечивается способ обнаружения наличия ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанного ракового заболевания у индивидуума или контролирования эффекта терапии, назначаемой страдающему указанным раковым заболеванием индивидууму, или на основе измерения концентрации белка холинкиназы альфа, или на основе измерения уровня экспрессии гена холинкиназы альфа.
В том случае, когда изобретение направлено на обнаружение белка холинкиназы альфа, способ настоящего изобретения включает в качестве первой стадии приведение в контакт белкового экстракта из образца с композицией из одного или нескольких антител, специфичных в отношении одного или нескольких эпитопов белка холинкиназы альфа, а в качестве второй стадии - количественное определение комплексов, образованных антителами и белком холинкиназой альфа.
Существует широкое множество иммунологических анализов, пригодных для обнаружения и количественного определения формирования специфических комплексов антиген-антитело; ряд анализов конкурентного и неконкурентного связывания белка описаны ранее, и большой ряд этих анализов коммерчески доступен.
Следовательно, количество белка холинкиназы альфа можно определить с помощью таких антител, как, например, моноклональные антитела, поликлональные антитела, являющиеся интактными, или их фрагментами, "комби-тела" и Fab- или scFv-фрагменты антител, специфичных в отношении белка холинкиназы альфа, причем эти антитела являются антителами человека, гуманизированными антителами или антителами, не происходящими от человека. Антитела, используемые в этих анализах, могут быть мечеными или немечеными; немеченые антитела можно использовать в анализах агглютинации; меченые антитела можно использовать в широком ряде анализов. Молекулы меток, которые можно использовать для мечения антител, включают радионуклеотиды, ферменты, флуорофоры, хемилюминесцентные реагенты, ферментные субстраты или кофакторы, ингибиторы ферментов, частицы, красители и производные.
Существует широкое множество хорошо известных анализов, которые можно применить в настоящем изобретении, используя немеченые антитела (первичные антитела) и меченые антитела (вторичные антитела); эти способы включают вестерн-блоттинг, ELISA (твердофазный иммуноферментный анализ), РИА (радиоиммуноанализ), конкурентный EIA (конкурентный иммуноферментный анализ) DAS-ELISA (ELISA с использованием двухслойного иммуносэндвича), иммуноцитохимические и иммуногистохимические способы, способы, основанные на использовании белковых биочипов или ранжированных микрорядов, включающих специфические антитела, или анализы, основанные на преципитации из коллоидного раствора в таких форматах, как металлические щипы для измерения уровня жидкости. Другие способы обнаружения и количественного определения белка EFNB2 или белка EDNRA включают способы аффинной хроматографии, анализы связывания лигандов или анализы связывания лектина.
Предпочтительным иммуноанализом в способе настоящего изобретения является ELISA с использованием двухслойного иммуносэндвича (DAS-ELISA). В этом иммуноанализе можно использовать любое антитело или комбинацию антител, специфичных в отношении одного или нескольких эпитопов белка холинкиназы альфа. Примером одного из множества возможных форматов этого анализа является приведение в контакт с анализируемым образцом моноклоклонального антитела или поликлонального антитела, или фрагмента этого антитела, или комбинации антител, которые покрывают твердую фазу, и инкубирование в течение подходящего времени и при подходящих условиях для формирования комплексов антиген-антитело. После промывки при подходящих условиях для удаления неспецифических комплексов комплексы антиген-антитело инкубируют при подходящих условиях и в течение подходящего времени с индикаторным реагентом, включающим моноклональное или поликлональное антитело, или фрагмент этого антитела, или комбинацию этих антител, связанным с соединением, образующим сигнал. Присутствие белка холинкиназы альфа в анализируемом образце обнаруживают и количественно определяют, при его существовании, путем измерения образуемого сигнала. Количество белка холинкиназы альфа, присутствующее в анализируемом образце, пропорционально этому сигналу.
В том случае, когда изобретение направлено на обнаружение мРНК или кДНК, соответствующей гену холинкиназы альфа, а не кодируемых ими белков, обеспечиваемый настоящим изобретением способ обнаружения in vitro карцином имеет разные стадии. Поэтому, когда образец получен, а общая РНК экстрагирована, способ настоящего изобретения, обнаружение мРНК или кДНК, соответствующей гену холинкиназы альфа, включает в качестве первой стадии амплификацию мРНК, присутствующей в экстракте общей РНК, или соответствующей кДНК, синтезированной с помощью обратной транскрипции мРНК, а в качестве второй стадии количественное определение продукта амплификации мРНК или кДНК гена холинкиназы альфа.
Примером амплификации мРНК является обратное транскрибирование мРНК в кДНК (ОТ) с последующей полимеразной цепной реакцией (ПЦР); ПЦР является методом амплификации определенной нуклеотидной последовательности (мишени), содержащейся в смеси нуклеотидных последовательностей. В ПЦР используется присутствующая в избыточном количестве пара олигонуклеотидных праймеров, которые гибридизуются с комлементарными цепями нуклеотидной последовательности-мишени. Затем фермент с полимеразной активностью (ДНК-полимераза Taq) удлиняет каждый праймер, используя в качестве матрицы нуклеотидную последовательность-мишень. После диссоциации исходной цепи-мишени продукты удлинения превращаются в последовательности-мишени. Новые молекулы праймеров гибридизуются, и полимераза их удлиняет; цикл повторяют с тем, чтобы экспоненциально увеличить количество последовательностей-мишеней. Этот метод описывается в патентах США № 4683195 и 4683202. Ранее описано много методов обнаружения и количественного определения продуктов, амплифицированных с помощью ПЦР, и любой из них можно использовать в настоящем изобретении. В предпочтительном способе настоящего изобретения амплифицированный продукт обнаруживают с помощью электрофореза в агарозном геле.
В другом примере обнаружение мРНК проводят путем переноса мРНК на нейлоновую мембрану посредством таких методов переноса, как, например, нозерн-блоттинг, и обнаружения ее с помощью специфических зондов мРНК или кДНК, соответствующей гену холинкиназы альфа.
В конкретном воплощении настоящего изобретения амплификацию и количественное определение мРНК, соответствующей гену холинкиназы альфа, осуществляют в одно и то же время посредством количественной ОТ-ПЦР в режиме реального времени (к-ПЦР).
Последняя стадия обеспечиваемого настоящим изобретением способа обнаружения карцином, о которых идет речь, in vitro, в образце от индивидуума, включает сравнение количества белка холинкиназы альфа, количества мРНК гена холинкиназы альфа или количества соответствующей кДНК в образце от индивидуума с количеством белка холинкиназы альфа, количеством мРНК гена холинкиназы альфа или количеством соответствующей кДНК, определенных в образцах контрольных субъектов или в более ранних образцах того же самого индивидуума, или с нормальными ссылоч