Hla-a*3303-рестриктированный пептид wt1 и содержащая его фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к области биохимии и иммунологии и может быть применено в медико-биологической промышленности при производстве препаратов для профилактики и лечения раковых заболеваний. Получен новый пептид, обладающий способностью избирательно связываться с молекулой HLA-A*3303, который представляет собой фрагмент транскрипционного фактора WT-1 и характеризуется аминокислотной последовательностью Ser-Asp-Gln-Leu-Lys-Arg-His-Gln-Arg. В изобретении раскрыты средства для получения данного пептида методом рекомбинантных ДНК и предложено его использование в качестве основного компонента в процессе индукции WT1 - специфичных цитотоксических лимфоцитов. 4 н.п. ф-лы, 8 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение относится к HLA-A*3303-рестриктированному пептиду, особенно к пептиду, содержащему аминокислотную последовательность, состоящую из 9 последовательных аминокислот из белка WT1, в котором аминокислота в положении 2 аминокислотной последовательности выбрана из группы, состоящей из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислота в положении 9 представляет собой Arg. Кроме того, настоящее изобретение относится к кодирующему пептид полинуклеотиду, содержащей его фармацевтической композиции для лечения или профилактики рака и т.п.
Предпосылки изобретения
Ген WT1 (ген 1 опухоли Вилма) был идентифицирован как ген, ответственный за возникновение опухоли Вилма, которая представляет собой рак почек у детей (непатентные документы 1 и 2). WT1 представляет собой транскрипционный фактор, имеющий структуру цинковых пальцев. Вначале ген WT1 считали опухолевым супрессором. Однако дальнейшие исследования (непатентные документы 3, 4, 5 и 6) показали, что ген WT1 скорее действует как онкоген в опухолях гематопоэтической системы и солидном раке.
Ген WT1 экспрессируется на высоком уровне в многих типах злокачественных опухолей. Было проверено, действительно ли свободный от мутаций продукт гена WT1, который является аутологичным белком, обладает иммуногенностью в организме. В результате было выяснено, что белок, получаемый в результате экспрессии гена WT1, который экспрессируется на высоком уровне в опухолевых клетках, является фрагментированным в результате внутриклеточного процессинга; полученные пептиды образуют комплексы с молекулами МНС класса I, и эти комплексы представлены на поверхности клеток; а вакцинацией пептидом можно индуцировать цитотоксические лимфоциты, узнающие такие комплексы (непатентные документы 7, 8 и 9). Также было показано, что у мышей, иммунизированных пептидом WT1 или кДНК WT1, с высокой вероятностью происходило отторжение пересаженных опухолевых клеток, экспрессирующих ген WT1 (непатентные документы 7 и 10), в то время как нормальные ткани, в которых ген WT1 экспрессируется на физиологическом уровне, не лизируются индуцированными цитотоксическими лимфоцитами (непатентный документ 7). В экспериментах на клетках человека in vitro было показано, что когда пептиды Db126 или WH187 (аминокислоты 187-195 из SEQ ID No: 1, SLGEQQYSV), обладающие высокой способностью связывать молекулу HLA-A*0201, которая является молекулой, принадлежащей к МНС класса I, используются для стимуляции периферических мононуклеарных клеток крови человека, имеющих HLA-A*0201, то происходит индукция цитотоксических лимфоцитов, специфичных к WT1; при этом они обладают цитотоксической активностью, специфичной к опухолевым клеткам, экспрессирующим высокий уровень эндогенного WT1, и цитотоксическая активность таких лимфоцитов рестриктирована HLA-A2 (непатентный документ 11). В экспериментах на клетках человека in vitro с использованием пептида WT1, который соответствует HLA-A*2402 (наиболее часто встречаемая HLA-A аллель у жителей Японии) (WT1235; аминокислоты 235-243 из SEQ ID No: 1, CMTWNQMNL), была продемонстрирована индукция специфичных к WT1 цитотоксических лимфоцитов (ТАК-1) (непатентный документ 12) и было показано, что индуцированные цитотоксические лимфоциты не подавляют колониеобразующую активность нормальных гематопоэтических стволовых клеток, которые физиологически частично экспрессируют ген WT1 (непатентные документы 13 и 14). Эти данные подтверждают гипотезу о том, что не только у мышей, но также и у человека можно индуцировать специфичные к WT1 цитотоксические лимфоциты, причем такие лимфоциты обладают цитотоксической активностью против раковых клеток, экспрессирующих ген WT1 на высоком уровне, но не обладают цитотоксической активностью против нормальных клеток, физиологически экспрессирующих ген WT1 (непатентные документы 7, 10, 11, 12, 13 и 14).
Продукт гена WT1 присутствует в клетке в виде ядерного белка, а в цитоплазме он подвергается протеасомальному процессингу до пептидов. Фрагментированные пептиды транспортируются в просвет эндоплазматического ретикулума молекулами ТАР (транспортер, ассоциированный с процессингом антигенов), образуют комплексы с МНС класса I и экспонируются на поверхности клеток. Цитотоксические лимфоциты (ЦТЛ), специфичные к WT1, индуцируются в результате узнавания TCR на клетках-предшественниках ЦТЛ молекулярных комплексов МНС класса I c пептидом WT1, таким образом оказывая цитотоксическое действие на раковые клетки, на которых молекулами МНС класса I представлен продукт гена WT1 (непатентные документы 7, 8 и 9). Поэтому, если пептид WT1 используется в иммунотерапии рака, мишенью которого является продукт гена WT1, то необходимо, чтобы он связывался с молекулой МНС класса I в организме. Однако диапазон молекул МНС класса I широк, аминокислотные последовательности пептидов WT1, связывающихся с соответствующими молекулами МНС класса I, отличаются друг от друга. Следовательно, необходимо обеспечить соответствие пептидов каждому подтипу МНС класса I. Однако на сегодняшний день в качестве пептидов WT1, связывающихся с молекулами HLA, известны только HLA-A*2402-, HLA-A*0201- и HLA-A*2601-рестриктированные пептиды (патентный документ 1, непатентный документ 11 и патентный документ 2 соответственно). Молекула HLA-A*3303 является второй по распространенности после HLA-A*2402 среди жителей Японии. Таким образом, необходимо найти HLA-A*3303-рестриктированный пептид WT1.
Патентный документ 1: WO 2003/106682
Патентный документ 2: WO 2005/095598
Непатентный документ 1: Daniel A. Haber et al., Cell. 1990 Jun 29; 61(7): 1257-69.
Непатентный документ 2: Call KM et al., Cell. 1990 Feb 9; 60(3): 509-20.
Непатентный документ 3: Menke AL et al., Int Rev Cytol. 1998; 181: 151-212. Review.
Непатентный документ 4: Yamagami T et al., Blood. 1996 Apr 1; 87(7): 2878-84.
Непатентный документ 5: Inoue K et al., Blood. 1998 Apr 15; 91(8): 2969-76.
Непатентный документ 6: Tsuboi A et al., Leuk Res. 1999 May; 23(5): 499-505.
Непатентный документ 7: Oka Y et al., J Immunol. 2000 Feb 15; 164(4): 1873-80.
Непатентный документ 8: Melief CJ et al., Immunol Rev. 1995 Jun; 145: 167-77.
Непатентный документ 9: Ritz J, J Clin Oncol. 1994 Feb; 12(2): 237-8.
Непатентный документ 10: Tsuboi A et al., J Clin Immunol. 2000 May; 20(3): 195-202.
Непатентный документ 11: Oka Y et al., Immunogenetics. 2000 Feb; 51(2): 99-107.
Непатентный документ 12: Ohminami H et al., Blood. 2000 Jan 1; 95(1): 286-93.
Непатентный документ 13: Gao L et al., Blood. 2000 Apr 1; 95(7): 2198-203.
Непатентный документ 14: Ohminami H et al., Blood. 2000 Jan 1; 95(1): 286-93.
Описание изобретения
Проблемы, которые должно разрешить изобретение
Проблемами, которые должно разрешить изобретение, являются предоставление HLA-A*3303-рестриктированного пептида WT1 и кодирующего его полинуклеотида, а также содержащей его фармацевтической композиции для лечения/профилактики рака и т.п.
Средства решения проблем
В результате интенсивных исследований вышеописанной проблемы авторы изобретения обнаружили, что пептид, содержащий аминокислотную последовательность, состоящую из 9 последовательных аминокислот из белка WT1, в котором аминокислота в положении 2 аминокислотной последовательности выбрана из группы, состоящей из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислота в положении 9 аминокислотной последовательности представляет собой Arg, может индуцировать высокий процент WT1-специфичных ЦТЛ. Тем самым настоящее изобретение было выполнено.
Настоящее изобретение относится к:
(1) пептиду, содержащему аминокислотную последовательность, состоящую из 9 последовательных аминокислот из белка WT1, в котором аминокислота в положении 2 аминокислотной последовательности выбрана из группы, состоящей из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислота в положении 9 аминокислотной последовательности представляет собой Arg:
(2) пептиду по п. (1), в котором аминокислотная последовательность выбрана из группы, состоящей из:
Leu Ser His Leu Gln Met His Ser Arg (SEQ ID No: 2),
Phe Ser Arg Ser Asp Gln Leu Lys Arg (SEQ ID No: 3),
Ser Asp Gln Leu Lys Arg His Gln Arg (SEQ ID No: 4) и
Thr Ser Glu Lys Pro Phe Ser Cys Arg (SEQ ID No: 5);
(3) пептиду по п. (2), в котором аминокислотная последовательность представляет собой Ser Asp Gln Leu Lys Arg His Gln Arg (SEQ ID No: 4);
(4) фармацевтической композиции для лечения или профилактики рака, содержащей пептид по п. (1);
(5) способу лечения или профилактики рака, включающему в себя введение эффективного количества фармацевтической композиции по п. (4) субъекту, несущему аллель HLA-A*3303;
(6) применению пептида по п.(1) для изготовления фармацевтической композиции по п.(4);
(7) полинуклеотиду, кодирующему пептид по п.(1);
(8) экспрессионному вектору, содержащему полинуклеотид по п.(7);
(9) фармацевтической композиции для лечения или профилактики рака, содержащей полинуклеотид по п.(7) или вектор по п.(8);
(10) способу лечения или профилактики рака, включающему в себя введение эффективного количества фармацевтической композиции по п.(9) субъекту, несущему аллель HLA-A*3303;
(11) применению полинуклеотида по п.(7) или вектора по п.(8) для изготовления фармацевтической композиции по п.(9);
(12) WT1-специфичным ЦТЛ, индуцируемым пептидом по п.(1);
(13) способу индукции WT1-специфичных ЦТЛ, включающему в себя культивирование мононуклеарных клеток периферической крови в присутствии пептида по п.(1) для индукции WT1-специфичных ЦТЛ из мононуклеарных клеток периферической крови;
(14) набору для индукции WT1-специфичных ЦТЛ, содержащему пептид по п.(1) в качестве основного компонента;
(15) антиген-представляющим клеткам, представляющим пептид WT1, который индуцируется пептидом по п.(1);
(16) способу индукции антиген-представляющих клеток, представляющих пептид WT1, включающий в себя культивирование незрелых антиген-представляющих клеток в присутствии пептида по п.(1) для индукции антиген-представляющих клеток, представляющих пептид WT1, из незрелых антиген-представляющих клеток;
(17) набору для индукции антиген-представляющих клеток, представляющих пептид WT1, содержащему пептид по п.(1) в качестве основного компонента;
(18) способу диагностики рака, включающему в себя применение ЦТЛ по п.(12) или антиген-представляющих клеток по п.(15);
(19) способу определения присутствия или количества WT1-специфичных ЦТЛ у субъекта, несущего аллель HLA-A*3303, включающему в себя:
(а) реакцию комплекса пептида WT1 и молекулы HLA-A*3303 с образцом, забранным у субъекта; и
(б) определение присутствия или количества ЦТЛ, распознающих комплекс, содержащийся в образце; и
(20) способу по п.(19), где комплекс находится в виде тетрамера.
Результаты изобретения
Настоящее изобретение относится к HLA-A*3303-рестриктированному пептиду WT1 и кодирующему его полинуклеотиду, а также к содержащей его фармацевтический композиции для лечения или профилактики рака и т.п. Таким образом, у субъектов, несущих аллель HLA-A*3303, возможна индукция WT1-специфичных ЦТЛ in vivo и in vitro. Поскольку у 24% жителей Японии присутствует, по крайней мере, одна молекула HLA-A*3303, то WT1-специфичные ЦТЛ можно индуцировать у широкого круга субъектов.
Краткое описание чертежей
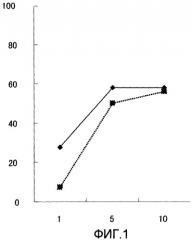
На фиг.1 представлена цитотоксическая активность ЦТЛ, индуцированных WT1337.
На фиг.2 представлена цитотоксическая активность ЦТЛ, индуцированных WT1364.
На фиг.3 представлена цитотоксическая активность ЦТЛ, индуцированных WT1367.
На фиг.4 представлена цитотоксическая активность ЦТЛ, индуцированных WT1409.
На фиг.5 представлена цитотоксическая активность ЦТЛ, индуцированных WT1364, против клетки, эндогенно экспрессирующей ген WT1.
На фиг.6 представлена цитотоксическая активность ЦТЛ, индуцированных WT1367, против клетки, эндогенно экспрессирующей ген WT1.
На фиг.7 представлена цитотоксическая активность ЦТЛ, индуцированных WT1409, против клетки, эндогенно экспрессирующей ген WT1.
На фиг.8 представлена цитотоксическая активность ЦТЛ, индуцированных WT1367, против клетки, экспрессирующей ген WT1.
Наилучший вариант осуществления изобретения
Аминокислотная последовательность белка WT1 человека приведена в SEQ ID No: 1. Ген WT1 экспрессируется на высоком уровне в своей нативной форме, например, в гематопоэтических опухолях, таких как лейкемия, миелодиспластический синдром, множественная миелома или злокачественная лимфома, и солидных раковых заболеваниях, таких как рак желудка, рак толстой кишки, рак легких, рак молочной железы, рак эмбриональных клеток, рак печени, рак кожи, рак мочевого пузыря, рак простаты, рак матки, рак шейки матки или рак яичников. Кроме того, якорный мотив для HLA-A*3303 отличается тем, что аминокислотой в положении 2 является любая из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислотой в положении 9 является Arg. Таким образом, в одном аспекте настоящее изобретение относится к HLA-A*3303-рестриктированному пептиду WT1, содержащему аминокислотную последовательность, состоящую из 9 последовательных аминокислот из белка WT1, в котором аминокислота в положении 2 аминокислотной последовательности, предпочтительно, выбрана из группы, состоящей из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислота в положении 9 аминокислотной последовательности предпочтительно является Arg (здесь и далее именуется как пептид WT1).
Состоящая из 9 аминокислот аминокислотная последовательность, содержащаяся в пептиде по настоящему изобретению, представляет собой, предпочтительно, Leu Ser His Leu Gln Met His Ser Arg (SEQ ID No: 2), Phe Ser Arg Ser Asp Gln Leu Lys Arg (SEQ ID No: 3), Ser Asp Gln Leu Lys Arg His Gln Arg (SEQ ID No: 4) или Thr Ser Glu Lys Pro Phe Ser Cys Arg (SEQ ID No: 5). Наиболее предпочтительной является Ser Asp Gln Leu Lys Arg His Gln Arg (SEQ ID No: 4). Кроме того, она может иметь от одной до нескольких, предпочтительно от одной до пяти аминокислот, замещенных другими аминокислотами, в 9 аминокислотах любой из последовательностей с SEQ ID No: 2-5. Любая из 9 аминокислот или других замещенных аминокислот может быть модифицирована соответствующим образом. В любых случаях пептид по настоящему изобретению сохраняет способность связывать молекулу HLA-A*3303.
Как описано выше, целью настоящего изобретения является получение HLA-A*3303-рестриктированного пептида WT1. Следовательно, пептидом по настоящему изобретению может являться любой до тех пор, пока он содержит аминокислотную последовательность, полученную из белка WT1, и состоит из 9 последовательных аминокислот. Следовательно, пептидом по настоящему изобретению может являться, например, пептид, состоящий из только аминокислотной последовательности, приведенной в любой из SEQ ID No: 2-5, или белок WT1, или его часть, включающие в себя аминокислотную последовательность, приведенную в любой из SEQ ID No: 2-5. На N-конец и/или С-конец аминокислотной последовательности, состоящей из 9 последовательных аминокислот, в пептиде по настоящему изобретению можно присоединить различные вещества. Например, можно присоединить аминокислоту, пептид или их аналог. Если такие вещества присоединены к пептиду по настоящему изобретению, они могут процессироваться, например, ферментом в организме или в результате внутриклеточного процессинга, и в конце может получаться аминокислотная последовательность, состоящая из 9 последовательных аминокислот и представленная на поверхности клетки в виде комплекса с молекулой HLA-A*3303, тем самым давая в результате эффект индукции ЦТЛ. Эти вещества могут представлять собой вещества, модулирующие растворимость пептидов по настоящему изобретению или увеличивающие их стабильность (резистентность к протеолитической деградации и т.д.) В качестве альтернативы, эти вещества могут являться веществами, доставляющими пептиды по настоящему изобретению в определенную область, например к данным ткани или органу, или они могут увеличивать эффективность поглощения антиген-представляющей клеткой и т.п. Эти вещества могут являться веществами, увеличивающими способность индуцировать ЦТЛ, такими как хелперные пептиды и т.п.
Пептид по настоящему изобретению можно синтезировать при помощи методов, обычно используемых в данной области, или при помощи их модификаций. Такие методы описаны, например, в Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol 2, Academic Press Inc., New York, 1976; Peptide-Gosei, Maruzen Co., Ltd., 1975; Peptide-Gosei No Kiso To Jikken, Maruzen Co., Ltd., 1985; и Iyakuhin No Kaihatsu (Zoku), Vol.14, Peptide-Gosei, Hirokawa - Book store, 1991.
Пептид по настоящему изобретению можно также получить, используя методы генной инженерии, на основе информации о нуклеотидной последовательности, кодирующей пептид по настоящему изобретению. Такие генно-инженерные методы хорошо известны специалисту в данной области.
В другом аспекте настоящее изобретение относится к фармацевтической композиции для лечения или профилактики рака, содержащей HLA-A*3303-рестриктированный пептид WT1. Ген WT1 экспрессируется на высоком уровне в гематопоэтических опухолях, таких как лейкемия, миелодиспластический синдром, множественная миелома или злокачественная лимфома, и солидных раковых заболеваниях, таких как рак желудка, рак толстой кишки, рак легких, рак молочной железы, рак эмбриональных клеток, рак печени, рак кожи, рак мочевого пузыря, рак простаты, рак матки, рак шейки матки или рак яичников. Следовательно, фармацевтическую композицию по настоящему изобретению можно применять для лечения или профилактики рака. При введении фармацевтической композиции по настоящему изобретению субъекту, несущему аллель HLA-A*3303, WT1-специфичные ЦТЛ индуцируются HLA-A*3303-рестриктированным пептидом WT1, содержащимся в фармацевтической композиции, и такие ЦТЛ лизируют раковые клетки у субъекта.
В дополнение к HLA-A*3303-рестриктированному пептиду WT1 в качестве действующего ингредиента фармацевтическая композиция по настоящему изобретению может содержать, например, носитель, вспомогательное вещество и т.п. HLA-A*3303-рестриктированный пептид WT1, содержащийся в фармацевтической композиции по настоящему изобретению, индуцирует WT1-специфичные ЦТЛ. Поэтому фармацевтическая композиция по настоящему изобретению может содержать соответствующий адъювант или ее можно вводить вместе с соответствующим адъювантом для усиления эффективности индукции. Примеры предпочтительных адъювантов включают, но не ограничены этим, полный или неполный адъювант Фрейнда и гидроксид алюминия.
Способ введения фармацевтической композиции по настоящему изобретению можно соответствующим образом выбрать в зависимости от условий, таких как тип заболевания, состояние субъекта или местоположение мишени. Примеры таких способов включают, но не ограничены этим, внутрикожное введение, подкожное введение, внутримышечное введение, внутривенное введение, назальное введение и пероральное введение. Количество пептида, содержащегося в фармацевтической композиции по настоящему изобретению, а также лекарственная форма, число введений и т.п. для фармацевтической композиции по изобретению можно выбрать соответствующим образом в зависимости от условий, таких как тип заболевания, состояние субъекта или местоположение мишени. Одиночная доза пептида обычно составляет 0,0001 мг-1000 мг, предпочтительно 0,001 мг-10000 мг.
В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака, включающему в себя введение эффективного количества фармацевтической композиции субъекту, несущему аллель HLA-A*3303. При лечении или профилактике рака раковое заболевание может быть любым, его примеры включают гематопоэтические опухоли, такие как лейкемия, миелодиспластический синдром, множественная миелома или злокачественная лимфома, и солидные злокачественные опухоли, такие как рак желудка, рак толстой кишки, рак легких, рак молочной железы, рак эмбриональных клеток, рак печени, рак кожи, рак мочевого пузыря, рак простаты, рак матки, рак шейки матки или рак яичников.
В другом аспекте настоящее изобретение относится к применению HLA-A*3303-рестриктированного пептида WT1 для изготовления фармацевтической композиции.
В дополнительном аспекте настоящее изобретение относится к способу определения присутствия или количества WT1-специфичных ЦТЛ у субъекта, несущего аллель HLA-A*3303, включающему в себя:
(а) реакцию комплекса пептида WT1 и молекулы HLA-A*3303 с образцом, забранным у субъекта; и
(б) определение присутствия или количества ЦТЛ, распознающих комплекс, содержащийся в образце. Образом, забранным у субъекта, может быть любой, если есть вероятность, что он содержит лимфоцит. Примеры образцов включают жидкости организма, такие как кровь, или лимфа, или ткань. Комплекс пептида WT1 и молекулы HLA-A*3303 можно получить в виде, например, тетрамера или пентамера, используя методы, известные специалисту в данной области, такие как биотин-стрептавидиновый метод. Присутствие или количество ЦТЛ, распознающих такой комплекс, можно измерить методом, известным специалисту в данной области. В этом аспекте настоящего изобретения комплекс может иметь метку. В качестве метки можно использовать известные метки, такие как флуоресцентные или радиоактивные метки. Мечение делает определение присутствия или количества ЦТЛ легким и быстрым. Способ по этому аспекту настоящего изобретения можно использовать в диагностике рака, его прогнозировании или в аналогичных целях.
Таким образом, настоящее изобретение также касается композиции для определения присутствия или количества WT1-специфичных ЦТЛ у субъекта, несущего аллель HLA-A*3303, содержащей комплекс пептида WT1 и молекулы HLA-A*3303.
Кроме того, настоящее изобретение относится к набору для определения присутствия или количества WT1-специфичных ЦТЛ у субъекта, несущего аллель HLA-A*3303, содержащему комплекс пептида WT1 и молекулы HLA-A*3303.
В дополнительном аспекте настоящее изобретение относится к способу получения WT1-специфичных ЦТЛ с использованием комплекса пептида WT1 и молекулы HLA-A*3303, включающему в себя:
(а) реакцию комплекса с образцом; и
(б) получение ЦТЛ, распознающих комплекс, содержащийся в образце. Комплекс пептида WT1 и молекулы HLA-A*3303 описан выше. Образцом, забранным у субъекта, может быть любой, если есть вероятность, что он содержит лимфоцит. Примеры образцов включают образцы, забранные у субъекта, такие как кровь, или клеточная культура. Распознающие комплекс ЦТЛ можно получить, используя способ, известный специалисту, такой как проточная цитофлуориметрия или разделение на магнитных частицах. Настоящее изобретение дает возможность культивировать полученные WT1-специфичные ЦТЛ и использовать их для лечения или профилактики различных раковых заболеваний.
Таким образом, настоящее изобретение также относится к WT1-специфичным ЦТЛ, которые можно получить способом получения WT1-специфичных ЦТЛ с использованием комплекса пептида WT1 и молекулы HLA-A*3303.
Кроме того, настоящее изобретение относится к набору для получения WT1-специфичных ЦТЛ, содержащему комплекс пептида WT1 и молекулы HLA-A*3303.
В другом аспекте настоящее изобретение относится к полинуклеотиду, кодирующему HLA-A*3303-рестриктированный пептид WT1 (здесь и далее именуемый как полинуклеотид WT1). Полинуклеотидом по настоящему изобретению может являться ДНК или РНК. Последовательность оснований полинуклеотида настоящего изобретения можно определить на основе аминокислотной последовательности HLA-A*3303-рестриктированного пептида WT1. Полинуклеотид можно получить, например, методом синтеза ДНК или РНК, ПЦР-методом или аналогичными методами.
В другом аспекте настоящее изобретение относится к экспрессионному вектору, содержащему полинуклеотид (здесь и далее именуемый как экспрессионный вектор WT1). Тип экспрессионного вектора, его последовательность, отличную от последовательности полинуклеотида, и т.п. можно соответственно выбрать в зависимости от типа хозяина, в который встраивается экспрессионный вектор по настоящему изобретению, цели применения или аналогичных факторов. Возможно лечение или профилактика возникновения гематопоэтических опухолей или солидных раковых заболеваний путем введения субъекту, несущему аллель HLA-A*3303, экспрессионного вектора по настоящему изобретению, чтобы в организме этого субъекта получить пептид WT1 и индуцировать WT1-специфичные ЦТЛ и таким образом лизировать клетки гематопоэтических опухолей или солидных раковых заболеваний у субъекта.
В другом аспекте настоящее изобретение относится к фармацевтической композиции для лечения или профилактики рака, содержащей полинуклеотиды WT1 или вектор, экспрессирующий WT1. Композиция, способ введения и другие параметры фармацевтической композиции по настоящему изобретению в этом аспекте описаны выше.
В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака, включающему в себя введение субъекту, несущему аллель HLA-A*3303, эффективного количества фармацевтической композиции, содержащей пептид WT1, или вектор, экспрессирующий WT1. Примеры раковых заболеваний, которые можно лечить или предотвратить подобным образом, включают гематопоэтические опухоли, такие как лейкемия, миелодиспластический синдром, множественная миелома или злокачественная лимфома, и солидные раковые заболевания, такие как рак желудка, рак толстой кишки, рак легких, рак молочной железы, рак эмбриональных клеток, рак печени, рак кожи, рак мочевого пузыря, рак простаты, рак матки, рак шейки матки или рак яичников.
В другом аспекте настоящее изобретение относится к применению полинуклеотида WT1 или вектора, экспрессирующего WT1, для изготовления фармацевтической композиции, содержащей полинуклеотид WT1 или вектор, экспрессирующий WT1.
В другом аспекте настоящее изобретение относится к клетке, содержащей экспрессионный вектор. Клетку по настоящему изобретению можно получить, например, трансформацией клетки-хозяина, такой как клетка E.coli, дрожжей, насекомых или животного. Способ для введения экспрессионного вектора в клетку-хозяина можно соответственно выбрать из различных способов. Пептид по настоящему изобретению можно получить культивированием трансформированных клеток и выделением или очисткой полученного пептида WT1.
В дополнительном аспекте настоящее изобретение относится к WT1-специфичным ЦТЛ, которые индуцируются HLA-A*3303-рестриктированным пептидом. ЦТЛ по настоящему изобретению распознают комплекс пептида WT1 и молекулы HLA-A*3303. Таким образом, ЦТЛ по настоящему изобретению можно применять для специфического лизиса опухолевых клеток, несущих молекулы HLA-A*3303 на поверхности и экспрессирующих WT1 на высоком уровне.
В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака, включающему введение WT1-специфичных ЦТЛ субъекту, несущему аллель HLA-A*3303. Способ введения WT1-специфичных ЦТЛ можно выбрать соответствующим образом в зависимости от условий, таких как тип заболевания, состояние субъекта и местоположение мишени. Примеры таких способов включают, но не ограничены этим, внутривенное введение, внутрикожное введение, подкожное введение, внутримышечное введение, назальное введение и пероральное введение.
В другом аспекте настоящее изобретение относится к способу индукции WT1-специфичных ЦТЛ, включающему в себя культивирование мононуклеарных клеток периферической крови в присутствии HLA-A*3303-рестриктированного пептида WT1 для индукции WT1-специфичных ЦТЛ из мононуклеарных клеток периферической крови. Субъект, от которого получают мононуклеарные клетки периферической крови, может являться любым индивидуумом, если он имеет аллель HLA-A*3303. При культивировании мононуклеарных клеток периферической крови в присутствии HLA-A*3303-рестриктированного пептида WT1 индуцируются WT1-специфичные ЦТЛ из клеток предшественников ЦТЛ, входящих в мононуклеарные клетки периферической крови. Возможно проводить лечение или предотвратить возникновение гематопоэтических опухолей или солидных раковых заболеваний у субъекта, несущего аллель HLA-A*3303, путем введения субъекту WT1-специфичных ЦТЛ, полученных по настоящему изобретению.
В другом аспекте настоящее изобретение относится к набору для индукции WT1-специфичных ЦТЛ, содержащему HLA-A*3303-рестриктированный пептид WT1 в качестве основного компонента. Предпочтительно, чтобы набор использовался в способе для индукции WT1-специфичных ЦТЛ. Набор по настоящему изобретению может содержать в дополнение к HLA-A*3303-рестриктированному пептиду WT1, например, средства получения мононуклеарных клеток периферической крови, адъювант, реакционные пробирки или аналогичные предметы. Обычно к набору прилагают руководство по использованию. Индукция WT1-специфичных ЦТЛ эффективно осуществляется с использованием набора по настоящему изобретению.
В дополнительном аспекте настоящее изобретение относится к антиген-представляющей клетке (такой, как дендритная клетка), представляющей пептид WT1 на молекуле HLA-A*3303, которая индуцируется HLA-A*3303-рестриктированным пептидом WT1. Индукция WT1-специфичных ЦТЛ эффективно осуществляется с использованием антиген-представляющей клетки по настоящему изобретению.
В другом аспекте настоящее изобретение относится к способу лечения или профилактики рака, включающему введение субъекту, несущему аллель HLA-A*3303, антиген-представляющей клетки, представляющей пептид WT1 на молекуле HLA-A*3303. Способ введения антиген-представляющих клеток можно выбрать соответствующим образом в зависимости от условий, таких как тип заболевания, состояние субъекта и местоположение мишени. Примеры таких способов включают, но не ограничены этим, внутривенное введение, внутрикожное введение, подкожное введение, внутримышечное введение, назальное введение и пероральное введение.
В другом аспекте настоящее изобретение относится к способу индукции антиген-представляющей клетки, представляющей пептид WT1 на молекуле HLA-A*3303, включающему культивирование незрелой антиген-представляющей клетки в присутствии HLA-A*3303-рестриктированного пептида WT1 для индукции антиген-представляющей клетки, представляющей пептид WT1 на молекуле HLA-A*3303, из незрелой антиген-представляющей клетки. Незрелой антиген-представляющей клеткой называется клетка, такая как незрелая дендритная клетка, которая может развиться в антиген-представляющую клетку. Субъект, от которого получают незрелые антиген-представляющие клетки, может являться любым индивидуумом, если он имеет аллель HLA-A*3303. Поскольку незрелые антиген-представляющие клетки входят, например, в мононуклеарные клетки периферической крови, то можно культивировать такие клетки в присутствии пептида WT1.
В другом аспекте настоящее изобретение относится к набору для индукции антиген-представляющих клеток, представляющих пептид WT1 на молекуле HLA-A*3303, содержащему HLA-A*3303-рестриктированный пептид WT1 в качестве основного компонента. Предпочтительно, чтобы набор использовался в способе индукции антиген-представляющих клеток. Другие компоненты, которые могут содержаться в наборе и т.п., описаны выше. Набор по настоящему изобретению можно использовать для эффективной индукции антиген-представляющих клеток, представляющих пептид WT1 на молекуле HLA-A*3303.
В другом аспекте настоящее изобретение относится к антителу против HLA-A*3303-рестриктированного пептида WT1 или антителу против кодирующего полипептид полинуклеотида. Антитело по настоящему изобретению может являться поликлональным антителом или моноклональным антителом.
В дополнительном аспекте настоящее изобретение относится к способу диагностики рака, включающему применение WT1-специфичных ЦТЛ, антиген-представляющих клеток, представляющих пептид WT1 на молекуле HLA-A*3303, или антитела против HLA-A*3303-рестриктированного пептида WT1 или антитела против кодирующего полипептид полинуклеотида. Предпочтительно, чтобы в способе диагностики по настоящему изобретению применялись WT1-специфичные ЦТЛ. Например, возможно диагностировать рак посредством инкубации ЦТЛ, антиген-представляющих клеток или антитела с образцом от субъекта, несущего аллель HLA-A*3303, или посредством введения их субъекту, несущему аллель HLA-A*3303, и определяя, например, их местоположение, участок связывания или количество. ЦТЛ, антиген-представляющие клетки или антитело могут нести метку. В результате присоединения метки способ диагностики по настоящему изобретению можно эффективно применять на практике.
В другом аспекте настоящее изобретение относится к набору для диагностики рака, содержащему WT1-специфичные ЦТЛ, антиген-представляющие клетки, представляющие пептид WT1 на молекуле HLA-A*3303, или антитело против HLA-A*3303-рестриктированного пептида WT1 или антитело против кодирующего полипептид полинуклеотида, в качестве основного компонента.
В следующих примерах изобретение будет пояснено подробнее, но их не следует истолковывать как ограничивающие объем изобретения.
Примеры
Пример 1
Выбор пептида WT1
С помощью программы NetMHC2.0 (Technical University of Denmark) были выбраны пептиды WT1337, WT1364, WT1367 и WT1409, которые представляют собой гидрофильные пептиды, состоящие из 9 аминокислот с соответствующим HLA-A*3303 якорным мотивом (вторая аминокислота от N-конца является любой из Ala, Ile, Leu, Val, Phe, Tyr, Ser и Asp, а аминокислота на С-конце является Arg), и которые, как ожидается, имеют высокую аффинность связывания пептида WT1 из белка WT1 (SEQ ID No: 1) с молекулой HLA-A*3303. Аминокислотные последовательности и аффинность связывания этих пептидов с молекулой HLA-A*3303 приведены в таблице.
| Пептид | Положение аминокислоты в SEQ ID No: 1 | Аминокислотная последовательность | Аффинность связывания с молекулой HLA-A*3303 |
| WT1337 (SEQ ID No: 2) | 337-345 | LSHLQMHSR | 18,827 |
| WT1364 (SEQ ID No: 3) | 364-372 | FSRSDQLKR | 15,143 |
| WT1367 (SEQ ID No: 4) | 367-375 | SDQLKRHQR | 14,496 |
| WT1409 (SEQ ID No: 5) | 409-417 | TSEKPFSCR | 15,310 |
Получение клеток B-LCL (В-лимфобластоидной клеточной линии)
Выделяли мононуклеарные клетки периферической крови (РВМС) центрифугированием в градиенте плотности Ficoll-Hypaque из периферической крови, забранной у здорового донора, несущего аллель HLA-A*3303 (HLA-A*3303/0207). Затем клетки РВМС высевали на 24-луночный культуральный планшет с плотностью примерно 1×107 в среде RPMI 1640, содержащей 10% фетальной бычьей сыворотки, и добавляли культуральный супернатант от клеток В95-8 (клеток, продуцирующих вирус Эпштейна-Барра). Клетки культивировали при 37°С в 5% CO2 в течение месяца. Таким образом были получены клетки B-LCL, трансформированные вирусом Эпштейна-Барра, которые являются опухолевыми В-клетками. Было подтверждено, что полученные клетки B-LCL не экспрессируют ген WT1. Клеткам был дан импульс путем инкубации их с 20 мкг/мл WT1337, WT1364, WT1367 или WT1409 в течение 2 часов, и они получили дозу ионизирующего облучения в 80 Гр. Полученные клетки B-LCL (здесь и далее именуемые как клетки B-LCL, получившие импульс пептидом WT1) использовали как антиген-представляющие клетки для нижеследующих экспериментов.
Индукция WT1-специфичных ЦТЛ
3×106 клеток PBMCs (HLA-A*3303/1101) культивировали в 24-луночном культуральном планшете в полной среде (45% среды RPMI, 45% среды AMI-V и 10% сыворотки АВ человека), содержащей 20 мкг/мл WT1337, WT1364, WT1367 или WT1409 при 37°С в 5% CO2 в течение 1 недели, чтобы получить отвечающие на стимул клетки. 2×106 полученных отвечающих на стимул клеток культивировали совместно с 1×106 клеток B-LCL, которые получили импульс тем же пептидом WT1 в полной среде в течение 1 недели (первая стимуляция). Клетки PBMC культивировали совместно с клетками B-LCL, которые получили импульс пептидом WT1, еще три раза (вторая-четвертая стимуляции) при условиях, при которых добавляли 20 ед./мл (конечная концентрация) IL-2 по следующей схеме: вторая стимуляция: два раза через день, начиная с третьего дня от начала стимуляции; третья и четвертые стимуляции: три раза с интервалами в один день, начиная со следующего дня после начала стимуляции. Полученные клетки концентрировали, используя набор Negative Selection Columns Gravity Feed Kit (StemSp), для того чтобы соотношение Т-клеток CD8+ стало примерно 80%, и культивировали совместно с клетками B-LCL, которым был дан импульс пептидом WT1 (пятая стимуляция). Т-клетки CD8+ (ЦТЛ), полученные на 5 день после последней стимуляции, использовали для измерения цитотоксической активности.
Цитотоксическая активность ЦТЛ
Цитотоксическую активность ЦТЛ измеряли, используя метод высвобождения 51Cr. Клетки ЦТЛ (здесь и далее именуемые эффекторные клетки) смешивали в соотношении (соотношение эффекторные клетки/клетки-мишени) 1:1, 5:1 или 10:1 в 200 мкл среды с клетками-мишенями, в которые был встроен 51Cr, и культивировали в 96-луночном культуральном планшете при 37°С в 5% CO2 в течение 4 часов. В качестве клеток-мишеней использовали клетки B-LCL, которые по