Химерный пептид и фармацевтическая композиция для лечения онкологических заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии и медицины. Описано применение химерного пептида, содержащего функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a и транспортную 16-аминокислотную последовательность из белка Antp, для лечения онкологического заболевания, выбранного из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника, при этом транспортная аминокислотная последовательность присоединена к С-концу указанной функциональной последовательности посредством группы X, где Х представляет собой аминокислотную последовательность, содержащую 1-50 аминокислотных остатков. Изобретение может быть использовано для разработки препарата, эффективно проникающего в клетки-мишени и обладающего высоким цитостатическим и цитотоксическим действием. 2 н. и 2 з.п. ф-лы, 19 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и медицины, в частности к новому химерному пептиду, состоящему из цитотоксического фрагмента р16 с аминокислотной последовательностью 84-103 или 84-106 и транспортного фрагмента Antp с аминокислотной последовательностью 43-58, обладающему ингибирующей активностью в отношении циклиновых киназ. Изобретение также относится к применению вышеуказанного химерного пептида для лечения онкологических заболеваний, а также к фармацевтической композиции, обладающей антипролиферативной активностью, и способу лечения онкологических заболеваний, включающему введение указанного химерного пептида нуждающемуся в таком лечении млекопитающему. Задачей изобретения является разработка препарата, эффективно проникающего в клетки-мишени и обладающего высоким цитостатическим и цитотоксическим действием.
Уровень техники
С начала 90-х годов в России ежегодно диагностируют более 400 тысяч случаев злокачественных новообразований (Давыдов М.И., Аксель Е.М. 2008). При этом в Европе ежегодная смертность от онкологических заболеваний за период с 1985 года по 2002 продолжает расти. В структуре причин смертности онкологические заболевания занимают 2-е место после заболеваний сердечно-сосудистой системы. Поэтому поиск новых лекарственных противоопухолевых препаратов является одной из актуальных задач современной биологии и медицины.
В настоящее время большое количество работ посвящено созданию новых лекарственных противоопухолевых препаратов на основании достижений молекулярной биологии (Richard J.P. et al., 2003; Takeshima K. et al., 2003; Jyotika A. et al., 2005, Копнин Б.П., 2000). Общепринято, что основополагающим признаком неопластической клетки является нарушение регуляции клеточного цикла и апоптоза (Chappuis P.O., Kapusta L., 2005). Известно, что регуляция процессов пролиферации клетки контролируется путем последовательной активации циклинов и соответствующих циклин-зависимых киназ (CDK). Активность циклиновых киназ определяется уровнем экспрессии соответствующих циклинов и активностью специфических ингибиторов циклиновых киназ (Kastan M.B., Bartek J., 2004). Имеется несколько семейств ингибиторов циклиновых киназ. Наиболее изученными и практически важными из них являются - p16INK4a, p21CIP/ KIP, p27 KIP1 (Lowe S.W. et al., 2004). Мутации или гиперметилирование промоторов генов ингибиторов циклиновых киназах наблюдаются в 40-60% случаев злокачественных лимфом, раке поджелудочной железы и ряде других злокачественных новообразований (Sawyers С., 2004; Ortega S. и др., 2002).
Основываясь на этих результатах, был синтезирован ряд низкомолекулярных ингибиторов циклиновых киназ, часть из которых проходит их экспериментальное изучение (Ross M.F., Murphy M.P., 2004), а один UCN-1 проходит первую фазу клинических исследований. Другим возможным направлением для создания ингибиторов циклиновых киназ может быть использование функциональных последовательностей из соответствующих внутриклеточных ингибиторов (Ziegler А. et al., 2005). Белок р16INK4a является одним из наиболее интересных кандидатов группы ингибиторов Cdk (Xu D. et al., 2004; Zhang Y. et al., 2005). Известно, что белок p16INK4a ингибирует циклин-зависимые киназы D и тем самым прохождение G1 фазы клеточного цикла (Fu G.H. et al., 2005; Ben-Saadon R. et al., 2004). Показано, что его функция нарушена при широком спектре онкологических заболеваний (Li J.Q. et al., 2004). В последнее время стали появляться экспериментальные работы, описывающие применение гена p16INK4a для генной терапии опухолей различного генеза (Lee A.W.C., Li J-H et. al. 2003; Liu S.X., Tang S.Q., Liang C.Y., 2003; Zhang Y., Liu J. et al. 2005). Дополнительным мотивом к поиску технологий применения естественных белковых ингибиторов пролиферации стало открытие коротких последовательностей аминокислот (n=15-30), способных выполнять векторные (транспортные) функции в отношении пептидных последовательностей и соединений другой химической природы (РНК, ДНК) (Fawell S., Seery J. et al., 1994; Vives E., Brodin P., Lebleu B. 1997; Kaplan I.M. et al., 2005; Gupta B. et al., 2005; Fernandez-Carneado J. et al., 2005).
До настоящего времени проблему восстановления нарушенной функции внутриклеточных белков пытались решать на основе методов доставки гена (генная терапия) (Георгиев Г.П. 2000; Wender P.A. et al., 2000; Барышников А.Ю. 2004). Однако эта технология до настоящего времени не получила широкого выхода в клиническую практику из-за ряда принципиальных проблем.
Альтернативный способ решения этой задачи, основанный на технологии пептидных векторов, обладающих способностью проникать в клетки, не повреждая плазматическую мембрану, является весьма перспективным ввиду слабой иммуногенности таких соединений и способности переносить достаточно крупные молекулы.
Соединение возможности целевой доставки пептидов в клетку и обнаружение коротких функциональных доменов в белках-регуляторах различных клеточных функций создали предпосылки для конструирования молекул, имеющих патогенетическую направленность (Schutze-Redelmeier М.Р. и др., 2004; Trehin R., Merkle H.P., 2004; Cong-Mei Wu и др., 2004). Относительная простота синтеза таких молекул позволяет говорить о принципиальной возможности создания индивидуальных химиопрепаратов на их основе, т.е. влияющих на патологические изменения, свойственные данной конкретной опухоли (Perea S.E. и др., 2004).
Открытие пептидов, способных проникать в клетку без участия мембранных белков и способных осуществлять внутриклеточный транспорт связанных с ними белковых фрагментов и олигонуклеотидов, открывает новый этап в развитии биологии и медицины. Одним из эффективных переносчиков крупных молекул внутрь клеток является пептид pAntp. Его свойства известны, в частности, из публикаций Derossi D. et al. The third helix of the Antennapedia homeodamain translocates through membranes.// J.Biol. Chem. 269 (1994) 10444-10450 и Morris MC. et al. A peptides carrier for the delivery of biologically active proteins in mammalian cells.//Nat. Biotechnology. 19 (2001) 1173-1176.
По мнению автора, наиболее близким аналогом настоящего изобретения является патент US 6569833 B1 (Cyclacel Limited, GB). В этом документе раскрываются пептиды, которые связываются с циклиновыми киназами и включают аминокислотные остатки 84-103 полноцепочечного белка р16 и могут быть объединены с последовательностью транспортного белка пенетратина посредством дисульфидной связи, образующейся между остатками цистеина, специально присоединенными к С-концу пептида р16 и N-концу пептида Antp. Недостатком данного подхода является необходимость избирательного и многоступенчатого синтеза химерной молекулы, что усложняет схему получения целевого продукта и увеличивает общие временные затраты на синтез.
Раскрытие изобретения
Настоящее изобретение относится к области биотехнологии и медицины.
Задачей изобретения является создание нового химерного пептида, обладающего повышенным терапевтическим действием и не требующего сложной и трудоемкой схемы его получения.
Техническим результатом настоящего изобретения является улучшенный медико-биологический эффект, объективно проявляющийся в выраженном цитотоксическом действии указанного химерного пептида в сравнении с другими аналогичными пептидами на опухолевые клетки таких заболеваний, как колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника, а также упрощение схемы получения химерного пептида за счет уменьшения общего количества стадий. Вторым техническим результатом является расширение арсенала лекарственных средств для лечения онкологических заболеваний. Кроме того, автор настоящего изобретения неожиданно обнаружил выраженный синергетический эффект при совместном использовании вышеуказанного химерного пептида с уже существующими химиотерапевтическими противоопухолевыми препаратами (таксол и 5-фторурацил).
Технический результат достигается благодаря получению химерного пептида, имеющего строго определенную последовательность связывания функционального и транспортного фрагментов в химерной пептидной молекуле, а также благодаря наличию дополнительных аминокислотных остатков (от 1 до 50), связывающих между собой два вышеуказанных пептидных фрагмента.
В одном варианте осуществления настоящее изобретение относится к химерному пептиду для лечения онкологических заболеваний, который содержит функциональную 20-аминокислотную последовательность из белка-ингибитора циклиновых киназ p16INK4a - DAAREGFLDTLVVLHRAGAR (SEQ ID NO.1), и транспортную 16-аминокислотную последовательность из белка Antp - RQIKIWFQNRRMKWKK (SEQ ID NO.2), при этом транспортная аминокислотная последовательность присоединена к С-концу указанной функциональной последовательности посредством группы X, где Х представляет собой аминокислотную последовательность, содержащую 1 до 50 аминокислотных остатков.
В одном из предпочтительных вариантов осуществления изобретение относится к химерному пептиду, который может быть использован для лечения онкологических заболеваний, выбранных из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
В наиболее предпочтительном варианте осуществления химерный пептид может быть использован для лечения колоректального рака.
В другом препочтительном варианте осуществления химерный пептид имеет аминокислотную последовательность DAAREGFLDTLVVLHRAGARSRQIKIWFQNRRMKWKK (SEQ ID NO.3).
В другом предпочтительном варианте осуществления химерный пептид имеет аминокислотную последовательность RGSDAAREGFLDTLVVLHRAGARSRQIKIW-FQNRRMKWKKSERKRGRQTYTRYQTLELEKEFHFNRYLTRRRRIEIAHALCLTE (SEQ ID NO.4).
В другом варианте осуществления настоящее изобретение относится к применению указанного химерного пептида для лечения онкологических заболеваний.
В предпочтительном варианте осуществления химерный пептид применяется для лечения онкологических заболеваний, выбранных из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
В другом варианте осуществления настоящее изобретение относится к применению указанного химерного пептида для получения лекарственного средства, предназначенного для лечения онкологических заболеваний.
В предпочтительном варианте осуществления указанное лекарственное средство может применяться для лечения онкологических заболеваний, выбранных из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, обладающей антипролиферативной активностью, которая включает в качестве терапевтически активного вещества вышеуказанный химерный пептид, в сочетании с фармацевтически приемлемыми носителями.
В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, обладающей антипролиферативной активностью, которая содержит два активных вещества, где первым активным веществом является вышеуказанный химерный пептид, а в качестве второго активного вещества может выступать химиотерапевтическое противоопухолевое средство, выбранное из группы, включающей таксол и 5-фторурацил.
В другом варианте осуществления настоящее изобретение относится к способу лечения онкологического заболевания, который включает введение млекопитающему, нуждающемуся в таком лечении, вышеуказанного химерного пептида.
В предпочтительном варианте осуществления вышеуказанного способа онкологическое заболевание выбрано из группы, включающей колоректальный рак, рак почек, рак легкого, рак молочной железы, рак мочевого пузыря, рак поджелудочной железы, рак матки, рак предстательной железы, рак желудка и рак яичника.
Краткое описание чертежей
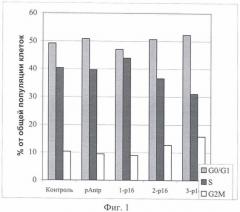
На Фиг.1 и 2 показано влияние химерных пептидов pAntp, содержащих фрагмент p16INK4a, на клеточный цикл. А - несинхронизированная клеточная линия - 293, Б - синхронизированная в S-фазе клеточная линия - 293. Концентрация пептидов - 40 мкМ.
На Фиг.3 и 4 показано влияние химерных пептидов pAntp, содержащих фрагмент p16INK4a, на клеточный цикл. А - несинхронизированная клеточная линия - 549, Б - синхронизированная клеточная линия - 549. Концентрация пептидов - 40 мкМ.
На Фиг.5 показано влияние химерных пептидов, содержащих фрагмент p16INK4a, на изменение уровня апоптоза в несинхронизированной и синхронизированной клеточной линии А549, концентрация пептидов - 40 мкМ. По оси Y -% апоптозных тел.
На Фиг.6 показано влияние химерных пептидов, содержащих фрагмент p16INK4a, на изменение уровня апоптоза в несинхронизированной и синхронизированной клеточной линии 293, концентрация пептидов - 40 мкМ. По оси Y -% апоптозных тел.
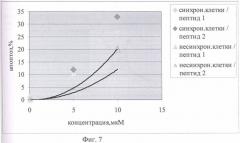
На Фиг.7 показано сравнение цитотоксического влияния химерных пептидов pAntp_p16 (1, 2) на 293 клеточную культуру.
На Фиг.8 показано сканирование клеточной линии А549, инкубировавшейся в течение 15 минут с пептидом с использованием лазерного сканирующего микроскопа LeicaTCS SP2. На фигуре изображены клетки, в которых химерный пептид р16р_Antp-ФИТС виден как светящиеся точки.
На Фиг.9 показано распределение белка pAntp_p16 в клетках А549 во времени. Через 1, 15 и 30 минут после добавления белка. Лазерный сканирующий микроскоп Leika.
На Фиг.10 показана динамика накопления ФИТЦ меченного химерного пептида p16p_Antp в мононуклеарной фракции клеток крови. Стрелкой указано время добавления пептида в кювету проточного цитометра.
На Фиг.11 показана кинетика накопления ФИТЦ - меченного пептида p16__pAntp в лимфоциты периферической крови in vitro. Ось Х - время в у.е., ось Y - интенсивность флуоресценции (у.е.).
На Фиг.12 показана динамика накопления ФИТЦ меченного химерного пептида p16p_Antp на примере клеточной линии Jurkat. Стрелкой указано время добавления химерного пептида в кювету проточного цитометра.
На Фиг.13 показана зависимость интенсивности внутриклеточной флуоресценции и концентрации препарата в среде. Первый пик отражает интенсивность флуоресценции при добавлении к клеточной культуре Raji химерного пептида Antp_p16, меченного ФИТЦ, в концентрации 0,1 мкМоль, инкубация с пептидом 15 минут в темноте; второй и третий пики - изменение интенсивности внутриклеточной флуоресценции при изменении внеклеточной концентрации пептидана 1 и 10 мкМоль, соответственно.
На Фиг.14 показана зависимость интенсивности флуоресценции клеток и внеклеточной концентрации химерного пептида.
На Фиг.15 показано изменение объема опухоли перевитых клеток у бестимусных мышей при введении в опухоль химерного интернализуемого пептида Antp_p16. Мышам перививали культуру клеток А549 и вводили пептид Antp_p16 в дозах 0,1 и 0,2 мг.
На Фиг.16 показано изменение объема опухоли перевитых клеток у бестимусных мышей при введении в опухоль химерного интернализуемого пептида Antp_p16. Мышам были перивиты клетки НСТ-116, пептид вводился в дозе 0,1 мг.
На Фиг.17 показаны фотографии экспериментальных животных на момент 7 инъекции исследуемого интернализуемого пептида P16_Antp. А и В - фотографии мышей с перевитыми клетками А549, А - мышь из контрольной группы на 16 день эксперимента, опухоль имеет размер 6,0×7,0 мм. В - мышь из опытной группы на 16 день эксперимента при введении P16_Antp в дозе 0,1 мг, опухоль размером 3,0×3,0 мм. Фигуры С и D - мыши с перевитыми клетками НСТ-116, С - мышь из контрольной группы на 18 день после перевивки опухолевых клеток (опухоль размером 11,5×13,5 мм). D - мышь из опытной группы после 7 инъекций P16_Antp в дозе 0,1 мг, опухоль размером 4,5×4,5 мм.
На Фиг.18 показана двухпараметрическая цитограмма клеток молочной железы. По оси Х - окраска PI, по оси Y- окраска цитокератином. Регион - «цитокератин-положительный апоптоз» указан стрелкой.
На Фиг.19 показано сочетанное действие химиопрепарата 5-фторурацила в концентрации 100 нМоль и химерного пептида pAntp_p16 (2) в концентрации 40 мкМоль. Распределение по фазам клеточного цикла культуры клеток А549 через 24 часа инкубации совместно с химиопрепаратом и исследуемым пептидом.
Осуществление изобретения
Материалы и методы исследования.
1. Методы получения химерных пептидов
1.1. Генно-инженерный метод получения химерного пептида
Получение генно-инженерной конструкции, кодирующей химерный пептид p16-Antp, наработку и очистку гибридного пептида проводили по следующим методикам. Фрагмент ДНК, кодирующий трансдукционный домен белка Antennapedia (Antp, 140-301 а,о.), из Drosophila melanogaster, наработанный методом ПЦР (полимеразной цепной реакции) и химически синтезированный фрагмент гена белка р16 (82-102 а.о.) клонировали в вектор pQE16. На основе полученных рекомбинантных плазмид сконструировали плазмиду pR762. pR762 содержит участок ДНК, кодирующий химерный пептид p16-Antp, состоящий из фрагментов белков р16 (82-102 а.о) и Antp (140-301 а.о). В N-концевой части кодируемого пептида содержится блок из 6-ти остатков гистидина, обеспечивающий возможность очистки данного белка с помощью аффинной хроматографии на Ni-NTA-агарозе. Наработку химерного пептида проводили в штамме Е. coli M15 [pREP4], способном экспрессировать данный белок в значимых количествах (около 5% от тотального белка клетки). Трансформацию клеток Е. coli плазмидой pR762 с геном гибридного белка p16-Antp проводили методом электропорации. Индукцию синтеза химерного белка и хроматографическую очистку на Ni-NTA-агарозе проводили в соответствии со стандартным протоколом фирмы QUIAGEN. Дополнительную очистку проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Степень чистоты полученного продукта проверяли методом электрофореза в полиакриламидном геле по Леммли. Полученный пептид стерилизовали методом фильтрации через фильтр с размером пор 0,2 мкм, хранили при -70°С порциями по 200 мкл и использовали для дальнейших экспериментов.
1.2. Получение химерного пептида твердофазным методом.
Некоторые использованные в работе пептиды были получены твердофазным методом с использованием Boc/Bzl-стратегии и следующих защитных групп для боковых функций аминокислот: Asp(cHex), Glu(cHex), Arg(Tos), Met(O), Ser(Bzl), Thr(Bzl), His(Bom), Lys(2Cl-Z) и Trp(CHO). В качестве полимерной подложки был использован сополимер стирола с 1% дивинилбензола, содержащий 0,53 ммоль/г Boc-Lys(2Cl-Z)-PAM производства Advanced Chem Tech Inc., U.S.A., производные аминокислот, конденсирующие агенты и катализаторы - производства Peptide Institute Inc., Japan, все растворители и трифторуксусная кислота (ТФУ) - отечественного производства. Деблокирование Вос-групп осуществляли действием 50% ТФУ в дихлорметане (DCM) с последующей нейтрализацией 5% раствором диизопропилэтиламина (Fluka, Switzerland) в DCM. Синтезы были осуществлены в проточном реакторе с непрерывной регистрацией изменения объема пептидилполимера (свеллографический мониторинг. Конденсации проводились с помощью TBTU (Bachem, Switzerland) в присутствии 1-гидроксибензотриазола (HOBt) и N-метилморфолина [59]. Полноту прохождения реакций конденсации на каждой стадии контролировали по качественному нингидриновому тесту. Четырехкратные избытки активированных производных применялись в ходе первой и, в случае необходимости, повторных конденсаций. В синтезе флуоресцентно меченного аналога FITC-P16-Ant N-концевой остаток присоединяли в форме Fmoc-Lys(Boc)-OH и после удаления Вос-группы/нейтрализации к пептидилполимеру прибавляли раствор 100 экв флуоресцеинизотиоцианата в диметилформамиде (ДМФ) и реакцию проводили в течение 20 часов. Непосредственно перед отщеплением пептида от полимерной подложки проводили удаление Fmoc и/или формильных групп, блокировавших боковые функции остатков триптофана, обработкой смолы 20%-ным раствором пиперидина в ДМФ (0°, 2 часа). Пептиды отщепляли от полимерной подложки с одновременным удалением постоянных защитных групп жидким фтористым водородом в две стадии по методике «low-high HF». После лиофилизации пептиды переводили в ацетат пропусканием через короткую колонку, заполненную ионообменной смолой Amberlite IRA-410 (Serva, Германия) (3 г, ацетатная форма), отделяли от побочных продуктов непептидной природы хроматографированием на колонке 2,6 см × 70 см с Sephadex G-10 (Pharmacia, Швеция), элюирование IN AcOH. Фронтальный пик собирали и лиофилизовали. Для всех пептидов получены адекватные величины молекулярных масс на масс-спектрометре VISION 2000 MALDI-TOF (Thermo Bioanalysis Corp. UK): 4485 и 5002, соответственно.
2. Исследования химерных пептидов
2.1. Исследование влияния положения и размера пептидного вектора на антипролиферативную активность химерных пептидов.
Одной из основных задач исследований было изучение влияния положения функциональной группы и размера пептида на их биологическую активность, для этого были синтезированы три пептида p16_pAntp (1-3) (Таблица 1). Отличия у данных химерных пептидов по месту расположения активного центра относительно N-C концов молекулы и по наличию вставки из 44 аминокислот (SERKRGRQTYTRYQTLELEKEFHFNRYLTRRRRIEIAHALCLTE) для пептида 3 (Таблица 1). Пептиды 1-3 состоят из функциональной части p16INK4a и интернализуемой последовательности pAntp и отличаются по местоположению функциональной группы относительно N-, С-концов молекулы и по наличию вставки для пептида 3 (получен генно-инженерным методом).
Пептиды p16_pAntp (1-2) отличаются местоположением функциональной группы p16INK4a: пептид 1 - p16INK4a расположен на С-конце молекулы, пептид 2 - p16INK4a расположен на N-конце, пептиды получены методом твердофазного синтеза. В случае химерного пептида p16_pAntp(3), полученного генно-инженерным методом, функциональная группа p16INK4a располагается нa N-конце, но имеется вставка из 44 АКО.
При исследовании свойств данных пептидов также исследовались синхронизированные и не синхронизированные клеточные культуры. В синхронизированную культуру пептид добавлялся в момент снятия блока синхронизации, в не синхронизированную - при плотности монослоя (для адгезионных культур) ~50%.
Результаты по изменению распределения клеток по фазам клеточного цикла для пептидов pAntp-p16INK4a (1,2,3) приведены на Фигурах 1-4. Добавление химерного пептида (1) (Таблица 1), содержащего фрагмент p16INK4a, не вызывает ожидаемого цитостатического эффекта. Как в случае синхронизированной, так и несинхронизированной культуры распределение клеток по фазам клеточного цикла практически не отличается по сравнению с контролем. Однако добавление пептидов 2 и 3 приводит к заметному снижению S-фазы, при этом также возрастает количество клеток в G0/1. Более четко это видно в экспериментах на синхронизированных культурах.
Эксперименты, проведенные на клеточной линии А549 (Фигуры 3 и 4), обнаружили сходные изменения клеточного цикла для всех исследованных пептидов.
Полученные результаты указывают, что химерный пептид pAntp-p16INK4a (1) не оказывает антипролиферативного действия на клетки. В то время как добавление химерных пептидов pAntp-p16INK4a (2 и 3) оказывает антипролиферативный эффект на клетки и приводит к увеличению клеток, находящихся в фазе G1.
Отсутствие цитостатического эффекта, при добавлении химерного пептида 1, возможно связано с изменением конформации пептидной молекулы из-за расположения интернализующей последовательности pAntp с N-конца химерного пептида (в случае пептидов 2 и 3 pAntp расположен с С-конца).
На следующем этапе работы проводилась оценка зависимости цитотоксического эффекта, оказываемого исследуемыми химерными пептидами с пептидным вектором pAntp. Эксперимент по определению уровня апоптоза проводили на клеточных линиях А549 (человек, карцинома легкого), 293 (человек, почка эмбриона) и MCF-7 (человек, аденокарцинома молочной железы). Клетки культивировали по стандартной методике, в среде DMEM, содержащей 10% ФСБ. Часть клеток была предварительно синхронизирована, используя методики двойного тимидинового блока и методику синхронизации с помощью обедненной среды. В культуральную среду добавляли исследуемые химерные пептиды p16p_Antp (1 и 2). В качестве отрицательного контроля использовали клетки, обработанные пептидом pAntp_zam (в качестве контроля использовали транспортный пептид (пептид Antp), или в части экспериментов, пептид, в котором была произведена замена аминокислот V95 и V96 на аланин, что приводит к потере его функциональной активности). (Фигуры 5 и 6).
Как видно из Фигур 5 и 6, на уровень апоптоза не влияет добавление контрольного пептида pAntp_zam, в то время как добавление p16p_ntp (1, 2) заметно увеличивает количество клеток, вошедших в апоптоз. При этом отличий в величине эффекта в зависимости от типа клеток (для линий А549 и 293) не обнаружено. Сравнение влияния пептидов p16p_ntp 1 и 2 на уровень апоптоза для клеточной линии 293 представлено на Фигуре 5. На Фигуре 6 видно, что зависимость количества апоптозных тел от концентрации p16_pAntp имеет степенной характер. Сравнение уровня апоптоза, при добавлении химерных пептидов, показало, что уровень апоптоза в случае добавления пептида 2 практически в 2 раза выше уровня апоптоза в эксперименте с химерным пептидом 1. Более выраженный цитотоксический эффект наблюдается на синхронизированной культуре. Таким образом, обнаружено, что химерные пептиды pAntp 1 и 2, содержащие фрагмент p16INK4a, обладают выраженными цитотоксичеческим действием по отношению к культурам клеток.
При сравнении цитотоксического и цитостатического действия химерных пептидов p16_pAntp 1 и 2 можно сделать вывод, что изменение положения интернализуемой последовательности pAntp, в химерном пептиде с С-конца на N-конец, приводит к исчезновению цитостатического эффекта и снижению цитотоксического эффекта.
На Фигуре 7 показано сравнение цитотоксического эффекта химерных пептидов p16_pAntp (1, 2) на 293 клеточную культуру.
Так как предполагаемым внутриклеточным эффектом исследуемых пептидов является ингибирование циклиновых киназ, был синтезирован контрольный пептид (Antp_zam), содержащий аналогичную последовательность из белка pl6INK4a (АКП 82-102) с заменой 92 тирозин - на 92 аланин. Данная замена была выбрана потому, что ранее в работе Ferouse et al. было показано, что замены 91 или 92 АКО приводят к утрате этим пептидом ингибирующей способности, свойственной для последовательности p16INK4a.
Таким образом, наиболее эффективным с точки зрения активации апоптоза является пептид, включающий циклин D ингибирующую последовательность из белка р16 (20 аминокислот) с векторной последовательностью pAntp (16 аминокислот), расположенной на С-конце функциональной аминокислотной последовательности.
2.2.Изучение проникающей способности интернализуемых пептидов.
Для регистрации проникновения пептидов внутрь клетки и исследования динамики накопления использовали идентичные химерные последовательности, конъюгированные с флуоресцентной меткой - флоуресцеин-изотиоцианатом (ФИТЦ). Т.к. включение молекул ФИТЦ в готовый полипептидный продукт часто приводит к существенному изменению его физико-химических свойств и потере физиологической активности, поэтому к исходной последовательности на N конце присоединялась молекула лизина, которая и несла одну молекулу ФИТЦ.
Методом световой флуоресцентной микроскопии было показано, что изучаемые пептиды связываются с клетками и проникают в клеточные линии Raji, Jurkatt, A549, 293 и периферические лимфоциты крови человека. Методом проточной цитофлуорометрии было показано связывание пептида с клетками и отсутствие эффекта тушения флуоресценции трипановым синим, что свидетельствует о накоплении пептида внутри клетки.
Наиболее объективные данные о накоплении пептида внутри клетки были получены с использованием метода сканирующей лазерной микроскопии (Фигура 8). Белок, меченный флюоресцеин-изотиоцианатом, был растворен в 0,9% NaCl. Клеточные линии A549, 293 выращивались на предметных стерильных стеклах и помещались в специальной камере непосредственно под окуляры микроскопа. Среда замещалась на среду с исследуемым белком. Насыщение белком наблюдали во времени. Кроме того, производилось послойное сканирование клеток с целью определения локализации пептида.
Анализ полученных изображений при данном увеличении не выявил преимущественного расположения белка p16_pAntp в клетке. Очевидно, что белок распределяется в компартментах клетки равномерно. Проникновение белка внутрь клетки происходит достаточно быстро. И уже через 15 минут инкубации можно наблюдать относительно гомогенное распределение его во внутриклеточном пространстве (Фигура 9).
Скорость проникновения пептида в периферические лимфоциты крови человека, а также лимфоциты клеточных линий (Raji, Jurkatt) была оценена с использованием метода проточной цитофлуорометрии. Данный метод позволяет исследовать большие концентрации клеток во времени и удобен для оценки скорости проникновения исследуемого пептида. Измерялась флуоресценция лимфоцитов под действием белка р16-рAntp-ФИТЦ при рН 7.5 и рН 6.0. Принцип метода основан на меньшем квантовом выходе флуоресценции ФИТЦ в растворах с более кислым рН. Так как скорость измерения происходит достаточно быстро, то значение рН внутри клетки не может измениться. Лимфоциты инкубировались с пептидом в течение 1-15 минут, после этого к ним сразу добавлялся 20-кратный объем фосфатного буфера с рН 6.0 и рН 7.5. При этом оценивалась разность интенсивности флуоресценции. В большинстве измерений интенсивности флуоресценции достоверно не отличались после 15 минут инкубации. Таким образом, можно предположить, что после 15 минут инкубации пептид полностью проникает внутрь клетки.
Для исследования скорости накопления пептида внутри клетки использовали метод проточной цитофлуорометрии. Для этого меченный ФИТЦ пептид вводили непосредственно в измерительную пробирку проточного цитометра, что позволяло регистрировать динамику изменения флуоресценции клеток (Фигура 10). Исследовалась мононуклеарная фракция лейкоцитов крови здоровых доноров, выделенная на градиенте фиколла. На Фигуре 10 приведена кинетика изменения флуоресценции клеток после добавления пептида, меченного ФИТЦ. Видно, что после небольшой лаг-фазы происходит быстрое накопление пептида в клетках нормальных лимфоцитов. Конечная концентрация достигается за время, равное ~ 1 мин.
На Фигуре 11 показан только фрагмент кривой, отражающей кинетику накопления химерного белка в клетке. Полученная кривая кинетики лучше описывается степенной
функцией типа С=const1-const2*t+const3, что отражает коэффициент регрессии (=0,79).
Похожая кинетика накопления пептида получена и для клеток злокачественных лимфом. В качестве моделей исследовались линии Jurkat (происходящая из лимфобластного лейкоза и имеющая Т-клеточный фенотип) и Raji - происходящая из В-клеточной лимфомы Беркита. На Фигуре 12 показана динамика накопления меченного ФИТЦ пептида в клетках Jurkat.
Приведенный график показывает, что и в опухолевые клетки пептид проникает с большой скоростью. Время достижения максимальной концентрации - менее 1 мин. Кинетика накопления исследовалась при комнатной температуре (t=20 C°). Следует подчеркнуть, что механизм проникновения исследуемого класса пептидов до настоящего времени не известен. Однако показано, что накопление происходит одинаково эффективно даже при температуре+5 С° и не связано с затратами энергии в клетке, не опосредуется клеточными рецепторами и не использует фаго- и пиноцитозный путь. Авторы также подтвердили факт накопления синтезированного пептида, содержащего интернализуемый фрагмент, при разных температурах (до +5 С°).
Также исследовали зависимость накопившегося в клетках пептида от внеклеточной его концентрации. На Фигуре 13 и 14 показано изменение интенсивности флуоресценции клеток в зависимости от внеклеточной концентрации.
На Фигуре 14 приведены те же данные, иллюстрирующие тот факт, что соотношение вне- и внутриклеточной концентрации имеет линейный характер (в исследованном диапазоне концентраций). Т.к. исследуемые пептиды могут преодолевать клеточную мембрану в обоих направлениях, можно предположить, что накопленные в клетке пептиды могут выходить из нее при снижении внеклеточной концентрации. Исследование процессов экспорта пептидов из клетки может быть темой отдельных исследований.
Таким образом, в результате проведенных экспериментов было показано, что кинетика накопления химерного пептида, содержащего интернализуемый фрагмент и фрагмент белка p16INK4a, имеет степенной характер с зависимостью типа С=const1+const2*t2. Показано также, что динамика накопления и внутриклеточного распределения пептида в нормальных и опухолевых клетках не отличается по характеру и по скорости накопления.
2.3. Материалы для исследований
2.3.1. Ведение клеточных линий
Исследование влияния пептидов на пролиферативную активность проводили in vitro на культурах клеток. Для этого были использованы следующие клеточные линии: Jurkat (Т-лимфобластный лейкоз, предоставлена ИБХ, Россия), 293 (человек, почка эмбриона, трансформированная ДНК аденовируса типа 5 (Ad5), предоставлена РАСХН), А549 - (человек, карцинома легкого, предоставлена РАСХН), Raji - (человек, лимфома Беркита, предоставлена Институт канцерогенеза), MCF-7 (человек, рак молочной железы, предоставлена ИБХ, Россия). Клетки Jurkat и Raji представляют собой адгезионные культуры, 293, А549 и MCF-7 - суспензионные. Для ведения клеток Jurkat и Raji использовалась среда RP Ml-1640 (ПанЭко, Россия), для ведения 293, А549 и MCF-7 среда DMEM (ПанЭко, Россия). Данные клеточные линии отличаются по экспрессии гена p16INK4a, так, как видно из Таблицы 2, в клеточных линиях Jurkat, А549 и MCF-7 p16INK4a не экспрессируется, а в линиях Raji и 293 его экспрессия не нарушена.
| Таблица 2 | |||||
| Уровень экспрессии генов р16 и р53 для используемых в работе клеточных линий | |||||
| Ген | Клеточная линия | ||||
| Jurkat | Raji | А549 | MCF7 | 293 | |
| Уровень экспрессии | |||||
| Р16 | - | + | - | - | + |
2.3.2. Ведение суспензионных культур (Raji, Jurkat)
Клетки культивировали в среде RPMI-1640 (ПанЭко, Россия), содержащей 10% FSB (ПанЭко, Россия), 300 нг антибиотика-антимикотика гентамицина (ПанЭко, Россия) и 2 мМ L-глутамина (ПанЭко, Россия) (37°С, 5% атмосфера СОг) (инкубатор). При достижении высокой плотности клетки отмывали от старой среды центрифугированием 2 мин при 1200 об./мин, ресуспендировали в среде RPMI-1640, содержащей 10% FSB, и пересевали.
2.3.3. Ведение адгезионных культур (293, А549, MCF-7)
Клетки культивировали в среде DMEM (ПанЭко, Россия), содержащей 10% FSB, 300 нг антибиотика-антимикотика и гентамицина и 2 мМ L-глутамина (37°С, 5% атмосфера СО2). Для снятия и рассаживания клеток с плашки удаляли супернатант. Промывали раствором фосфатно-солевого буфера (ФСБ). Добавляли 0.25% трипсина (ПанЭко, Россия) в ЭДТА, клетки отходили за 5 мин (иногда требуется инкубировать при 37°С в 5% атмосфере СО2 в течение 10 мин). Клетки отбирали, отмывали от трипсина центрифугированием 2 мин при 1200 об/мин, ресуспендировали в среде DMEM, содержащей 10% FSB, ставили флакон в инкубатор на 37°С в 5% атмосфере СО2.
При работе с клеточными культурами соблюдались необходимые требования к стерильности используемых реагентов и приборов. Клетки предварительно культивировали (37°С, 5% атмосфера COz) в культуральной среде, содержащей 10%FSB, либо при необходимости синхронизировали.
2.3.4. Исследование противоопухолевой активности химерного пептида p16_Antp in vivo (местное введение)
На бестимусных мышах (Nude) исследовалась противоопухолевая активность химерного интернализуемого пептида P16_Antp.
Методика исследования
Мышам были перевиты опухолевые культуры клеток человека линий А549 и НСТ-116 в количестве около 1 млн клеток на мышь.
39 мышам были привиты клетки А549, из них 20 мышей составили контрольную группу, им в дальнейшем вводили плацебо. 10 мышей составили 1 опытную группу. Им после образования пальпируемой опухоли (через 4 дня после перевивки клеток) стали вводить непосредственно в опухоль исследуемый пептид в дозе 0,1 мг. 9 мышей составили 2 опытную группу, им также после образования опухолевого узла на 4 день перевивки стали вводить в ложе опухоли по 0,2 мг пептида. Пептид в опытных группах вводили один раз в два дня. Эксперимент продолжался 24 дня.
Результаты
В опытных группах наблюдали снижение темпов роста опухолей и на 6 день после начала введения пептида можно наблюдать заметное снижение объема опухолей в опытных группах по сравнению с контрольной (Фигура 15). Эксперимент продолжался 24 дня. За это время в опытных группах было проведено 10 инъекций химерного пептида. В контрольной группе на 24 день эксперимента средний объем опухолей у мышей составил 95,24 мм3, одна мышь погибла. В первой опытной группе (доза вводимого пепти