Получение антител из одних тяжелых цепей в трансгенных животных
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии. Описан способ получения VH антител, включающий стадии обеспечения более одного гетерологического VH локуса тяжелых цепей на разных хромосомах в данном млекопитающем. Причем каждый VH локус тяжелых цепей содержит один или более сегментов V-гена, один или более сегментов D-гена, один или более сегментов J-гена и сегмент гена, кодирующий постоянную область тяжелых цепей, которая при экспрессии не включает участок Сн1. В результате антигенной стимуляции только один локус продуктивно рекомбинируется в В-клетке, что приводит к получению VH антитела из одних тяжелых цепей и экспрессии указанного VH антитела из указанного продуктивно рекомбинировавшегося локуса. Изобретение позволяет расшить репертуар ответа антител. 4 н. и 28 з.п. ф-лы, 12 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к улучшенным способам для получения у трансгенных нечеловеческих млекопитающих разнообразного репертуара функциональных антител из одних тяжелых цепей со зрелой аффинностью в ответ на антигенную стимуляцию и их применениям. Изобретение также относится к получению разнообразного репертуара класс-специфических антител из одних тяжелых цепей из многочисленных локусов.
В частности, настоящее изобретение относится к способу получения человеческих антиген-специфических антител любого класса или комбинации классов из одних тяжелых цепей с высокой аффинностью и выделения и экспрессии полностью функциональных VH антигенсвязывающих доменов.
Также описаны антитела из одних тяжелых цепей, полученные с применением способов настоящего изобретения.
В следующем описании все номера положений аминокислотных остатков даны в соответствии с номенклатурой, разработанной Kabat et al., [1].
УРОВЕНЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Антитела
Структура антител хорошо известна в данном уровне техники. Большинство естественных антител являются тетрамерами, содержащими две тяжелые цепи и две легкие цепи. Тяжелые цепи связаны друг с другом дисульфидными связями между шарнирными участками, расположенными приблизительно посередине каждой тяжелой цепи. Легкая цепь связана с каждой тяжелой цепью на N-концевом домене шарнирного участка. Каждая легкая цепь в норме связана с соответствующей ей тяжелой цепью посредством дисульфидной связи около шарнирного участка.
Если молекула антитела правильно сложена, то каждая цепь складывается в ряд различных глобулярных доменов, связанных посредством более линейных пептидных последовательностей. Например, легкая цепь складывается из вариабельного (VL) и постоянного (CL) участков. Тяжелые цепи имеют единственный вариабельный участок (VH), первый постоянный участок (CH1), шарнирный участок и два или три дополнительных постоянных участка. Постоянные участки тяжелых цепей и шарнирный участок вместе образуют то, что обычно известно как постоянная область тяжелой цепи антитела. Взаимодействие вариабельных участков тяжелой (VH) и легкой (VL) цепи приводит к образованию антигенсвязывающей области (FV). Взаимодействию тяжелой и легкой цепей способствуют CH1 участок тяжелой цепи и Cκ или Cλ участок легкой цепи. Обычно для связывания антигена необходимы как VH, так и VL, хотя было показано, что димеры тяжелой цепи и аминоконцевых фрагментов сохраняют активность в отсутствие легкой цепи [2].
В пределах вариабельных участков как тяжелой (VH), так и легкой (VL) цепей некоторые короткие полипептидные сегменты показывают исключительную изменчивость. Данные сегменты называются гипервариабельными областями или гипервариабельными участками (CDR). Промежуточные сегменты называются каркасными областями (FR). В каждом из участков VH и VL существует три CDR (CDR1- CDR3).
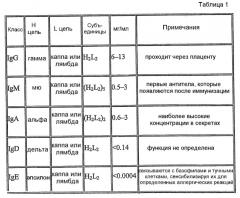
У млекопитающих существует пять классов антител: IgA, IgD, IgE, IgG и IgM с четырьмя подтипами IgG и двумя подтипами IgA, присутствующими у людей.
www.drugresearcher.com
Классы антител отличаются своей физиологической функцией. Например, IgG играет основную роль в зрелом иммунном ответе. IgM вовлечен в связывающий комплемент и агглютинацию. IgA является основным классом антител секретов - слез, слюны, молозива, слизи - и, таким образом, играет роль в локальном иммунитете. Эффекторные функции естественных антител обеспечиваются постоянной областью тяжелой цепи.
IgA можно обнаружить в местах, содержащих слизь (например, в кишечнике, в дыхательных путях или в мочеполовом канале) и он предотвращает колонизацию слизистых мест патогенами. IgD функционирует главным образом в качестве антигенного рецептора на B-клетках. IgE связывается с аллергенами и запускает высвобождение гистамина из тучных клеток (лежащее в основе механизма аллергии), и также обеспечивает защиту от гельминтов (червей). IgG (в его четырех изотипах) обеспечивает большую часть основанного на антителах иммунитета от инвазивных патогенов. IgM экспрессируется на поверхности B-клеток и также в секретируемой форме с очень высокой склонностью к удалению патогенов из организма на ранних стадиях опосредованного B-клетками иммунитета (например, до того как будет в наличии достаточное количество IgG, для того чтобы удалить из организма патогены).
Нормальные человеческие B-клетки содержат единственный локус тяжелой цепи на 14 хромосоме, из которого вырабатывается посредством перестройки ген, кодирующий тяжелую цепь. У мыши локус тяжелой цепи располагается на 12 хромосоме. Нормальный локус тяжелой цепи содержит множество сегментов V-гена, ряд сегментов D-гена и ряд сегментов J-гена. Большая часть VH участка кодируется сегментом V-гена, а С-конец каждого VH участка кодируется сегментом D-гена и сегментом J-гена. VDJ реаранжировка в B-клетках, за которой следует созревание аффинности, обеспечивает каждый VH участок с его антигенсвязывающей специфичностью. Анализ последовательности нормальных H2L2 тетрамеров показывает, что разнообразие происходит преимущественно из-за комбинации VDJ перестройки и соматической сверхмутации [3]. Существует свыше 50 человеческих сегментов V-генов, присутствующих в геноме человека, из которых только 39 являются функциональными.
Вполне человеческие антитела H2L2 могут вырабатываться у трансгенных мышей в ответ на антигенную стимуляцию. У подобных трансгенных мышей содержится единственный человеческий локус тяжелой цепи и отдельный локус легкой цепи. Сопоставимые локусы тяжелой и легкой цепи мыши удаляются или подавляются таким образом, что вырабатываются только человеческие антитела в отсутствие антител мыши [4-10].
С появлением новых методик молекулярной биологии присутствие антитела из одних тяжелых цепей (лишенного легкой цепи) распознавали при пролиферативных нарушениях B-клеток у человека (болезнь тяжелых цепей) и в мышиных модельных системах. Анализ болезни тяжелых цепей на молекулярном уровне показал, что мутации и делеции на уровне генома могли бы привести к нецелесообразной экспрессии участка тяжелой цепи CH1, вызывая экспрессию антитела из одних тяжелых цепей, лишенного способности связывать легкую цепь [11, 12].
Было показано, что камелиды, в результате естественных генных мутаций, вырабатывают функциональные димеры IgG2 и IgG3 из одних тяжелых цепей, которые не способны связывать легкую цепь из-за отсутствия участка CH1, который опосредует связывание с легкой цепью [13]. Характерным признаком антитела камелида из одних тяжелых цепей является специфический набор VH участков камелида, который обеспечивает улучшенную растворимость относительно VH участков человека и нормального камелида. VH участки камелида в данном специфическом наборе обычно называются участками VHH.
Также было показано, что такие виды, как акула, вырабатывают семейство связывающих белков, подобных таким, как из одних тяжелых цепей, возможно связанных с рецептором T-клеток млекопитающих или с легкой цепью антитела [14].
Для получения антитела камелида из одних тяжелых цепей локус тяжелой цепи зародыша камелида содержит генные сегменты, кодирующие некоторые или все возможные постоянные области тяжелой цепи. В течение созревания реаранжированный VHHDJ связывающий участок сплайсируется на 5'-конце генного сегмента, кодирующего шарнирный участок, для того чтобы обеспечить реаранжированный ген, кодирующий тяжелую цепь, в которой отсутствует CH1 участок, и, следовательно, не способен связывать легкую цепь.
Участки VHH камелида содержат ряд характерных аминокислот в положениях 37, 44, 45 и 47 [49]. Считается, что данные консервативные аминокислоты являются важными для обеспечения растворимости в антителах из одних тяжелых цепей. Только определенные VH участки камелида являются VHH участками с улучшенными характеристиками растворимости. Они ограничиваются VH подсемейством и, таким образом, продуктивно реагируют только на ограниченный диапазон антигенов.
Моноклональные антитела из одних тяжелых цепей можно восстановить из B-клеток селезенки камелида стандартной технологией клонирования или из мРНК B-клеток посредством бактериофага или другой технологии индикации [18]. Антитела из одних тяжелых цепей, полученные из камелидов, обладают самой высокой аффинностью. Анализ последовательности мРНК, кодирующей антитело из одних тяжелых цепей, показывает, что разнообразие происходит преимущественно из-за комбинации VHHDJ перестройки и соматической сверхмутации [49], как это также наблюдается при получении нормальных тетрамерных антител.
Важным и общим признаком естественных VH участков камелида и человека является то, что каждый участок связывается в виде мономера независимо от димеризации с участком VL для оптимальной растворимости и связывающей аффинности.
В последнее время были разработаны способы получения антител из одних тяжелых цепей у трансгенных нечеловеческих млекопитающих (см. WO 02085945 и WO 02085944). Функциональное антитело из одних тяжелых цепей потенциально любого класса (IgM, IgG, IgD, IgA или IgE) и полученное из любого млекопитающего может вырабатываться у трансгенных нечеловеческих млекопитающих (предпочтительно мышей) в результате антигенной стимуляции. Предварительные исследования основывались на применении двух сегментов V-гена ламы и имели ответ с ограниченным репертуаром антител.
Janssens et al. [15] разработали способы получения антител из одних тяжелых цепей в трансгенных мышах. Данные антитела из одних тяжелых цепей имеют высокую связывающую аффинность в результате созревания антитела в B-клетках, могут быть получены в результате антигенной стимуляции и селектированы с применением установленной технологии гибридомы и могут вырабатываться в виде любого класса антител с отсутствующей легкой цепью (например, IgG, IgA, IgM) или в виде только VH связывающих участков. Данные антитела из одних тяжелых цепей были получены из локуса тяжелой цепи антитела в зародышевой (т.е. нереаранжированной) конфигурации, который содержал два сегмента VHH-гена (класс 3) ламы, соединенные со всеми сегментами D- и J-генов и сегментами гена, кодирующего все человеческие постоянные области. Сегменты гена, кодирующего каждую из постоянных областей, имели делецию CH1 участка, для того чтобы предотвратить связывание легких цепей. Кроме того, локус содержал антитело LCR на 3'-конце для того, чтобы обеспечить высокий уровень экспрессии в клетках B-клеточной линии. Данный локус был введен мышам микроинъекцией оплодотворенных яйцеклеток.
Получение продуктов, основанных на антителах
Получение продуктов, основанных на антителах, посредством генной инженерии, в частности получение человеческих или гуманизированных продуктов, основанных на антителах, привело к образованию новых классов лекарственных препаратов, диагностических средств и реагентов и, помимо этого, к возможности для новой отрасли производства, применения и создания материальных благ (см., www.leaddiscovery.co.uk). Продукты, основанные на антителах, обычно получают из естественных тетрамерных антител. Существует множество патентов и заявок, которые относятся к получению продуктов, основанных на антителах. Данные патенты и заявки относятся к способам получения (например, из трансгенных мышей), способам производства и продукт-специфическим веществам. Данные продукты, основанные на антителах, отличаются от полностью тетрамерных антител фрагментами антитела в единственной цепи Fv (scFv) молекул.
Продукты, основанные на антителах, будут представлять большую часть новых лекарственных препаратов, запущенных в 21 веке. Терапия моноклональных антител уже признается предпочтительным способом лечения ревматоидного артрита и болезни Крона, и существует впечатляющий прогресс в лечении рака. Продукты, основанные на антителах, также разрабатываются для лечения сердечно-сосудистых и инфекционных заболеваний. Самые распространенные на рынке продукты, основанные на антителах, распознают и связывают единственный хорошо определяемый эпитоп на лиганде мишени (например, TNFα).
В последнее время VH участки с высокой аффинностью были выбраны из случайных человеческих VH участков в библиотеках генов или получены из антитела из одних тяжелых цепей, полученного естественным путем из-за антигенной стимуляции камелидов, или получены из библиотек VH участков, составленных из камелидов. Данные VH участки с высокой аффинностью были включены в продукты, основанные на антителах. Данные VH участки, также называемые VHH участками, проявляют ряд отличий от классических VH участков, в частности ряд мутаций, которые обеспечивают улучшенную растворимость и стабильность тяжелых цепей при отсутствии легких цепей. Самым главным из данных изменений является наличие заряженной аминокислоты в 45 положении [16].
Ряд групп работали над получением антител из одних тяжелых цепей, полученных из естественных тетрамерных антител. Jaton et al. [2 и другие ссылки, приведенные в контексте данного документа] описывают выделение редуцированных компонентов тяжелой цепи очищенного, хорошо охарактеризованного антитела кролика с аффинностью, после чего следует последовательная ренатурация отдельных тяжелых цепей. Иммунологическая характеристика ренатурированных тяжелых цепей показала, что только гомодимер тяжелой цепи без легкой цепи способен связывать антиген.
Впоследствии Ward et al. [18] однозначно показали, что клонированные мышиные VH области, при экспрессии в виде растворимых белковых мономеров в экспрессионной системе E.coli, сохраняют способность связывать антиген с высокой аффинностью. Ward et al. [18] описывают выделение и исследование VH участков и излагают потенциальные коммерческие преимущества данного подхода по сравнению с классическим получением моноклональных антител (см. последний абзац). Они также признают, что VH участки, выделенные из тяжелых цепей, которые естественно связываются с легкой цепью, испытывают недостаток в растворимости естественных тетрамерных антител. Следовательно, Ward et al. [18] использовали понятие «адгезивный» для описания данных молекул и предположили, что данная «адгезивность» может быть обращена к структуре VH участков с улучшенными свойствами растворимости.
Улучшение растворимости VH было впоследствии обращено к применению комбинаций отобранных случайно и сайт-специфических подходов с использованием фагового дисплея. Например, Davies and Riechmann [17] и другие (см. WO 92/01047) включили некоторые признаки VH участков антител камелида из одних тяжелых цепей в комбинации с фаговым дисплеем, для того чтобы улучшить растворимость, в то же время сохраняя связывающую специфичность.
Отдельные исследования выделенных человеческих VH участков, полученных из фаговых библиотек, показали антиген-специфическое связывание VH участков, но данные VH участки, как оказалось, обладают низкой растворимостью. Кроме того, предположили, что селекция человеческих VH участков со специфичными связывающими характеристиками, показанными на фаговых структурах, могли бы образовывать структурные единицы для генно-инженерных антител [18].
Человеческие VH участки можно разработать для улучшения характеристик растворимости [19, 20] или растворимости можно достигнуть естественной селекцией in vivo [21]. Однако, поскольку VH связывающие участки были получены из фаговых библиотек, то истинная аффинность для антигена остается в от низкого микромолярного до высокого наномолярного диапазона несмотря на заявление способов улучшения аффинности, включая, например, способ случайного отбора «горячей точки» аффинности [22].
VH участки человека или камелида, полученные технологией фагового дисплея или альтернативной технологией, не имеют преимущества улучшенных характеристик в результате соматических мутаций и дополнительного многообразия, полученного посредством рекомбинации сегментов D- и J-генов в области CDR3 связывающего сайта нормального антитела. Некоторые VH(VHH) участки, хотя и проявляющие преимущества в растворимости относительно человеческих VH участков, могут оказаться антигенными для человека и, кроме того, страдают таким недостатком, что VH участки камелидов должны вырабатываться посредством иммунизации камелидов или посредством технологии фагового дисплея.
Полученные из фагов человеческие VH области являются тяжелыми в применении, так как они требуют много циклов пэннинга и последующего мутагенеза, для того чтобы достигнуть связывающих характеристик высокой аффинности. VHH участки камелидов требуют такой же тяжелой процедуры при выделении из фага или из подобных генных библиотек, или требуют иммунизации больших животных (лам или верблюдов, которые также вырабатывают классические антитела), неподдающихся классической технологии гибридомы. Кроме того, связывающие участки камелидов могут оказаться антигенными и требуют гуманизации.
Получение антител из одних тяжелых цепей у трансгенных нечеловеческих млекопитающих (см. WO 02085945 и WO 02085944) в результате антигенной стимуляции преодолевает многие из данных проблем.
Однако остается необходимость на данном уровне техники максимизировать разнообразие антител из одних тяжелых цепей и B-клеточный ответ in vivo и, в частности, получить функциональный репертуар класс-специфических человеческих антител из одних тяжелых цепей и функциональных VH участков, связывающих только тяжелые цепи, которые сохраняют максимальную антигенсвязывающую способность для использования в многообразии клинических, промышленных и исследовательских применений.
ИЗОБРЕТЕНИЕ
Настоящие изобретатели, на удивление, преодолели ограничения предыдущего уровня техники и показали, что репертуар ответа антител можно значительно расширить посредством увеличения числа локусов одних тяжелых цепей, присутствующих у трансгенного нечеловеческого млекопитающего, которые обычно вырабатывают класс-специфические антитела из одних тяжелых цепей.
Изобретение основывается на таком открытии, что поскольку трансгенное нечеловеческое млекопитающее обладает множественными локусами одних тяжелых цепей, то данные локусы подвергаются аллельному исключению. Следовательно, случайно выбирается и успешно рекомбинируется только один локус, приводя к получению антитела из одних тяжелых цепей. Множественные VH локусы тяжелых цепей, следовательно, можно применять в таком же трансгенном нечеловеческом млекопитающем, для того чтобы максимизировать репертуар и многообразие антител, получаемых из млекопитающего. При антигенном стимулировании трансгенное нечеловеческое млекопитающее «выбирает» локус, содержащий сегмент V-гена, который является наиболее подходящим для ответа на специфическую антигенную стимуляцию с исключением остальных локусов.
Антитела из одних тяжелых цепей, которые можно получить способами изобретения, проявляют высокую связывающую аффинность в результате того, что трансгенное нечеловеческое млекопитающее способно «выбирать» из ряда локусов, из которых сегменты V, D и J-генов реаранжируются, и могут происходить соматические мутации, в основном в отсутствие расширенной CDR3 петли. По существу, нормальное созревание B-клетки наблюдается при высоких уровнях антител из одних тяжелых цепей, присутствующих в выделенной плазме (при условии, что участок CH1 был выделен из всех классов антител, присутствующих в рекомбинантном локусе). Созревание B-клетки и секреция связанных димеров (например, IgG) или мультимеров (например, IgM) не зависит от присутствия или экспрессии генов легких цепей.
Соответственно, в первом аспекте настоящего изобретения обеспечивается способ получения VH антител из одних тяжелых цепей у трансгенного нечеловеческого млекопитающего, включающий стадию получения более одного гетерологического VH локуса тяжелых цепей у данного млекопитающего, причем каждый VH локус тяжелых цепей содержит один или более сегментов V-гена, один или более сегментов D-гена, один или более сегментов J-гена и сегмент гена, кодирующего постоянную область тяжелых цепей, которая при экспрессии не включает участок CH1, и экспрессирующего VH антитела из одних тяжелых цепей, по крайней мере, из одного из вышеназванных локусов.
Предпочтительно каждый VH локус тяжелых цепей содержит один или множество сегментов V-гена, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 45, 50 или 60 сегментов V-гена, которые могут быть получены из любых видов позвоночных.
В одном варианте осуществления каждый локус может содержать только один сегмент V-гена. Одновременно альтернативно данному варианту осуществления каждый сегмент V-гена отличается от всех других сегментов V-гена. В качестве второй альтернативы каждый сегмент V-гена идентичен всем другим сегментам V-гена. В качестве данной второй альтернативы остальные сегменты гена в каждом локусе могут быть одинаковыми или отличаться от сегментов гена во всех других локусах.
Таким образом, предусматривается, что нечеловеческое млекопитающее может содержать множество копий единственного VH локуса тяжелых цепей. Данный факт имеет преимущество оптимизации возможностей, что в B-клетке будет происходить продуктивная реаранжировка, таким образом, позволяя получение полезных антител из одних тяжелых цепей.
Если нечеловеческое млекопитающее содержит ряд различных VH локусов тяжелых цепей, то этот факт будет, кроме того, оптимизировать возможности получения антител из одних тяжелых цепей с необходимой специфичностью.
В другом варианте осуществления каждый локус содержит множество сегментов V-гена. В данном варианте осуществления сегменты V-гена в любом одном локусе могут быть все получены из организма одинаковых видов, например, все сегменты V-гена могут быть человеческого происхождения. В качестве альтернативы сегменты V-гена в любом одном локусе могут быть все получены из организмов разных видов, например некоторые сегменты V-гена из человека, а другие из камелидов или из акул.
Предпочтительны сегменты V-гена человеческого происхождения.
Понятие «сегмент V-гена» охватывает любой естественный сегмент V-гена, полученный из позвоночного, включая камелидов и человека. Сегмент V-гена должен быть способен рекомбинировать с сегментом D-гена, сегментом J-гена и сегментом гена, кодирующим постоянную (эффекторную) область тяжелых цепей (которая может содержать несколько экзонов, но исключает CH1 экзон), для того чтобы вырабатывать VH антитела из одних тяжелых цепей при экспрессии нуклеиновой кислоты.
Сегмент V-гена также содержит в своем составе любую генную последовательность, кодирующую гомолог, производное или белковый фрагмент, который способен рекомбинировать с сегментом D-гена, сегментом J-гена и сегментом гена, кодирующим постоянную область тяжелых цепей (содержащую один или более экзонов, но не CH1 экзон), для того чтобы вырабатывать антитела из одних тяжелых цепей, как определено в контексте данного документа. Сегмент V-гена можно, например, получить из локуса T-клеточного рецептора или локуса легкой цепи иммуноглобулина.
Предпочтительно множественные локусы тяжелых цепей данного изобретения содержат любое количество или комбинацию 39 функциональных сегментов человеческого V-гена и их генно-инженерных модификаций с улучшенными свойствами растворимости, распределенных по множественным локусам. Это возможно для любого количества локусов, например четыре локуса, содержащие восемь сегментов V-гена, плюс один локус, содержащий семь сегментов V-гена; семь локусов, содержащие четыре сегмента V-гена, плюс один локус, содержащий три сегмента V-гена; или тридцать девять локусов, содержащие по одному сегменту V-гена каждый.
Человеческие V-гены классифицируют на семь семейств, от VH1 до VH7, и отдельные гены пронумерованы в пределах каждого семейства. Частота, с которой применяется каждый ген, зависит от изменяющихся условий частного иммунного ответа. Например, гены семейства VH3 могут предпочтительно применяться по сравнению с генами семейства VH5 при ответе на бактериальные антигены. Следовательно, в дополнительном предпочтительном варианте осуществления изобретения было показано, что группы сегментов V-гена, применимые для получения ответа антитела на специфические антигены, располагаются группами в отдельных линиях трансгенных нечеловеческих млекопитающих. Сегменты V-гена могут располагаться группами в соответствии с семейством, или они могут располагаться группами в соответствии с индивидуальной функцией. Например, показывают, что если V-гены семейства VH3 являются применимыми для получения иммунного ответа на бактериальные антигены, то они могут применяться для получения трансгенного нечеловеческого млекопитающего, которое, в частности, применимо для получения антител из одних тяжелых цепей на бактериальные антигены. В качестве альтернативы, если показывают, что несколько индивидуальных генов из семейств VH3 и VH5 применимы для получения иммунного ответа на бактериальные антигены, то они могут располагаться группами вместе и применяться для получения трансгенного нечеловеческого млекопитающего, которое, в частности, применимо для получения антител из одних тяжелых цепей на бактериальные антигены.
В контексте настоящего изобретения понятие «гетерологический» означает нуклеотидную последовательность или локус, описанный в контексте данного документа, который не является эндогенным по отношению к млекопитающему, в котором находится.
«VH локус тяжелых цепей» в контексте настоящего изобретения относится к минимальному микролокусу, кодирующему VH участок, содержащий один или более сегментов V-гена, один или более сегментов D-гена и один или более сегментов J-гена, операционно связанному с одним или более генными сегментами, кодирующими эффекторные области тяжелых цепей (каждая без CH1 участка). Предпочтительно первоисточником изменчивости репертуара антител является область CDR3, образованная селекцией сегментов V, D и J-генов и V-D и D-J области стыка.
Преимуществом настоящего изобретения является то, что репертуар и разнообразие антител, полученных в реаранжированных последовательностях VH гена, можно максимизировать посредством применения множественных VH локусов тяжелых цепей в одном и том же трансгенном нечеловеческом млекопитающем. Janssens et al., 2006 [15] показали, что трансгенный локус, описанный выше, ведет себя подобно локусу нормального иммуноглобулина в том, что касается реаранжировки и аллельных исключений. Этот факт раскрывает возможность иметь множественные локусы в одном и том же животном (на разных хромосомах), для того чтобы максимизировать ряд возможных VH рекомбинаций посредством применения аллельного исключения. Каждый из трансгенных локусов содержал бы, вероятно, от одной до более сорока VH областей. Процесс аллельного исключения, который случайно выбирает один из локусов для начала рекомбинации, за которым идет следующий локус, если первая рекомбинация была непродуктивной, и т.д., пока не будет осуществлена продуктивная рекомбинация из одного из локусов, обеспечивал, вероятно, что фактически все VH области, присутствующие в комбинированных локусах, были бы частью общего процесса рекомбинации.
Janssens et al., [15] также на удивление обнаружили, что если многочисленные локусы тяжелых цепей в одном и том же трансгенном нечеловеческом млекопитающем расположены вместе на одной и той же хромосоме, то продуктивная реаранжировка и экспрессия антитела могут происходить из множественных локусов тяжелых цепей. В таких случаях последовательные клоны гибридомы являются поликлональными. Специалист в данной области примет во внимание, что это еще один механизм увеличения разнообразия антител.
В соответствии с другим аспектом изобретения обеспечивается способ, описанный в контексте данного документа, в котором присутствуют, по крайней мере, два или более VH локусов тяжелых цепей в трансгенном нечеловеческом млекопитающем, расположенных вместе на одной и той же хромосоме, тогда продуктивная реаранжировка и экспрессия антитела могут происходить из двух или более локусов одновременно.
Предпочтительно ряд локусов тяжелых цепей сначала будет введен отдельно трансгенному нечеловеческому млекопитающему, получая трансгенное нечеловеческое млекопитающее с единственным локусом тяжелых цепей. Данные животные затем будут скрещены, для получения потомства с множественными локусами тяжелых цепей, для того чтобы максимизировать ряд VH областей, приводя к максимальному разнообразию. Локусы также можно добавить посредством нового цикла трансгенеза. Новые локусы, вероятно, были бы введены в яйцеклетки, полученные из нечеловеческих млекопитающих, уже содержащих один или более гетерологических VH локусов тяжелых цепей. Устойчивая интеграция новых гетерологических VH локусов тяжелых цепей, вероятно, приводила бы к увеличению доступности VH областей, а следовательно, разнообразия. Устойчивая трансфекция ES клеток, полученных из нечеловеческих трансгенных млекопитающих, содержащих гетерологический VH локус тяжелых цепей с дополнительными гетерологическими VH локусами тяжелых цепей, обеспечивает альтернативный способ увеличения разнообразия в нечеловеческих млекопитающих (например, мышах), причем технологию ES клеток можно применять для трансгенеза посредством эмбрионального слияния и зародышевой инъекции.
Предпочтительно каждый отдельный локус тяжелых цепей будет присутствовать в виде единственной копии в геноме трансгенного нечеловеческого млекопитающего.
Кроме того, применение множественных сегментов V, D и J-генов обеспечивает дополнительное увеличение полученного репертуара и разнообразия антител. Последующая соматическая мутация осуществляется во время применения минимального локуса (микролокуса) без необходимости в локусах VL и LC (легкая цепь) антител.
В контексте настоящего изобретения понятия «сегмент D-гена» и «сегмент J-гена» включают естественные последовательности сегментов D и J-генов. Предпочтительно сегменты D и J-генов получают из тех же самых позвоночных, из которых получают сегмент V-гена. Например, если сегмент V-гена получают из человека, то сегменты D и J-генов с необходимой растворимостью или генно-инженерные также предпочтительно получают из человека. В качестве альтернативы сегменты V-гена можно получить, например, из камелида, а сегменты D и J-генов из человека или наоборот.
Понятия «сегмент D-гена» и «сегмент J-гена» также включают в себя производные, гомологи и их фрагменты до тех пор, пока получающийся в результате сегмент может рекомбинировать с остальными компонентами локуса тяжелой цепи антитела, описанного в контексте данного документа, для того чтобы получить антитело из одних тяжелых цепей, описанное в контексте данного документа. Сегменты D и J-генов могут быть получены из естественных источников или их можно синтезировать, применяя способы, хорошо известные специалистам в данной области техники и описанные в контексте данного документа. Сегменты V, D и J-генов способны к рекомбинации и предпочтительно подвергаются соматической мутации.
Сегменты D и J-генов предпочтительно получают только из видов позвоночных. Это могут быть любые виды позвоночных, но предпочтительным является человек.
Предпочтительно каждый VH локус тяжелых цепей содержит от одного до сорока (2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 14, 16, 18, 20, 30 или 40) или более сегментов D-гена. Сегменты D-гена могут быть получены из любых видов позвоночных, но более предпочтительно, сегментами D-гена являются человеческие сегменты D-гена (обычно 25 функциональных сегментов D-гена).
Предпочтительно каждый VH локус тяжелых цепей содержит от одного до двадцати (2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18 или 20) или более сегментов J-гена. Сегменты J-гена могут быть получены из любых видов позвоночных, но более предпочтительно, сегментами J-гена являются человеческие сегменты J-гена (обычно 6 (шесть) сегментов J-гена).
Каждый VH локус тяжелых цепей может содержать одни и те же сегменты D и J-генов. В качестве альтернативы каждый VH локус тяжелых цепей может содержать различные комбинации сегментов D и J-генов. Например, если каждый VH локус тяжелых цепей содержит только один сегмент V-гена, и данный сегмент идентичен в каждом локусе, то это является благоприятным для применения различных комбинаций сегментов D и J-генов в каждом локусе для дополнительной оптимизации возможностей получения продуктивной реаранжировки. Однако, если каждый VH локус тяжелых цепей содержит один или более различных сегментов V-гена, то это может быть благоприятным для применения одних и тех же комбинаций сегментов D и J-генов в каждом локусе.
Предпочтительно VH локус тяжелых цепей содержит один или более сегментов V-гена, двадцать пять функциональных человеческих сегментов D-гена и шесть человеческих сегментов J-гена.
Каждый сегмент гена, кодирующий постоянную область тяжелой цепи, может содержать один или более экзонов постоянной области тяжелой цепи класса Cδ, Cγ1-4, Cµ, Cε или Cα1-2 при условии, что сегменты гена постоянной области тяжелой цепи не экспрессируют участок CH1. Сегменты гена постоянной области тяжелой цепи выбирают в зависимости от предпочтительного класса или необходимой смеси классов антител. Необязательно гетерологический локус тяжелой цепи является Cµ- и Cδ-дефицитным.
Таким образом, каждый VH локус тяжелых цепей может содержать сегмент гена, кодирующий, по крайней мере, одну постоянную область тяжелой цепи, обеспечивая эффекторные функции in vivo (например, IgG, IgM, IgA, IgE или IgD или их изотип), причем каждая постоянная область не включает участок CH1. Каждый локус может содержать только один сегмент гена, кодирующий одну конкретную постоянную область. Это будет благоприятным, если необходимы определенные эффекторные функции. В качестве альтернативы каждый локус может содержать более одного сегмента гена, причем каждый кодирует различные постоянные области. Это будет благоприятным, если нет необходимости в конкретных эффекторных функциях, так как это позволит получить многообразие классов антител из одних тяжелых цепей.
Каждый локус может содержать кодирующие постоянную область сегмент(ы) гена или каждый локус может иметь разные или разные комбинации кодирующего постоянную область сегмента(ов) гена.
Операционно постоянная область тяжелой цепи кодируется естественным или генно-инженерным сегментом гена, который способен рекомбинировать с сегментом V-гена, сегментом D-гена и сегментом J-гена в B-клетке.
В каждом антителе из одних тяжелых цепей постоянная область экспрессируется без участка CH1, так что может происходить получение антитела из одних тяжелых цепей. Экзоны CH1 можно удалить, так что постоянная область VH антитела из одних тяжелых цепей, описанная выше, не содержит функциональный участок CH1.
Включение класс-специфических постоянных областей тяжелых цепей при генной инженерии комплексов мультиспецифического связывания обеспечивает терапевтическую полезность эффекторной функции in vivo в зависимости от необходимой функциональности. Генная инженерия отдельных эффекторных областей может также привести к добавлению или удалению функциональности [23]. Таким образом, включение функциональности постоянной области IgA обеспечило бы вероятно улучшенное функционирование слизистой оболочки против патогенов [24], тогда как присутствие функциональности постоянной области IgG1 обеспечивает повышенную сывороточную устойчивость in vivo. Присутствие постоянных