Способ обнаружения наличия микроорганизмов в биологическом образце
Иллюстрации
Показать всеСпособ включает применение диагностической мультиплексной панели (DMP), созданной для одновременной идентификации совокупности возможных микроорганизмов, которые могут присутствовать в биологическом образце, с применением реакции удлинения праймеров в отношении высококонсервативных нуклеотидных последовательностей в тестируемых микроорганизмах. Биологический образец иммобилизуют на или в твердом субстрате в первом местоположении, затем переносят в другое местоположение и осуществляют стадию экстракции на твердом субстрате таким образом, чтобы экстрагировалась ДНК любого микроорганизма, присутствующего в пробе. Затем проводят амплификацию нуклеиновой кислоты на экстрагированных ДНК микроорганизмов, затем смешивают целевые последовательности с праймерами с применением DMP. В результате определяют генотип любых присутствующих микроорганизмов и идентифицируют искомые микроорганизмы. Для осуществления способа используют диагностическую мультиплексную панель (DMP), пригодную для генотипирования патогенных микроорганизмов и набор для тестирования микроорганизмов. Использование изобретения позволяет надежный отбор биологических образцов и их тестирование, обеспечивая при этом одновременное тестирование множества микроорганизмов. 3 н. и 19 з.п. ф-лы, 2 ил., 3 табл.
Реферат
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к высокопроизводительному мультиплексному тестированию на микроорганизмы, которые могут присутствовать в биологическом образце, с применением ферментных методов на основе нуклеиновых кислот. Более конкретно, изобретение относится к идентификации патогенных микроорганизмов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
С того момента, как в девятнадцатом веке микроорганизмы были идентифицированы как основная причина заболеваемости и смертности, продолжались попытки наблюдения и контроля за распространением инфекционного заболевания. Самые ранние попытки были предприняты пионерами молодой науки эпидемиологии, такими как Д-р John Snow (Джон Сноу). В двадцатом веке появление антибиотиков, массовая вакцинация и антивирусные лекарства обеспечили беспрецедентный уровень контроля над распространением таких заболеваний, по крайней мере, в развитых странах. Тем не менее, во всем мире инфекционные заболевания все еще остаются одной из основных причин смерти, причем кажется, что ежегодно неумолимо появляется непрерывный ряд "новых" микробов-убийц. MRSA (золотистый стафилококк, резистентный к метициллину), SARS (тяжелый острый респираторный синдром (ТОРС), атипичная пневмония), птичий грипп, ВИЧ и малярия являются только малой частью многих инфекционных патогенов, вызывающих страх и беспокойство во всем мире.
Международные организации, отвечающие за охрану здоровья, такие как ООН и ВОЗ, постоянно выражают тревогу в связи с неограниченным применением антибиотиков, ведущим к повышению уровней устойчивости многих видов бактерий к антибиотикам. Помимо этого в настоящее время в мире инфекции, передающиеся половым путем (ИППП, STIs), представляют собой одну из важнейших проблем, связанных с инфекционными заболеваниями, а в некоторых регионах, в частности, в Африке и в бывшем Советском Союзе, находятся на уровне эпидемии. Согласно одному исследованию (Adler, М., 2005, Why sexually transmitted infections are important. In: ABC of Sexually Transmitted Infections. 5th ed. BMJ Books) подтвержденное число инфицированных в Западной Европе составляет 17 миллионов, в США 15 миллионов, в Африке 70 миллионов, а всего в мире 400 миллионов человек.
Борьба с инфекциями, передающимися половым путем, и ВИЧ/СПИД остается главной в правительственных программах по охране здоровья в мире, и необходимость в большей доступности служб системы здравоохранения и в создании и обеспечении диагностических служб, доступных для всех нуждающихся в них, очевидны. Многие STI являются бессимптомными и могут диагностироваться только с помощью тестов, однако, стандартные программы скрининга чрезвычайно редки, общественные предрассудки широко распространены, финансирование неадекватно, а понимание населения ограниченно.
Воздействие инфекционных заболеваний не ограничивается человеческой популяцией, большие экономические потери приносят вспышки болезней домашнего скота и культурных растений. Эпидемии чумы у свиней, вируса ящура у крупного рогатого скота и вируса гриппа птиц быстро распространяются и наносят большой урон сельскохозяйственной продукции и экономике страны. В Великобритании в 2001 году эпидемия ящура привела к потере более семи миллионов голов крупного рогатого скота и овец, а также к фактическому "закрытию" сельскохозяйственных площадей.
Современные системы скрининга на присутствие микроорганизмов в образце, полученном от хозяина (такого как пациент, животное или источник растительного происхождения), характеризуются низкой производительностью. В клинических условиях обычно в одном образце проверяется только один микроорганизм, если нет медицинских показаний, что хозяин может страдать несколькими заболеваниями, вызванными микроорганизмами. Это означает, что обычно в одном тесте возможно детектировать только единственную инфекцию, что очень сильно влияет на стоимость и время тестирования. Кроме того, у хозяина с бессимптомным характером заболевания часто трудно решить, на какой микроорганизм следует проводить тест у пациента. Отрицательные результаты по двум или трем возбудителям инфекции могут создать ложное ощущение безопасности.
В новейших системах детекции (обнаружения), применяемых в клинической практике, для обнаружения инфицирования микроорганизмами используют анализы на основе ДНК. Наиболее обычные методы основаны на полимеразной цепной реакции (ПЦР, PCR), лигазной цепной реакции, амплификации с вытеснением цепи, транскрипционной амплификации, самоподдерживающей репликации последовательностей (NASBA) и некоторых других. Эти методы также низкопроизводительны, занимают много времени, требуют много ручного труда и трудны для автоматизации. Кроме того, по-прежнему отсутствует надежный метод, который можно было бы использовать для детекции нескольких патогенов в единственном тесте на одном образце, взятом от организма-хозяина.
Следовательно, было бы желательно создать надежный и дешевый способ тестирования множества микроорганизмов, которые могут присутствовать в биологическом образце. В частности, было бы желательно создать способ осуществления тестирования, который дал бы возможность надежного отбора биологических образцов (проб) на дому или в поле.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В целом настоящее изобретение решает вышеприведенные проблемы предыдущего уровня техники, предоставляя способы и приборы для высокопроизводительного тестирования биологических образцов, которые могут содержать, или не содержать, микроорганизмы. Способы включают применение диагностической мультиплексной панели (ДМП, DMP), специально созданной для одновременного определения множества вероятных видов микроорганизмов, которые могут присутствовать, или отсутствовать, в биологическом образце.
В первом аспекте изобретение включает способ определения, действительно ли один или более заданных (точно определенных) микроорганизмов находится в биологическом образце, который, возможно, содержит микроорганизмы, включающий:
(а) иммобилизацию биологического образца на и/или в твердом субстрате (твердой подложке) в одном месте;
(б) перенос иммобилизованного биологического образца, по меньшей мере, в другое место и осуществление стадии экстракции на твердом субстрате таким образом, чтобы экстрагировалась ДНК любого микроорганизма, иммобилизованная на и/или в твердом субстрате;
(в) осуществление стадии амплификации нуклеиновой кислоты на ДНК микроорганизмов, экстрагированных на стадии (б), причем стадия амплификации относится к амплификации, по меньшей мере, одной высококонсервативной последовательности одного или более определенных (конкретных, заданных) микроорганизмов, а амплифицированные последовательности именуются целевыми последовательностями;
(г) смешение (объединение) целевых последовательностей с последовательностями ряда праймеров, содержащихся на диагностической мультиплексной панели (DMP), причем последовательность каждого праймера способствует генотипированию целевой последовательности;
(д) проведение реакции удлинения праймеров с применением объединения (смеси) целевых последовательностей и DMP, присутствующей на стадии (г), тем самым получение продукта реакции с DMP; и
(е) анализ продукта реакции с тем, чтобы определить генотип любых присутствующих целевых последовательностей, и корреляция генотипа целевых последовательностей, имеющихся в продукте реакции, с идентификацией конкретных микроорганизмов в биологическом образце.
Во втором аспекте изобретение включает DMP, пригодную для применения в генотипировании патогенных микроорганизмов, известных как вызывающие, по меньшей мере, одно инфекционное заболевание, которые могут присутствовать в биологическом образце, причем DMP содержит ряд праймерных последовательностей, направленных на идентификацию, по меньшей мере, двух или более SNP (однонуклеотидных полиморфизмов) в высококонсервативном аллеле, по меньшей мере, одного микроорганизма, известного как вызывающий инфекционное заболевание, при использовании в реакции удлинения праймеров.
В третьем аспекте изобретение включает набор для тестирования микроорганизмов, пригодный для персонального пользования пользователем, расположенным в первом месте, причем набор содержит поверхность тестирования, находящуюся в герметизируемой камере, поверхность тестирования дополнительно содержит твердую подложку (субстрат), способную иммобилизовать биологический образец либо в, либо на своей поверхности, и когда биологический образец осаждается на поверхности тестирования, герметизируется пространство (камера) вокруг поверхности тестирования таким образом, что набор для тестирования можно отправить во второе место для анализа, позволяющего определить, действительно ли в биологическом образце присутствует один или более микроорганизмов.
В четвертом аспекте изобретение включает способ лечения животного, в том числе человека, предположительно, являющегося носителем одного или более инфекционных микроорганизмов, заключающийся в получении биологического образца животного, тестировании биологического образца в соответствии с методами по данному описанию, диагностировании в результате этого, действительно ли животное инфицировано одним или более инфекционных микроорганизмов, и проведении лечения животного, причем это лечение проводится (организуется) с учетом сведений относительно типа (типов) инфекционных микроорганизмов, найденных в биологическом образце. Необязательно лечение дополнительно организуется с учетом сведений, касающихся статуса резистентности одного или более инфекционных микроорганизмов к антибиотикам, обнаруженных в биологическом образце. Эти и другие применения, признаки и преимущества изобретения должны быть очевидны специалистам в данной области техники из раскрытия в данном описании.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
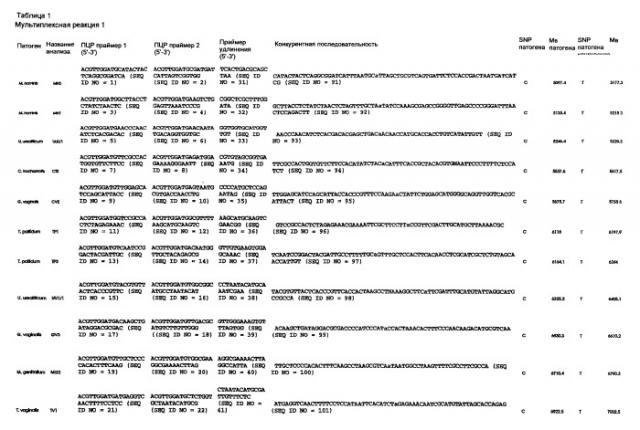
На Фигуре 1 схематически представлены высококонсервативные консенсусные последовательности, ДНК-консенсусные последовательности получают путем сравнения нескольких штаммов одного вида - показаны местоположения, в которых праймеры для реакций амплификации или удлинения праймеров выбираются для применения в DMP по изобретению. Для каждого праймера первые две буквы определяют организм, следующая буква определяет целевую последовательность для вида (1-3); 1stPCRP обозначает первый ПЦР праймер; 2ndPCRP обозначает второй ПЦР праймер; Е1 или Е2 обозначает праймер для удлинения; в случае уреаплазмы имеется два сайта, для которых предназначены праймеры (UU1 и UU2). Идентичность праймеров представлена в Таблице 1. Включены следующие (микро)организмы: (а) Кандида альбиканс (Candida albicans); (б) Хламидия трахоматис (Chlamydia trachomatis); (в) Гарднерелла вагиналис (Gardnerella vaginalis); (г) Микоплазма гениталиум (Mycoplasma genitalium); (д) Микоплазма хоминис (Mycoplasma hominis); (е) Нейссерия гонорея (Neisseria gonorrhoea); (ж) Бледная трепонема (Treponema pallidum); (з) Трихомонас вагиналис (Trichomonas vaginalis); (и) Уреаплазма уреалитикум (Ureaplasma urealyticum).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При изложении изобретения дается ряд определений, которые помогут понять данное изобретение. Во избежание сомнений все цитируемые в данном описании ссылочные материалы вводятся ссылкой во всей полноте. Если не указано иначе, все технические и научные термины, применяемые в данном описании, имеют то же значение, которое известно рядовому специалисту в области техники, к которой относится данное изобретение. При описании обычных методов молекулярной биологии предполагается, что специалист в данной области техники знает эти методы, например, из стандартных учебников, таких как Sambrook J. et al., (2001) Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY.
Предполагается, что термин "определенные (конкретные, заданные) микроорганизмы" по данному описанию обозначает один или более определенных видов микроорганизма, которые могут, или не могут присутствовать в биологическом образце. Определенные микроорганизмы представляют собой микроорганизмы соответствующего вирусного, бактериального, грибкового (включая одноклеточные дрожжи) и/или протозойного (простейшие, включая плазмодий) происхождения. Обычно определенные микроорганизмы являются патогенными в отношении хозяина-животного в некоторые периоды своего жизненного цикла. Однако, настоящее изобретение подходит для тестирования видов микроорганизмов, которые находятся в состоянии глубокого покоя, вызывают симбионтную инфекцию или субклиническую инфекцию.
Предполагается, что термин "биологический образец" по данному описанию охватывает образцы, которые содержат один или более определенных микроорганизмов, тестируемых в соответствии с данным изобретением. В зависимости от назначения DMP биологический образец можно получать от человека, отличного от человека животного, из растения или из пищевого продукта. В последнем случае предполагается, что DMP предназначен для определения загрязнения пищевого продукта патогенами, передающими заболевание алиментарным путем. Образцы могут включать, например, мочу; фекалии; вагинальные, назальные или оральные мазки; кровь, слюну; и/или мокроту; сперму; вагинальные выделения или выделения из уретры и их мазки; слезы (например, выделения слезных желез); биоптаты тканей; и смывы (мазки) с поверхностей, на которых могут отлагаться вышеуказанные выделения и вещества. Хотя биологический образец по настоящему изобретению может содержать клетки, ткань и/или ДНК организма-хозяина, например, человека, содержанием изобретения является тестирование на присутствие микроорганизмов в этом хозяине - не тестирование собственной ДНК хозяина.
Твердую подложку (твердый субстрат) по изобретению выбирают соответствующим образом из поглощающего (гигроскопического) волокнистого материала, пропитанного одним или двумя реагентами, которые способствуют иммобилизации и инактивации любых микроорганизмов в биологическом образце, или, даже еще проще, вызывают иммобилизацию нуклеиновой кислоты, содержащейся в микроорганизмах. Такие реагенты могут включать детергенты: анионные или катионные детергенты, хелатирующие агенты (например, EDTA), мочевину и/или мочевую кислоту. Сам твердый субстрат может включать поглотитель, материал, выбранный из целлюлозной бумаги (например, бумага для блоттинга); мембраны из микроволокна; стекловолокна; материала из полимерного волокна (например, найлоновый мембранный фильтр); тканый материал и нетканый материал. Подходящие твердые субстраты (подложки, носители) описаны, например, в патентах США № 549562, 5756126, 5807537, 5939259, 5972386, 5985327, 6168922, 6746841 и 6750059. В конкретных вариантах настоящего изобретения твердый субстрат (подложка, носитель) включает фильтровальную бумагу, обработанную реагентом Whatman FTA® или Whatman FTA Elute®, такую как бумага Whatman FTA® или Whatman FTA Elute®.
Заметным преимуществом способа по настоящему изобретению является то, что твердый субстрат, обработанный реагентом, таким как реагент Whatman FTA Elute®, человек может применять не в клинических условиях. Например, рассматривается, что начальную фазу отбора проб (образцов) способа по изобретению можно осуществлять, индивидуально приобретая набор и просто увлажняя твердый продажный субстрат, скажем, пробой (образцом) мочи или слюны. Твердый субстрат иммобилизует любые микроорганизмы в моче или слюне, так что инфекционные патогены становятся неинфекционными и образец (пробу) можно переносить в место тестирования (при этом не требуются дорогие манипуляции, а именно, охлаждение или дополнительная фиксация химическими реагентами), например, обычной почтой. ДНК иммобилизованного микроорганизма можно легко извлечь из твердого субстрата в месте тестирования, например, простым нагреванием и элюцией водой. Таким образом, данное изобретение включает систему, в которой отбор биологических проб (образцов) можно осуществлять даже дома или в поле, пробы можно хранить неограниченно долго, а тест проводить позднее. Преимущества такого порядка значительны, так как до настоящего времени большинство диагностических тестов трудно проводить в связи с необходимостью отбирать пробы в клинических условиях, что снижает доступность для популяции в целом.
В соответствии с вариантом настоящего изобретения подходящий набор для тестирования на дому содержит герметизируемую камеру (футляр), которая включает в себя поверхность для тестирования. Набор включает инструкции по применению, которые указывают пользователю, где на поверхности тестирования поместить биологический образец (пробу), такой как капля мочи. Поверхность тестирования содержит твердый субстрат (подложку, носитель) описанного выше типа. После того как образец размещается на поверхности тестирования, герметизируемую камеру (футляр) можно закрыть таким образом, чтобы она инкапсулировала и защищала поверхность тестирования от дальнейшего воздействия. В герметично закрытом состоянии набор остается защищенным от внешнего воздействия или загрязнения, и его можно отправить в испытательный центр, расположенный в удалении от места жительства пользователя. В испытательном центре герметизируемую камеру можно открыть (при необходимости, вскрывая камеру), давая доступ к поверхности тестирования для аналитических целей в соответствии со способом по изобретению.
"Нуклеотидная последовательность" ("последовательность нуклеиновой кислоты") представляет собой одно- или двухцепочечную связанную ковалентными связями последовательность нуклеотидов, где 3' и 5' концы каждого нуклеотида связаны фосфодиэфирными связями. Нуклеотидные последовательности обычно представляют собой полинуклеотиды, которые могут состоять из дезоксирибонуклеотидных звеньев или рибонуклеотидных звеньев. Полинуклеотиды включают ДНК и РНК и могут получаться синтетическими методами in vitro или выделяться из природных источников. Размеры нуклеотидных последовательностей обычно выражаются в виде числа пар оснований (п.о., b.р.) для двухцепочечных полинуклеотидов, или, в случае одноцепочечных полинуклеотидов, в виде числа нуклеотидов (nt). Одна тысяча п.о. (b.р.) или nt равняется килобазе (т.п.о., т.н.). Полинуклеотиды, имеющие протяженность менее чем, примерно, 40 нуклеотидов, обычно называют "олигонуклеотидами". Последовательности праймеров (праймерные последовательности), используемые в настоящем изобретении для стадий амплификации нуклеиновых кислот и удлинения праймеров, представляют собой одноцепочечные олигонуклеотиды.
Выражение "реакция амплификации нуклеотидов (нуклеиновых кислот)" по данному описанию обозначает любой из ряда родственных ферментных методов, в котором используется термостабильная ДНК-полимераза для амплификации определенной последовательности ДНК в ходе периодических (серийных) циклов удлинения праймеров, денатурации и гибридизации. Обычно ПЦР является предпочтительной реакцией амплификации нуклеотидов, применяемой в способе по настоящему изобретению.
Предполагается, что термин "реакция удлинения праймеров" обозначает реакцию, в которой нуклеотидные праймеры создаются таким образом, чтобы гибридизоваться с целевой последовательностью и биокаталитически (с помощью ферментов) удлиняться при добавлении одного или более нуклеотидов к 3'-концу праймера. Праймеры гибридизуются по положению на данной целевой последовательности, которое находится непосредственно 5' к или в нескольких основаниях "выше" (5') от положения полиморфизма, такого как однонуклеотидный полиморфизм. В вариантах изобретения, в которых праймер гибридизуется по основанию "выше" (апстрим, 5') известного SNP сайта, удлинение праймера на одно основание влияет на гибриды праймер- целевая последовательность, добавляя одноцепочечный-терминирующий нуклеотид, часто дидезоксинуклеотид. Только один из четырех нуклеотидов, которые удлиняют праймер, является тем одним нуклеотидом, который комплементарен последовательности на целевой нити (цепи, тяже). Идентичность добавленного нуклеотида определяют в фазе анализа способа по изобретению, более подробно описанной ниже.
Термин "полиморфный аллель" применяется в данном описании для обозначения одной или более альтернативных форм генетической последовательности, занимающих один и тот же хромосомный локус и контролирующих (регулирующих) один и тот же наследственный признак. Аллельный вариант в природе возникает в результате мутации и может привести в результате к фенотипическому полиморфизму внутри популяции или может привести к консервативному (не- фенотипическому) полиморфизму. Мутации в генах обычно приводят к измененной нуклеотидной последовательности. Явление аллельного полиморфизма по данному описанию используется по отношению к однонуклеотидным полиморфизмам (SNP), инсерциям, делениям, инверсиям и заменам, все они могут встречаться в генах, которые являются высококонсервативными в данном виде. SNP представляют собой полиморфизмы, в которых аллели отличаются заменой (replacement/substitution) единственного нуклеотида в последовательности ДНК в данном положении в геноме. В высококонсервативных генах, таких как 16S рРНК в бактериях, SNP являются высокоспецифическими в отношении вида и штамма, что способствует получению точной информации о генотипировании. Другие высококонсервативные области микроорганизмов включают бактериальный ген 32S рРНК, дрожжевые гены 16S и 18S рРНК и гены вирусной полимеразы. Тем не менее в компетенции специалиста применить методы биоинформатики для идентификации SNP в других альтернативных консервативных областях генома данного микроорганизма. Полиморфизмы, такие как полиморфизмы, описанные выше, могут быть связаны со специфическими фенотипическими признаками в испытуемом организме. Например, резистентность к антибиотикам обусловлена мутацией и, таким образом, полиморфизмом. Однако способ по настоящему изобретению не ограничивается идентификацией только полиморфных положений в геномах исследуемых микроорганизмов. Если для данной консервативной целевой последовательности используются конкурентные контрольные последовательности, термин "полиморфный аллель" используют приблизительно для обозначения варианта на данном участке последовательности между последовательностью дикого типа (которая проверяется) и искусственной конкурентной последовательностью. В данном случае понятно, что так называемый полиморфизм просто способствует дифференциации продуктов реакции удлинения праймера на конкурентной матрице по сравнению с матрицей дикого типа, поскольку соответствующие продукты реакции имеют различные относительные молекулярные массы.
Настоящее изобретение частично основано на способе надежного и высокопроизводительного тестирования одного или более биологических образцов на присутствие микроорганизмов в этом образце. Высокопроизводительному анализу способствует применение диагностической мультиплексной панели (DMP), которая предназначена для генотипирования множества микроорганизмов, теоретически присутствующих в биологическом образце. DMP включает комбинацию праймеров, каждый из которых претерпевает специфически гибридизацию высококонсервативной последовательности в ДНК, выделенной из микроорганизмов, которые могут присутствовать в биологическом образце. DMP делает возможными одновременные реакции удлинения праймеров с целью определения, действительно ли один или несколько микроорганизмов присутствуют в изолированном образце. DMP по настоящему изобретению может быть соответствующим образом предназначена для конкретной области терапии или диагностики, когда проверяется в широком смысле соответствие микроорганизмов области или типу заболевания. В примере применяемого изобретения, более подробно описанном ниже, собирают DMP, предназначенную для диагностики присутствия инфекции, передающейся половым путем, в биологических образцах, взятых у людей. Эта форма DMP подходит для проверки присутствия бактериальных патогенов, таких видов, как микоплазма (Mycoplasma spp.); хламидия (Chlamydia spp.); уреаплазма (Ureaplasma spp); нейссерия (Neisseria spp.); гарднерелла (Gardnerella spp.); трихомонас (Trichomonas spp.); трепонема (Treponema spp); или дрожжей кандида альбиканс (Candida albicans); или вирусных патогенов, таких как: цитомегаловирус (ЦМВ, CMV); вирусы гепатита (например, HAV, HBV и HCV и т.д.); вирус иммунодефицита человека (ВИЧ, HIV); вирусы папилломы человека (ВПЧ, HPV); вирус простого герпеса (ВПГ, HSV); вирус контагиозного моллюска (Molluscum contagiosum, MCV); вирус гриппа; вирус Эпштейна-Барр (ВЭБ, EBV) и вирус варицелла-зостер (ВВЗ, VZV). Другие заболевания, для диагностики которых хорошо подходит DMP, включают: пищевое отравление; туберкулез, вирусный рак; энцефалит; малярию; гепатит; менингит; лейшманиоз; сонную болезнь; пневмонию; чуму; атипичную пневмонию SARS; устойчивый к метициллину золотистый стафилококк (MRSA); бешенство; сибирскую язву; лихорадку долины Рифт; туляремию; шигеллез; ботулизм; желтую лихорадку; Q лихорадку; лихорадку Эбола; лихорадку денге; лихорадку Западного Нила (ЛЗН); дизентерию; грипп; корь и тиф.
Помимо этого изобретение делает возможным обнаружение последовательностей, которые придают бактериальным патогенам чувствительность к антибиотикам, за счет включения таких последовательностей в дизайн DNP-тестирования. Это позволяет ускорить начало лечения больных, у которых обнаружены такие патогены, так как опускается дополнительная отдельная стадия микробиологического определения чувствительности к антибиотикам. Кроме того, изобретение может предоставить данные о прогрессировании некоторых заболеваний путем определения концентрации детектированных патогенов, которая во многих случаях отражает прогрессирование заболевания. Концентрация может включать, например, оценку вирусной нагрузки. Количественные данные можно получить в реакционной фазе удлинения праймеров, например, включая конкурентную последовательность в данную целевую последовательность, причем эта конкурентная последовательность содержит введенный полиморфизм в определенном положении по сравнению с целевой последовательностью. Конкурентная последовательность может включать альтернативный нуклеотид в положении известного SNP, но во всем другом является идентичной. Если конкурентную последовательность в известной концентрации (или известное число копий) добавляют на стадии амплификации нуклеотида, тогда она может служить в качестве исходного данного для количественного определения концентрации, содержащей полиморфизм целевой последовательности из представляющего интерес микроорганизма. В конкретном варианте изобретения можно включать дополнительные конкурентные последовательности в различных концентрациях (например, в низкой, средней или высокой концентрации), все они с введенным вариантом последовательности, направленным на специфический сайт в целевой последовательности, что способствует более точному количественному определению концентрации микроорганизмов в исходном биологическом образце. Помимо количественного определения, включение конкурентных последовательностей предоставляет также внутренний контроль для всех ферментных стадий диагностического способа по изобретению.
DMP по изобретению предоставляются в виде совокупности соответствующего сплетения (plexed) праймеров. Однако DMP может также содержать праймеры, которые иммобилизованы на твердой поверхности, например, в виде микрочипа. Твердая поверхность может быть в виде силиконовой подложки или в виде стеклянной подложки.
Разделение (разрешение) продуктов реакции на DMP после удлинения праймеров можно осуществить различными методами, включая масс-спектрометрию (например, MALDI-TOF), электрофорез (например, капиллярный электрофорез), ДНК микрочипы (например, GeneChip™ от фирмы Аффиметрикс или ДНК-чипы на печатной матрице), включение нуклеотидов, меченных флуоресцентной меткой (например, SNPstream® от Beckman Coulter или Applied Biosystems SNPlex®), или другие метки (например, антигенная метка, биотинная или радиометка). Предпочтительный способ разделения продуктов реакции удлинения праймеров включает определение по относительной молекулярной массе, для этой цели предпочтительны как масс-спектрометрия, так и капиллярный электрофорез.
В одном конкретном варианте настоящего изобретения изменяется общая длина нуклеотидной последовательности каждого праймера, имеющегося в DMP, таким образом, что нет двух праймеров с одинаковой относительной молекулярной массой ни до, ни после реакции удлинения праймеров. Продукты реакции очищают для оптимизации масс-спектрометрического анализа. После очистки продукты в виде пятен наносят на соответствующий элемент, предпочтительно, силиконовый чип, включающий высокой плотности светоустойчивый набор сайтов для масс-спектрометрического анализа (например SpectroCHIP®) и анализируют на время-пролетном масс-спектрометре с лазерной десорбцией/ионизацией пробы (MALDI-TOF) (например, на масс-спектрометре Mass Array® компании Sequenom, как описано в патентах США № 6500621, 6300076, 6258538, 5869242, 6238871, 6440705 и 6994969). Результаты масс-спектрометрического анализа обрабатывают с помощью соответствующего пакета программ, чтобы получить данные о присутствии или отсутствии продуктов удлинения праймеров, которые коррелируют с присутствием или отсутствием точно определенных микроорганизмов в биологическом образце.
Далее изобретение иллюстрируется с помощью следующего неограничивающего примера.
ПРИМЕР
Авторы настоящего изобретения создали экономичный, надежный и высокоточный тест, который дает возможность определять любое число инфекций в отдельном образце. Тест состоит из двух частей: простого набора для отбора проб на дому (использующего бумагу Whatman FTA Elute® в качестве субстрата (подложки), на который нанесен образец) и новой мультиплексной панели инфекций, передающихся половым путем (STIMP), в качестве Диагностической мультиплексной панели (DMP), которая позволяет определить методами на основе ДНК, действительно ли какой-либо данный индивидуум инфицирован одним или несколькими передающимися половым путем бактериальными, вирусными, протозойными (простейшими) и/или грибковыми патогенами.
Настоящий пример показывает, что:
- бумага Whatman FTA Elute® является адекватным носителем бактериальных, грибковых и протозойных (простейших) патогенов из образца человеческой мочи.
- соединения, присутствующие в бумаге Whatman FTA Elute® или в моче, не препятствуют последующим процессам ферментного тестирования.
- новая STIMP функционирует в качестве DMP и способна детектировать отдельные патогены из смеси патогенов.
МАТЕРИАЛЫ И МЕТОДЫ
- КЛИНИЧЕСКИЕ ОБРАЗЦЫ (ПРОБЫ)
Всего 44 образца взяты у пациентов частной клиники GUM (мочеполовых заболеваний) на Украине.
Пациентов в экспериментальной группе просили предоставить образец (пробу) первой порции мочи (около 30-50 мл) в стерильном сосуде после консультации. Все образцы (пробы) получены с согласия информированных пациентов, и все этические требования и технические нормы (включая метод отбора проб) соблюдались и соответствовали требованиям Министерства здравоохранения Украины.
Каждую пробу мочи переносят на карту (плату) для образцов Whatman FTA Elute® (Whatman plc, Brentford, UK), однократно погружая стерильный губчатый аппликатор (Puritan®, Maine, USA) в сосуд с пробой мочи, а затем четыре раза наносят пятна в четырех разных местах карты (платы).
После переноса проб каждую отдельную карту Whatman FTA Elute® высушивают при комнатной температуре до полного высыхания. Для предупреждения кросс-загрязнения сухие карты с образцами по отдельности помещают в самозапечатывающиеся полиэтиленовые пакеты и затем хранят при комнатной температуре.
Затем пробы (образцы) из партий 1 и 2 (31 и 13 отдельных образцов, соответственно) отправляют в виде двух посылок (курьерской службой Federal Express®) в место тестирования (анализа, проведения теста) в лабораторию в Германии. Отбор проб в партии 1 проводят в период с 12 декабря по 26 декабря 2006 года включительно. Отбор проб в партии 2 проводят в период с 5 января по 12 января 2007 года включительно.
Все образцы (пробы) параллельно анализируют в независимой местной лаборатории (Киев, Украина) специалисты в области анализа инфекций, передающихся половым путем, с применением обычных методов обнаружения на основе ДНК, рекомендуемых Министерством здравоохранения Украины.
Все образцы проверяют на присутствие следующих микроорганизмов:
Candida albicans (кандида альбиканс)
Chlamydia trachomatis (хламидия трахоматис)
Gardnerella vaginalis (гарднерелла вагиналис)
Mycoplasma genitalium (микоплазма гениталиум)
Mycoplasma hominis (микоплазма хоминис)
Neisseria gonorrhoeae (нейссерия гонореи)
Trichomonas vaginalis (Трихомонас вагиналис)
Treponema pallidum (Бледная трепонема)
Ureaplasma urealyticum (Уреаплазма уреалитикум)
Результаты, полученные в местной аналитической лаборатории (обозначенные как 'клинические', 'clinic') сравнивают затем с результатами, полученными методом STIMP/DMP (обозначены как 'лаб', 'lab').
- МЕТОДЫ ЭКСПЕРИМЕНТА
ЭКСТРАКЦИЯ ДНК
Чтобы учесть разницу концентраций ДНК, из каждой карты для образцов Whatman FTA Elute® ручным пробойником вырезают шесть дисков по 6 мм с образцами в следующей последовательности - 1 х круг для пробирки на 2 мл, 2 X круга для пробирки на 2 мл, 3 х круга для пробирки на 2 мл. После вырезания из каждой карты для образцов пробойник чистят, трижды продавливая через чистую фильтровальную бумагу, а затем еще три раза продавливая через фильтровальную бумагу, смоченную 70% ЕtOН. Чтобы предупредить кросс-загрязнение, затем один раз продавливают чистую карту FTA Elute® и экстрагируют ДНК, как указано ниже (пробирка номер 4).
ДНК экстрагируют в соответствии с протоколом экстракции ДНК с карты Whatman FTA Elute® в нашей модификации, учитывая, что продавлен диск с образцом размером 6 мм, а рекомендуемый размер диска с образцом 3 мм. Один, два и три диска с образцом по 6 мм, или вырезанные фрагменты бумаги (Excised Paper Fragments, EPF) помещают в отдельные круглодонные пробирки Эппендорфа на 2 мл и в них добавляют, соответственно, 0.7 мл, 1.4 мл и 2.1 мл Н2О.
Каждый образец трижды перемешивают на вортексе по 5 секунд и диски с образцом переносят в отдельные чистые пробирки Эппендорфа на 0.5 мл.
В каждую пробирку, содержащую один, два и три диска с образцом, добавляют, соответственно, 50 мкл, 80 мкл и 100 мкл ddH2О, после чего пробирки инкубируют при 95°С в течение 30 минут. После инкубации образцы центрифугируют при 12000 g в течение 2 минут и хранят при +4°С. Для ПЦР амплификации 1 мкл каждого образца используют непосредственно или в виде разведения 1:1 с ddH2О.
ПОЛОЖИТЕЛЬНЫЕ КОНТРОЛИ
В качестве положительных контролей используют нижеприведенные линии клеток, полученные из Национальной коллекции типовых культур (NCTC).
Линия клеток № Вид
| NC12700 | N. gonorrhoeae |
| NC11148 | N. gonorrhoeae |
| NC08448 | N. gonorrhoeae |
| NC10177 | U. urealyticum |
| NC10111 | M. hominis |
| NC10915 | G. vaginalis |
| NCPF3179 | C. albicans |
| NC10195 | M. genitalium |
Клетки разводят с 500 мкл свежей мочи, а затем отбирают по 50 мкл каждого образца для приготовления положительного контроля следующим образом.
Положительный контроль № 1
| NC12700 | N. gonorrhoeae |
| NC10177 | U. urealyticum |
| NC10111 | M. hominis |
| NC10915 | G. vaginalis |
| NCPF3179 | C. albicans |
| NC10195 | M. genitalium |
Положительный контроль № 2
| NC11148 | N. gonorrhoeae |
| NC10177 | U. urealyticum |
| NC10111 | M. hominis |
| NC10915 | G. vaginalis |
| NCPF3179 | C. albicans |
| NC10195 | M. genitalium |
Положительный контроль № 3
| NC08448 | N. gonorrhoeae |
| NC10177 | U. urealyticum |
| NC10111 | M. hominis |
| NC10915 | G. vaginalis |
| NCPF3179 | C. albicans |
| NC10195 | M. genitalium |
Положительные контроли и образец свежей мочи, используемой для разведения клеток, наносят пипеткой на отдельные карты (платы) Whatman FTA Elute® в соответствии с рекомендациями производителя Whatman (50 мкл, примерно, на 1 см2). После нанесения образцов карты (платы) сушат при 60°С в течение одного часа и экстрагируют ДНК, как описано выше.
Помимо этого, аликвоту каждого положительного контроля и образца свежей мочи (для разведения клеток) использ