Способ диагностики нарушений метаболизма в организме в условиях окислительного стресса
Иллюстрации
Показать всеПредлагаемое изобретение относится к медицине и может быть использовано для диагностики дисбаланса функционирования ферментов антирадикальной защиты. Сущность изобретения: в комплексе определяют активность супероксиддисмутазы (СОДi) и каталазы (KATi) в гемолизате, оценивают изменение этих показателей относительно нормы, которая соответствует значениям СОДk=0,16±0,02 и KATk=115,55±9,41. При значении соотношения этих показателей, равном 1,000±0,002, определяют отсутствие дисбаланса функционирования ферментов антирадикальной защиты, а при других значениях дополнительно определяют степень выраженности окислительного стресса по максимуму и площади вспышки хемилюминесценции. Далее оценивают дисбаланс функционирования ферментов антирадикальной защиты, вычисляя показатель ИПФФАРЗi, по формуле. При значении ИПФФАРЗi ниже 70,0 ед. определяют недостаточность каталазы, а при значении ИПФФАРЗi выше 130,0 ед. определяют недостаточность супероксиддисмутазы. Использование способа дает возможность оценить функционирование исследуемых ферментов, что позволяет проводить диагностику заболеваний, сопровождающихся окислительным стрессом, а также способ позволяет определять индивидуальный подход к медикаментозной коррекции. 4 табл., 4 ил.
Реферат
Предлагаемое изобретение относится к медицине и может быть использовано в диагностике заболеваний, сопровождающихся окислительным стрессом при дисбалансе функционирования ферментов антирадикальной защиты.
Нарушение функционирования ферментов антирадикальной защиты (ФАРЗ) является одним из значимых показателей диагностики окислительного стресса и контроля за лечением антиоксидантными средствами при многих заболеваниях - сахарный диабет, астма, стенокардия, инфаркт миокарда, катаракта, злокачественные новообразования, ревматоидный артрит и другие [Кулинский В.И. Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита. // Соросовский образовательный журнал. - 1999. - №1. - С.2-8]. При этом нередко ключевым механизмом, способствующим формированию окислительного стресса, является развитие дисбаланса в работе ферментов первой и второй линий антирадикальной защиты - супероксиддисмутазы и каталазы [Дубинина Е.Е., Ефимова Л.Ф., Софронова Л.Н., Геронимус А.Л. Сравнительный анализ активности супероксиддисмутазы и каталазы эритроцитов и цельной крови у новорожденных детей при хронической гипоксии. // Лаб. дело. - 1988. - №8. - С.16; Владимиров Ю.А. Свободные радикалы в биологических системах. // Соросовский образовательный журнал. - 2000. - №12. - С.13-19; Gurer Orhan H., Sabir H.U., Ozgunes H. Correlation between clinical indicators of lead poisoning and oxidative stress parameters in controls and lead-exposed workers // Toxicology. - 2004, - Vol.195, N2-3. - P.147-154].
Своевременная диагностика и коррекция нарушений в работе ферментного звена антиоксидантной системы требует четко сформулированных критериев, разграничивающих адаптивную напряженность ФАРЗ, их регуляторные разнонаправленные изменения [Байляк М., Господарев Д., Семчишин Г., Лущак В. - Ингибирование каталазы аминотриазолом in vivio приводит к снижению активности глюкозо-6-фосфатдегидрогеназы в клетках Saccharomyces cerevisiae. - Биохимия. - 2008. - Том 73, вып.4. - С.515-523] и наличие дисбаланса в работе этих ферментов, приводящее к формированию окислительного стресса.
Известен способ выявления дисбаланса ферментов антиоксидантной защиты - «Показатель отношения Глутатионпероксидазы / Супероксиддисмутазы» [Сукоян Г.В., Андриадзе Н.А., Варазанашвили Н.А., Чикобава Е.А., Отаришвили И.О., Головач И.В., Митьковская Н.П., Карсанов Н.В. // Вопросы биологической, медицинской и фармацевтической химии. - 2001. - №2. - С.34-40], основанный на определении активности глутатионпероксидазы и супероксиддисмутазы как показателей ферментного звена антиоксидантной системы, с последующим вычислением отношения активности глутатионпероксидазы и супероксиддисмутазы.
Ход определения: активность СОД определяют на основе метода В.Г.Мхитарян, Г.Е.Бадалян [Мхитарян В.Г., Бадалян Г.Е. Влияние пероксидированных и непероксидированных ненасыщенных жирных кислот на активность супероксиддисмутазы. Журнал экспериментальной и клинической медицины. - 1978. - №6. - С.7-11]; активность глутатионпероксидазы - по методу Е. Beutler [Beutler E. Red Cell Metabolism. A Manual of Biochemical Methods. - New York, 1973. - P.74], методом Oshino и соавт. [Oshino N, Chance B, Sies H, Bücher T. The role of H2O2 generation in perfused rat liver and the reaction of catalase compound I and hydrogen donors. Biochem 1973; 154: 117-131].
Показатель отношения ГП/СОД рассчитывают по формуле 1:
ГП/СОД = активность ГП/активность СОД (формула 1),
где ГП/СОД - отношение активности глутатионпероксидазы и активности супероксиддисмутазы.
Результаты оценивают следующим образом: среднестатистическая величина ГП/СОД, полученная в контрольной группе, будет равна 13,5; состояние, при котором значения антиоксидантного индекса (АОИ) выше 13,5, рассматривают как дисбаланс работы ферментов, чувствительный тест ишемии и реперфузии.
Недостатки:
а) использование в способе «Показатель отношения Глутатионпероксидазы/Супероксиддисмутазы» результатов исследования активности ферментов без учета содержания субстратов, катализируемых ими реакций или содержания продуктов этих реакций приводит к снижению его достоверности и затрудняет трактовку данного показателя, что связано с широкой вариабельностью изменения активности этих ферментов как в сторону повышения, так и в сторону понижения, даже в условиях одной патологии, например в случаях активации ферментов при недостатке субстрата или обратном ингибировании ферментов продуктами катализируемых ими реакций;
б) использование в качестве одной из составляющих в «Показателе отношения Глутатионпероксидазы/Супероксиддисмутазы» активности митохондриальной глутатионпероксидазы уменьшает возможность широкого его использования в клинике, особенно при поражении тканей с исходно невысокой активностью глутатионпероксидазы, что может затруднять трактовку полученных результатов;
в) трудоемким представляется забор биоматериала, необходимого для исследования активности глутатионпероксидазы непосредственно в тканях, поскольку наибольшая ее активность выявлена в миокарде, мозговой ткани, легких, мышцах, глазах [Давыденкова Е.Ф., Шафран М.Г. Атеросклероз и процесс перекисного окисления липидов. // Вест. АМН СССР. - 1989. - №3. - С.10-18], в свою очередь забор в качестве образцов для лабораторных исследований эритроцитов крови может приводить к снижению достоверности получаемых результатов.
За ближайший аналог принят интегральный коэффициент, характеризующий свободнорадикальное окисление (СРО) и антиоксидантную защиту (АОЗ) слюны [Петрович Ю.А., Лемецкая Т.И., Пузин М.Н., Сухова Т.В. Интегральный коэффициент, характеризующий свободнорадикальное окисление и антиоксидантную защиту, и новый «остаточный» коэффициент, отражающий результативность применения антиоксидантов при пародонтите. // Стоматология, 2001, №1, с.38-41], позволяющий выявлять дисбаланс факторов свободнорадикального окисления и антиоксидантной защиты слюны, основанный на определении активности ферментов 1-й и 2-й линии антирадикальной защиты и интенсивности свободнорадикального окисления. Для его осуществления проводят определение уровня малонового диальдегида здоровых и больных (МДАз и МДАб), максимальной амплитуды хемилюминесценции здоровых и больных (МХЛз и МХЛб), периода, в течение которого интенсивность хемилюминесценци достигает полуамплитуды максимальной вспышки у здоровых и больных (ППХЛз и ППХЛб), активности глутатионпероксидазы здоровых и больных (ГПОз и ГПОб), активности супероксиддисмутазы, с последующим делением прооксидантных показателей на антиоксидантные.
Объектом исследования служила смешанная слюна здоровых и больных людей. Пробы слюны центрифугировали при 3000 об/мин в течение 15 мин. Исследовали супернатант. О показателях СРО судят по максимальной амплитуде хемилюминесценции (МХЛ), которую регистрируют фотоэлектронным умножителем после введения раствора сульфата железа, также по периоду, в течение которого интенсивность хемилюминесценции достигает полуамплитуды максимальной вспышки (ППХЛ), и по уровню МДА, который определяют с помощью стандартной методики [Гаврилов В.Б., Гаврилова A.Р., Мажуль Л.М. Анализ методов определения продуктов перекисного окисления сыворотки крови по тесту с тиобарбитуровой кислотой. Вопр. мед. химии. 1987. - Т.33, №1. - С.118-122]. Антиоксидантный потенциал оценивают по активности глутатионпероксидазы (ГПО) по методам [Терехина Н.А., Петрович Ю.А. Свободнорадикальное окисление и антиоксидантная система (теория, клиническое применение, методы). Пермь, 1992, 34 с., Ravin НА. An improved colorimetric enzymatic assay of ceruloplas-min. J Lab Clin Med 1961; S8:1:161-168] и активность супероксиддисмутазы (СОД) по [Терехина Н.А., Петрович Ю.А. Свободнорадикальное окисление и антиоксидантная система (теория, клиническое применение, методы). Пермь, 1992; 34], определение которых основано на изменении экстинкции опытного раствора в спектрофотометре.
Расчет проводят по формуле 2:
Чем ниже было значение антиоксидантного коэффициента (АОК) по сравнению с показателями донорской группы, принятой за 100%, тем более выраженным считают дисбаланс (окислительный стресс) в системе анти- /прооксиданты организма.
Недостатки:
а) из прооксидантных показателей учитывают только узкоспецифичный конечный продукт пероксидации липидов - МДА, что приводит к снижению достоверности данного метода;
б) отсутствует учет промежуточных продуктов окислительной модификации биологических молекул как липидной (диеновый конъюгат и т.п.), так и другой природы (белковой, нуклеотидной, углеводной), что снижает чувствительность данного метода и приводит к неверному отражению уровня имеющегося окислительного стресса, а следовательно, неадекватному назначению терапии, направленной на его устранение;
в) при расчете данного коэффициента не учитывают возможность разнонаправленного изменения активности ферментов антирадикальной защиты - супероксиддисмутазы (1-я линия антирадикальной защиты) и глутатионпероксидазы (3-я линия антирадикальной защиты), поскольку произведение этих ферментов в делителе будет оставаться примерно одной и той же величиной в случаях одновременного снижения активности одного из них при параллельном повышении активности другого, что приведет к неправильной оценке вклада дисбаланса функционирования ферментов антирадикальной защиты в развитие окислительного стресса, например при повышении активности супероксиддисмутазы в два раза и одновременном снижении активности глутатионпероксидазы в два раза произведение делителя составит как в норме единицу:
(МДАб:МДАз)·(МХЛб:МХЛз)·(ППХЛб:ППХЛз)/(1·1=1)
((МДАб:МДАз)·(МХЛб:МХЛз)·(ППХЛб:ППХЛз)/(2·0,5=1)), хотя имеющийся дисбаланс в работе этих ферментов может приводить к накоплению пероксида водорода - продукта реакции дисмутации супероксидного анион-радикала, катализируемого супероксиддисмутазой, а в дальнейшем к образованию и других активных форм кислорода, в том числе при взаимодействии пероксида водорода с металлами переменной валентности (железо и другие) к увеличению содержания в тканях гидроксильного радикала - наиболее токсичного для клеточных структур;
г) исследования проводят в слюне, что не всегда объективно отражает функционирование эндогенных систем в крови и тканях, поскольку большое влияние оказывают условия забора слюны для биохимических исследований (без стимуляции, при стимуляции химическими веществами, сплевыванием в пробирку или с помощью специальных капсул, например Лешли-Красногорского), что может изменять качественный и количественный состав слюны и ротовой жидкости, кроме того, большое влияние могут оказывать стоматологические заболевания на характер получаемой слюны, искажая истинную картину состояния внутренней антиоксидантной системы организма.
Задача - создание комплексного, достоверного и однозначно трактуемого способа интегральной оценки функционирования ферментов антирадикальной защиты в условиях окислительного стресса с помощью показателя, основанного на использовании минимального количества дополнительных специальных лабораторных методов диагностики, позволяющего определять выраженность дисбаланса ферментов антирадикальной защиты в условиях окислительного стресса, своевременно назначать рациональную антиоксидантную терапию в должном объеме и контролировать ее эффективность в процессе лечения; с последующей проверкой в практической медицине вышеизложенных предложений при диагностике и лечении окислительного стресса.
Сущностью изобретения является то, что в комплексе определяют активность супероксиддисмутазы (СОДi) и каталазы (КATi) в гемолизате, далее оценивают изменение этих показателей относительно нормы, которая соответствует значениям СОДk=0,16±0,02 и КATk=115,55±9,41, и при значении соотношения этих показателей, равном 1,000±0,002, определяют отсутствие дисбаланса функционирования ферментов антирадикальной защиты, а при других значениях этого соотношения дополнительно определяют степень выраженности окислительного стресса по максимуму и площади вспышки хемилюминесценции и оценивают дисбаланс функционирования ферментов антирадикальной защиты по формуле 3:
, где
ИПФФАРЗi - интегральный показатель функционирования ферментов антирадикальной защиты обследуемого, в единицах соотношения каталаза/супероксиддисмутаза, ед. соотн. КАТ/СОД,
100 - расчетный коэффициент,
КATi - активность каталазы гемолизата обследуемого, в единицах активности, ед. акт.,
КATk - активность каталазы гемолизата контрольной группы, в единицах активности, ед. акт.,
СОДi - активность супероксиддисмутазы гемолизата обследуемого, в единицах активности, ед. акт.,
COДk - активность супероксиддисмутазы гемолизата контрольной группы, в единицах активности, ед. акт.,
ПХЛi - площадь хемилюминесценции обследуемого, в единицах площади, ед. пл.,
ПХЛk - площадь хемилюминесценции контрольной группы, в единицах площади, ед. пл.,
MBXЛi - максимум вспышки хемилюминесценции обследуемого, в условных единицах, усл. ед.,
MBXЛk - максимум вспышки хемилюминесценции контрольной группы, в условных единицах, усл. ед.,
при значении ИПФФАРЗi ниже 70,0 ед. соотношения КАТ/СОД определяют недостаточность каталазы, а при значении ИПФФАРЗi выше 130,0 ед. соотношения КАТ/СОД определяют недостаточность супероксиддисмутазы.
Техническим результатом изобретения является:
1) интегральная оценка функционирования ключевых ферментов антирадикальной защиты - каталазы и супероксиддисмутазы, с одновременным определением их роли в развитии и формировании окислительного стресса в организме обследуемого;
2) использование в качестве критерия выраженности явлений окислительного стресса как максимума вспышки хемилюминесценции, позволяющего определить количество прооксидантных факторов в организме (металлы переменной степени окисления, органические пероксиды и гидропероксиды), так и площади хемилюминесценции, позволяющей определить снижение пролонгированной устойчивости антиоксидантной системы к свободнорадикальным процессам;
3) для определения данного интегрального показателя используют доступный биоматериал - эритроциты крови, в которых в достаточном количестве содержится как супероксиддисмутаза, так и каталаза [Уайт А., Хендлер Ф., Смит Э., Хилл Р., Леман Н. Основы биохимии. // Пер. с англ. - М.: Мир, 1981. - Т.1-3. - 1878 с.; Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы. // Лаб. дело. - 1988. - №1. - С.16], что повышает универсальность определения и использования данного показателя для клинических исследований при различных заболеваниях;
4) применяют приоритетный подход в дифференцированной оценке вклада каждой из составляющих уравнения в получаемый результат при расчете интегрального показателя функционирования ферментов антирадикальной защиты и их роли в развитии окислительного стресса путем возведения отношения каталаза/супероксиддисмутаза в степень показателя произведения максимума и площади хемилюминесценции, позволяющих определить интенсивности образования супероксидного анион-радикала и пероксида водорода - субстратов для супероксиддисмутазы и каталазы соответственно, с учетом контрольных значений, что позволяет как повысить чувствительность способа, то есть увеличить процент истинно положительных результатов у лиц, страдающих заболеваниями с явлениями окислительного стресса, вызываемого дисбалансом работы ферментов антирадикальной защиты (когда ПХЛi/ПХЛk·MBXЛi/MBXЛk существенно отличается от показателя 1,0), так и повысить специфичность, то есть уменьшить частоту ложноположительных результатов у обследуемых с произведением максимума и площади хемилюминесценции, близкой к контрольным значениям (когда ПХЛi/ПХЛk·МВХЛi/МВХЛk стремится к показателю 1,0), таким образом достигается максимально возможная диагностическая эффективность для данного способа определения дисбаланса в системе ферментов антирадикальной защиты (табл.1, табл.2, фиг.1, фиг.2).
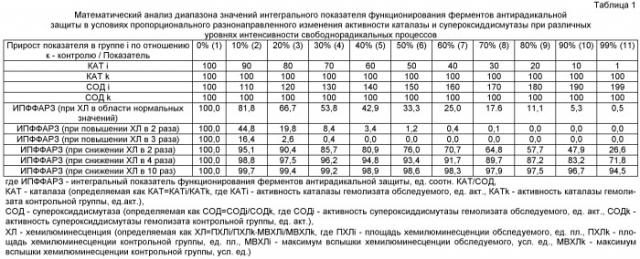
На фиг.1 с помощью графиков показано моделирование диапазона значений ИПФФАРЗ в условиях пропорционального снижения активности каталазы и повышения активности супероксиддисмутазы при различных уровнях хемилюминесценции (данные приведены в таблице 1, где ИПФФАРЗ - интегральный показатель функционирования ферментов антирадикальной защиты, ед. соотношения КАТ/СОД, КАТ - каталаза, определяемая как КАТ = КATi/КATk, где КATi - активность каталазы гемолизата обследуемого, ед. акт., КATk - активность каталазы гемолизата контрольной группы, ед.акт., СОД - супероксиддисмутаза, определяемая как СОД=СОДi/СОДk, где СОДi - активность супероксиддисмутазы гемолизата обследуемого, ед. акт., СОДk - активность супероксиддисмутазы гемолизата контрольной группы, ед. акт., ХЛ - хемилюминесценция, определяемая как ХЛ=ПХЛi/ПХЛk·МВХЛi/МВХЛk, где ПХЛi - площадь хемилюминесценции обследуемого, ед. пл., ПХЛk - площадь хемилюминесценции контрольной группы, ед. пл., МВХЛi - максимум вспышки хемилюминесценции обследуемого, усл. ед., МВХЛk - максимум вспышки хемилюминесценции контрольной группы, усл. ед.).
На фиг.2 с помощью графиков показано моделирование диапазона значений ИПФФАРЗ в условиях снижения активности супероксиддисмутазы при различных уровнях хемилюминесценции (данные приведены в таблице 2, где ИПФФАРЗ - интегральный показатель функционирования ферментов антирадикальной защиты, ед. соотношения КАТ/СОД, КАТ - каталаза, определяемая как КАТ=KATi/КATk, где КАТi - активность каталазы гемолизата обследуемого, ед. акт., КATk - активность каталазы гемолизата контрольной группы, ед.акт., СОД - супероксиддисмутаза, определяемая как СОД=СОДi/СОДk, где СОДi - активность супероксиддисмутазы гемолизата обследуемого, ед. акт., СОДk - активность супероксиддисмутазы гемолизата контрольной группы, ед. акт., ХЛ - хемилюминесценция, определяемая как ХЛ=ПХЛi/ПХЛk·МВХЛi/МВХЛk, где ПХЛi - площадь хемилюминесценции обследуемого, ед. пл., ПХЛk - площадь хемилюминесценции контрольной группы, ед. пл., МВХЛi - максимум вспышки хемилюминесценции обследуемого, усл. ед., MBXЛk - максимум вспышки хемилюминесценции контрольной группы, усл. ед.).
5) Особенностью ферментов антирадикальной защиты и белков, непосредственно взаимодействующих с активными формами кислорода, является их сравнительно повышенная устойчивость к окислительной деструкции [Gutteridge J.M.C., Wilkins S. Copper salt-dependent hydroxyl radical formation. Damage to proteins acting as antioxidants // Biochim. Biophys. Acta. - 1983. - V.758. - P.38-41, Halliwell В., Aruoma O.I., Wasil M., Gutteridge J.M.C. The resistents of transferrin and ceruloplasmin to oxidative damage // Biochem. J. - 1988. - V.256. - P.311-312, Sharonov B.P., Govorova N.Yu., Lyzlova S.N. Serum protein degradation by hypochlorite // Biochem. Internat. - 1989. - V.19, №1. - P.27-35, Salo D.C., Pacifici R.E., Lin S.W., Giulivi C., Davies K.J.A. Superoxide dismutase undergoes proteolysis and fragmentation following oxidative modification and inactivation // J. Biol. Chem. - 1990. - V.265, №20. - P.11919-11927]. Но и они оказались ранжированы как в отношении действия конкретного оксиданта, так и по чувствительности к различным концентрациям активных форм кислорода. Например, при изучении влияния некоторых оксидантов на супероксиддисмутазу, каталазу и глутатионпероксидазу наиболее устойчивым оказался первый фермент, а наименее - последний [Aruoma O.I., Halliwell В. Action of hypochlorous acid on the antioxidant protective enzymes superoxide dismutase, catalase and glutathione peroxidase // Biochem. J. - 1987. - V.248, №.3. - P.973-976]. В связи с чем представляется важным для объективной оценки дисбаланса функционирования ферментов антирадикальной защиты в условиях окислительного стресса параллельно с определением активности этих ферментов измерять уровень интенсивности свободнорадикального окисления, в том числе с помощью хемилюминесцентных методов.
Способ осуществляют следующим образом.
Для диагностики дисбаланса функционирования ферментов антирадикальной защиты организма человека используют интегральный показатель функционирования ферментов антирадикальной защиты (ИПФФАРЗ). Объектом исследования служит кровь обследуемых, стабилизированная антикоагулянтами, в которой определяют активность каталазы и супероксиддисмутазы, а также активность свободнорадикальных процессов хемилюминометрическим методом.
Активность каталазы определяют в гемолизате эритроцитов по методу [Beers R., Sizer I. A Spectrophotometric Method for Measuring the Breakdown of Hydrogen Peroxide by Catalase // J. Biol. Chem. - 1952. - №195. - P. 133] в модификации [Павлюченко И.И., Луговая И.А., Федосов С.Р., Басов А.А., Быков М.И. Активность ферментов антирадикальной защиты в эритроцитах и в раневом отделяемом у больных с осложненным течением сахарного диабета // XIV международная конференция «Новые информационные технологии в медицине, биологии, фармакологии и экологии». - Ялта - Гурзуф, 2006. - С.281-287]. Определение активности каталазы основано на определении скорости утилизации перекиси водорода в реакционной смеси, в которую вносится биологический материал, содержащий фермент. Об интенсивности утилизации перекиси водорода судили по скорости снижения экстинкции при длине волны 260 нм, на которой перекись водорода имеет максимум светопоглощения. Приготовление гемолизата производилось путем внесения в пробирку с 10 мл дистиллированной Н2О 50 мкл отмытых эритроцитов. Параллельно ставилась контрольная (без биологического материала) и опытная (в присутствии исследуемого биологического материала) пробы. В пробирки с опытной и контрольной пробой вносили 0,5 мл 3% H2O2 + 2 мл 0,1 М калий-фосфатного буфера (рН 7,4). Затем в пробирки с контрольной пробой добавляли 0,3 мл 50% раствора трихлоруксусной кислоты (для инактивации каталазы перед внесением в контроль раствора пероксида водорода). Подогревали опыт и контроль в течение 10 минут при температуре 37°С. Вносили 200 мкл гемолизата эритроцитов параллельно в опыт и контроль и инкубировали в течение 180 секунд при температуре 37°С в сухом термостате. После окончания инкубации в пробирки с опытной пробой добавляли 0,3 мл 50% раствора трихлоруксусной кислоты и пробирки центрифугировали 10 мин при 3000 об/мин. Супернатант фотометрировали против 5% раствора трихлоруксусной кислоты при длине волны 260 нм. Полученная экстинкция соответствует содержанию перекиси водорода в супернатанте. Разность в оптической плотности контрольной и опытной проб использовалась для расчета активности каталазы. Расчет активности каталазы производили по разнице экстинкций в опытной и контрольной пробах согласно закону Бугера-Ламберта-Бэра с учетом молярного коэффициента светопоглощения перекиси водорода при длине волны 260 нм ε = 22 М-1 · см-1 по формуле 4:
где А - активность каталазы, ммоль / (мин·л);
ΔЕ - разность экстинкций контрольных и опытных проб;
Vp.c. - объем реакционной смеси (3 мл);
Vпр - объем пробы, использованной для определения активности КАТ (0,2 мл);
l - длина оптического пути (1 см);
ε - молярный коэффициент светопоглощения H2O2;
t - время инкубации (3 мин);
х - степень разведения эритроцитарной взвеси в гемолизате.
Полученные результаты активности каталазы делили на количество эритроцитов в использованной взвеси и выражали в условных единицах активности (ед. акт.).
Для определения активности супероксиддисмутазы используют методику [Костюк В.А., Потапович А.И., Ковалева Ж.В. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина // Вопросы медицинской химии. - 1990. - №2. - С.88-91] в модификации [Павлюченко И.И., Луговая И.А., Федосов С.Р., Басов А.А., Быков М.И. Активность ферментов антирадикальной защиты в эритроцитах и в раневом отделяемом у больных с осложненным течением сахарного диабета // XIV международная конференция «Новые информационные технологии в медицине, биологии, фармакологии и экологии». - Ялта - Гурзуф, 2006. - С.281-287]. Метод основан на способности супероксиддисмутазы ингибировать реакцию аутоокисления кверцетина в связи с тем, что одним из промежуточных продуктов этой реакции является супероксидный анион-радикал. Выполнение методики заключается в определении разницы экстинкций растворов опытной пробы (с биосубстратом) и контрольной пробы (без биосубстрата). Аутоокисление кверцетина (1,4 мкМ) проводили в течение 15 минут при комнатной температуре в 0,015 М фосфатном буфере рН 7,8, содержащем 0,08 мМ этилендиаминтетраацетата и 0,8 мМ тетраметилэтилендиамина в конечном объеме 3,5 мл. Реакцию начинали внесением в среду инкубации кверцетина в 0,1 мл диметилсульфоксида. Спектры поглощения регистрировали на спектрофотометре при 406 нм. Степень ингибирования аутоокисления кверцетина определяли по разнице в оптической плотности опытной и контрольной пробы. Результаты активности супероксиддисмутазы выражают в единицах активности (ед. акт.), соответствующих степени ингибирования реакции за единицу времени, которую находят по формуле (формула 5):
, где
СОД - активность супероксиддисмутазы гемолизата, в единицах активности, ед. акт.,
Е0кон - экстинкция контрольной пробы перед инициацией аутоокисления кверцетина, в единицах оптической плотности, е.о.п.,
Е15кон - экстинкция контрольной пробы через 15 минут после инициации аутоокисления кверцетина, в единицах оптической плотности, е.о.п.,
Е0оп - экстинкция опытной пробы перед инициацией аутоокисления кверцетина, в единицах оптической плотности, е.о.п.,
Е15оп - экстинкция опытной пробы через 15 минут после инициации аутоокисления кверцетина, в единицах оптической плотности, е.о.п.
Люминол-зависимая H2O2-индуцированная хемилюминесценция плазмы крови и экссудата раны измерялась на хемилюминотестере ЛТ-1 производства НПО «Люмин» (Ростов-на-Дону) по авторской методике [Павлюченко И.И., Басов А.А., Федосов С.Р. «Система лабораторной диагностики окислительного стресса». Патент на полезную модель №54787 по заявке №2006101586 от 19.01.2006]. В кювету вносили 2,9 мл 50 мкМ раствора люминола в 0,1 М трис-HCl буфере (рН 6,8). Биологический субстрат (плазма крови или раневой экссудат) осаждали 28% трихлоруксусной кислотой в соотношении 1:10 и центрифугированием на 3000 об/с в течение 10 минут. Затем добавляли 100 мкл полученного супернатанта в кювету. Термостатировали кювету с реакционной системой 500 секунд в сухом термостате (t=37°С). После этого кювета помещалась в люминотестер ЛТ-1 и реакция радикального окисления люминола запускалась впрыскиванием с помощью шприца-дозатора через инжектор 0,5 мл 3% Н2О2. Интенсивность вспышки хемилюминесценции регистрировалась в условных единицах (у.е.) хемилюминесценции в виде двух параметров: максимум вспышки хемилюминесценции и площадь хемилюминесценции. Изучение динамики процесса хемилюминесценции [Федосов С.Р., Павлюченко И.И., Басов А.А. Способ повышения информативности прибора «Хемилюминотестер LT-1» // Современные проблемы науки и образования. - 2006. - №4 (прил. №1). - С.27-28] производилось с помощью собственного аппаратно-программного комплекса [Пат. 2236008 Российская Федерация. МПК А61К 33/00. Способ лабораторной диагностики окислительного стресса организма человека / Павлюченко И.И., Басов А.А., Федосов С.Р.; заявитель и патентообладатель Павлюченко И.И., Басов А.А., Федосов С.Р. - №2006101586/22; заявл. 19.01.2006; опубл. 27.07.2006 // Бюл. - 2006. - №21. - 2 с.] с программным обеспечением [Свидетельство об официальной регистрации программы для ЭВМ 2006611562. Программа для регистрации сигналов хемилюминотестера ЛТ-1 / Павлюченко И.И., Федосов С.Р., Басов А.А.; заявитель и правообладатель Павлюченко И.И., Федосов С.Р., Басов А.А. - №2006610783; заявл. 16.03.2006; зарег. 10.05.2006], позволяющим оцифровывать аналоговый сигнал с выхода хемилюминотестера ЛТ-1. Определялись следующие показатели хемилюминесценции: максимум вспышки хемилюминесценции в сравнении с эталоном (рабочий раствор люминола) и площадь хемилюминесценции за 25 секунд в сравнении с эталоном (рабочий раствор люминола). В обоих случаях эталоном служила реакционная смесь без биологического образца. Интенсивность реакций свободнорадикального окисления, определяемая с помощью люминол-зависимой хемилюминесценции по максимуму и площади хемилюминесценции, указывает на наличие окислительного стресса и отражает его уровень.
Полученные результаты трактуют следующим образом.
Чем ниже значения в 100 единиц (соотношение КАТ/СОД) положительный результат ИПФФАРЗ, тем большую роль в развитии окислительного стресса организма играет недостаточность каталазы (второй линии ФАРЗ), чем выше значения 100 единиц (соотношение КАТ/СОД) положительный результат ИПФФАРЗ, тем большую роль в развитии окислительного стресса организма играет недостаточность супероксиддисмутазы (первой линии ФАРЗ), а чем ближе к значению 100,0 условных единиц положительный результат ИПФФАРЗ, тем меньшую роль в развитии окислительного стресса играют ферменты антирадикальной защиты - как каталаза, так и супероксиддисмутаза.
Обоснование достигнутых результатов
Особенность предлагаемого способа заключается в определении дисбаланса функционирования ферментов антирадикальной защиты (каталазы и супероксиддисмутазы) и параллельной оценки их роли в развитии окислительного стресса, выраженность которого оценивают по уровню генерации активных форм кислорода - супероксидного анион-радикала и пероксида водорода, определяемых методом люминол-H2O2-зависимой хемилюминесценции с помощью авторской модификации [Павлюченко И.И., Басов А.А., Федосов С.Р. «Система лабораторной диагностики окислительного стресса». Патент на полезную модель №54787 по заявке №2006101586 от 19.01.2006], позволяющей определять как максимум вспышки хемилюминесценции, так и площадь хемилюминесценции.
Помимо эндогенного синтеза, ферменты антирадикальной защиты могут поступать в организм в составе пищевых веществ, фармацевтических препаратов и биодобавок. Супероксиддисмутазу и каталазу нередко используют в виде лекарственных форм при ожоговой болезни, заболеваниях сердечно-сосудистой системы, в хирургической практике, ревматологии, в качестве антитромботических средств, при воспалительных заболеваниях и иммунодефицитных состояниях, в стоматологии [Гайворонская Т.В., Петросян Э.А., Галенко-Ярошевский В.П. Влияние натрия гипохлорита и препаратов супероксиддисмутазы на состояние про-антиоксидантной системы крови при гнойной ране. - Бюллетень экспериментальной биологии и медицины. - 2007. - Прил.3: 174-177; Гайворонская Т.В. Экспериментальное обоснование эффективности применения непрямого электрохимического окисления крови и антиоксидантной терапии при лечении гнойных ран мягких тканей. - Стоматология. - 2008. - 1: 18-22; Макаревич О.П., Голиков П.П. Активность супероксиддисмутазы крови в острый период различных заболеваний. // Лаб. дело. - 1983. - №6. - С.24-27, Максименко А.В., Тищенко Е.Г. Ковалентная модификация субъединиц супероксиддисмутазы хондроитинсульфатом. // Биохимия. - 1997. - Т. 62. - Вып.10. - 1359-1363, Максименко А.В., Тищенко Е.Г. Модификация каталазы хондроитинсульфатом. // Биохимия. - 1997. - Т.62. - Вып.10. - С.1364-1368, Максименко А.В., Тищенко Е.Г., Голубых В.Л. Антитромботическое действие производных каталазы и хондроитинсульфата при артериальном поражении у крыс. // Вопросы медицинской химии. - 1998. - Т. 44. - Вып.4. - С.362-368, Архипенко Ю.В., Сазонтова Т.Г. Роль про- и антиоксидантных факторов при адаптации к различным видам гипоксии // Кислород и свободные радикалы: материалы международного симпозиума. - Гродно, 1996. - С.7-8., Berckman R., Flohe L. The pathogenetic role of superoxide dismutaze. // Bull. Eur. Physiopathol. Respirat. - 1981. - N914. - P.275-285, Blane D.R., Heal N.D., Treby D.A. Protection again hydrogen peroxide in synovial fluid from rheumathoid patients. // Clin. Sci. - 1981. - V.61. - N4. - P.483-486, McCord J.M. Superoxide radical: controversies, contradictions, and paradoxes // Proc. Soc. Exp. Biol. Med. - 1995. - V.209. - №2. - P.112-117], кроме того, в настоящее время в медицине используются также имитаторы ферментов антирадикальной защиты [Packer L., Cadenas E. Handbook of Synthetic Antioxidants. - New York: Marcel Dekker, 1996] - все это требует новых надежных и доступных методов диагностики их функционирования для определения показаний к назначению данной группы препаратов и мониторинга эффективности антиоксидантной терапии, проводимой с их использованием.
Проведены исследования состояния баланса каталазы и супероксиддисмутазы крови у различных категорий больных (n>200 чел.).
Анализируя активность каталазы у пациентов с сахарным диабетом и у здоровых людей, можно отметить отсутствие между ними существенного различия. Так, активность каталазы у пациентов с сахарным диабетом составляет 110,51±4,82 ед. акт., а у здоровых людей - 115,55±9,41 ед. акт.
При сравнении активности супероксиддисмутазы у пациентов с сахарным диабетом и у здоровых людей обращает на себя внимание имеющееся между ними различие. Так, активность супероксиддисмутазы у пациентов с сахарным диабетом составляет 0,097±0,01 ед. акт., а у здоровых людей - 0,159±0,015 ед. акт. Активность супероксиддисмутазы у пациентов с сахарным диабетом снижена на 39% от аналогичного показателя у здоровых людей.
Максимум вспышки хемилюминесценции плазмы крови у пациентов с сахарным диабетом составляет 0,832±0,086 усл. ед., а у здоровых людей - 0,236±0,021 усл. ед. Максимум вспышки хемилюминесценции у пациентов с сахарным диабетом превышает аналогичный показатель у здоровых людей в 3,52 раза, что связано с наличием сахарного диабета и нарушениями в системах специфической и неспецифической защиты организма.
Площадь хемилюминесценции плазмы крови у пациентов с сахарным диабетом составляет 0,978±0,02 ед. пл., а у здоровых людей - 0,723±0,049 ед. пл. Площадь хемилюминесценции у пациентов с сахарным диабетом превышает аналогичный показатель у здоровых людей в 1,35 раза, что в первую очередь обусловлено метаболическими расстройствами и снижением защитных механизмов у пациентов, страдающих сахарным диабетом.
С целью увеличения наглядности авторами был произведен расчет ИПФФАРЗi у пациентов с сахарным диабетом. ИПФФАРЗi составил 853,4 ед. соотн. КАТ/СОД, что свидетельствует об имеющем существенное значение для организма снижении активности супероксиддисмутазы у пациентов с сахарным диабетом.
Использование интегрального коэффициента ИПФФАРЗi в сравнении с отдельно взятыми показателями активности каталазы и супероксиддисмутазы позволяет с большей точностью и эффективностью определять состояние ферментативного компонента антиоксидантной системы, что может иметь решающее значение при выборе оптимального метода лечения пациента.
Пример 1. В отделение гнойной хирургии Краевой клинической больницы г.Краснодара 10 июня 2006 года поступил пациент Карагозян М.А., возраст 37 лет. Диагноз: «Сахарный диабет 2 типа, инсулинпотребный, тяжелая форма. Синдром диабетической стопы, нейропатическая форма, глубокая флегмона тыла и подошвы правой стопы». Длительность заболевания сахарным диабетом составляла 8 лет. Проведено обследование с целью диагностирования возможного наличия дисбаланса основных ферментов антирадикальной защиты - каталазы и супероксиддисмутазы. Активность каталазы была снижена на 13,2% (по сравнению со средним показателем активности каталазы у здоровых людей КАТ=115,55 ед. акт.) и составила КATi=100,27 ед. акт. Активность супероксиддисмутазы была повышена на 6,3% (по сравнению со средним показателем активности супероксиддисмутазы у здоровых людей СОД=0,159 ед. акт.) и составила СОДi=0,169 ед. акт. Показатель максимума вспышки хемилюминесценции был повышен в 5,3 раза (по сравнению со средним показателем максимума вспышки хемилюминесценции у здоровых людей МВХЛ=0,236 усл. ед.) и составила MBXЛi=1,281 усл. ед. Показатель площади хемилюминесценции был повышен в 3,1 раза (по сравнению со средним показателем площади хемилюминесценции у здоровых людей ПХЛ=0,723 ед. пл.) и составила ПХЛi=2,224 ед. пл. У этого пациента ИПФФАРЗi составил 27,7 ед. соотн. КАТ/СОД, что определили как выраженный дисбаланс в сторону преобладания активности супероксиддисмутазы над активностью каталазы.
В течение 20 дней было проведено хирургическое и медикаментозное лечение, в том числе с применением антиоксидантных препаратов (липоевой кислоты в стандартной дозировке). После завершения лечения проведено повторное обследование с целью определения динамики изменений вышеуказанных показателей. Активность каталазы была снижена на 11,4% (по сравнению со средним показателем активности каталазы у здоровых людей КАТ=115,55 ед. акт.) и составила: КATi=102,32 ед. акт. Активность супероксиддисмутазы была снижена на 13,4% (по сравнению со средним показателем активности супероксиддисмутазы здоровых людей СОД=0,159 ед. акт.) и составила: СОДi=0,138 ед. акт. Показатель максимума вспышки хемилюм