Скрининговый способ диагностики асептического некроза суставных концов костей крупных суставов
Иллюстрации
Показать всеИзобретение относится к медицине, лучевой диагностике в травматологии и ортопедии и предназначено для исследования тканевых компонентов крупных суставов на разных стадиях асептического некроза, различного генеза. Скрининговый способ выявления асептического некроза в суставных концах костей, составляющих крупные суставы, включает оценку данных магнитно-резонансной томографии (МРТ) путем получения измененных костных структур в различных плоскостях на уровне предположительных изменений. Исследования проводят в коронарной, саггитальной и аксиальной плоскостях, используя МР-модифицированный протокол T1FFE/M последовательности со следующими характеристиками: ТЕ - 3,8, TR - 22, ECHO - 1/1, TSE - 3, NSA - 3, angl - 45°, матрица - 256, срез 5,0 мм, расстояние между срезами - 1,0 мм, число пакетов 3, число срезов в пакетах по 5-8, в зависимости от объема исследования. Способ обеспечивает снижение затратности, ускорение, повышение информативности, точности диагностики асептического некроза суставных концов костей на любой стадии процесса. 2 ил.
Реферат
Изобретение относится к медицине, а именно к лучевой диагностике в травматологии и ортопедии, предназначено для исследования состояния тканевых компонентов суставов с наличием асептического некроза на разных стадиях, различного генеза.
Анализ гистологических препаратов головок бедренных костей человека, удаленных при операции эндопротезирования по поводу деформирующего остеоартроза, выявил два процесса, протекающих в хрящевой и костной тканях, составляющих головку. Первый проявляется в виде дегенеративно-дистрофических изменений межклеточного матрикса и специализированных клеточных элементов. Очевидно, эти изменения связаны со следующими факторами: 1. Перегрузка сустава - длительное (хроническое) превышение физиологической нагрузки на суставные хрящи или резкая сильная нагрузка, приводящая к трещинам суставного хряща, отрывом фрагментов с образованием его дефектов. 2. Нарушение трофики хряща при физиологической нагрузке или с ее превышением. 3. Изменение состава синовиальной жидкости, связанной с воспалительным процессом или алиментарной недостаточностью, что приводит к нарушению ее реологических характеристик и, следовательно, трибологических свойств. 4. Нестабильность сустава, вызванная несостоятельностью связочного аппарата. 5. Различные варианты сочетания вышеуказанных факторов. 6. Предрасполагающий фактор - преклонный возраст.
Второй процесс является ответом сохраненной ткани на измененные компоненты сустава. Это репаративная регенерация. Однако последняя не приводит к восстановлению полноценной структуры, т.к. причины (факторы), вызывающие дегенеративно-дистрофические процессы, как правило, не устраняются, а условия жизнедеятельности тканевых компонентов суставов (хрящ и кость) далеки от оптимальных. Тем не менее, выявляются признаки репаративной регенерации как хрящевой, так и костной ткани.
Все изменения экстрацеллюлярного матрикса суставного хряща при артрозах являются следствием нарушения функции хондроцитов - продуцентов всех макромолекулярных компонентов матрикса, как структурных, необходимых для поддержания целостности матрикса, так и ферментативных, осуществляющих его деградацию.
После гибели большей части хондроцитов процесс становится практически необратимым. Постепенно деструкция распространяется на костную ткань, захватывая в тяжелых случаях всю толщину субхондральной костной пластинки, достигая границы с подлежащим губчатым костным веществом и распространяясь дальше вглубь костной ткани эпифиза. С этого момента заболевание становится остеоартрозом. Деструкция суставных концов костей приводит к прогрессирующему развитию деформаций - деформирующий артроз.
Наряду с прогрессирующим в течение определенного времени (зависящим от множества факторов, своевременных лечебных мероприятий, в том числе и социального статуса пациента) деформирующим остеоартрозом, существует острая стадия трофических нарушений суставных концов костей, составляющих сустав, - асептический некроз. Состояние острой декомпенсации обменных процессов в субхондральной и более глубоких зонах кости возникает при травмах, сопровождающихся внутрисуставными переломами (например - импрессия), при конечных стадиях деформирующего остеоартроза (асептический некроз смежных суставных концов костей), при острой внутрикостной ишемии с развитием аваскулярного участка костной ткани (болезни Пертеса, Кенига, различные виды т.н. остеохондропатий костей, с изначально дефицитным кровообращением).
Существует условная стадийность асептического некроза, основанная на клинических данных и данных методов лучевой диагностики (аналоговой или цифровой рентгенографии, УЗИ ЦДК, МРТ, КТ) - доклиническая стадия, дорентгенологическая стадия, стадия основных клинических и рентгенологических проявлений, варианты заключительной стадии: 1) благоприятный исход - формирование на месте очага некроза фокуса компактно-кистозных изменений (репарация с частичным ограничением функций сустава); 2) неблагоприятный исход - тотальный некроз суставного конца кости, с развитием терминальной стадии деформирующего остеоартроза и стойкой утратой функций сустава (неизбежность оперативного лечения - эндопротезирования).
Благоприятный (условно) исход асептического некроза зависит в первую очередь от раннего включения адаптационных механизмов организма, что связано с социальной адаптацией пациента к новым условиям существования, своевременной и комплексной терапией, направленной на ликвидацию дистрофических процессов в области, непосредственно граничащей с участком некроза, стимуляцию коллатерального кровообращения, репаративных процессов. В связи с этим трудно переоценить раннюю диагностику развивающегося асептического некроза, основанную на современных высокоразрешающих методах - УЗИ ЦДК, МРТ и МСКТ. Алгоритм исследования для целей выявления асептического некроза на современном уровне достаточно известен: клинический осмотр - рентгенография - применение специализированных высокоразрешающих методов исследования (КТ, МРТ).
Применяемые в клинической практике, представленные дифференциально-диагностические алгоритмы, на современном диагностическом уровне позволяют верифицировать причину болевого синдрома при наличии доклинической и дорентгенологической стадии асептического некроза, определить необходимость и объем консервативной органосохраняющей комплексной терапии. Во многих случаях ранняя диагностика острой стадии остеоартроза (асептического некроза) и комплексная терапия могут минимизировать объем или вообще отказаться от оперативного вмешательства - эндопротезирования.
В результате патентных исследований были отобраны для анализа следующие патенты-аналоги.
Известен способ диагностики для определения распространенности нарушения васкуляризации концов ложного сустава и протяженности участка асептического некроза путем введения в костную ткань контрастного вещества и ее рентгенологического исследования (пат. РФ 2003283). Данный способ не обладает достаточной информативностью, что не позволяет избрать необходимую тактику в лечении больных и предвидеть исход в лечении.
Известные способы прогнозирования и диагностики асептического некроза головки бедра основаны на том, что пораженная головка теряет свою механическую прочность и под действием механической нагрузки деформируется (пат. РФ 2257573). Деформация головки определяет возникновение видимых изменений на рентгенограмме, с учетом которых и ставят диагноз. Таким образом, известные способы заведомо исключают возможность постановки диагноза до нарушения хотя бы минимальных анатомических изменений. Известно также, что в процессе развития асептического некроза вначале происходит относительное снижение плотности костной ткани за счет вымывания минеральной составляющей костной ткани из подвергшихся некрозу участков костей.
Однако при визуальном просмотре рентгенограмм подобные изменения плотности изображения нередко не регистрируются, т.к. глаз человека способен достоверно различать изменение плотности не менее чем в 25-30%.
Для определения изменений рентгеновской плотности костей конечности в настоящее время широко применяется метод рентгенодеситометрии, позволяющий с высокой точностью, превышающей возможности человеческого глаза, определять изменения оптической плотности, а при использовании эталона и сравнивать эти показатели на различных рентгенограммах (авт. свид. СССР №1725834). Недостаток указанного способа - установить диагноз можно только после развития анатомических изменений в суставе, т.е. лечение заболевания начинается на относительно поздней стадии заболевания.
Известен способ ультразвуковой диагностики асептического некроза головки бедренной кости путем воздействия проникающими через ткани волнами, получения изображения, измерения его с последующим сопоставлением с изображением другого сустава (авт. свид. СССР 1648382, пат. РФ 2143225, пат. США 1648382). Недостаток - трудоемкость за счет последовательного зондирования каждого из участков исследуемой поверхности, причем чем мельче участок зондирования, тем сложнее на практике провести его точное ультразвуковое исследование.
Известен радионуклидный метод диагностики асептического некроза костей путем определения области некроза за счет внутривенного введения внутривенно 113мJn-коллоидного, затем проводят сцинтиграфию и при фиксации 113мJn-коллоидного в костном мозгу в области некроза кости диагностируют благоприятный прогноз, а при отсутствии фиксации - диагностируют неблагоприятный прогноз (авт. свид. СССР 1377023). Метод пригоден только для онкологических больных.
Известен остеотометрический метод диагностики начальной стадии болезни путем измерения внутрикостного давления (пат. РФ 2184481). Метод сложен в применении, применим только в условиях стационара, опасность возникновения инфекционных осложнений в связи с многочисленными манипуляциями после введения иглы.
Известен ряд методов диагностики асептического некроза костной ткани путем определения различных биохимических показателей. Например, известен иммуноферментный способ диагностики компенсаторных возможностей организма у больных с асептическим некрозом головки бедренной кости и кистовидной перестройкой суставных концов (пат. РФ 2233450). Сущность способа состоит в том, что в сыворотке крови, взятой из периферической вены, определяют содержание аутоантител к коллагену 11 типа и при их значении 0,008 мг/мл компенсаторные возможности оценивают как высокие. Недостаток - расхождение тяжести клинического состояния больных и рентгенологических изменений в суставе достигает 60-70%.
Наиболее близким техническим решением является способ томографического исследования тазобедренных суставов путем получения сканограмм в различных плоскостях, например в фронтальной и аксиальной (пат. РФ 2209593).
Недостаток способа по прототипу - определяют только центр смещения головки бедра пораженного сустава.
Цель предлагаемого изобретения - создание наименее затратного и наиболее информативного скринингового способа выявления асептического некроза в концевых отделах суставных концов костей для определения необходимости и объема дальнейшего комплексного обследования.
Поставленная цель достигается за счет применения скринингового способа выявления асептического некроза в концевых отделах суставных концов костей, составляющих суставы, включающего оценку данных магнитно-резонансной томографии путем получения измененных костных структур в различных плоскостях на уровне предположительных изменений. При этом исследования проводят в коронарной, саггитальной и аксиальной плоскостях и используют магнитно-резонансный модифицированный протокол T1FFE/M последовательности.
Скрининговый способ выявления патологических изменений (асептического некроза) в концевых отделах суставных концов костей составляющих суставы (напр. - головки и мыщелки бедренных и большеберцовых костей и т.п.) включает оценку данных магнитно-резонансной томографии путем получения T1FFE/M взвешенного изображения (ВИ) в стандартных и общепринятых коронарной, саггитальной и аксиальной плоскостях на уровне предположительно измененных костных структур.
Пример реализации способа.
Для получения специальных скрининговых томограмм пациент укладывается на стол МРТ в стандартном положении с применением спинального антенного комплекса. Проводится исследование суставов по модифицированному (по отношению к стандартному) протоколу прицельного исследования со следующими характеристиками: ТЕ - 3,8, TR - 22, ECHO - 1/1, TSE - 3, NSA - 3, angl - 45°, матрица - 256, срез 5,0 мм, расстояние между срезами - 1,0 мм, число пакетов 3, число срезов в пакетах по 5-8, в зависимости от объема исследования.
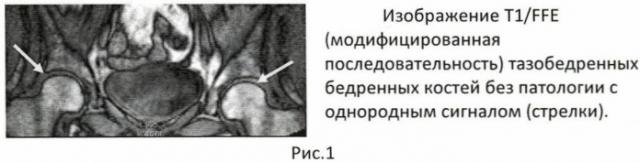
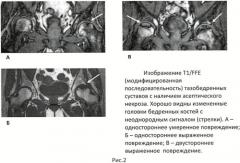
Применение специального скринингового протокола исследования обусловлено быстротой диагностической процедуры (время исследования - от 25 до 40 секунд, что в 20-30 раз меньше стандартных методов МР исследования), практически 100% диагностической верификацией наличия асептического некроза костной ткани суставных концов костей в любой стадии процесса (ишемия - отек - некроз - компактизация субхондральной области). Полученные изображения характеризуются высококонтрастными очаговыми изменениями в костной ткани по отношению к непораженным участкам (Рис.1, Рис.2 А, Б, В).
После визуального исследования полученных изображений выявляется необходимость проведения дополнительного пакета томограмм в стандартных проекциях и последовательностях для уточнения характера поражения костной ткани в области исследования.
Таким образом, результаты исследований показывают, что предлагаемый способ обследования пациентов в доклинической и дорентгенологической стадиях асептического некроза наименее затратный и наиболее информативный из существующих в настоящее время в клинической практике.
Скрининговый способ выявления асептического некроза в суставных концах костей, составляющих крупные суставы, включающий оценку данных магнитно-резонансной томографии путем получения измененных костных структур в различных плоскостях на уровне предположительных изменений, отличающийся тем, что исследования проводят в коронарной, саггитальной и аксиальной плоскостях и используют магнитно-резонансный модифицированный протокол T1FFE/M последовательности со следующими характеристиками: ТЕ - 3,8, TR - 22, ECHO - 1/1, TSE - 3, NSA - 3, ang1 - 45°, матрица - 256, срез 5,0 мм, расстояние между срезами - 1,0 мм, число пакетов 3, число срезов в пакетах по 5-8 в зависимости от объема исследования.