Хирургическое волокно, способ его получения и изделия из него
Иллюстрации
Показать всеИзобретение относится к медицине. Описаны длительно сохраняющие высокие прочностные свойства биоразрушаемые и биосовметимые моножильные волокна и сетчатые эндопротезы из них. Описано хирургическое волокно на основе биоразрушаемого полимера с абсолютной прочностью не менее 306 МПа, состоящее из сополимера 3-гидроксибутирата и 3-гидроксивалериата и содержащее 3-гидроксивалериат в количестве от 5 до 95 моль %. Сополимер имеет молекулярную массу не менее 600 кДа. Сополимер имеет степень кристалличности не более 60%. Описан способ получения медицинского шовного волокна, включающий плавление сополимера 3-гидроксибутирата и 3-гидроксивалериата, экструдирование и ориентирование моножильного волокона. Техническим результатом изобретения является получение хирургического волокна различного диаметра с высокими показателями прочности, длительно сохраняющего целостность и прочность при имплантации в организм и пригодного для использования в качестве хирургических шовных нитей и хирургических сетчатых эндопротезов. 3 н. и 5 з.п. ф-лы, 8 ил.
Реферат
Изобретение относится к медицине и медицинской технике, а именно к длительно сохраняющим высокие прочностные свойства биоразрушаемым и биосовметимым моножильным волокнам (тонким непряденым нитям искусственного происхождения) и сетчатым медицинским эндопротезам из них.
В современной практике хирургические нити, в основном, изготавливаются из природных или синтетических полимерных материалов и подразделяются на деградируемые и не деградируемые, монофиламентные и многофиламентные (крученые). Недеградируемые шовные нити получают из синтетических полимеров: полипропилена (марки «Prolene», «Sirgilene», «Deklene»), полиамидов («Sirgilin», «Dermalon», «Nylon 66», «Полиамид 6»), галогенсодержащих полимеров («Gore-Tex», «FUMALEN®"), используют их для формирования глубоко расположенного хирургического шва, такие нити пожизненно остаются в организме, покрываясь фиброзной капсулой [Буянов В.М., Егиев В.Н., Удотов О.А. Хирургический шов. М., 1993. Воробьев Г.И. 50 лекций по хирургии (под ред. B.C.Савельева). - М. - 2003. Егиев В.Н. Шовный материал (лекция)// Хирургия. - 1998. - №3. - С.33-38].
Биодеградируемые хирургические нити должны надежно удерживать операционные швы и иметь достаточную эластичность, постепенно резорбироваться со скоростью, адекватной кинетике восстановления тканей, продукты деструкции материала должны легко элиминировать из зоны имплантации, быть абсолютно безвредными для организма и не вызывать негативных реакций как со стороны окружающих тканей, так и организма в целом. Многофиламентные (крученые) нити из резорбируемых синтетических полиэфиров гликолевой кислоты (типа «Dexon»), сополимеров гликолевой и молочной кислот (типа «Vicryl») достаточно быстро теряют прочность (на 50% через 14 суток, на 80% - в течение 21 суток, при полном рассасывании - 60-80 суток), поэтому они не рекомендованы для случаев, когда необходима длительная аппроксимация тканей. Крученые нити недостаточно эластичны, без дополнительного специализированного покрытия имеют шероховатую поверхность, травмирующую ткани (т.е имеют «фитильные» свойства и могут вызывать развитие «пилящего эффекта» в тканях).
Монофиламентные нити имеют гладкую поверхность, это улучшает скольжение нити в тканях и ослабляет «распиливающий» эффект. Нити из сополимеров гликолевой кислоты и триметилкарбоната («Maxon») и полидиоксанона («PDS») имеют более длительный срок функционирования (за месяц происходит потеря прочности на 30-50%), но их использование требует применения узла сложной конфигурации (не менее 3 узлов), что увеличивает количество имплантируемого в ткани инородного материала. При использовании нитей из полимолочной и полигликолевой кислот и их сополимеров происходит закисление тканей вследствие высвобождения при гидролизе в жидкой среде мономеров, сопровождающееся воспалительной и аллергической реакциями на продукты деструкции этих полимеров.
Новый класс биоразрушаемых и биосовместимых полиэфиров - полигидроксиалканоаты (ПГА)-линейные термопластичные, биорезорбируемые и биосовметимые полимеры микробиологического происхождения. Физико-химические свойства ПГА в зависимости от химической структуры значительно варьируются, полное разрушение изделий из ПГА в организме происходит от нескольких месяцев до 1-2 лет, в зависимости от молекулярной массы полимера, геометрии и способа получения изделия, места имплантации. Высокая биосовместимость ПГА базируется на том, что продукт деструкции - гидроксимасляная кислота - естественный метаболит клеток и тканей, ее концентрация у взрослых организмов в норме составляет 3-10 мг на 100 мл крови [Hocking and Marchessault, 1994]. Соли гидроксимасляной кислоты используются как терапевтическое средство для лечения болезненных состояний, опосредованных свободными радикалами, токсическими агентами и генетическими дефектами [патент США №224227].
Наиболее изученными и распространенными типами ПГА являются 3-полигидроксибутират (3-ПГБ) и сополимер 3-полигидроксибутират/3-полигидроксивалериат (3-ПГБ/3-ПГВ), способы получения которых хорошо освоены и которые пригодны для получения монофиламентных нитей, в том числе из расплава полимера. Однако ПГА не кристаллизуются упорядоченно и содержат аморфную фазу, из которой нити не могут быть вытянуты. Для правильного процесса кристаллизации ПГА необходимо строго контролировать время и температуру процесса для дальнейшего проведения ориентирования нитей с целью придания им прочности и необходимых физико-механических свойств.
Известны монофиламентные нити, получаемые экструдированием из расплава гомополимера 3-ПГБ [Yamane H., Теrаo К., Hiki S. et al. Processing melt spun Polyhydroxybutyrate Fibers // Polymer. - 2001a. - V.42. - P.3241-3249].
Известны биоразрушаемые нити, также получаемые экструдированием из расплава гомополимера 3-ПГБ [Yamane Н., Теrаo К., Hiki S., et al. Enzymatic degradation of bacterial homo-poly(3-hydroxybutyrate) melt spun fibers // Polymer. - 2001b. - V.42. - P.7873-7878]. Нити в зависимости от условий экструдирования и ориентирования имеют удовлетворительную прочность.
Общий недостаток вышеуказанных нитей - быстрая кристаллизация 3-ПГБ и образование крупных сферолитов, что дает шероховатость поверхности, которая более доступна ферментативной атаке, поэтому имеет место быстрая потеря прочности нитей при взаимодействии с ферментами.
В целом, гомополимер 3-ПГБ обладает высокой биологической совместимостью, деградирует в биологических средах и может быть использован для получения нитей. Однако его высокая кристалличность требует введение технологических добавок из-за трудностей при переработке этого полимера в изделия, для которых характерна хрупкость и низкая ударная прочность.
Высокая кристалличность 3-ПГБ устраняется в случае применения сополимера 3-гидроксибутирата с 3-гидрокисвалератом, где роль пластификатора выполняет фракция 3-гидроксивалерата, которая делает полимер более пластичным и повышает прочность изделий.
Известны моножильные волокна и крученые мультинити, а также плетеные изделия из них. Волокно получают из расплава 4-гидроксибутирата с показателями степени кристалличности (60-80%), со значением средневесовой молекулярной массы (Мв) 575 кДа (а также расплава сополимеров 4-ПГБ с гликолатом) на одношнековом экструдере при формовании через 4 зоны экструдера со следующими температурами: 140, 190, 200 и 205°C с последующим многократным ориентированием [Martin et al. Patent US №2004234576]. Далее волокно перед ориентированием, из-за липкости, обрабатывают Goulston, Lurol PT-6A, который растворяют в изопропаноле (10% об./об.) и этим раствором волокна смазывают перед подачей на вальцы для 6-11-кратного ориентирования. В зависимости от процедуры экструдирования и последующего ориентирования получаемые моножильные волокна имеют разрывную прочность свыше 126 МПа и длительно сохраняют свои свойства (потеря Мв за 26 недель имплантации составляет 43% от исходной, при сохранении до 80% разрывной прочности).
Недостатки данного способа, моножильных волокон и изделий из них заключаются в том, что для получения волокон применяют малораспространенный тип ПГА, который синтезируют генетически модифицированным штаммом-продуцентом на дорогостоящем углеродном субстрате - натриевой соли 4-гидроксимасляной кислоты, а получаемые при этом волокна не достаточно прочны из-за высокой степени кристалличности (60-80%).
Известны биоразрушаемые моно- и мульфиламентные нити, получаемые прядением из расплавов сополимеров 3-ПГБ/3-ПГВ с невысоким включением 3-гидроксивалерата - 6 мол.% с молекулярной массой 750 кДа, которые получают экструзией расплава полимера, смешивают его с нуклеирующим агентом нитридом бора и пластификатором триацетином [Mochizuki et al., Japanese Patent №06264306, 1994].
Недостаток - необходимость использования технологических добавок для получения нитей.
Известны биоразрушаемые нити, получаемые из сополимера 3-ПГБ/3-ПГВ также с невысоким включением 3-гидроксивалерата - 12 мол.% и невысоким значением молекулярной массы (Мв) 200 кДа; нити получают экструзией расплава сополимера в смеси с полибутиленсукцинатом или полиэтиленсукционатом в соотношении 1:1 [Yamada et al. Japanese Patent №07-324227, 1995), при варьировании условий формования из расплава и последующего многоступенчатого ориентирования нити имеют ударную прочность по Изоду 2-4 Дж/дм.
Недостаток заключается в необходимости использования технологических добавок для получения нитей.
Наиболее близкими по технической сущности и достигаемому результату являются волокно и способ его получения из сополимера 3-ПГБ/3-ПГВ с включение 3-гидроксивалерата 10, 15 и 21 мол.%, со средневесовой молекулярной массой не выше 300 кДа, а именно 300, 280 и 240 кДа, соотвесттвенно, полученные экструзией из расплава [Гордеев, Шишацкая, Волова. Перспектвиные материалы. - 2005, №3. С.50-54, (прототип)]. С учетом температуры плавления образца, которая зависела от величины включения 3-ГВ, режимы экструзии составили для образца с включением 3-ГВ 10 мол.% 155-158-160-162-165°С, при 3-ГВ 15 мол.% 150-155-157-160-162°С, при 3-ГВ 21 мол.% 142-144-148-152-155°С. Давление на фильере поддерживали 35-40 атм. Температура приемной ванны составила не выше 18-20°С при скорости приемки экструдатов не выше 25-30 м/мин. Свежесформованное волокно подвергали ориентированию в течение 5-7 минут сразу после экструдирования, ориентирование проводили в диапазоне температур 80-100°С, при кратности вытягивания 7-8. Изменение температуры ниже или выше обозначенных значений не позволяло получать прочные волокна. Получены моножильные волокна с диаметром 0,17-0,20 мм, с гладкой однородной поверхностью, имеющие следующие характеристики: абсолютная прочность от 254 до 306 МПа, модуль упругости от 2,1 до 3,0 ГПа, удлинение при разрыве от 24,1 до 32,4%. В ходе отработки описываемого способа было показано, что в отличие от температуры в начальных зонах экструдера, существенное влияние на стабильность экструзии полимерного расплава оказывает температура в конце экструдера и на фильере при оптимуме давления на фильере 35-40 атм, при температуре приемной ванны 18-20°С и скорости приемки не свыше 25-30 м/мин, ее общая протяженность должна быть не менее 5 м, при повышении температуры до 50-60°С длину ванны можно сократить, но это вызывает слипание волокон.
Недостатки прототипа заключаются в том, что диаметр получаемых моножильных волокон имеет узкий диапазон от 0,17 до 0,20 мм, невозможно получить прочные моножильные волокна диаметром свыше 0,2 мм, невозможно увеличить скорость приемки экструдатов и температуру приемной ванны из-за склеивания волокон в процессе формования и необходимо применение приемной ванны длиной не менее 5 м, что не технологично.
Техническим результатом, достигаемым при осуществлении изобретения, является получение хирургического волокна различного диаметра с высокими показателями прочности, длительно сохраняющего целостность и прочность при имплантации в организм, полученное технологичным способом и пригодного для использования в качестве хирургических шовных нитей и хирургических сетчатых эндопротезов.
Технический результат достигается тем, что в хирургическом волокне на основе биоразрушаемого полимера с абсолютной прочностью не менее 306 МПа, состоящего из сополимера 3-гидроксибутирата и 3-гидроксивалериата, новым является то, что сополимер содержит 3-гидроксивалериат в количестве от 5 до 95 моль %, имеет молекулярную массу не менее 600 кДа и степень кристалличности не более 60%.
Моножильное волокно сополимера имеет диаметр 0,1-0,4 мм. Моножильное волокно сополимера имеет разрывное удлинение ниже 30%. Моножильное волокно сополимера имеет модуль упругости не менее 3,9 ГПа. Молекулярная масса хирургического волокна уменьшается не более чем на 20% после имплантации в течении 6 месяцев. Масса хирургического волокна уменьшается менее чем на 30% после имплантации в течении 6 месяцев.
Технический результат достигается также тем, что в способе получения хирургического волокна по п.1, включающем плавление сополимера 3-гидроксибутирата и 3-гидроксивалериата, экструдирование и ориентирование моножильного волокона, новым является то, что сополимер предварительно подвергают гранулированию, а затем плавят и экструдируют при температуре 145-168°С, при скорости приемки 30-38 м/мин и температуре приемной ванны 40-80°С, с обработкой волокна перед ориентированием замасливателем, а ориентирование проводят при температуре 60-140°С сразу же после экструдирования или после предварительного охлаждения и последующего нагревания до температуры ниже температуры плавления сополимера.
Технический результат достигается также и изделием, таким как хирургические шовные нити или хирургические сетчатые эндопротезы из хирургического волокна на основе биоразрушаемого полимера с абсолютной прочностью не менее 306 МПа, состоящего из сополимера 3-гидроксибутирата и 3-гидроксивалериата с включением 3-гидроксивалериата от 5 до 95 моль %, с молекулярной массой не менее 600 кДа и степенью кристалличности не более 60%.
Технический результат основывается на выполненной оптимизации параметров экструдирования и ориентирования, что заключается в строго заданных параметрах температуры экструдирования по зонам экструдера, исходя из химического состава выбранного типа ПГА (сополимера 3-ПГБ/3-ПГВ), с широким диапазоном соотношения мономеров и вытекающих из этого физических характеристик полимера, прежде всего, в повышенной молекулярной массе и пониженной степени кристалличности, а введение замасливателя для защиты нитей предотвращает расслоение, слипание и закручивание нитей на барабане.
Заявляемая группа изобретений соответствует требованию единства изобретения, поскольку группа разнообъектных изобретений образует единый изобретательский замысел, причем один из заявляемых объектов - способ получения хирургического волокна, предназначен для получения других заявленных объектов - хирургического волокна и изделий из него, при этом все объекты группы изобретений направлены на достижение одного и того же технического результата.
Сопоставительный анализ с прототипом позволил выявить совокупность существенных по отношению к техническому результату отличительных признаков для каждого из заявляемых объектов группы, изложенных в формулах. Заявляемая группа изобретений отличается использованием специально подобранных образцов ПГА-сополимера 3-ПГБ/3-ПГВ с варьированием соотношения мономеров в широких пределах от 5 до 95 моль%, с молекулярной массой не менее 600 кДа, имеющих более низкие по сравнению с образцами 3-ПГБ/3-ПГВ в прототипе значениями степени кристалличности (не более 60%) и более высокую молекулярную массу (Мв свыше 600 кДа), с предварительным гранулированием сополимера перед плавлением и экструдированием расплава и обработкой волокна перед ориентированием замасливателем.
Следовательно, каждый из объектов группы изобретений соответствует критерию «новизна». Признаки, отличающие заявляемые технические решения от прототипа, не выявлены в других технических решениях при изучении данных и смежных областей техники и, следовательно, обеспечивают заявляемым решениям соответствие критерию «изобретательский уровень».
Сущность изобретения поясняется чертежами.
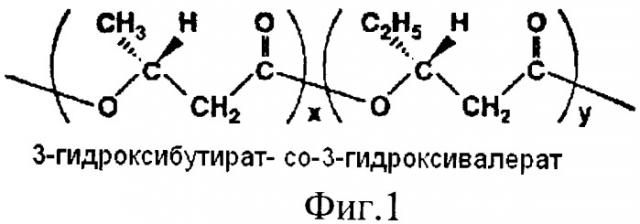
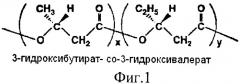
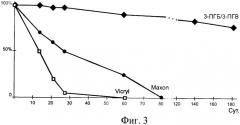
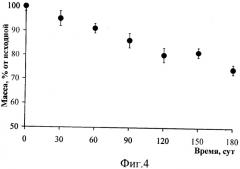
На фиг.1 дана структурная формула сополимера 3-гидркосибутирата-3-гидрокси валериата (3-ПГБ/3-ПГВ). На фиг.2 (а) представлен внешний вид хирургических шовных нитей, полученных экструзией из расплава 3-ПГБ/3-ПГВ, диаметром 0.1 мм и изделий из них: (б) - сетчатый стент); (в, г) - сетчатые эндопротезы. На фиг.3 дана динамика изменения разрывной прочности хирургических шовных нитей из сополимера 3-ПГБ/3-ПГВ по сравнению с коммерческими нитями при имплантации (в % от исходных значений). На фиг.4 представлена динамика изменения массы хирургических шовных нитей, полученных из сополимера 3-ПГБ/3-ПГВ (в % от исходных значений) в ходе имплантации. На фиг.5 показаны хроматограммы распределения молекулярных масс у образцов хирургических шовных нитей из 3-ПГБ/3-ПГВ: 1 - исходные, 2 и 3 - после 120 и 180 суток после имплантации. На фиг.6 представлены РЭМ снимки хирургических шовных нитей из 3-ПГБ/3-ПГВ, имплантированных животным. Маркер 30 мкм. На фиг.7 даны гистологические срезы фрагментов мышечной ткани с имплантированными хирургическими шовными нитями из 3-ПГБ/3-ПГВ. Окраска гематоксилин-эозин. Маркер 0.01 мм. На фиг.8 представлены РЭМ снимки имплантированных хирургических шовных нитей из 3-ПГБ/3-ПГВ: а - нить в районе хирургического узла, 14 суток после имплантации, маркер 100 мкм, б - фрагмент мышечной ткани с имплантированными нитями, 120 суток после имплантации, маркер 200 мкм, в - ультратонкий срез имплантированной нити, 180 суток после имплантации, маркер 30 мкм.
Для получения заявляемого хирургического волокна используют сополимер 3-ПГБ/3-ПГВ, полученный согласно Техническим условиям на сополимер (ТУ №2200-001-03533441-2004 рег. 14.12.2005 №068/003058) на опытном производстве Института биофизики СО РАН (Гигиенический сертификат соответствия Главной санитарной службы РФ соответствия условий производству материалов для медицины №2449.05.000.М.007682.01.05 от 24.01.2005 г.), синтезированный природным штаммом Ralstonia eutropha B5786 на одном из углеродных субстратов (СO2, или фруктоза, или ацетат натрия) [патент РФ №2053292], с различным включением гидроксивалерата (3-ГВ) от 5 до 95 мол.%. Значение средневесовой молекулярной массы (Мв) образцов сополимеров в зависимости от включения 3-ГВ, т.е. соотношения мономеров, составило от 680 до 1480 кДа, степень кристалличности (%) от 45 до 60%, температура плавления (Тпл) соответственно от 145 до 168°С, с разрывом температуры плавления и температуры термической деградации (Тдегр) не менее 80-100°С.
Хирургическое волокно получают экструзией из расплава сополимера 3-ПГБ/3-ПГВ, используя одношнековый экструдер с круглой фильерой (диаметр 1 мм) фирмы Брабендер (Германия). Режимы экструзии и температуру расплава задают в зависимости от соотношения мономеров. Давление на фильере поддерживают в диапазоне 35-40 атм. Температура приемной ванны 40-80°С при скорости приемки экструдатов, равной 30-38 м/мин. Свежесформованное волокно перед ориентированием для его укрепления и избежания склеивания обрабатывают замасливателем (типа СКБ-16 или ЗГВ-110), затем подвергают ориентированию сразу после экструдирования или после предварительного охлаждения экструдата и последующего нагревания до температуры ниже температуры плавления сополимера. Ориентирование волокна проводят вытягиванием на вальцах в диапазоне температур 60-140°С, кратность вытягивания в отдельных вариантах составляет 7-11. В результате получают моножильное ориентированное волокно диаметром от 0,1 до 0,4 мм, с гладкой однородной поверхностью, имеющее следующие характеристики: молекулярную массу не менее 600 кДа, абсолютную прочность не менее 379 МПа, модуль упругости не менее 3,9 ГПа, удлинение при разрыве ниже 30%.
ПРИМЕР 1
Хирургическое волокно получают экструзией из расплава сополимера 3-ПГБ/3-ПГВ (включение 3-ГВ 5 мол%) (фиг.1). Химический состав сополимера определяют на хроматомасс-спектрометре Agilent 5975Inert, фирмы Agilent (США) после предварительного метанолиза пробы полимера. Полимер синтезирован природным штаммом бактерий Ralstonia eutropha В 5786 [патент РФ №2053292] на ацетате натрия с добавками валерата калия в культуру согласно [патент РФ №2051968]. Рентгеноструктурный анализ и определение степени кристалличности сополимера осуществляют на рентгеноспектрометре D8 ADVANCE фирмы «Bruker» (Германия) (графитовый монохроматор на отраженном пучке), степень кристалличности (Сх) составила 60%. Молекулярную массу исходного сополимера и после экструдирования регистрируют системой гель-проникающей хроматографии «Waters Alliance GPC 2000 Series» фирмы «Waters» (США) с набором полистериновых стандартов (Sigma); средневесовая молекулярная масса полимера (Мв) составила 1218 кДа. Температуру плавления образца определяют на дериватографе СТА - STA 449 Jupiter фирмы NETZSCH (Германия), она составила 168°С. Перед плавлением полимер подвергают гранулированию с использованием гранулятора фирмы BRABENDER (Германия) при бесступенчатом регулировании скорости через компьютер при скорости вытяжки 20 м/мин, что позволяет получить экструдаты диаметром 3 мм, которые режут на фрагменты длиной 2,5-3,0 мм, т.е. полученный гранулят имеет размер 2,5-3,0×3,0 мм. На лабораторном автономном мини-экструдере Е 19/25 D фирмы Brabender® (Германия), оборудованном винтом 19/25 D, 1-й зоной нагрева и 2-мя зонами нагрева/охлаждения при подаче воздуха 200 л/мин при давлении 0.5 бар, с резьбовым кольцом 2 3/4, 8 N, диаметром вала 19 мм, длиной вала 25 дюймов, экструзионная головка диаметром 1 мм, выполняют плавление гранулята и экструдирование нитей. Параметры экструдирования: температура экструдирования по зонам 160-162-166-168-172°С, давление на фильере 37 атм, скорость приемки экструдатов 30 м/мин, температура приемной ванны 40°С, длина ванны 4 м. Свежесформованное волокно перед ориентированием для его укрепления и избежания склеивания обрабатывают, замасливателем типа СКБ или ЗГВ-110 затем ориентируют на вальцах при температуре 100°С в течение 5 минут. Получают моножильное ориентированное волокно диаметром 0,2 мм, с гладкой однородной поверхностью (фиг.2,а). Падение величины Мв сополимера после гранулирования, плавления и экструдирования не превышает 8-10% от исходной величины. Регистрацию механо-физических характеристик полученного волокна выполняют с использованием универсальной электромеханической разрывной машины Инстрон 5565, 5KN фирмы «Instron» (Великобритания). Волокно имеет следующие характеристики: разрывная прочность 396 МПа, модуль упругости 4,1 ГПа, удлинение при разрыве 22%. Перед затариванием и стерилизацией хирургическое волокно освобождают от остатков замасливателя.
ПРИМЕР 2
Хирургическое волокно получают экструзией из расплава сополимера 3-ПГБ/3-ПГВ (включение 3-ГВ 32 мол.%). Образец имел следующие характеристики: степень кристалличности 56%; Мв 818 кДа, Тпл 163°С (химический состав сополимера и физические характеристики определены аналогично Примеру 1). Экструзионное получение хирургического волокна выполнено аналогично Примеру 1 на лабораторном автономном мини-экструдере Е 19/25 D фирмы Brabender® (Германия). Параметры экструдирования: температура экструдирования по зонам 157-160-162-165-167°С, давление на фильере 36 атм, скорость приемки экструдата 32 м/мин, температура приемной ванны 40°С, длина ванны 3.5 м. Свежесформованное волокно после обработки замасливателем сразу подвергают ориентированию на вальцах при температуре 115°С в течение 6 минут. Получают моножильное ориентированное волокно диаметром от 0,1 мм, с гладкой однородной поверхностью. Полученное волокно имеет следующие характеристики: абсолютная прочность 386 МПа, модуль упругости 3,9 ГПа, удлинение при разрыве 24%. Перед затариванием и стерилизацией хирургическое волокно освобождают от остатков замасливателя.
ПРИМЕР 3
Хирургическое волокно получают экструзией из расплава сополимера 3-ПГБ/3-ПГВ (включение 3-ГВ 45 мол.%). Характеристики образца сополимера: степень кристалличности 58%, средневесовая молекулярная масса (Мв) 980 кДа, температура плавления 157°С. Экструдирование проводят аналогично Примеру 1 при давлении на фильере 35 атм, температуре экструдирования по зонам 154-156-158-160-164°С, скорости приемки экструдата 34 м/мин, температуре приемной ванны 50°С, длина ванны 3 м. Через 1,5 часа после обработки замасливателем проводят ориентирование волокна на вальцах при температура 95°С в течение 3 минут, которое далее охлаждают в приемной ванне до 65°C с последующим ориентированием в течение 2,5 мин при 105°С. Получают моножильное ориентированное волокно диаметром 0,3 мм, с гладкой однородной поверхностью, которое имеет следующие характеристики: абсолютная прочность 448 МПа, модуль упругости 4,2 ГПа, удлинение при разрыве 21%. Перед затариванием и стерилизацией хирургическое волокно освобождают от остатков замасливателя.
ПРИМЕР 4
Хирургическое волокно получают экструзией из расплава сополимера 3-ПГБ/3-ПГВ (включение 3-ГВ 95 мол.%). Характеристики образца сополимера: степень кристалличности 51%, средневесовая молекулярная масса (Мв) 680±45, температура плавления 153°С. Экструдирование проводят аналогично Примеру 1 при давлении на фильере 35 атм, температуре экструдирования по зонам 148-150-153-157-159°С, скорости приемки экстру дата 38 м/мин, температуре приемной ванны 80°С, длина ванны 3 м. Через 0,5 часа после обработки замасливателем проводят ориентирование волокна на вальцах при температура 115°С в течение 2,5 минут, далее волокно охлаждают в приемной ванне до 45°C с последующим ориентированием в течение 2,0 мин при 95°С. Получают моножильное ориентированное волокно диаметром 0,40 мм, с гладкой однородной поверхностью, имеющее следующие характеристики: абсолютная прочность 379 МПа, модуль упругости 4,4 ГПа, удлинение при разрыве 28%. Перед затариванием и стерилизацией нити освобождают от остатков замасливателя.
Изделия из хирургического волокна (хирургические шовные нити и хирургические сетчатые эндопротезы) обладают биосовместимостью, тромборезистивностью и антиспаечными свойствами, резистивностью к инфекциям, гибкостью и эластичностью и, в то же время, прочные, биологически инертны, не аллергичны, не вызывают воспаление и отторжение, не оказывают общетоксического действия на организм.
Хирургические шовные нити и хирургические сетчатые эндопротезы по санитарно-химическим и токсиколого-гигиеническим характеристикам соответствуют требованиям, предъявляемым к изделиям для медицины, контактирующим с внутренней средой организма, включая контакт с кровью, определяемые нормативной документацией (ISO 10993; ГОСТ Р ИСО 10993 «Оценка биологического действия медицинских изделий». ГОСТ 31214-2003 «Изделия медицинские. Требования к образцам и документации, представляемым на токсикологические, санитарно-химические испытания, испытания на стерильность и пирогенность».
Апробация изделий из хирургического волокна приведена в Примерах 5-6.
ПРИМЕР 5
Медико-биологические исследования биосовместимости и сохранения прочностных характеристик хирургических шовных нитей из 3-ПГБ/3ПГВ при имплантации проводились на кроликах. Стерильные хирургические шовные нити, полученные согласно Примеру 2, использовались для ушивания мышечно-фасциальных разрезов в эксперименте на кроликах. Протокол операции: экспериментальным 20-ти животным под ингаляционным наркозом (диэтиловый эфир) в асептических условиях производили разрез кожи на спине, далее производили разрез длиной мышцы спины и ее фасции длиной 4 см. На мышцу справа накладывали 6-8 одиночных узловых шва из хирургических шовных нитей из 3-ПГБ/ЗПГВ (общая длина 60-75 мм), кожу зашивали шелком. В группах сравнения (по 20 животных в каждой) использовали коммерческие нити «Vicryl» и «Mаxоn». Для изучения динамики биоразрушения и прочности нитей в шейную складку зашивали диффузионные камеры, в которые помещали отрезки нитей их 3-ПГБ/3-ПГВ и нитей сравнения. Наблюдение за состоянием швов и нитей и реакцией на них тканей осуществлялось в течение 6 мес. После выведения животных из эксперимента летальной дозой эфирного наркоза высекали фрагменты тканей с имплантированными нитями, оценивали состояние хирургических швов, состояние близлежащих тканей, а также характеристики нитей, извлеченных из диффузионных камер. Для этого, после очистки нитей от биологического материала, регистрировали остаточную массу нитей (весы фирмы Metler (США), 4-го класса точности), разрывную прочность и средневесовую молекулярную массу нитей (аналогично Примеру 1), состояние и структуру нитей анализировали электронно-микроскопическими исследованиями (электронный микроскоп FEI Company Quanta 200 с приставкой рентгеновского микроанализа EDAX с безазотным охлаждением GENESIS XM 2 60 - Imaging SEM with APOLLO 10 (США). Хирургические шовные нити из 3-ПГБ/3-ПГВ длительно сохраняют прочность (фиг.3), в течение 2-месячной экспозиции in vivo потеря разрывной прочности этих изделий не превысила 10% от исходной величины, коммерческие изделия, напротив, резко теряли прочность, у нитей «Vicryl» остаточная разрывная прочность через 4 недели не превысила 10% от исходной, у «Mаxоn» - порядка 50%, полная резорбция этих изделий зафиксирована соответственно через 60 и 80 суток. Разрывная прочность хирургических шовных нитей из 3-ПГБ/3-ПГВ к концу наблюдения (180 суток) была на уровне 80% от исходной. Потеря массы нитей происходила медленно (фиг.4) и составила на 180 сутки свыше 70% от исходной. Молекулярная масса хирургических шовных нитей из 3-ПГБ/3-ПГВ также снижалась незначительно (фиг.5), на представленных хроматограммах видно, что значения Мв у нитей после 120 и 180 суточной имплантации были близки к исходному показателю, падение Мв не превышало 15-20%. Подтверждением длительного сохранения высоких прочностных характеристик хирургических шовных нитей из 3-ПГБ/3-ПГВ служат электронно-микроскопические и гистологические исследования (фиг.6-8), на которых видно, что даже через 120 и 180 суток после имплантации состояние поверхности нитей и внутренней структуры практически не изменилось. Существенных дефектов на их поверхности не было отмечено, несмотря на достоверное уменьшение массы, биоразрушение нитей из 3-ПГБ/3-ПГВ in vivo происходит при постепенном разрушении поверхности без образования грубых локальных дефектов и резкой потери прочности. Хирургические шовные нити из 3-ПГБ/3-ПГВ обладают необходимой прочностью в течение всего периода заживления мышечно-фасциальных ран и превосходят по длительному сохранению прочности известные коммерческие шовные материалы. Реакция тканей на хирургические шовные нити из 3-ПГБ/3-ПГВ выражена в меньшей степени по сравнению с реакцией на коммерческие шовные изделия из полимолочной и полигликолевой кислот, при этом ответ тканей характеризуется типичной реакцией на инородное тело в виде непродолжительного асептического воспаления с макрофагальной стадией, приводящих к образованию негрубых фиброзных капсул вокруг нитей, которые спустя 4-6 месяцев подвергаются инволюции. Соединительно-тканные капсулы вокруг материалов сравнения подвержены инволюции в значительно меньшей степени, а ответная воспалительная реакция более выражена.
ПРИМЕР 6
Хирургические сетчатые эндопротезы, изготовленные из хирургического волокна, полученного по Примеру 2, диаметром 0.1 мм и разрывной прочностью 386 МПа представлены на фиг.2 (б, в, г). Толщина изделия на фиг.2 (б, в) - 0.45 мм, толщина изделия фиг.2 (г) - 0.28 мм, плотность петель от 22 до 30/см2, типоразрядный ряд: от 6×11 до 30×30 см, поверхностная плотность 45-140 г/см2.
Фрагмент стерильного сетчатого эндопротеза толщиной 0.45 мм (фиг.2, в) размером 1.5×1.5 см имплантировали наркотизированным половозрелым крысам линии Вистар (средней массой 230 г) разводки питомника Института цитологии и генетики СО РАН в боковые отделы брюшной стенки (на апоневроз). Общее число экспериментальных животных 24, по 6 - на каждую точку наблюдения (1, 2, 4, 8 недель после имплантации). Реакцию тканей и состоятельность сетчатого эндопротеза оценивали стандартной гистологической техникой. Для этого отбирали фрагменты тканей в месте имплантирования нитей, материал фиксировали в 10-ти % формалине и заключали в парафин, из блоков готовили срезы толщиной 5-10 мкм и анализировали с использованием Image Analysis System «Carl Zeis» (Германия), оценивали силу и длительность воспаления, динамику прорастания эндопротеза соединительнотканной капсулой и ее клеточный состав. Негативных осложнений в виде гнойного воспаления, смещения протеза, выраженного спаечного процесса не отмечено на всех сроках наблюдения. Спустя 1 неделю в месте имплантации сетчатого эндопротеза отмечены единичные макрофаги и лейкоциты в поле зрения, то есть остаточные явления незначительно выраженной асептической воспалительной реакции, в месте контакта элементов сетчатого эндопротеза с тканями отмечено формирование нежной грануляционной ткани с признаками васкулиризации. Спустя 2 недели в месте имплантации сетчатого эндопротеза отмечено формирование соединительной ткани богатой коллагеновыми волокнами и хорошо васкулиризированной. Спустя 4 недели после имплантации зафиксировано прорастание протеза соединительной тканью на 60%, встречаются вытянутые фибробласты, в межклеточном веществе отмечены коллагеновые волокна, как показатель созревания соединительной ткани. В конце наблюдения (8 недель) зафиксирована зрелая соединительная ткань, образующая прочную соединительно тканную капсулу вокруг имплантата, в капсуле - сформированные коллагеновые волокна с примыкающими зрелыми фиброцитами, неблагоприятных проявлений не выявлено. После освобождения эндопротеза от остатков биологического материала определена его масса, которая составила 90% от исходной величины, достоверное падение молекулярной массы полимера при этом (Мв) не превысило 8% от исходной величины.
Хирургические сетчатые эндопротезы характеризуются хорошей моделируемостью, удобны в работе, устойчивы к микробной контаминации, высокой прочностью, длительно сохраняющейся во времени, предназначены для пластики мягких тканей, хирургического лечения грыж различной этиологии. Вследствие биодеградации при имплантации в организм могут быть использованы в педиатрии, т.к. не препятствует растяжению тканей в процессе роста детей.
Хирургическое волокно и изделия из него биосовместимы, биологически инертны, резистентны к инфекции в результате высокой гидрофобности поверхности, не вызывают сенсибилизации и аллергической реакции организма, воспаления и отторжения тканей при контакте с ними, атравматичны, механически прочные, стерилизуются общепринятыми термическими, физическими и химическими методами практически без потери прочности, удобны при хирургических манипуляциях, длительно сохраняют свои свойства, не требуя специальных условий [Волова Т.Г., Севастьянов В.И., Шишацкая Е.И. «Полиоксиалканоаты - биоразрушаемые полимеры для медицины. / Под ред. академика В.И.Шумакова. - Красноярск: изд-во «Группа компаний Платина», 2006]. Хирургическое волокно и изделия из него могут применяться для реконструкции внутренних органов и тканей в качестве хирургических шовных нитей для ушивания мышечно-фасциальных и кожных ран, наложения различных анастомозов, ушивания серозных оболочек, хрящей, сухожилий и связок, нервной ткани, для изготовления сеток, стентов, оплеток, тканых и нетканых хирургических изделий и устройств для общей хирургии (лечения грыж, опущения органов малого таза), кардиохирургии (восстановление целостности перикарда). В качестве аналога перикарда, элементов сердечно-сосудистой системы, а также сосудистые фистулы и в качестве матрикса для клеточной и тканевой инженерии.
Хирургическое волокно и хирургические изделия из него не подвержены гидролизу в жидких средах и разрушаются в организме в результате истинной биологической резорбции под воздействием ферментов крови и тканей, а также клеток макрофагального ряда с образованием масляной кислоты (и/или валериановой, гексановой и других алкановых кислот) без резкого закисления тканей, что имеет место при использовании изделий из полимолочной и полигликолевой кислот.
1. Хирургическое волокно на основе биоразрушаемого полимера с абсолютной прочностью не менее 306 МПа, состоящего из сополимера 3-гидроксибутирата и 3-гидроксивалериата, отличающееся тем, что сополимер содержит 3-гидроксивалериат в количестве от 5 до 95 моль %, имеет молекулярную массу не менее 600 кДа и степень кристалличности не более 60%.
2. Хирургическое волокно по п.1, отличающееся тем, что волокно сополимера моножильное и имеет диаметр 0,1-0,4 мм.
3. Хирургическое волокно по п.1, отличающееся тем, что волокно сополимера моножильное и имеет разрывное удлинение ниже 30%.
4. Хирургическое волокно по п.1, отличающееся тем, что волокно сополимера моножильное и имеет модуль упругости не менее 3,9 ГПа.
5. Хирургическое волокно по п.1, отличающееся тем, что молекулярная масса хирургического волокна уменьшается не более чем на 20% после имплантации в течение 6 месяцев.
6. Хирургическое волокно по п.1, отличающееся тем, что масса хирургического волокна уменьшается менее, чем на 30% после имплантации в течение 6 месяцев.
7. Способ получения хирургического волокна по п.1, включающий плавление сополимера 3-гидроксибутирата и 3-гидроксивалериата, экструдирование и ориентирование моножильного волокона, отличающийся тем, что сополимер предварительно подвергают гранулированию, а затем плавят и экструдируют при температуре 145-168°С, при