Катализатор и способ риформинга кислородсодержащих соединений
Иллюстрации
Показать всеИзобретение относится к области химии. Катализатор реформинга в водной фазе включает: а) углеродный носитель, включающий углерод, модифированный титаном, ванадием, вольфрамом или рением, и каталитическую композицию, прикрепленную к углеродному носителю. Каталитическая композиция включает Re и второй металл, выбранный из группы, состоящей из Ir, Ni, Pd, Pt, Rh и Ru, и Ce или La, прикрепленный к углеродному носителю или каталитической композиции. Для реформинга кислородсодержащих углеводородов приводят в контакт сырьевой раствор, включающий воду и по меньшей мере 20 мас.% в расчете на общую массу сырьевого раствора кислородсодержащего углеводорода с катализатором реформинга при условиях температуры реакции и давлении реакции, эффективных для получения газообразного водорода и алканов, имеющих от 1 до 8 атомов углерода. Кислородсодержащий углеводород имеет по меньшей мере один атом кислорода. Катализатор реформинга включает рений и по меньшей мере один переходный металл Группы VIII на водостойком носителе. Изобретения позволяют повысить эффективность процесса реформинга кислородсодержащих углеводородов. 2 н. и 5 з.п. ф-лы, 8 табл., 5 ил.
Реферат
Данное изобретение было выполнено при поддержке правительства Соединенных Штатов, оказанной присуждением DOC NIST ANP Grant No 70NANB3H3014 и DOE Grant No DE-FG36-04GO14258. Соединенные Штаты имеют определенные права на это изобретение.
Настоящее изобретение направлено на катализаторы и способы реформинга кислородсодержащих соединений, в том числе соединений, полученных из биомассы, с образованием таких продуктов, как водород или алканы путем процессов реформинга, таких как реформинг в водной фазе. Описанные здесь катализаторы и способы можно использовать, например, для преобразования водных растворов глицерина, сахарных спиртов, сахаров или многоатомных спиртов, таких как этиленгликоль и пропиленгликоль, так же как и гидрокарбоновых кислот.
Существует конечное количество невозобновляемых ископаемых топлив, таких как сырая нефть и природный газ, которые в настоящее время используют для производства энергии. Биомасса (материал, полученный из растений) является одним из наиболее важных возобновляемых энергетических ресурсов. Преобразование биомассы в топливо, химикаты, материалы и энергию уменьшает зависимость от иностранной нефти и природного газа. В настоящее время биомасса представляет единственную возобновляемую альтернативу для жидкого транспортного топлива. Использование биомассы усиливает экономику сельского хозяйства, уменьшает зависимость Америки от импортируемой нефти, уменьшает загрязнение воздуха и воды и уменьшает выделение парниковых газов.
Ключевой проблемой для продвижения и поддержания жизнеспособности и роста промышленного сектора является развитие эффективных и экологичных технологий для производства топлива, такого как водород, из возобновляемых ресурсов. Производство энергии из возобновляемых ресурсов, таких как биомасса, уменьшает чистый коэффициент производства диоксида углерода, важного парникового газа, который вносит вклад в глобальное потепление. Это вызвано тем, что биомасса сама по себе потребляет диоксид углерода в течение ее жизненного цикла.
Реформинг в водной фазе (РВФ) является способом каталитического реформинга, который вырабатывает топливо, богатое водородом, из кислородсодержащих соединений, полученных из биомассы (глицерин, сахара, сахарные спирты). Получаемый топливный газ можно использовать в качестве источника топлива для производства электричества посредством топливных элементов с полимерной электролитной мембраной (ПЭМ), твердооксидных топливных элементов, генераторной установки с двигателем внутреннего сгорания или газотурбинной генераторной установки. При помощи способов РВФ можно вырабатывать легкие углеводороды (например, метан, этан, пропан, бутан и гексан) и/или водород путем реакции кислородсодержащих соединений с жидкой водой при низких температурах (например, менее 300°С). Важным достижением способа РВФ является то, что реформинг можно осуществлять в жидкой фазе. Способ РВФ может протекать при температурах (например, от 150°С до 270°С), когда реакция сдвига равновесия в водяном газе («реакция сдвига», shift reaction) является предпочтительной, делая возможной выработку водорода с низким количеством СО в одном химическом реакторе. Преимущества способа РВФ включают: (1) выполнение реакции при давлениях (обычно от 1,5 до 5 МПа (от 15 до 50 бар)), при которых богатый водородом поток можно эффективно очистить; (2) выработку богатого водородом топливного газа при низких температурах без необходимости испарять воду, что представляет большую экономию энергии; (3) работу при температурах, при которых «реакция сдвига» является предпочтительной, делая возможной выработку высококачественного газового топлива с низким количеством СО в одном химическом реакторе; (4) работу при температурах, которые сводят к минимуму нежелательные реакции разложения, обычно возникающие, когда углеводы нагревают до повышенных температур и (5) использование полученного из сельского хозяйства источника сырья, найденного в Соединенных Штатах.
Способ РВФ реализует преимущество термодинамических свойств кислородсодержащих соединений, содержащих С:О со стехиометрическим отношением 1:1, для выработки водорода из этих кислородсодержащих соединений при относительно низких температурах в одну реакционную стадию (см. Фиг.1), в противоположность определенным многореакторным системам, используемым для получения водорода посредством парового реформинга углеводородов. Фиг.1 создан на основе термодинамических данных, полученных из Chemical Properties Handbook, С.L.Yaws, McGraw Hill, 1999.
Условия реакции для получения водорода из углеводородов могут диктоваться термодинамикой для парового реформинга алканов с образованием СО и Н2 (реакция 1) и «реакцией сдвига» с образованием СО2 и Н2 из СО (реакция 2).
На Фиг.1 показаны изменения стандартной свободной энергии Гиббса (ΔG°/RT), в связи с реакцией 1 для ряда алканов (СН4, С2Н6, С3Н8, C6H14), нормированной на моль полученного СО. Паровой реформинг алканов является термодинамически предпочтительным (то есть имеет отрицательные значения величины ΔG°/RT) при температурах выше примерно 675 К. Кислородсодержащие углеводороды, имеющие отношение С:O, равное 1:1, производят СО и Н2 согласно реакции 3.
Существенные кислородсодержащие углеводороды, имеющие отношение С:O, равное 1:1, включают метанол (СН3ОН), этиленгликоль (С2Н4(ОН)2), глицерин (С3Н5(ОН)3) и сорбитол (С6Н8(ОН)6). На Фиг.1 пунктирные линии показывают значения In(P) для давлений паров СН3ОН, С2Н4(ОН)2, С3Н5(ОН)3 и С6Н8(ОН)6 в зависимости от температуры (давление выражено в атмосферах). На Фиг.1 показано, что паровой реформинг этих кислородсодержащих углеводородов с получением СО и Н2 может быть термодинамически предпочтителен при значительно более низких температурах, чем температуры, которые требуются для алканов с аналогичным количеством атомов углерода. Соответственно, паровой реформинг кислородсодержащих углеводородов, имеющих отношение С:O, равное 1:1, мог бы предоставить низкотемпературный технологический маршрут для образования СО и Н2. На Фиг.1 также показано, что значение ΔG°/RT для сдвига равновесия водяного газа от СО к СO2 и Н2 является более предпочтительным при более низких температурах. Поэтому возможно получить Н2 и СO2 из парового реформинга кислородсодержащих соединений, используя одностадийный каталитический способ, так как «реакция сдвига» является предпочтительной при таких же низких температурах, когда возможен паровой реформинг углеводов.
Хотя на Фиг.1 показано, что конверсия кислородсодержащих соединений в присутствии воды в Н2 и СО2 является весьма предпочтительной при этой низкой температуре, последующая реакция Н2 и СО2 с образованием алканов (СnН2n+2) и воды является также весьма предпочтительной при низких температурах. Например, постоянная равновесия при 500 К для конверсии СO2 и Н2 в метан (реакция 4) составляет порядка 1010 на моль СO2.
Реакция реформинга может быть оптимизирована не только по выходу водорода, но и по выходу углеводородов. Например, полный реформинг сорбитола дает 13 молей водорода на каждые 6 молей выделяемого СO2:
Однако в более термодинамически предпочтительной реакции потребляется водород, для того чтобы получить смесь воды и углеводородов:
Ссылаясь на Фиг.2, все индивидуальные реакции для получения метана, этана и гексана являются термодинамически предпочтительными (то есть ΔG°/RT<0) в пределах всего диапазона температур, представленного на чертеже. Более того, производство этих углеводородов является более предпочтительным, чем выработка водорода из реакции воды с сорбитолом. Термодинамика образования пропана, бутана и пентана гладко подогнана в пределах гомологического ряда (между этаном и гексаном), однако эти треки были опущены на Фиг.2 для ясности. Таким образом, как полностью описано ниже, настоящая реакция может быть оптимизирована по выходу получаемой смеси, включающей почти исключительно углеводороды, а не водород. Фиг.2 создана на основе термодинамических данных, полученных Chemical Properties Handbook, С.L.Yaws, McGraw Hill, 1999.
В патенте США 6699457, так же как и в заявке на патент США 2005/0207971 А1 с серийным номером 11/124717, поданной 9 мая 2005 г., которые включены в этот документ путем ссылки, описан способ получения водорода из кислородсодержащих углеводородных реагентов, включая примеры, показывающие конверсию исходного сырья, содержащего до 10% глицерина, глюкозы или сорбитола, в водород. Способ может протекать в паровой фазе или в конденсированной жидкой фазе. Способ может включать стадии взаимодействия воды и растворимого в воде кислородсодержащего углеводорода, имеющего по меньшей мере два атома углерода, в присутствии металлсодержащего катализатора. Данный катализатор содержит металл, выбранный из группы, состоящей из переходных металлов VIII Группы, их сплавов и их смесей. Раскрываемый способ может протекать при более низких температурах, чем те, которые использовались в обычном паровом реформинге алканов.
В патенте США 6953873 Cortright et al., который включен в этот документ путем ссылки, раскрыт способ получения углеводородов из кислородсодержащих углеводородных реагентов, таких как глицерин, глюкоза или сорбитол. Данный способ может протекать в паровой фазе или в конденсированной жидкой фазе (предпочтительно в конденсированной жидкой фазе). Данный способ может включать стадии взаимодействия воды и растворимого в воде кислородсодержащего углеводорода, имеющего по меньшей мере два атома углерода, в присутствии металлсодержащего катализатора. Данный катализатор может содержать металл, выбранный из группы, состоящей из переходных металлов VIIB Группы, их сплавов и их смесей. Эти металлы могут быть нанесены на носители, которые проявляют кислотность, или реакцию проводят в условиях жидкой фазы при кислотных рН. Раскрытый способ позволяет получать углеводороды путем реакции в жидкой фазе воды с кислородсодержащими соединениями, полученными из биомассы.
В патентах США 6964757 и US 6964758 Cortright et al., которые включены в этот документ путем ссылки, раскрыт способ получения водорода из кислородсодержащих углеводородных реагентов, таких как метанол, глицерин, сахара (например, глюкоза и ксилоза), или сахарные спирты (например, сорбитол). Данный способ протекает в конденсированной жидкой фазе. Способ может включать стадии взаимодействия воды и растворимого в воде кислородсодержащего углеводорода, имеющего по меньшей мере два атома углерода, в присутствии металлсодержащего катализатора. Данный катализатор может содержать металл, выбранный из группы, состоящей из переходных металлов VIIIB Группы, их сплавов и их смесей. Раскрытый способ может протекать при более низких температурах, чем те, которые использовались в обычном паровом реформинге алканов.
В патенте США 4223001 раскрыты способы выработки водорода из водного исходного сырья, включающего растворимый в воде спирт, такой как метанол или этиленгликоль, используя катализатор, включающий металл VIII группы, такой как гомогенный катализатор, содержащий родий (например, RhCl3·3Н2O в водной фазе).
Cortright et al. описывают конверсию кислородсодержащих соединений, метанола, этиленгликоля, глицерина, сорбитола и глюкозы посредством реформинга в водной фазе на 3% Pt/Al2O3 катализаторе. Температура реакции находится в диапазоне от 498 до 538 К, давление в системе составляет от 2,9 до 5,6 МПа (от 29 до 56 бар) и концентрация загрузки составляет 1 мас.% кислородсодержащего соединения (Cortright, R.D., Davda R.R., Dumesic J.A., Nature, Vol.418, p.964, 2002).
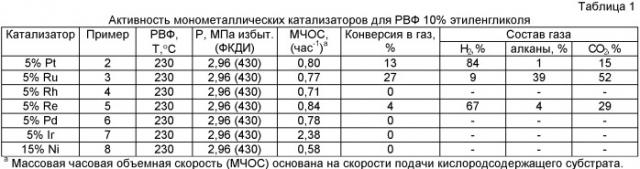
Davda et al. описывают изучение кинетики реакции реформинга в водной фазе растворов 10 мас.% этиленгликоля на металлических катализаторах, нанесенных на диоксид кремния. Температуры реакции для этих исследований составляли 483 и 498 К и реакционное давление составляло 2,2 МПа (22 бар). Результаты из этой статьи показывают, что общая каталитическая активность этих катализаторов уменьшается в следующем порядке: Pt~Ni>Ru>Rh~Pd>Ir (Davda R.R., Shabaker J.W., Huber G.W., Cortright R.D., Dumesic J.A.; Appl. Cat. B: Environmental, Vol 43, p.13, 2003).
Shabaker et al. описывают изучение кинетики реакции реформинга в водной фазе растворов 10 мас.% этиленгликоля с использованием платиновой черни и Pt, нанесенных на ТiO2, Al2O3, активированный уголь, SiO2, SiO2-Al2O3, ZrO2, CeO2 и ZnO. Температуры реакции составляли 483 и 498 К и реакционные давления составляли 2,24 и 2,93 МПа (22,4 и 29,3 бар) соответственно. Высокая активность получения Н2 путем реформинга в водной фазе наблюдалась при использовании платиновой черни и Pt, нанесенных на ТiO2, углерод и Al2O3, умеренную каталитическую активность получения водорода демонстрировала Pt, нанесенная на SiO2-Al2O3 и ZrO2, и низкую каталитическую активность проявляла Pt, нанесенная на CeO2, ZnO и SiO2. Pt, нанесенная на Al2O3, и в меньшей степени на ZrO2, проявляет высокую селективность получения Н2 и СO2 из реформинга этиленгликоля в водной фазе (Shabaker J.W., Huber G.W., Davda R.R., Cortright R.D., Dumesic J.A; Catalysis Letters, Vol.88, p.1, 2003).
Davda et al. описывают условия реакции, требуемые для выработки водорода с низкими концентрациями СО посредством реформинга этиленгликоля в жидкой фазе на 3% Pt/Аl2O3 катализаторе. Температура реакции находилась в диапазоне от 498 до 512 К, давление системы - от 2,58 до 3,62 МПа (от 25,8 до 36,2 бар) и концентрация этилена - от 2 до 10 мас.% (Davda R.R., Dumesic J.A; Angew. Chem. Int. Ed., Vol.42, p.4068, 2003).
Huber et al. описывают реакцию сорбитола для получения от С1 до С6 алканов на катализаторе на основе платины, с различным количеством водорода, добавленного в качестве сопутствующего сырья. В этой статье платину наносили либо на оксид алюминия, либо на алюмосиликаты. В этой статье обсуждают механизм этого процесса через бифункциональный маршрут, включающий реакцию дегидратации, катализируемую кислотой, за которой следует катализируемая металлом реакция гидрогенизации. Температура реакции находилась в диапазоне от 498 до 538 К, давление - от 2,58 до 6,07 МПа (от 25,8 до 60,7 бар) и концентрация загрузки составляла 5 мас.% сорбитола (Huber G.W., Cortright R.D., Dumesic J.A.; Angew. Chem. Int. Ed., Vol.43, p.1549, 2004).
Davda et al. рассматривали реформинг в водной фазе кислородсодержащих соединений. Обсуждено влияние носителей, нанесенных металлов, условия реакции и конфигурации реактора. В этой статье концентрации кислородсодержащих соединений составляли менее 10% (Davda R.R., Shabaker J.W., Huber G.W., Cortright R.D., Dumesic J.A., Appl. Cat. B: Environmental, Vol 56, p.171, 2005).
Huber et al. описывают эффективность модифицированного оловом катализатора на основе никеля для реформинга в водной фазе кислородсодержащих соединений, таких как этиленгликоль, глицерин и сорбитол, при 498 и 538 К. Концентрации кислородсодержащих соединений, изученные в этом исследовании, составляли менее 5 мас.% (Huber G.W., Shabaker J.W., Dumesic J.A.; Science, Vol.300, p.2075, 2003).
В предшествующих патентах и статьях описаны способы реформинга в водной фазе растворимых в воде кислородсодержащих соединений при концентрациях 10 мас.% или ниже. Энергетические балансы системы РВФ показывают, что могут возникать значительные энергетические потери из-за испарения воды в реакторной системе для поддержания парциального давления воды в пузырьках газообразного водорода, образующихся в реакторе.
Таким образом, существует потребность в каталитических системах и способах, которые обладают более высокими уровнями активности для поддержки высокой степени конверсии высоких концентраций кислородсодержащего углеводородного сырья в системе водного реформинга.
Первый аспект изобретения касается нанесенного катализатора реформинга в водной фазе, включающего а) углеродный носитель, включающий углерод, модифицированный титаном, ванадием, вольфрамом или рением, и б) каталитическую композицию, прикрепленную к углеродному носителю, причем каталитическая композиция включает Re и второй металл, выбранный из группы, состоящей из Ir, Ni, Pd, Pt, Rh и Ru, и в) Ce или La, прикрепленный к углеродному носителю или каталитической композиции.
В одном из воплощений изобретения каталитическая композиция выбрана из группы, состоящей из Re1,0Rh3,8, Ni1,0Re16,0 и Re2,5Pt1,0.
Согласно другому воплощению изобретения каталитическая композиция выбрана из группы, состоящей из Re1,0Rh2,0Ce2,0, Re1,0Rh1,0Ce1,0, Re1,0Rh1,0La3,0.
Примеры подходящих биметаллических катализаторов включают IrRe, NiRe, PdRe, PtRe, Rh3Re, RhRe и RuRe. Pt1,0Re2,5 является примером особенно предпочтительного катализатора.
Каталитическая композиция может быть прикреплена к водостойкому носителю. Например, прикреплена к носителю, включающему один или более материалов, выбираемых из группы, состоящей из углерода, диоксида циркония, диоксида титана или диоксида церия. Предпочтительно, композицию прикрепляют к углеродному носителю. Углеродные носители могут быть модифицированы другими материалами, такими как титан, ванадий, вольфрам или рений. В одном конкретном воплощении катализатор может быть прикреплен к носителю так, что сочетание катализатора и носителя включает 0,25-10 мас.% металла Группы VIII на катализаторе, и катализатор включает Re и металл Группы VIII. Атомное отношение Re и металла Группы VIII предпочтительно составляет от 0,25 до 10. Один из предпочтительных катализаторов включает Pt1,0Re2,5, прикрепленный к углеродному носителю.
Изобретение также относится к способу реформинга кислородсодержащих углеводородов, включающему стадию приведения в контакт сырьевого раствора, включающего воду и по меньшей мере 20 мас.% в расчете на общую массу сырьевого раствора, кислородсодержащего углеводорода, с описанным выше катализатором реформинга при условиях температуры реакции и давления реакции, эффективных для получения газообразного водорода и алканов, имеющих от 1 до 8 атомов углерода, где кислородсодержащий углеводород имеет по меньшей мере один атом кислорода и где катализатор реформинга включает рений и по меньшей мере один переходный металл Группы VIII на водостойком носителе.
Атомное отношение Re к металлу Группы VIII в катализаторе может составлять от 0,25 к 1 до 10 к 1 и сочетание катализатора и носителя может включать от 0,25 до 10 мас.% металла Группы VIII.
Кислородсодержащий углеводород предпочтительно является растворимым в воде углеводородом, включающим многоатомные спирты с любым подходящим числом атомов углерода, такие как растворимые в воде кислородсодержащие углеводороды, содержащие от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода. Примеры предпочтительных кислородсодержащих углеводородов включают этиленгликоль, глицерин и сорбитол. Способы реформинга кислородсодержащего углеводорода включают способы получения водорода, так же как и способы получения смесей водорода и алканов из одного или более кислородсодержащих углеводородов в сырье. Сырьевой раствор может быть водным раствором, содержащим по меньшей мере 20 мас.% кислородсодержащих углеводородов, в расчете на общую массу сырьевого раствора, имеющих по меньшей мере один атом кислорода. Например, сырьевой раствор может включать по меньшей мере примерно 20%, 30%, 40% или 50% кислородсодержащего углеводорода.
Сырьевой раствор можно приводить в контакт с катализатором реформинга при условиях температуры реакции и давления реакции, эффективных для получения газообразного водорода, как описано в этом документе. Температуру и давление реакции предпочтительно выбирают так, чтобы поддерживать исходное сырье в жидкой фазе. Например, температура реакции может составлять от примерно 80°С до примерно 300°С и давление реакции может составлять от примерно 1 МПа (10 бар) до примерно 9 МПа (90 бар). Более предпочтительно, температура реакции может составлять от примерно 120°С до примерно 300°С, даже более предпочтительно от примерно 150°С до примерно 300°С и давление реакции может составлять от примерно 1 МПа (10 бар) до примерно 5 МПа (50 бар). Жидкофазные модификаторы, такие как водорастворимые соли щелочных или щелочноземельных металлов, можно добавлять к исходному сырью в количестве от 0,1 до 10 мас.% водного раствора для оптимизации продуктов реакции. Например, добавление соединений для увеличения рН исходного сырья может увеличить количество водорода в продуктах реакции.
С помощью способов реформинга кислородсодержащих углеводородов можно получать множество полезных продуктов реакции, таких как водород, диоксид углерода и/или легкие углеводороды (например, метан, этан, пропан, бутан и пентан) из исходного сырья, включающего сорбитол или глицерин. В одном аспекте предложены способы получения алканов, которые включают приведение сырьевого раствора в контакт с катализатором реформинга. Исходное сырье может включать водный раствор, содержащий примерно 10-60% одного или более C1-С6 кислородсодержащих углеводородов, предпочтительно глицерина, этиленгликоля и/или сорбитола. Исходное сырье можно приводить в контакт с катализатором, включающим один или более металлов, выбранных из группы, состоящей из платины, родия и рения. В другом аспекте предложены способы получения водорода, которые включают приведение сырьевого раствора в контакт с подходящим катализатором реформинга, как описано в этом документе.
Описаны также способы изготовления катализатора реформинга. Например, способ приготовления катализатора может включать стадию окисления углеродного носителя путем нагревания этого углеродного носителя до температуры примерно 450°С, введение воздуха для образования активированного углеродного носителя и приведение углеродного носителя в контакт с катализатором. Например, активированный уголь можно нагревать до требуемой температуры в потоке инертного газа, такого как азот, и затем приводить в контакт с потоком воздуха с подходящим расходом, добавленным к азоту. Углерод можно обрабатывать в течение подходящего периода времени и затем охлаждать в токе азота. Способ приготовления катализатора дополнительно включает стадию введения оксида металла в носитель из активированного угля путем начального смачивания носителя из активированного угля раствором, включающим алкоксид металла, включающим оксид металла.
Предпочтительно, оксид металла вводят без суспендирования углеродного носителя в растворителе. Например, функционализированные углеродные поверхности можно модифицировать путем пропитки оксидами металлов перед пропиткой предшественников катализатора. Органические растворы подходящих оксидов металлов, такие как н-бутоксид титана или триизопрооксид оксида ванадия в безводном изопропаноле, можно добавлять путем начального смачивания к функционализированному воздушным окислением углероду, и смоченный углерод может быть впоследствии высушен.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой график, изображающий термодинамику конверсии углеводородов и кислородсодержащих углеводородов с образованием моноксида углерода и водорода (Н2);
Фиг.2 представляет собой график, изображающий термодинамику конверсии сорбитола с образованием водорода, диоксида углерода, воды и различных углеводородов;
Фиг.3 представляет собой график, изображающий влияние состава исходного сырья на тепловой КПД при 100% конверсии в системе реформинга в водной фазе;
Фиг.4 представляет собой схему реакторной системы, которую можно использовать для оценки активности катализаторов при реформинге в водной фазе согласно одному из воплощений настоящего изобретения, и
Фиг.5 представляет собой график, изображающий конверсию глицерина в газофазные продукты при использовании реформинга в водной фазе согласно одному из воплощений настоящего изобретения.
Здесь описаны различные способы реформинга высоких концентраций кислородсодержащих углеводородов с водой при низких температурах и в жидкой фазе. Если не указано другое, следующие термины должны быть определены здесь как указано ниже.
Термин «реформинг» обычно обозначает полное взаимодействие кислородсодержащего углеводорода и воды с образованием смешанного продукта, включающего углеводороды и/или водород и СO2, независимо от того, протекает ли реакция в газовой фазе или в конденсированной жидкой фазе. В случае, когда данное различие является важным, оно также должно быть отмечено.
Термин переходный металл «Группы VIII» относится к элементу, выбранному из группы, состоящей из Fe, Со, Ni, Ru, Rh, Pd, Os, Ir, Pt, Hs, Mt и Ds при любой степени окисления.
Термин переходной металл «Группы VIIB» относится к элементу, выбранному из группы, состоящей из Mn, Тс, Re и Bh при любой степени окисления.
Когда реформинг кислородсодержащих углеводородов выполняют в жидкой фазе, настоящее изобретение делает возможным получение углеводородов из водных растворов кислородсодержащих углеводородов, обладающих ограниченной летучестью, таких как сахара (глюкоза и ксилоза) и многоатомные спирты с более высокой молекулярной массой, такие как ксилитол и сорбитол.
Сокращения и определения:
«ГХ» = газовый хроматограф или газовая хроматография.
«ГЧОС» = газовая часовая объемная скорость.
«ФКДИ» = фунтов на квадратный дюйм относительно атмосферного давления (то есть избыточное давление). (1 ФКДИ=6895 Па избыт.).
«Объемная скорость» = масса/объем реагента на единицу катализатора в единицу времени.
«ЧО» = частота оборота.
«МЧОС» = массовая часовая объемная скорость = масса кислородсодержащего соединения на массу катализатора в час.
«СРВГ» = сдвиг равновесия в водяном газе.
Кислородсодержащие углеводороды
Описанные здесь кислородсодержащие углеводороды для способов реформинга предпочтительно являются растворимыми в воде. Желательно, чтобы кислородсодержащий углеводород имел от 1 до 12 атомов углерода и более предпочтительно от 1 до 6 атомов углерода. Для исходного сырья особенно предпочтительны концентрации примерно 30% кислородсодержащих углеводородов с количеством атомов углерода от 1 до 6. Предпочтительные кислородсодержащие углеводороды включают по меньшей мере 1 атом кислорода в кислородсодержащем углеводороде, и соотношение кислорода к углероду составляет от 0,50:1,00 до 1,50:1,00, включая соотношения 0,25:1,00; 0,33:1,00; 0,66:1,00; 0,75:1,00; 1,00:1,00; 1,25:1,00; 1,5:1,00, также как и промежуточные соотношения. Предпочтительно кислородсодержащие углеводороды имеют соотношение кислорода к углероду, равное 1:1. Кислородсодержащий углеводород также может быть многоатомным спиртом. Неограничивающие примеры предпочтительных растворимых в воде кислородсодержащих углеводородов можно выбрать из группы, состоящей из метанола, этанола, этандиола, этандиона, уксусной кислоты, пропанола, пропандиола, пропионовой кислоты, глицерина, глицеральдегида, дигидроксиацетона, молочной кислоты, пировиноградной кислоты, малоновой кислоты, бутандиолов, бутановой кислоты, альдотетрозов, винной кислоты, альдопентозы, альдогексозы, кетотетрозы, кетопентозы, кетогексозы и альдитов. Среди 6-углеродных кислородсодержащих углеводородов, альдогексозы и соответствующие альдиты являются особенно предпочтительными, причем глюкоза и сорбитол наиболее предпочтительны. Ксилоза, арабиноза, арабинол и ксилитол являются особенно предпочтительными кислородсодержащими соединениями, имеющими 5 атомов углерода. Сахароза является предпочтительным кислородсодержащим углеводородом, имеющим более 6 атомов углерода.
Реформинг в паровой фазе требует, чтобы реагенты из кислородсодержащих углеводородов имели достаточно высокое давление пара при температуре реакции, так чтобы реагенты находились в паровой фазе. В частности, кислородсодержащие углеводородные соединения, предпочтительные для использования в парофазном способе настоящего изобретения, включают метанол, этанол, этандиол, глицерин и глицеральдегид, но не ограничиваются этими соединениями. Когда реакция протекает в жидкой фазе, сахара, такие как сахароза, глюкоза, ксилоза, и многоатомные спирты, такие как ксилитол и сорбитол, являются наиболее предпочтительными кислородсодержащими углеводородами.
В способах настоящего изобретения кислородсодержащее углеводородное соединение предпочтительно смешивают с водой, чтобы получить водный раствор. Отношение воды к углероду в растворе предпочтительно составляет от примерно 0,5:1 до примерно 7:1, включая промежуточные соотношения, такие как 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, и любые соотношения, находящиеся между этими значениями. Этот диапазон представлен как один из примеров неограничивающего, предпочтительного диапазона. Отношения воды к углероду за пределами этого диапазона также включены в область данного изобретения. Сырьевой раствор может быть водным раствором по меньшей мере 20 мас.% кислородсодержащего углеводорода, имеющего по меньшей мере один атом кислорода, в расчете на общую массу сырьевого раствора. Например, сырьевой раствор может включать по меньшей мере примерно 20%, 30%, 40%, 50% или 60% одного или более кислородсодержащих углеводородов. Если не указано другое, то ссылки на процентное отношение кислородсодержащего углеводорода в исходном сырье относятся к общему количеству видов кислородсодержащих углеводородов в сырьевом растворе, который может включать смеси множества видов кислородсодержащих углеводородов.
Предпочтительно, остальное содержание сырьевого раствора составляет вода. В некоторых воплощениях сырьевой раствор состоит преимущественно из воды, одного или более кислородсодержащих углеводородов и, возможно, одного или более модификаторов исходного сырья, описанных здесь, таких как щелочные или щелочноземельные соли или кислоты. Сырьевой раствор может предпочтительно содержать незначительные количества водорода, предпочтительно при парциальном давлении менее примерно 0,1 МПа (1 бар). В предпочтительных воплощениях водород не добавляют к исходному сырью.
Способ водного реформинга можно осуществлять при концентрациях сырья в этом диапазоне при использовании различных катализаторов. Например, Shabaker et al. описывают реформинг в водной фазе растворов с 5 и 63 мас.% этиленгликоля с NiSn катализатором (Shabaker J.W., Simonetti D.A, Cortright R.D., Dumesic J.A.; J.Catal., Vol.231, p.67, 2005). Как показано на Фиг.3, тепловой КПД системы может быть улучшен путем работы системы с более высокими концентрациями исходного сырья. На Фиг.3 показано, что по мере того, как возрастает от 10 до 60 мас.% концентрация сырья, вычисленный КПД системы возрастает от менее 10% до более 80% при 100% конверсии этиленгликоля. Фиг.3 создана с использованием термодинамических данных и данных по давлению пара, взятых из Chemical Properties Handbook, С.L. Yaws, McGrawHill, 1999.
Катализаторы
Системы металлических катализаторов, предпочтительные для использования в настоящем изобретении, включают один или более металлов Группы VIII, объединенных с одним или более металлов Группы VIIB. Предпочтительные металлы Группы VIIB представляют собой рений или марганец. Предпочтительными металлами Группы VIII являются платина, родий, рутений, палладий, никель или их сочетания. Предпочтительные концентрации металлов Группы VIII составляют от 0,25 до 25 мас.% на углероде, включая приращения 0,10 мас.% и 0,05 мас.% между этими величинами, такими как 1,00%, 5,00%, 10,00%, 12,50%, 15,00% и 20,00%. Предпочтительное атомное отношение металла Группы VIIB к металлу Группы VIII составляет от 0,25 к 1 до 10 к 1, включая промежуточные отношения, такие как 0,50; 1,00; 2,50; 5,00 и 7,50 к 1.
Предпочтительная каталитическая композиция была получена путем дополнительного добавления оксидов Группы IIIB и соответствующих редкоземельных оксидов. В этом случае предпочтительными компоненты являются оксиды либо лантана, либо церия. Предпочтительное атомное отношение соединений Группы IIIB к металлу Группы VIII составляет от 0,25 к 1 до 10 к 1, включая промежуточные отношения, такие как 0,50; 1,00; 2,50; 5,00 и 7,50 к 1.
Если не указано другое, здесь представление каталитической композиции в виде «X:Y», где X и Y являются металлами, относится к группе каталитических композиций, включающих по меньшей мере металлы X и Y в любых подходящих стехиометрических сочетаниях и, возможно, включающих другие материалы. Аналогично, представление каталитической композиции в виде «X1,0Y1,0» относится здесь к композиции, включающей по меньшей мере металлы X и Y в стехиометрическом молярном отношении 1:1. Соответственно, особенно предпочтительные каталитические композиции являются биметаллическими металлическими композициями, описываемыми формулой X:Y, где X является металлом Группы VIII и Y является металлом Группы VIIB. Например, катализаторы, обозначенные «Re:Pt», включают биметаллические катализаторы Re1,0Pt1,0 и Re2,5Pt1,0. Более того, указание биметаллического катализатора X:Y может включать дополнительные материалы, помимо X и Y, такие как La и Се. Например, катализаторы, обозначенные «Re:Rh», здесь включают такие катализаторы, как Re1,0Rh1,0, Re1,0Rh3,8, Re1,0Rh2,0Ce2,0, Re1,0Rh1,0Ce1,0 и Re1,0Rn1,0La3,0.
В некоторых воплощениях катализаторы могут быть снабжены подходящим носителем. Каталитические системы могут быть нанесены на форму носителя, которая устойчива при выбранных условиях реакции. Может быть выбран любой подходящий носитель, однако носители предпочтительно являются весьма устойчивыми в сырьевом растворе, таком как водный сырьевой раствор, для того чтобы функционировать на желаемом уровне. Одним особенно предпочтительным носителем катализатора является углерод. Предпочтительно, чтобы такой углеродный носитель имел относительно высокую площадь поверхности (более 100 м2 на грамм). Такие углеродные материалы включают активированный уголь (гранулированный, порошкообразный или таблетированный), активированную углеродную ткань, ворс или волокно, углеродные нанотрубки или нанорожки, углеродные фуллерены, углеродные листы со структурой пчелиных сот с высокой площадью поверхности, углеродные пены (сетчатые углеродные пены) и углеродные блоки. Углерод может быть получен посредством либо химической, либо паровой активации торфа, древесины, бурого угля, каменного угля, скорлупы кокосовых орехов, косточек оливок и углерода на нефтяной основе. Один предпочтительный носитель представляет собой гранулированный активированный уголь, полученный из кокосов. Другие пригодные носители катализатора для практического применения настоящего изобретения включают, но не ограничиваются этим, диоксид кремния, алюмосиликат и оксид алюминия. Предпочтительно, каталитическая система представляет собой платину на диоксиде кремния или алюмосиликате, причем платина дополнительно сплавлена или смешана с никелем или рутением. Носитель также может быть обработан путем поверхностной модификации, чтобы модифицировать поверхностные группы, такие как водородная и гидроксильная группы. Поверхностные водородные и гидроксильные группы могут вызывать локальные изменения рН, которые будут влиять на эффективность катализатора. Носитель может быть модифицирован, например, путем обработки его модификатором, выбранным из группы, состоящей из сульфатов, фосфатов, вольфраматов и силанов.
Предпочтительно, чтобы выбранный углерод мог быть предварительно обработан либо паром, кислородом (из воздуха), неорганическими кислотами, либо перекисью водорода для получения большего количества поверхностных кислородных центров. При предпочтительной предварительной обработке используют либо кислород (из воздуха), либо перекись водорода.
Предварительно обработанный углерод может быть модифицирован путем добавления оксидов Группы IVB и Группы VB. Предпочтительно использовать оксиды титана, ванадия, циркония и их смеси.
Каталитические системы по настоящему изобретению могут быть приготовлены путем обычных способов, известных специалистам в данном уровне техники. Эти способы включают технологии проп