Способ получения n-фенилзамещенных трициклических азотистых соединений, меченных тритием
Иллюстрации
Показать всеИзобретение описывает способ получения N-фенилзамещенных трициклических азотистых соединений, меченных тритием, общей формулы:
; способ предусматривает прямое фенилирование гетероциклического атома азота в трициклических азотистых соединениях (акридин, фенантридин), равномерно нанесенных на стабилизирующую соль - KBF4, находящихся в замкнутой системе, проводят нуклеогенными фенил катионами, генерируемыми при бета-распаде трития в составе двукратно меченного бензола. Технический результат - описан новый, простой по выполнению одностадийный способ получения с хорошими выходами по радиоактивности неизвестных меченных тритием N-фенилакридиниевых и фенантридиниевых производных. 1 ил.
Реферат
Изобретение относится к радиохимии, а именно к новому способу осуществления прямого фенилирования атома азота нуклеогенными фенил катионами в трициклических азотистых соединениях и простому одностадийному синтезу N-фенилакридиниевых и фенантридиниевых производных, меченных тритием, общих формул:
;
Шестичленные гетероциклические производные азота - акридин и фенантридин, представляют собой конденсированную систему, состоящую из двух бензольных и одного пиридинового кольца. Трициклическая система акридина аналогична антрацену, а азоаналогом фенантрена является фенантридин. Производные акридина и фенантридина это уже хорошо известные в практике акридиновые антибактериальные средства - профлавин и акрафлавин, анальгетик - тактрин, полезный антималярийный препарат - менакрин и фенантридиновый трипаноцидный препарат - этидиум [Общая органическая химия. Под ред. Д.Бартон, У.Д.Оллис. Т.8. Азотсодержащие гетероциклы. Под ред. П.Г.Сэммс. Перевод с англ. Под ред. Н.К.Кочеткова. М.: Химия. 1985. 752 с.]. Широк спектр исследования, биологического и терапевтического применения акридиновых и фенантридиниевых соединений: начиная, с биологических флуоресцентных проб [W.T.Mason. In Fluorescent and Luminescent Probes, 2nd Ed. Academic Press: Cambridge. 1999; C.D.Geddes. Optical thin polymeric sensors for the determination of aqueous chloride, bromide and iodine ions at high pH, based on the quenching of fluorescence of two acridinium dyes. Dyes and Pigments. 2000. V.45(3). P.243-251; K.Smith, Z.Li, J.-J. Yang, I.Weeks, J.S.Woodhead. Synthesis and properties of novel chemiluminescent biological probes: substituted 4-(2-succinimidyloxycarbonylethyl)phenyl-10-methylacridinium-9-carboxylate trifluoromethane-sulphonate. Journal of Photochemistry and Photobiology A: Chemistry. 2000. V.132. P.181-191; N.W.Luedtke, Q.Liu, Y.Tor. Synthesis, photophysical properties, and nucleic acid binding of phenanthridinium derivatives based on ethidium. Bioorganic & Medicinal Chemistry. 2003. V.11(23). P.5235-5247; J.Lin, H.Ju. Electrochemical and chemiluminescent immunosensors for tumor markers. Biosensors and Bioelectronics. 2005. V.20. P.1461-1470.], антибактериальных и антималярийных веществ [А.Г.Михайловский, Т.Г.Таранова, Б.Я.Сыропятов, М.И.Вахрин. Синтез, антиагрегационная и антиаритмическая активность производных фенантридина. Хим.-фарм. Журнал. 1992. С.53-55; D.Figgitt, W.Denny, P.Chavalitshewinkoon, P.Wilairat, R.Ralph. In Vitro Study of Anticancer Acridines as Potential Antitrypanosomal and Antimalarial Agents. Antimicrobial agents and chemotheraphy. 1999. P.1644-1647; Т.Ferenc, E.Janik-Spiechowicz, W.Bratkowska, D.Lopaczynska, H.Strozynski, A.Denys, A.Mordalska. Genotoxicity assessment of new synthesized acridine derivative - 3,6-diamino-10-metyl-9,10-dihydroacridine. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 1999. V.444(2). P.463-470; Y.-L. Chen, I-L. Chen, C.-M. Lu, C.-C-. Tzeng, L.-T. Tsao, J.-P. Wang. Synthesis and anti-inflammatory evaluation of 9-phenoxyacridine and 4-phenoxyfuro[2,3-b]quinoline derivatives. Part. 2. Bioorganic and Medical Chemistry. 2003. V.11(18). P.3921-3927; J. Chiron, J.-P. Galy. Reactivity of the acridine ring: one-pot regioselective single and double bromomethylation of acridine and some derivatives. SYNLETT. 2003. №15. P.2349-2350], блокаторов кальциевых каналов [R.Simsek, M.Ozkan, E.Kismetli, S.Uma, C.Safak. Some arylacridine derivatives possessing potassium chanel opening activity. IL FARMACO. 2004. V.59. P.939-943], бор нейтронозахватной терапии [M.Johnson, N.Bergstand, К.Edwards. Optimization of drug loading procedures and characterization of liposomal formulation of two novel agents for boron neutron capture theraphy (BNCT). Journal of Liposome Research. 199. V.9(1). P.53-79] и заканчивая, противораковыми препаратами и лекарствами против ВИЧ-инфекции [Н.Т.Чаганова В.Н.Буянов, Н.Н.Суворов, Т.С.Сафонова, И.А.Безруков, Ю.А.Ершова, Е.Ф.Кулешова. Синтез и противоопухолевая активность некоторых 9-{1'-N-индолил}-9-{1'-N-индолинил} акридинов. Хим.-фарм. Журнал. 1991. Т.12. С.27-30; J.Stanslas, D.J.Hagan, M.J.Ellis, C.Turner, J.Carmichael, W.Ward, T.R.Hammonds, M.F.G. Stevens. Antitumor polycyclic acridines. 7. Synthesis and biological properties of DNA affinic tetra- and pentacyclic, acridines. J.Med. Chem. 2000. V.43(8). P.1563-1572; Б.Клемент, M.Вайде. Производные фенатридина, способы их получения и лекарственные средства, содержащие производные фенантридина. Патент РФ №2180333. Опубликовано 10.03.2002 г.; R.A.Heald, С.Modi, J.C.Cookson, I.Hutchinson, C.A.Laughton, S.M.Gowan, L.R.Kelland, M.F.G. Stevens. Antitumor polycyclic acridines.8. Synthesis and telomerase-inhibitory activity of methylated pentacyclic acridinium salts. J.Med. Chem. 2002. V.45. P.590-597; H.Baruah, C.L.Rector, S.M.Monnier, U.Bierbach. Mechanism of action of non-cisplatin type DNA-targeted platinum anticancer agents: DNA interections of novel acridinylthioureas and their platinum conjugates. Biochemical Pharmacology. 2002. V.64(2). P.191-200; N.H.Cambell, G.N.Parkinson, A.P.Reszka, S.Neidle. Stuctural basis of DNA quadruplex regognition by an acridine drug. J. Am. Chem. Soc. 2008. V.130. P.6722-6724; J.R.Goodell, A.V.Ougolkov, H.Hiasa, H.Kaur, R.Remmel, D.D.Billadeau, D.M.Ferguson. Acridine-based agents with topoisomerase II activity inhibit pancreatic cancer cell proliferation and induce apoptosis. J. Med. Chem. 2008. V.51(2). P.179-182; Z. Ma, G.Saluta, G.L.Kucera, U.Bierbach. Effect of linkage geometry on biological activity of thiourea- and quanidine-substituted acridines and platinum-acridines. Bioorg. Med. Chem. Lett. 2008. V.18(13). P.3799-3801]. Причем необходимо отметить, что основную часть исследуемых веществ составляют кватернизированные алкильные производные акридиния и фенантридиния. Установлено, что наличие положительного заряда на атоме азота существенно усиливает биологическую активность как антибактериальную [J.W.Lown, B.C.Gunn, K.С.Majumbar, E.McGoran. Synthesis of potential DNA bisintercalative agents of the phenanthridinium class. Can.J. Chem. 1979. V.57. P.2305-2313; С.Goto, Т.Someya, S.Chihara, Y.Mizuguchi, M.Fukunaga. Mutagenesis of amino and/or methyl analogs of acridine in Salmonella and yeast: a comparison between the spotest and the pre-incubation methods. J UOEH. 1984. V.6(3). P.257-263; W.Monte, J.Stamm. The synthesis of new acridinium salt aquatic antifungals. Tetrahedron Lett. 1993. V.34 (45) P.1563-1572; M.J.Gill, N.P.Brenward, R.Wise. Identification of an efflux pump gene, pmrA, associated with fluoroquinolone resistance in Streptococus pneumoniae. Antimicrobial Agents and Chemotherapy. 1999. V.43(1). P.187-189; Т.Mine, Y.Morita, A.Kataoka, T.Mizushima, T.Tsuchiya. Expression in Escherichia coliof a new multidrug efflux pump, mexXY, from Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 1999. V.43(2). P.415-417; J.N.A.Tettey, G.G.Skellern, J.M.Midgley, M.H.Grant, R.Willkinson, A.R.Pitt. Intracellular localization and metabolism of the phenathridinium trypanocide, ethidium bromide, by isilated rat hepatocytes. Xenobiotica. 1999. V.29(4). P.349-360; R.J.Anderson, P.W.Groundwater, Y.Huang, A.L.James, S.Orenga, A.Rigby, С Roger-Dalbert, J.D.Perry. Synthesis and evaluation of novel chromogenic peptidase substrates based on 9-(4'-aminophenyl)-10-methylacridinium salts as diagnostic tools in clinical bacteriology. Bioorganic & Medical Chemistry Letters. 2008. V.18. P.832-835], так и противораковую [В.И.Сладков, В.А.Хохлов, Ю.А.Ершова, В.А.Чернов, Ю.В.Хохлова, А.Ф.Нанасюк, Н.Н.Суворов. Синтез и биологическая активность бензо[с] - и бензо[б]фенантридиниевых солей. Хим-фарм. журнал. 1987. Т.21, №6. С.660-663; N.W.Luedtke, Q.Liu, Y.Tor. Synthesis, photophysical properties, and nucleic acid binding of phenanthridinium derivatives based on ethidium. Bioorganic & Medicinal Chemistry. 2003. V.11(23). P.5235-5247; А.Масуда, M.Сува, M.Сузуки. Производные фенантридиния, фармацевтическая композиция, обладающая противораковой активностью, способ ингибирования роста раковых клеток. Патент РФ. №2183626. Опубликовано 20.06.2002 г.; N.Patino, С.Di Giorgio, С.Dan-Covalciuc, V.Peytou, R.Terreux, D.Cabrol-Bass, C.Bailly, R.Condom. Modeling, synthesis and biological evaluation of an ethidium-arginine conjugate linked to a ribonuclease mimic directed against TAR RNA of HIV-1. European Journal of Medicinal Chemistry. 2002. V.37(7). P.573-584; С.Leonetti, S.Amodei, C.D'Angelo, A.Rizzo, B.Benassi, A.Antonelli, R.Elli, M.F.G.Stevens, M.D'Incalci, G.Zupi, A.Biroccio. Biological activity of G-quadruplex ligand RHPS4 (3,11-difluoro-6,8,13-trimethyl-8H-quino[4,3,2-kl]acridinium methosulfate) is associated with telomere capping alteration. Molecular Pharmacology. 2004. V.66. Р. 1138-1146; A.D.C.Parently, L.V.Smith, K.M.Guthrie, D-L.Long, J.Plumb, R.Brown, L.Cronin. Highly stable phenanthridinium frameworks as a new class of tunable DNA binding agents with cytotoxic properties. Journal of Medical Chemistry. 2005. V.48(14). P.4504-4506; A.Parently, L.Cronin, R.Brown. Phenathridinium derivatives as DNA binding agents. Patent GB. WO/2005/054241. Publication 16.06.2005]. В настоящее время не только продолжается, но и расширяется диапазон поиска новых лекарственных веществ, содержащих в своем составе акридиновую или фенантридиновую структуры. Это связано еще и с тем, что при исследовании антибактериальных препаратов было обнаружено возрастание сопротивляемости бактерий (особенно грамотрицательных) к постоянно используемым биоцидам, что требует, разработки новых структурных аналогов лекарственных средств [L.S.Stratchounski, R.S.Kozlov, G.K.Rechedko, O.U.Stetsiouk, E.P.Chavrikova. Antimicrobial resistance pattens among aerobic gram-negative bacilli isolated from patients in intensive care units: results of multicentre study in Russia. Clinical Microbiology and Infection. 1998. V.9(4). P.497-507; Materials of the 49th Session of the Regional Committee for the Eastern Mediterranean. Antimicrobial resistance and rational use of antimicrobial agents. Cairo, Egypt 30 September - 3 October 2002; Abstracts of 2010 Conference on Antimicrobial Resistance. Bathesda, Maryland, USA, January 31 - February 3, 2010; M.H.Scheetz, K.M.Hurt, G.A.Noskin, C.M.Oliphant. Applying antimicrobial pharmacodynamics to resistant gram-negative pathogens. American Journal of Health-System Pharmacy. 2006. V.63(14). P.1346-1360; K.Kurokawa, H.Hamamoto, M.Matsuo, S.Nishida, N.Yamane, B.L.Lee, K.Murakami, H.Maki, K.Sekimizu. Evaluation of target specificity of antibacterial agents using Staphylococcus aureus ddlA mutants and D-cycloserine in a silkworm infection model. Antimicrobial Agents and Chemotherapy. 2009, V.53(9). P.4025-4027; G.P.Suresha, K.C.Prakasha, K.N.S.Kumara, W.Kapfo, D.C.Gowda. Design and Synthesis of Heterocyclic Conjugated Peptides as Novel Antimicrobial Agents. Int. J.Pept. Res. Ther. 2009. V.15. P.25-30]. А, во-вторых, буквально в последнее время было установлено, что производные фенантридина дают возможность потенциально новой терапии рака, мишенью которой является пролиферация (деление) раковых, но не здоровых клеток [D.Inbar-Rozensal, A.Castiel, L.Visochek, D.Castel, F.Dantzer, S.Izraeli, M.Cohen-Armon. A selective eradication of human nonhereditary breast cancercells by phenanthridine-derived polyADP-ribose polymerase inhibitors. Breast Cancer Research. 2009, V.11(6). P.111-121].
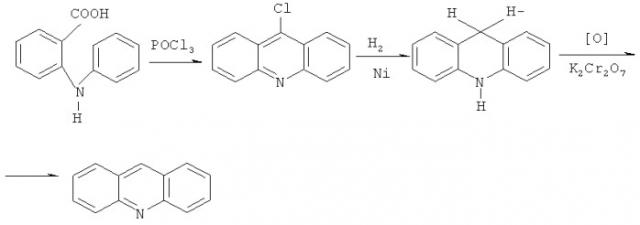
Классические синтетические методы получения даже самих исходных соединений акридина и фенантридина сложны, состоят из нескольких постадийных процессов и не позволяют получать данные соединения с хорошими выходами. Это могут быть реакции циклизации соответствующих замещенных анилинов и о-галогенпроизводных кислот и альдегидов или же в некоторых случаях подходящим методом может быть конденсация производных дифениламина или дифенилметана [Heterocyclic Chemistry; 4th Ed. J.A.Joule, K.Mills. Blackwell Science. 2000. 589 с.; J.Chiron, J-P.Galy. Reactivity of the acridine ring: a review. Synthesis. 2004. №3. P.313-325]. Одним из основных методов получения акридина можно считать реакцию циклизации 2-(фениламино)бензойной кислоты, с последующим восстановлением полученного 9-хлоракридина в акридан и окислением последнего в акридин [В.И.Иванский. Химия гетероциклических соединений. Москва. Высшая школа. 1978. 560 с.; Т.Джилкрист. Химия гетероциклических соединений. М.: Мир. 1996. 464 с.]:
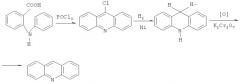
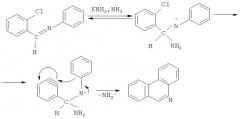
Один из способов получения фенантридина может быть представлен как циклизация N-[(2-хлорфенил)метилиден] анилина по следующей схеме [Т.Джилкрист. Химия гетероциклических соединений. М.: Мир. 1996. 464 с.]:
Благодаря наличию sp2-гибридизированной неподеленной паре электронов на атоме азота пиридиновые производные обладают основными свойствами и могут вступать в реакции электрофильного присоединения по атому азота с образованием четвертичных производных. При взаимодействии акридина и фенантридина с галоидными алкилами образуются N-алкильные акридиниевые и фенантридиниевые соли [Supplements to the 2nd edition of Rodd's chemistry of carbon compounds. Ed. By M.F.Ansell. V. IV. Heterocyclic compounds. Part. G.Elsevier Science Publishers B.V. 1987. P.35-38; A.R.Katritzky. Handbook of heterocyclic chemistry. Pergamon Press. 1985. P.145-210], последняя широко известна как соль этидиния (3,8-диамино-5-этил-6-фенилфенантридиний):
Существенно отметить, что, как и в случае других пиридиновых производных, реакция прямого фенилирования гетероциклического атома азота для конденсированных соединений также неосуществима. При прямом фенилировании акридина фениллитием по типу реакции Михаэля может быть получен только 9-фенил-9,10-дигидроакридин с последующим восстановлением до 9-фенилакридина [В.Dutta, G.K.Kar, J.K.Ray. Direct regioselective phenylation of acridine derivatives by phenyllithium. Tetrahedron Lett. 2003. V.44. P.8641-8643], а не соль N-фенилакридиния. Соль N-фенилзамещенного фенантридиния (7,9-диэтокси-5-фенилфенантридиний) может быть получена из солей N-фенилхинолиния при взаимодействии с кетеном диэтилацеталя [G. Scherowsky, J.Pickardt. Reaktionen heterocyclischer oniumsaize mit elektronenreichen mehrfachbindungssystemen. Chem. Ber. 1983. V.116. P.186-1961:
В связи с все возрастающей важностью акридиниевых и фенантридиниевых производных разработка новых путей синтеза неизвестных и труднодоступных соединений данного ряда является крайне актуальной и перспективной задачей. Получение же этих соединений с фиксированной тритиевой меткой дает возможность детального исследования тонких механизмов биологического действия препаратов акридиниевой и фенантридиниевой структуры и процессов их метаболизма с помощью метода меченых маркеров.
Ни один из приведенных классических путей синтеза N-фенилзамещенных трициклических производных не позволяет получить эти соединения с фиксированной тритиевой меткой вследствие трудности и многостадийности метода синтеза, что при активном синтезе ведет к существенной потере радиоактивности, а также из-за отсутствия необходимых исходных меченых соединений.
Всех указанных недостатков лишен предлагаемый новый способ прямого фенилирования атома азота нуклеогенными фенил катионами в трициклических азотистых соединениях и простого одностадийного синтеза N-фенилакридиниевых и фенантридиниевых производных, меченных тритием. Ранее предложили "Меченные тритием N-фенилхинолиниевые и хинальдиниевые соли и способ их получения" (Патент РФ №2320647 от 20.12.06 г., бюл. №9 от 27.03.08 г.), который является прототипом. В предлагаемом изобретении по сравнению с прототипом имеется ряд существенных преимуществ. Метод распространен на получение неизвестных и труднодоступных соединений, а именно N-фенильных солей акридиния и фенантридиния. Изменена методика ядерно-химического синтеза, а именно усовершенствован синтез двукратно меченного бензола - источника нуклеогенных фенил-катионов, что способствовало получению более химически чистого бензола. Кроме того, при проведении ион-молекулярных реакций было достигнуто более равномерное нанесение субстрата на кристаллы стабилизирующей соли за счет нанесения растворов веществ в легколетучем растворителе.
Задачей данного изобретения является разработка нового, простого по выполнению одностадийного способа получения с хорошими выходами по радиоактивности меченных тритием N-фенилакридиниевых и фенантридиниевых соединений, которые являются структурными аналогами крайне важных биологических и медицинских препаратов.
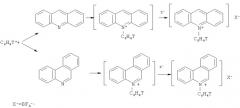
Поставленная задача достигается описываемым новым способом получения новых меченных тритием по фенильному кольцу трициклических азотистых соединений, заключающийся в том, что акридин и фенантридин подвергают реакции прямого фенилирования циклического атома азота нуклеогенными фенил катионами, генерируемыми при процессах бета-распада трития, в составе двукратно меченного тритием бензола.
Вышеперечисленная совокупность существенных признаков позволяет получить следующий технический результат: авторами создан новый, простой по выполнению одностадийный способ получения с хорошими выходами по радиоактивности неизвестных меченных тритием N-фенилакридиниевых и фенантридиниевых производных. Схема предложенного ядерно-химического синтеза состоит в следующем:
Изобретение иллюстрируется следующим примером.
Пример 1
Синтез двукратно меченного тритием бензола проводился в вакуумной системе по реакции:
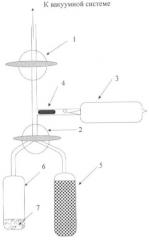
На чертеже представлена установка для синтеза дважды меченого тритием бензола. Где 1 - вакуумный кран; 2 - трехходовой кран; 3 - ампула с газообразным тритием; 4 - магнитный боек, 5 - ампула с молекулярными ситами 13А; 6 - реакционный сосуд; 7 - реакционная смесь.
Из 3,4 мг (0,014 ммоль) дибромбензола, 5,0 мкл (0,020 ммоль) три-н-бутиламина в гексане и 3,3 (0,054 ммоль) кюри газообразного трития путем гидрирования на катализаторе 5% Pd/BaSO4 (предварительная активация катализатора проведена при температуре 160-180°С в течение 45 мин в динамическом вакууме 10-3 мм рт.ст.) при комнатной температуре в течение 1 часа был получен двукратно меченный тритием бензол. Сорбент необходим, чтобы более полно использовать тритий, а для этого нужно повысить давление трития в реакционной ампуле. Чтобы этого добиться, молекулярные сита прогревают до 400°С при постоянном вакуумировании (динамический вакуум), для удаления всех сорбированных веществ, главным образом, воды. При охлаждении сит жидким азотом тритий почти количественно на них сорбируется. После перевода трехходового крана в положение, когда объединены обе ампулы, но отсечены все остальные части установки, при охлаждении реакционной ампулы с реагентами жидким азотом сита отогреваются до комнатной температуры. Тритий десорбируется в гораздо меньший объем (реакционная ампула + ампула с ситами), чем общий объем установки.
Теперь, если отсечь реакционную ампулу и от ампулы с ситами, то большая часть трития оказывается в реакционной ампуле, том числе и за счет разности температур в ампуле с тритием (комнатная) и реакционной ампуле (-196 градусов) Это не только повышает давление в реакционной ампуле, но и позволяет проводить синтез с меньшими количествами растворителя, так как уменьшение объема приводит и к меньшему количеству легко летучего растворителя (гексана), перешедшего в газовую фазу при отогреве реакционной смеси до комнатной температуры, а гидрирование проводится как раз при этой температуре. Добавка амина необходима для связывания образующегося бромоводорода. Использование более высококипящего амина (для трибутиламина Т кип.=213°С) позволило при отгонке бензола в вакууме (t=-30°C) добиться более эффективного отделения взятого в избытке третичного амина. Химическая чистота синтезированного двукратно меченого бензола - не менее 99%. Объемная удельная активность полученного раствора в гексане составила 1 Ки/мл.
Ион-молекулярные реакции осуществлялись в запаянных ампулах, содержащих третированный бензол - 1 мкл (источник фенил-катионов), субстраты (акридин и фенантридин - 9,9 мг) в мольном соотношении ~1:1000, которые были нанесены на кристаллы стабилизирующей соли (тетрафторобората калия). Для равномерного распределения субстратов по поверхности стабилизирующей соли вещества были предварительно растворены в подходящем растворителе (эфир, бензол), растворенные вещества внесены в ампулы и затем под небольшим вакуумом удален растворитель. Ампулы с реакционной смесью выдерживались для накопления продуктов реакции в количествах, достаточных для их надежного детектирования по радиоактивности (не менее 1 месяца), непрореагировавший бензол отгонялся, а затем проводилось выделение и идентификация синтезированных соединений. Радиохроматография полученных тритированных продуктов осуществлялась на стеклянных пластинках Reverse Phase С 18 silica gel (Fluorescent Indicator) с использованием в качестве элюента ацетонитрила. Участки адсорбционного слоя хроматограммы по 0,5 см длиной переносились в сцинтиллятор на основе диоксана, и проводилось измерение их радиоактивности с помощью жидкостного сцинтилляционного счетчика RackBeta 1215 (LKB Wallac, Finland).
Выход борфторида N-фенилакридиния 14±2%. Выход соли N-фенилфенантридиния 17±1%. Удельная активность препаратов 0,2 мКи/мл.
Впервые полученные соединения имеют удельную активность, достаточную для проведения биологических и медицинских исследований с помощью меченых маркеров.
Способ получения N-фенилзамещенных трициклических соединений, меченных тритием, общей формулы: отличающийся тем, что прямое фенилирование гетероциклического атома азота в трициклических азотистых соединениях (акридин, фенантридин), равномерно нанесенных на стабилизирующую соль - KBF4, находящихся в замкнутой системе, проводят нуклеогенными фенилкатионами, генерируемыми при бета-распаде трития в составе двукратно меченного бензола.