Способ получения моноклональных антител к аблюминальному мембранному антигену церебральных эндотелиоцитов
Иллюстрации
Показать всеИзобретение касается получения биологически активных антител, связывающихся с живой клеткой. Препаратом мембранных белков церебральных эндотелиоцитов иммунизируют мышь линии Balb/C. Выделяют В-лимфоциты селезенки этой мыши и сливают с клетками миеломы мыши линии Sp2/0-Ag14, получают гибридомы, тестируют супернатанты полученных гибридом иммунохимически и отбирают гибридомы, продуцирующие моноклональные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов. Из них выбирают гибридому, характеризующуюся наибольшим количеством антитело-продуцирующих гибридных клеток, синтезирующих антитела, относящиеся к классу иммуноглобулинов G, сохраняющие биологическую активность в сыворотке крови не менее 24 часов, выделяют моноклональные антитела из супернатанта выбранной гибридомы, в частности, методом аффинной хроматографии на протеин-G-агарозе. Способ по изобретению обеспечивает получение моноклональных антител к антигену церебральных эндотелиоцитов с высокой иммунохимической активностью, позволяющих визуализировать церебральные эндотелиоциты как ех vivo, так и в условиях in vitro и in vivo для характеристики сосудистой системы глиом. 1 з.п. ф-лы, 9 ил.
Реферат
Изобретение относится к области молекулярной биологии, в частности к проблеме получения биологически активных антител, связывающихся с живой клеткой.
Известны работы по получению поликлональных антител и моноклональных антител, визуализирующих капилляры головного мозга [Lin J.H. et al. 2002]. Наиболее селективный маркер церебральных эндотелиоцитов - ЕВА визуализируется антителами SMI-71 только на срезах мозга крысы (Sternberger L.A. et al. 1992). Подобным образом, антитела ОХ-26 окрашивают трансферриновый рецептор CD-71 только в микрососудах крысы (Pardridge at al. 2002). Получены моноклональные антитела, специфичные к инсулиновому рецептору церебральных микрососудов человека и различных видов животных. Известны также коммерческие препараты моноклональных антител к VEGF, FV для визуализации сосудов головного мозга [Zymed, USA]. Известно, что не все моноклональные антитела, полученные с целью визуализации церебральных эндотелиоцитов, могут применяться для визуализации живых клеток. Кроме того, в открытой печати приводятся противоречивые данные о кинетике аллогенных антител, вводимых в кровоток здоровым животным. Некоторые исследователи высказывают предположение о том, что аллогенные антитела при попадании в системный кровоток очень быстро теряют иммунохимическую активность вследствие взаимодействия с белками плазмы крови и элиминируются в результате захвата клетками печени и селезенки. При этом объективная оценка иммунохимической активности аллогенных антител в сосудистом русле подчас значительно ограничена вследствие методологических затруднений.
Задачей изобретения является получение биологически активных моноклональных антител к аблюминальному мембранному антигену церебральных эндотелиоцитов с высокой иммунохимической активностью, позволяющих визуализировать церебральные эндотелиоциты как ex vivo, так в условиях in vitro и in vivo.
Технической задачей предлагаемого изобретения является разработка способа получения биологически активных моноклональных антител к аблюминальному мембранному антигену церебральных эндотелиоцитов, связывающихся с живой клеткой.
Авторами установлено, что аблюминальный антиген церебральных эндотелиоцитов доступен для циркулирующей в крови наносистемы на основе специфичных моноклональных антител при развитии опухолевого процесса в головном мозге крыс (глиома С6). Полученная наносистема способна проникать через патологический гемато-энцефалический барьер из кровеносного русла в область глиомы, что позволяет визуализировать сосудистую систему глиомы С6.
Сущность изобретения заключается в следующем.
Препаратом мембранных белков церебральных эндотелиоцитов иммунизируют мышь линии Balb/C. Выделяют В-лимфоциты селезенки этой мыши и сливают с клетками миеломы мыши линии Sp2/0-Ag14, получают гибридомы, тестируют супернатанты полученных гибридом иммунохимически и отбирают гибридомы, продуцирующие моноклональные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов. Из них выбирают гибридому, характеризующуюся наибольшим количеством антитело-продуцирующих гибридных клеток, синтезирующих антитела, относящиеся к классу иммуноглобулинов G, сохраняющие биологическую активность в сыворотке крови не менее 24 часов, выделяют моноклональные антитела из супернатанта выбранной гибридомы.
В частности, выделение моноклональных антител из супернатанта выбранной гибридомы проводят методом аффинной хроматографии на протеин-G-агарозе.
Изобретение поясняется следующими фигурами.
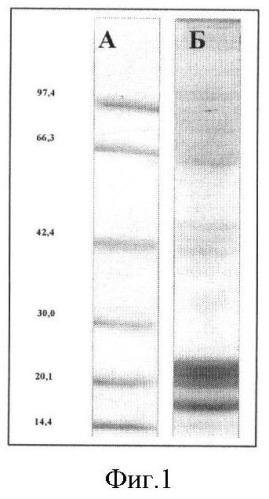
На Фигуре 1 представлен диск-электрофорез солюбилизированного препарата мембранных белков церебральных эндотелиоцитов крысы. А. - Маркеры молекулярной массы. Б. - Препарат мембранных белков (окрашивание кумасси G-250).
Фигура 2. Конфокальная лазерная микроскопия церебральных эндотелиоцитов на срезах головного мозга крысы с помощью анти-ВЕМР-1 антител.
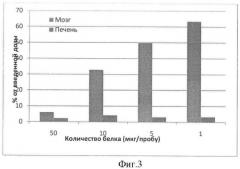
Фигура 3. Накопление Анти-ВЕМР-1 в микрососудах мозга и печени (%) in vitro в зависимости от введенного количества меченых антител.
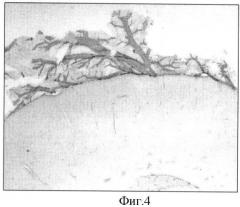
Фигура 4. Иммуногистохимическое окрашивание пиальных микрососудов Анти-ВЕМР-1. Увеличение 1×100.
Фигура 5. Иммунопероксидазное окрашивание микрососудов мозжечка с помощью анти-ВЕМР антител exvivo, увеличение 1×100.
Фигура 6. Распределение меченных I125 Анти-ВЕМР-1 в микрососудах мозга, печени и бессосудистой фракции мозга (in vitro).
Фигура 7. Распределение IgG в микрососудах мозга и печени (%) in vitro при различном количестве введенных меченых антител.
Фигура 8. Результаты лазерной конфокальной микроскопии визуализации церебральных эндотелиоцитов с помощью анти-ВЕМР-1 антител. По расположению ядра, окрашенного DAPI (синий цвет), антиген, к которому получены антитела, локализуется на аблюминальной поверхности церебральных эндотелиоцитов.
Фигура 9. Иммуногистохимический анализ срезов печени (А), легкого (Б, В) и почек (Г) с помощью анти-ВЕМР-1.
Способ осуществляется следующим образом.
В основу модификаций приготовления препаратов аблюминального антигена церебральных эндотелиоцитов, использованных в данной работе, положена методика Lidinsky et al. для мембранных белков микрососудов головного мозга. Основным требованием к модифицированным способам получения является максимальное сохранение антигенного спектра препарата мембранных белков церебральных эндотелиоцитов с наибольшей экстракцией интегральных мембранных белков.
Используемая авторами методика получения препарата мембранных белков церебральных эндотелиоцитов включает в себя следующие этапы.
1. Гомогенизация. К 50 г ткани головного мозга крысы добавляют 500 мл PBS, содержащего 5,5 mM глюкозу, 2 mM ЭДТА, 4 mM фенилметилсульфонилфлуорид и апротинин в дозе 0,5 Ед/мл и измельчают в гомогенизаторе ЕТА 0010 в течение 30 секунд на максимальной скорости.
2. Фильтрация. Полученный гомогенат однократно пропускают через сито с диаметром пор 360 µm, а затем полученный фильтрат - двукратно через сито с диаметром пор 160 µm. Полученный фильтрат центрифугируют при 1000 g в течение 10 мин.
3. Градиентное центрифугирование в декстране. Осадок суспендируют в растворе декстрана Т-70 до конечной концентрации 15% (масса/об.), наслаивают по 10 мл на 25% раствор декстрана в пробирках по 50 мл и центрифугируют при 25000 g в течение 10 мин в бакетном роторе. Фракцию микрососудов, формировавших линию на интерфазе растворов декстрана различных плотностей, отбирают и повторно центрифугируют при 25000 g в течение 10 мин.
4. Осмотический лизис клеток. Препарат микрососудов суспендируют в 50 мл дистиллированной воды, перемешивают в течение 2 часов при 4°С и центрифугируют 15000 g в течение 10 мин. Процедуру повторяют дважды, отбирая осадок.
5. Сонификация. Осадок лизированных клеток растворяют в минимальном объеме H2O и озвучивают на ультразвуковом дезинтеграторе «G112SP1T» (Laboratory Supplies Co. Inc.) при частоте 80 кГц в течение 20 мин (3 раза) в охлажденной дистиллированной воде с детергентом Triton-Х100. Препарат центрифугируют при 25000 g в течение 10 мин и отбирают надосадок.
Полученной в результате градиентного центрифугирования в декстране и последующего осмотического лизиса очищенной фракцией мембран эндотелиоцитов проводят иммунизацию мыши Balb/c в количестве 20 мкг по общему белку. Подкожно в три точки вводят препарат мембранных белков церебральных эндотелиоцитов (20 мкг) с равным объемом полного адъюванта Фрейнда с интервалом 1 раз в 10 дней, с последующим 2-месячным перерывом. Затем повторяют цикл иммунизации и на 5-6-й день после второго цикла иммунизации вводят внутрибрюшинно 50 мкг препарата мембранных белков церебральных эндотелиоцитов в смеси с неполным адъювантом Фрейнда. Эффективность иммунизации оценивают методом иммунодиффузии с тест-системой (экстракт мозга).
Гибридизацию проводят на 3-4-й день после последней инъекции препарата мембранных белков церебральных эндотелиоцитов в соотношении клеток миеломы и В-лимфоцитов 1:10. Гибридные клоны отбирают на селективной среде, содержащей гипоксантин, тимидин и аминоптерин. Скрининг гибридом на продукцию специфичных антител проводят методами иммуногистохимии и иммуноцитохимии in vitro и in vivo. А именно, клетки гибридомы проводятся через серию реклонирований под контролем высокочувствительного иммуногистохимического метода на основе авидин-биотинового пероксидазного кита «ABC-Vectastain» (Vector Lab., USA) с усилением окрашивания DAB с помощью CoCl2 и лазерной конфокальной микроскопии с использованием вторичных флюоресцентных антител (Invitrogen, USA).
Из большого количества положительно реагирующих гибридом выбирают те, супернатанты которых содержали аффинные моноклональные антитела к мембранным антигенам эндотелиоцитов церебральных микрососудов, после чего проводятся последовательные серии реклонирования и анализа супернатантов для каждой из этих гибридом.
Отбирается одна гибридома, продуцирующая моноклональные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов, характеризующаяся наибольшим процентом антитело-продуцирующих гибридных клеток с продукцией моноклональных антител, относящихся к классу G, сохраняющих биологическую активность в сыворотке крови лабораторного животного не менее 24 часов.
Отбор гибридомы, продуцирующей моноклональные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов, проводится по результатам конфокальной микроскопии. Определение класса иммуноглобулинов осуществляется по результатам изотипирования с помощью коммерческих сывороток (Sigma, USA). Изучение биологической активности антител в сыворотке крови лабораторного животного проводится по результатам иммунохимического тестирования на срезах головного мозга крысы после 24-часовой циркуляции моноклональных антител, введенных в кровеносное русло крысы.
Для выполнения последующих экспериментов гибридные клетки выбранной гибридомы вводятся внутрибрюшинно мышам Balb/c для получения асцита. Асцит также проверяется методами иммуногистохимии и иммунофлюоресценции, положительные пробы объединяются и хранятся в холодильнике глубокого холода (-80°). Гибридные клетки из асцита отделяют центрифугированием и либо снова вводятся в мышь, либо стерильно замораживаются в жидком азоте в среде с ДМСО и нормальной сывороткой лошади.
Данная технология позволяет в любое время провести размораживание гибридных клеток и, после процедуры реклонирования, снова ввести их в мышь и получить асцит в неограниченном количестве (не менее 300 мл асцита со средней концентрацией MAb 4 мг/мл). Полученные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов названы авторами, как анти-ВЕМР-1 антитела.
Для проведения иммуногистохимического анализа на специфичность и/или последующего создания векторных иммунолипосом анти-ВЕМР-1 антитела выделяются из полученного асцита с помощью аффинной хроматографии на протеин-G агарозе. Фракцию IgG отбирают под контролем фотометра, концентрируют методом ультрафильтрации и хранят при -20° в растворе 50% глицерина. Иммунохимическая целостность антител контролируется иммуногистохимически на каждом этапе очистки и концентрирования. Чистота полученных анти-ВЕМР-1 антител оценивается в диск-электрофорезе в ПААГ с SDS.
На тканевую и видовую специфичность анти-ВЕМР-1 антитела проверяются методом иммуногистохимического анализа на срезах других органов крысы и срезах головного мозга других животных.
Для оценки специфичности взаимодействия анти-ВЕМР-1 антител с эндотелиальными антигенами церебральных микрососудов проводят радиоиммунное исследование накопления меченых анти-ВЕМР-1 антител в микрососудах печени и мозга in vitro. Анти-ВЕМР-1 антитела и неспецифические IgG мыши (контроль) конъюгируют с радиоактивным I125 Т-хлораминовым методом (Fraker P.J. и Speck J.C.Jr). Препараты меченных I125 антител отделяют от свободного йода и инкубируют с препаратом нативных микрососудов из свежеприготовленного гомогената мозга крысы. В качестве контроля используют меченые неспецифические иммуноглобулины G мыши (IgG-I125). Расчет вводимой дозы проводят по удельной радиоактивности белковых препаратов (СРМ/мкг), точность расчетов проверяют по определению радиоактивности в образцах (СРМ/мл) с известной концентрацией белка. После инкубации с мечеными антителами препараты трехкратно отмывают 50-кратным объемом PBS методом центрифугирования по 10 мин при 50000 g. После отмывки препараты помещают в γ-счетчик и определяют общую и удельную радиоактивность сырого вещества микрососудов.
Для доказательств возможности осуществления предложенного способа с достижением заявленного назначения и указанного технического результата приводим следующие данные.
ПРИМЕР 1
Для получения препарата мембранных белков головного мозга к 50 г ткани головного мозга крысы добавляли 500 мл PBS, содержащего 5,5 mM глюкозу, 2 mМ ЭДТА, 4 mM фенилметилсульфонилфлуорид и апротинин в дозе 0,5 Ед/мл и измельчали в гомогенизаторе ЕТА 0010 в течение 30 секунд на максимальной скорости. Полученный гомогенат однократно пропускали через сито с диаметром пор 360 µm, а затем полученный фильтрат - двукратно через сито с диаметром пор 160 µm. Фильтрат центрифугировали при 1000 g в течение 10 мин. Осадок суспендировали в растворе декстрана Т-70 до конечной концентрации 15% (масса/об.), наслаивали по 10 мл на 25% раствор декстрана в пробирках по 50 мл и центрифугировали при 25000 g в течение 10 мин в бакетном роторе. Фракцию микрососудов, формировавших линию на интерфазе растворов декстрана различных плотностей, отбирали и повторно центрифугировали при 25000 g в течение 10 мин. Препарат микрососудов суспендировали в 50 мл дистиллированной воды, перемешивали в течение 2 часов при 4°С и центрифугировали 15000 g в течение 10 мин. Процедуру повторяли дважды, отбирая осадок. Осадок лизированных клеток растворяли в минимальном объеме H2O и озвучивали на ультразвуковом дезинтеграторе «G112SP1T» (Laboratory Supplies Co. Inc.) при частоте 80 кГц в течение 20 мин (3 раза) в охлажденной дистиллированной воде с детергентом Triton-Х100. Препарат центрифугировали при 25000 g в течение 10 мин, отбирая надосадок. Полученный гетерогенный препарат мембранных белков микрососудов мозга был охарактеризован методом диск-электрофореза (Фигура 1).
Полученная в результате градиентного центрифугирования в декстране и последующего осмотического лизиса очищенная фракция мембран эндотелиоцитов была использована для иммунизации и последующего слияния, в результате которого были получены несколько гибридом, продуцирующих антитела, визуализирующие на срезах головного мозга крысы микрососуды. Под контролем иммунофлюоресцентного анализа с использованием конфокальной микроскопии анализа была отобрана гибридома, продуцирующая моноклональные антитела (анти-ВЕМР-1 антитела), специфичные к аблюминальному мембранному антигену эндотелиоцитов церебральных микрососудов.
Первоначально клетки выбранной гибридомы были проведены через серию реклонирований под контролем высокочувствительного иммуногистохимического метода в авторской модификации на основе авидин-биотинового пероксидазного кита «ABC-Vectastain» (Vector Lab., USA) с усилением окрашивания DAB с помощью СоСl2. После проведения седьмой процедуры реклонирования супернатанты из 97% лунок окрашивали эндотелиоциты микрососудов мозга с одинаковой интенсивностью, что свидетельствовало об устойчивой секреции гибридными клетками моноклональных антител. Таким образом, было получено более 50 положительно реагирующих субклонов, из которых отобрали один, продуцирующий максимальное количество высококачественных анти-ВЕМР-1-антител к аблюминальному мембранному антигену микрососудов головного мозга под контролем иммунофлюоресцентного анализа с применением лазерной конфокальной микроскопии (Фигура 8, Г).
Для получения асцита гибридные клетки выбранной гибридомы в количестве 2×106 ввели внутрибрюшинно мышам Balb/c. He менее чем 7 дней после внутрибрюшинного введения гибридных клеток у мышей отбирали асцит. По ходу сбора асцит также проверялся методами иммуногистохимии и иммунофлюоресценции, положительные пробы объединяли и хранили в холодильнике глубокого холода (-80°).
С целью проведения иммуногистохимического анализа на специфичность и в последующем для создания векторных иммунолипосом для работ in vivo анти-ВЕМР-1 антитела были выделены из асцита мышей, иммунизированных препаратом мембранных белков церебральных эндотелиоцитов методом аффинной хроматографии на протеин-G-агарозе. Выход анти-ВЕМР-1 антител в аффинной хроматографии составлял не менее 50%.
Фракцию IgG (анти-ВЕМР-1 антител) отбирали под контролем фотометра, концентрировали методом ультрафильтрации и хранили при -20° в растворе 50% глицерина. Иммунохимическая функциональность антител контролировалась иммуногистохимически на каждом этапе очистки и концентрирования. Чистота полученных анти-ВЕМР-1 антител была оценена в диск-электрофорезе в ПААГ с SDS и составляла не менее 90%.
В дальнейшем, получив очищенный препарат антител анти-ВЕМР-1, авторы показали наличие большого количества антигена в препарате мембранных белков микрососудов мозга методом вестерн-иммуноблота.
Иммуногистохимический и иммунофлюоресцентный анализ очищенного препарата анти-ВЕМР-1 показал, что они прекрасно связываются с аблюминальным мембранным антигеном эндотелиоцитов церебральных микрососудов на срезах головного мозга крысы. Окрашивание микрососудов хорошо визуализировалось на срезах головного мозга крысы при использовании разведений от 1:1000 до 1:100000. При больших разведениях (1:200000, 1:300000) также микрососуды визуализировались при иммуногистохимии на срезах головного мозга крысы, но интенсивность окрашивания микрососудов значительно падала. При разведениях менее 1:1000 резко увеличивалось тонирование фона вследствие неспецифической сорбции антител. Рекомендуемый рабочий диапазон разведений полученного препарата анти-ВЕМР-1 антител для иммуногистохимии и иммунофлюоресценции на срезах головного мозга составляет 1:5000-1:10000.
Наиболее выраженная иммуногистохимическая реакция наблюдалось в ростральных отделах неокортекса, в гипоталамусе, в области коры мозжечка и в продолговатом мозге. Визуализировались как мелкие микрососуды (8-10 мкм), так и довольно крупные элементы сосудистого русла (100 и более мкм).
Абсорбция первичных антител сухой плазмой крови и экстрактами органов и тканей не влияла на интенсивность окрашивания. В то же время абсорбция гомогенатом ткани головного мозга приводила к резкому снижению интенсивности окрашивания, вплоть до его исчезновения. Наряду с окрашиванием микрососудов паренхимы мозга наблюдалось интенсивное окрашивание сосудистой системы оболочек мозга (пиальных микрососудов) и микрососудов хориоидального сплетения (Фигура 4).
В дальнейшем анти-ВЕМР-1 антитела проверялись на тканевую специфичность с помощью иммуногистохимического анализа на срезах других органов. Согласно выбранной схеме все супернатанты и асциты от субклонов выбранной гибридомы, а затем и очищенные анти-ВЕМР-1 антитела из асцита проверяли на срезах печени, сердца, легких, почки и селезенки (Фигура 5).
Таким образом, проведенное исследование показало, что анти-ВЕМР-1 визуализируют аблюминальный мембранный антиген, экспрессирующийся на аблюминальной поверхности эндотелиоцитов микрососудов мозга и в значительно меньшей степени - в микрососудах, локализующихся в слизистой и мышечной оболочках крупных бронхов. Это позволяет говорить о высокой тканевой специфичности анти-ВЕМР-1 антител.
Видовую специфичность анти-ВЕМР-1 антител характеризовали с помощью иммунопероксидазного и иммунофлюоресцентного анализа на срезах мозга крысы, мыши, кролика, быка и человека. На срезах мозга мыши определялось окрашивание микрососудов как с помощью иммунопероксидазной, так и иммунофлюоресцентной методик визуализации. При этом интенсивность окрашивания была несколько ниже, чем аналогичная на срезах мозга крысы. Это свидетельствовало о перекрестной иммунохимической реакции анти-ВЕМР-1 антител с гомологичными эпитопами мыши и крысы. На срезах мозга кролика, быка и человека положительной иммуногистохимической реакции на какие-либо структуры не наблюдалось. Таким образом, было сделано заключение об ограниченной видовой специфичности анти-ВЕМР-1 антител.
Для оценки специфичности взаимодействия анти-ВЕМР-1 антител с эндотелиальными антигенами церебральных микрососудов было проведено радиоиммунное исследование накопления меченых Анти-ВЕМР-1 в микрососудах печени и мозга in vitro. С этой целью выделенные из асцита анти-ВЕМР-1 антитела и неспецифические IgG мыши (контроль) конъюгировали с радиоактивным I125. Йодирование проводили Т-хлораминовым методом в соответствии с процедурой, описанной Fraker P.J. и Speck J.C.Jr. Препараты меченных I125 антител отделяли от свободного йода на микроколонках с Sephadex G-50. Содержание общего белка в препаратах определяли при помощи бицинхониновой кислоты (ВСА Protein Assay reagent, «Pierce», США).
Препарат нативных микрососудов получали из свежеприготовленного гомогената мозга крысы путем ультрацентрифугирования в ступенчатом градиенте декстрана Т-70.
Взвесь микрососудов разделили на равные аликвоты и проинкубировали в течение 12 часов с мечеными анти-ВЕМР-1 антителами (анти-ВЕМР-1-I125). В качестве контроля использовались меченые неспецифические иммуноглобулины G мыши (IgG-I125). Расчет вводимой дозы проводили по удельной радиоактивности белковых препаратов (СРМ/мкг), точность расчета проверяли путем непосредственного определения радиоактивности в образцах (СРМ/мл) с известной концентрацией белка. Удельная радиоактивность белковых препаратов существенно не отличалась: в различных сериях эксперимента колебания удельной радиоактивности для анти-ВЕМР-1-I125 и для IgG-I125 не выходили за пределы 3-5·105 СРМ/мкг. В этой связи стандартизацию вводимой дозы в опыте и в контроле проводили по общему белку. Оценивались следующие концентрации меченых антител: 50, 10, 5 и 1 мкг на аликвоту микрососудов. Все пробы исследовали в дублях.
После инкубации с мечеными антителами препараты трехкратно отмывали не менее чем 50-кратным объемом PBS с центрифугированием по 10 мин при 50000 g на каждом этапе отмывки. Полученный осадок помещали в γ-счетчик и определяли общую и удельную радиоактивность сырого вещества микрососудов. Результаты исследования представлены на гистограммах (Фигура 6, Фигура 7).
Было обнаружено достоверное накопление меченых анти-ВЕМР-1 антител в микрососудах мозга крысы. При этом наблюдался обратный дозозависимый эффект. При исходной концентрации анти-ВЕМР-1 антител 50 мкг/пробу соотношение радиоактивности мозг/печень составляло примерно 3:1. При уменьшении количества введенных антител степень специфического взаимодействия значительно возрастала и при концентрации 1 мкг/пробу в исходном препарате соотношение мозг/печень было около 20:1.
В контроле с мечеными неспецифическими IgG мыши эффекта захвата антител микрососудами мозга не наблюдалось. Независимо от введенного количества белка накопление метки в мозге колебалось от 2,12 до 4,1% от введенной дозы (Фигура 3). Накопление IgG-I125 в печеночных и церебральных микрососудах существенно не отличалось.
При сравнении захвата микрососудами мозга анти-ВЕМР-1-I125 антител и IgG-I125 также был выявлен эффект достоверно большего накопления первых, максимально выраженный при исходной концентрации антител 1 мкг/пробу. При дальнейшем повышении концентрации анти-ВЕМР-1-I125 происходило насыщение микрососудов антителами и доля захваченных антител от введенной дозы снижалась.
Полученные данные были воспроизведены в экспериментах in vitro на препаратах выделенных церебральных микрососудов несколько раз. В качестве второго контроля, кроме микрососудов печени, использовался препарат бессосудистой фракции мозга крысы. Суммарные данные всех экспериментов представлены на гистограмме (Фигура 6).
Накопление меченых анти-ВЕМР-1 антител в пересчете на вес сырого вещества церебральных микрососудов составило 19,79%/100 мг, что в 27 раз превышает их накопление в микрососудах печени и в 11,5 раз в бессосудистой фракции мозга. Накопление неспецифических IgG в церебральных микрососудах при этом составило 1,03%/100 мг.
Следующий эксперимент с использованием полученных авторами и очищенных анти-ВЕМР-1 антител проводился с оценкой иммунохимической активности и кинетики антител после введения в кровеносное русло лабораторного животного. Здоровым крысам (8) под кетаминовым наркозом в бедренную вену вводили по 1 мг анти-ВЕМР-1 антител (3 крысы), анти-GFAP-антител (3 крысы) и неспецифических IgG мыши (2 крысы). Через 10 и 30 минут, 1, 2, 3 и 12 часов из противоположной бедренной вены забирали 0,3 мл крови, центрифугировали и инкубировали полученную сыворотку крови со срезами головного мозга крысы (в качестве первичных антител) в разведениях 1:100, 1:500 и 1:1000. Результаты исследования представлены на Фигуре 5.
Инкубация с крысиной сывороткой, содержащей неспецифические IgG крысы, ни в одном из 3-х случаев не привела к окрашиванию срезов мозга крысы. В отличие от IgG, инкубация с образцами сыворотки, содержащей специфические моноклональные антитела, приводила к окрашиванию срезов мозга крысы. Последнее свидетельствует о способности длительно циркулировать в крови без потери иммунохимической активности.
Следующий эксперимент был проведен для оценки иммунохимической активности анти-ВЕМР-1 антител после введения в кровеносное русло крыс с экспериментальной глиомой С6. Трем крысам в бедренную вену было введено по 1 мг анти-ВЕМР-1 антител, ковалентно связанных с липосомальными наноконтейнерами, содержащими гадолиний DTPA, после чего через 24 часа циркуляции иммунолипосом в кровотоке проводили МРТ исследование головного мозга. Результаты МРТ сканирования по накоплению диагностической метки в местах экспресии ВЕМР-1 свидетельствует о способности анти-ВЕМР-1 антител длительно циркулировать в крови (не менее 24 часов) без потери иммунохимической активности и достигать антигена мишени живой клетки (аблюминальной поверхности церебральных эндотелиоцитов).
Таким образом, полученные авторами моноклональные анти-ВЕМР-1 антитела, вводимые в кровоток живой крысы, сохраняют иммунохимическую активность в плазме крови по крайней мере в течение не менее 24 часов после инъекции и способны достигнуть антигена мишени.
Предложенный способ может быть использован для получения аналогов у человека. Иммуногистохимический анализ эндотелиальных антигенов с помощью моноклональных антител, полученных предложенным авторами способом, может применяться в экспериментальных исследованиях in vitro и in vivo для характеристики сосудистой системы глиом.
1. Способ получения моноклональных антител к аблюминальному мембранному антигену церебральных эндотелиоцитов, при котором получают препарат мембранных белков церебральных эндотелиоцитов, иммунизируют им мышь линии Balb/C, выделяют В-лимфоциты селезенки этой мыши и сливают с клетками миеломы мыши линии Sp2/0-Ag14, получают гибридомы, тестируют супернатанты полученных гибридом иммунохимически и отбирают гибридомы, продуцирующие моноклональные антитела к аблюминальному мембранному антигену церебральных эндотелиоцитов, из них выбирают гибридому, характеризующуюся наибольшим количеством антителопродуцирующих гибридных клеток, синтезирующих антитела, относящиеся к классу иммуноглобулинов G, сохраняющие биологическую активность в сыворотке крови не менее 24 ч, выделяют моноклональные антитела из супернатанта выбранной гибридомы.
2. Способ по п.1, отличающийся тем, что выделение моноклональных антител из супернатанта выбранной гибридомы проводят методом аффинной хроматографии на протеин-G-агарозе.