Способ лечения диабета ii типа и ожирения, осмотическое устройство для доставки и способ его изготовления
Иллюстрации
Показать всеИзобретение относится к медицине и касается осмотического устройства для доставки, способствующего высвобождению эксенатида с постоянной скоростью в диапазоне от приблизительно 5 мкг/сут до приблизительно 160 мкг/сут. Настоящее изобретение также касается способа лечения диабета II типа у субъекта и способа лечения ожирения у субъекта. Изобретение обеспечивает улучшенную согласованность лечения, повышенную эффективность лечения, улучшенное качество жизни для излечиваемых субъектов (по сравнению с лечением путем инъекций) и возможность немедленного прерывания лечения путем удаления осмотического устройства для доставки. 4 н. и 11 з.п. ф-лы, 5 табл., 5 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к органической химии, химии фармацевтических составов и химии пептидов, к фармацевтическим исследованиям и разработке лекарственных препаратов. Объекты настоящего изобретения включают суспензионные составы инсулинотропных пептидов для применения при лечении заболеваний и состояний млекопитающих.
Уровень техники
Глюкагоноподобный пептид-1 (GLP-1) является важным гормоном и представляет собой фрагмент молекулы проглюкагона человека. GLP-1 подвергается быстрому метаболизму под действием пептидазы (дипептидилпептидазы IV или ДПП-IV). Его фрагмент, амид глюкагоноподобного пептида-1(7-36) (глюкагоноподобный инсулинотропный пептид или GLIP), является пептидом желудочно-кишечного тракта, который усиливает высвобождение инсулина в физиологических концентрациях (GutniakM. и др., N. Engl. J. Med. (1992), 14 мая, т.326, №20, сс.1316-1322). GLP-1 и амид GLP-1 (7-36) относятся к инкретинам. Инкретины являются гормонами желудочно-кишечного тракта, которые приводят к увеличению количества инсулина, высвобождаемого бета-клетками после приема пищи.
Потребление пищи и возбуждение симпатической нервной системы стимулирует секрецию GLP-1 в тонком кишечнике млекопитающих. Более того, GLP-1 стимулирует продуцирование и секрецию инсулина, высвобождение соматостатина, утилизацию глюкозы за счет повышения чувствительности к инсулину, а также, по данным испытаний на моделях животных, стимулирует функцию и пролиферацию бета-клеток.
Амид GLP-1 (7-36) и GLP-1 (7-37) нормализуют гипергликемию натощак у пациентов с диагнозом диабета типа 2 (Nauck M.A. и др., Diabet. Med., т.15, №11, сс.937-945 (1998)).
Эксендин-4, миметик инкретина (т.е. имитирующий физиологическое действие инкретина), выделенный из яда Heloderma suspectum (Eng J. и др., J. Biol. Chem., т.267, сс.7402-7405 (1992)), в структурном отношении близок инкретину - амиду GLP-1 (7-36). Эксендин-4 и амид фрагмента эксендина (9-39) специфично взаимодействуют с рецепторами GLP-1 клеток инсулиномы и мембран легких (Goke R. и др., J. Biol. Chem., т.268, сс.19650-19655 (1993)). Эксендин-4 приблизительно на 53% гомологичен GLP-1 человека (Pohl М. и др., J. Biol. Chem., т.273, сс.9778-9784 (1998)). С другой стороны, в отличие от GLP-1, эксендин-4 устойчив к расщеплению под действием ДПП-IV. Такая устойчивость связана с заменой остатка глицина (Young A.A. и др., Diabetes, т.48, №5, сс.1026-1034 (1999)).
Раскрытие изобретения
Настоящее изобретение относится к суспензионным составам, включающим состав частиц и суспензию носителя, а также к устройствам, содержащим указанные составы, способам получения таких составов и устройств и способам их применения.
Один объект настоящего изобретения относится к суспензионному составу, включающему состав частиц, состоящий из инсулинотропного пептида и одного или более стабилизаторов, выбранных из группы, включающей углеводы, антиоксиданты, аминокислоты, буферные растворы и неорганические соединения. Кроме того, суспензионный состав состоит из неводной однофазной суспензии носителя, состоящей из одного или более полимеров и одного или более растворителей. Суспензия носителя представляет собой вязкую жидкость, в которой диспергирован состав частиц.
В другом объекте настоящего изобретения суспензионный состав состоит из частиц, состоящих из инсулинотропного пептида, дисахарида (например, сахарозы), метионина и буферного вещества (например, цитрата) и неводной однофазной суспензии носителя, включающей один или более полимеров пирроллидонового (например, поливинилпирроллидон) и один или более растворителей (например, лауриллактат, лауриловый спирт, бензилбензоат или их смеси).
Примеры инсулинотропных пептидов включают (не ограничиваясь только ими) глюкагоноподобный пептид-1 (GLP-1), эксенатид и их производные или аналоги. В одном варианте осуществления настоящего изобретения в качестве инсулинотропного пептида используют амид GLP-1 (7-36). В другом варианте в качестве инсулинотропного пептида используют эксенатид.
Кроме того, составы частиц по настоящему изобретению могут включать буферное вещество, выбранное, например, из группы, состоящей из цитрата, гистидина, сукцината и их смесей.
Кроме того, составы частиц по настоящему изобретению могут включать неорганическое соединение, выбранное, например, из группы, включающей цитрат, гистидин, сукцинат и их смеси с NaCl, Na2SO4, NаНСО3, КСl, КН2РО4, CaCl2 и MgCl2.
Один или более стабилизаторов в составе частиц могут включать, например, углевод, выбранный из группы, включающей лактозу, сахарозу, трегалозу, маннит, целлобиозу и их смеси.
Один или более стабилизаторов в составе частиц могут включать, например, антиоксидант, выбранный из группы, включающей метионин, аскорбиновую кислоту, тиосульфат натрия, этилендиаминтетрауксусную кислоту (ЭДТУ), лимонную кислоту, цистеины, тиоглицерин, тиогликолевую кислоту, тиосорбит, бутилированный гидроксианизол, бутилированный гидрокситолуол и пропилгаллат и их смеси.
Один или несколько стабилизаторов в составе частиц могут содержать аминокислоту.
В одном варианте осуществления настоящего изобретения растворитель для суспензии носителя выбирают из группы, содержащей лауриллактат, лауриловый спирт, бензилбензоат и их смеси. В качестве полимера для получения суспензии носителя используют, например, пирролидон (например, поливинилпирроллидон). В предпочтительном варианте в качестве полимера используют пирролидон, а в качестве растворителя бензил бензоат.
Общее содержание влаги в суспензии, как правило, составляет приблизительно менее 10 мас.%, в более предпочтительном варианте приблизительно менее 5 мас.%.
Для хранения и доставки суспензионного состава по настоящему изобретению можно использовать имплантируемое устройство для доставки лекарственного средства. В одном варианте устройство является осмотическим устройством доставки.
Суспензионный состав по настоящему изобретению можно использовать для лечения множества заболеваний и состояний у субъекта, нуждающегося в лечении, например диабета II типа. В одном варианте настоящего изобретения имплантируемое устройство для доставки обеспечивает доставку суспензионного состава по настоящему изобретению, в основном, при постоянной скорости в течение от приблизительно 1 месяца до приблизительно года. Устройство можно, например, имплантировать подкожно в требуемом участке организма.
Настоящее изобретение также включает способ получения суспензионного состава, состава частиц, суспензии носителя и устройств по настоящему изобретению, как описано в данном контексте.
Осуществимость указанных и других вариантов настоящего изобретения будет без труда понятна для среднего уровня специалиста из нижеследующего описания.
Краткое описание чертежей
На фиг.1 и 2 приведены последовательности двух примеров инсулинотропных пептидов: фиг.1 - амид глюкагоноподобного пептида 1 (7-36) (амид GLP-1(7-36)) (SEQ ID NO:1), и фиг.2 - синтетический пептид эксенатид (SEQ ID NO:2).
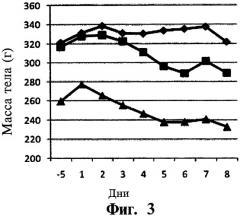
На фиг.3 приведены данные для группы исследуемых животных со средней массой тела, которым непрерывно вводили эксенатид с использованием устройства DUROS® (ALZA Corporation, Mountain View CA, лицензированная фирма Intarcia Therapeutics, Inc., Hayward CA). На вертикальной оси указана масса тела в граммах (масса тела (г)), на горизонтальной оси указано время (дни). В группу 1 включали животных с диабетом тучных (ромбы, контрольная группа), которым один раз в сутки вводили 0 мкг эксенатида с использованием устройства DUROS®. В группу 2 включали животных с диабетом тучных (квадраты), которым один раз в сутки вводили 20 мкг эксенатида с использованием устройства DUROS®. В группу 3 включали животных с диабетом тощих (треугольники), которым один раз в сутки вводили 20 мкг эксенатида.
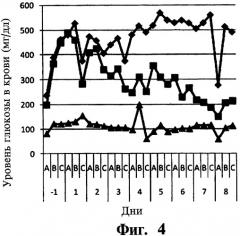
На фиг.4 представлены данные для группы исследуемых животных по среднему содержанию глюкозы в крови, которым непрерывно вводили эксенатид с использованием устройства DUROS®. На вертикальной оси указаны средние значения содержания глюкозы в крови в мг/дл (содержание глюкозы в крови (мг/дл)), на горизонтальной оси указано время (дни), где в каждый день определяли три значения содержания глюкозы в крови (А, В, С). В день -1А и день 8А указано содержание глюкозы в крови натощак. В группу 1 включали животных с диабетом тучных (ромбы, контрольная группа), которым один раз в сутки вводили 0 мкг эксенатида. В группу 2 включали животных с диабетом тучных (квадраты), которым один раз в сутки вводили 20 мкг эксенатида с использованием устройства DUROS®. В группу 3 включали животных с диабетом тощих (треугольники), которым один раз в сутки вводили 20 мкг эксенатида с использованием устройства DUROS®.
На фиг.5 приведены данные для группы исследуемых животных по среднему значению гемоглобина, которым непрерывно вводили эксенатид с использованием устройства DUROS®. На вертикальной оси указаны значения НbА1 в процентах (НbА1 (%)), на горизонтальной оси указано время (дни). В группу 1 включали животных с диабетом тучных (ромбы, контрольная группа), которым один раз в сутки вводили 0 мкг эксенатида. В группу 2 включали животных с диабетом тучных (квадраты), которым один раз в сутки вводили 20 мкг эксенатида. В группу 3 включали животных с диабетом тощих (треугольники), которым один раз в сутки вводили 20 мкг эксенатида с использованием устройства DUROS®.
Осуществление изобретения
Все патенты, публикации и патентные заявки, цитированные в настоящем описании изобретения, включены в описание в полном объеме в качестве ссылок.
1.0.0 Определения
Необходимо понимать, что используемая в данном контексте терминология используется для описания отдельных вариантов осуществления настоящего изобретения (не ограничиваясь ими). Как указано в подробном описании и формуле настоящего изобретения, существительные в единственном числе включают также множественное число, если в тексте не указано иное. Так, например, ссылка на "растворитель" включает комбинацию двух и более растворителей, ссылка на "пептид" включает один или более пептидов, их смесь и т.п.
В случае, если не указано иное, все технические и научные термины, используемые в данном контексте, имеют те же стандартные значения, которые обычно известны специалистам в данной области техники. Несмотря на то что на практике можно использовать другие способы и материалы, аналогичные или эквивалентные описанным, в данном контексте описаны предпочтительные материалы и способы.
В описании и формуле настоящего изобретения была использована следующая терминология.
Термины "пептид", "полипептид" и "белок" используются в данном контексте взаимозаменяемо и обычно означают молекулу, включающую одну, две или более остатков аминокислот (например, обычно, L-аминокислоты, но также включают, например, D-аминокислоты, модифицированные аминокислоты, аналоги аминокислот и/или миметики аминокислот). Пептиды также содержат дополнительные группы, модифицирующие аминокислотный остаток, например функциональные группы, образующиеся в результате посттрансляционной модификации. Примеры посттрансляционных модификаций включают, не ограничиваясь только ими, ацетилирование, алкилирование (включая метилирование), биотинилирование, глутамилирование, глицилирование, гликозилирование, изопренилирование, липоилирование, введение остатков фосфопантетеина, фосфорилирование, селенирование и амидирование по С-концевому остатку. Термин пептид также включает модификацию пептида по С-концевому или N-концевому аминокислотному остатку. Модификация по N-концевой аминогруппе включает (не ограничиваясь только ими) дезаминирование, N-(низш.)алкил-, N-(ди-низш.)алкил- и N-ацил- модификацию. Модификация по С-концевой группе включает (не ограничиваясь только ими) амидирование, (низш.) алкиламидирование, диалкиламидирование и (низш.) алкилэтерификацию (например, (низш.) алкил означает С1-C4алкил).
Концевой аминокислотный остаток пептидной цепи обычно содержит свободную аминогруппу (т.е. N-концевую аминогруппу). Аминокислотный остаток с другого конца цепи обычно содержит свободную карбоксильную группу (т.е., концевую карбоксильную группу). Обычно, аминокислотные остатки в составе пептида нумеруются, начиная с N-концевого аминокислотного остатка до С-концевого аминокислотного остатка.
Термин "аминокислотный остаток", использованный в данном контексте, относится к аминокислоте, которая присоединена через амидную связь или миметик амидной связи.
Термин "инсулинотропный", использованный в данном контексте, относится к способности соединения, например, пептида, стимулировать или влиять на продуцирование и/или активность инсулина (например, инсулинотропный гормон). Указанные соединения обычно стимулируют секрецию или биосинтез инсулина в организме субъекта.
Термин "инсулинотропный пептид", использованный в данном контексте, включает (не ограничиваясь только ими) глюкагоноподобный пептид 1 (GLP-1), а также его производные и аналоги, и эксенатид, а также его производные и аналоги.
Термин "носитель", использованный в данном контексте, относится к среде, предназначенной для переноса соединения. Носители по настоящему изобретению обычно включают компоненты, такие как растворители и полимеры. Суспензии носителя по настоящему изобретению обычно включают растворители и полимеры, предназначенные для получения суспензионных составов частиц полипептида.
Термин "разделение фаз", использованный в данном контексте, относится к образованию нескольких фаз (например, жидкая и гелеобразная фаза) в суспензии носителя, например, если суспензия носителя взаимодействует с водной средой. В некоторых вариантах осуществления настоящего изобретения суспензия носителя разделяется на фазы при контактировании с водной средой, содержание воды в которой составляет менее приблизительно 10%.
Термин "однофазный", использованный в данном контексте, относится к твердой, полутвердой или жидкой гомогенной системе, которая полностью однородна в физическом и химическом отношении.
Термин "диспергированный", использованный в данном контексте, относится к растворению, диспергированию, суспендированию или иному распределению соединения, например, пептида в суспензии носителя.
Термин "химически стабильный", использованный в данном контексте, относится к образованию в составе в течение определенного времени продуктов распада, в приемлемом процентном соотношении и образующихся в ходе химического процесса, такого как деамидирование (обычно, в условиях гидролиза), агрегация или окисление.
Термин "физически стабильный", использованный в данном контексте, относится к образованию в составе агрегатов (например, димеров или других продуктов большей молекулярной массы) в приемлемом процентном соотношении. Кроме того, в физически стабильном составе не изменяется физическое состояние, как, например, не происходит переход из жидкого состояния в твердое или из аморфного в кристаллическое.
Термин "вязкость", использованный в данном контексте, относится к соотношению напряжения сдвига к скорости сдвига (см., например, Considine D.M. & Considine G.D. Encyclopedia of Chemistry, 4-е изд., VanNostrand, Reinhold, NY, 1984), которое рассчитывают по следующему уравнению:
F/A=µ·V/L
где F/A - обозначает напряжение сдвига (сила на единицу площади),
µ - означает коэффициент пропорциональности (вязкость) и
V/L - скорость, деленная на толщину слоя (скорость сдвига).
Вязкость определяют по указанному уравнению соотношения напряжения сдвига к скорости сдвига. Измерения напряжения сдвига и скорости сдвига, как правило, проводят с использованием реометра с плоскопараллельными пластинами при выбранных условиях (например, при температуре приблизительно 37°С). Другие методы определения вязкости включают измерение кинематической вязкости с использованием вискозиметра, например вискозиметр Каннон-Фенске, вискозиметр Уббелоде для непрозрачных растворов Каннон-Фенске или вискозиметр Оствальда. Как правило, суспензия носителя по настоящему изобретению характеризуется вязкостью, достаточной для предотвращения оседания суспендированных в суспензии частиц в процессе хранения и применения для доставки, например, в имплантируемом устройстве для доставки лекарственного средства.
Термин "неводный", использованный в данном контексте, относится к общему содержанию влаги, например, в суспензионном составе, которое обычно составляет приблизительно 10 мас.%, или предпочтительно менее приблизительно 5 мас.% и более предпочтительно менее приблизительно 4 мас.%.
Термин "субъект", использованный в данном контексте, относится к любому члену подтипа хордовых, включая (не ограничиваясь только ими) человека и других приматов, включая нечеловекообразных приматов, таких как резус-макаки, шимпанзе и другие виды мартышек и обезьян, сельскохозяйственных животных, таких как крупный рогатый скот, овцы, свиньи, козы и лошади, домашние млекопитающие, такие как собаки и кошки, лабораторные животные, включая грызунов, таких как мыши, крысы и морские свинки, птицы, включая домашних, диких и промысловых, таких как курица, индейка и другая птица, утки, гуси и т.п. Указанный термин не относится к определенному возрасту. Таким образом, в настоящее изобретение включены взрослые и новорожденные особи.
Используемые в данном контексте термины "лекарственное средство", "терапевтический агент" и "ценный агент" используются взаимозаменяемо и относятся к любой терапевтически активной субстанции, которую требуется доставить в организм для достижения благоприятного эффекта. В другом варианте лекарственным средством является инсулинотропный пептид, например GLP-1, эксенатид и их производные и аналоги. Устройства и методы по настоящему изобретению являются пригодными для доставки пептидов и низкомолекулярных соединений и их комбинаций.
Термин "устройство осмотической доставки", использованный в данном контексте, обычно относится к устройству, используемому для доставки одного или более ценных агентов (например, инсулинотропного пептида) субъекту, в организм которого имплантировано указанное устройство, например резервуар (изготовленный, например, из титанового сплава) с полостью, в которой содержится суспензионный состав (например, включающий инсулинотропный пептид) и состав осмотического агента. В резервуаре установлен клапан, отделяющий суспензионный состав от состава осмотического агента. С одной стороны резервуара, соседней с составом осмотического агента, расположена полупроницаемая мембрана, а с другой стороны резервуара, соседней с суспензионным составом, расположен регулятор потока, который ограничивает выходное отверстие, через которое суспензионный состав высвобождается из устройства. Обычно, устройство осмотической доставки имплантируют субъекту, например подкожно (например, с внешней, внутренней или задней стороны плеча или в брюшную полость).
2.0.0 Краткое описание изобретения
Следует понимать, что настоящее изобретение не ограничивается конкретными типами доставки лекарственного средства, конкретными типами устройств для доставки лекарственного средства, конкретными источниками пептидов, конкретными растворителями, конкретными полимерами и т.п., так как применение таких конкретных объектов следует из настоящего описания. Следует также понимать, что представленная в данном контексте терминология необходима только для описания конкретных вариантов осуществления настоящего изобретения, не ограничиваясь только ими.
В одном объекте настоящее изобретение относится к суспензионному составу, включающему состав частиц и суспензию носителя. Состав частиц содержит (не ограничиваясь только ими) инсулинотропный пептид и один или более стабилизаторов. Один или более стабилизаторов, как правило, выбирают из группы, состоящей из углеводов, антиоксидантов, аминокислот и буферных веществ. Суспензия носителя, как правило, представляет собой неводную, однофазную суспензию носителя, включающую один или более полимеров и один или более растворителей. Суспензия носителя представляет собой жидкость с соответствующими вязкостными характеристиками, в которой равномерно распределен состав частиц.
В одном варианте осуществления настоящего изобретения инсулинотропным пептидом является глюкагоноподобный пептид-1 (GLP-1) или производное GLP-1 (например, амид GLP-1 (7-36)) или аналог GLP-1.
В другом варианте инсулинотропным пептидом является эксенатид, или производное эксенатида, или аналог эксенатида.
Состав частиц по настоящему изобретению обычно включает один или более следующих стабилизаторов: один или более углеводов (например, дисахарид, такой как лактоза, сахароза, треглаоза, целлобиоза и их смеси), один или более антиоксидантов (например, метионин, аскорбиновая кислота, тиосульфат натрия, этилендиаминтетрауксусная кислота (ЭДТУ), лимонная кислота, бутилированный гидрокситолуол и их смеси) и одно или более буферных веществ (например, цитрат, гистидин, сукцинат и их смеси). В предпочтительном варианте состав частиц содержит инсулинотропный пептид, сахарозу, метионин и цитрат. Соотношение инсулинотропного пептида и общего количества сахарозы и метионина обычно составляет приблизительно 1:20, приблизительно 1:10, приблизительно 1:5, приблизительно 1:2, приблизительно 5:1, приблизительно 10:1 или приблизительно 20:1, предпочтительно от приблизительно 1:5 до 5:1, наиболее предпочтительно от приблизительно 1:3 до 3:1. Состав частиц получают методом высушивания с распылением, и он характеризуется низким содержанием влаги, которое предпочтительно равно приблизительно 10 мас.% или менее, наиболее предпочтительно равно приблизительно 5 мас.% или менее. В другом варианте состав частиц высушивают лиофильно.
Суспензия носителя по настоящему изобретению включает один или более растворителей и один или более полимеров. Предпочтительно растворитель выбран из группы, включающей лауриллактат, лауриловый спирт, бензилбензоат и их смеси. Более предпочтительно в качестве растворителя используют лауриллактат или бензилбензоат. Предпочтительно в качестве полимера используют пирролидон. В некоторых вариантах в качестве полимера используют поливинилипирролидон (например, поливинилпирроллидон К-17, средняя молекулярная масса которого обычно составляет 7900-10800). В одном варианте растворитель в основном включает бензилбензоат и поливинилипирролидон.
Содержание влаги в суспензионном составе составляет как правило низкую величину, например, равно приблизительно 10 мас.% или менее и в наиболее предпочтительном варианте равно приблизительно 5 мас.% или менее.
В другом объекте настоящего изобретения предлагается имплантируемое устройство для доставки лекарственного средства, включающее суспензионный состав по настоящему изобретению. В предпочтительном варианте устройство доставки лекарственного средства является осмотическим устройством.
Кроме того, настоящее изобретение включает способы получения суспензионного состава по настоящему изобретению, а также устройства осмотической доставки, содержащие суспензионный состав по настоящему изобретению. В одном варианте предлагается способ получения устройства осмотической доставки, который заключается в том, что резервуар устройства осмотической доставки заполняют суспензионным составом.
В другом объекте настоящего изобретения предлагается способ лечения диабета (например, сахарного диабета типа 2 или гестационного диабета) у субъекта, нуждающегося в таком лечении, который заключается в том, что доставку суспензионного состава по настоящему изобретению осуществляют из устройства осмотической доставки в основном при постоянной скорости. Как правило, доставка суспензии происходит в течение от приблизительно одного месяца до приблизительно одного года, предпочтительно от приблизительно трех месяцев до приблизительно одного года. Кроме того, способ заключается в подкожной имплантации в организм субъекта устройства осмотической доставки, заполненного суспензионным составом по настоящему изобретению.
В других объектах настоящего изобретения предлагаются способы стимуляции секреции инсулина, подавления секреции глюкагона, замедления опорожнения желудка, лечения связанных с диабетом расстройств, лечения гипергликемии, лечения ожирения, контроля аппетита, снижения массы тела и регуляции перистальтики желудочно-кишечного тракта.
2.1.0 Составы и композиции
2.1.1. Составы частиц
В одном объекте настоящего изобретения предлагается фармацевтическая композиция, которая включает суспензионный состав инсулинотропного пептида, например GLP-1 или эксенатида. Суспензионный состав включает неводный однофазный носитель, содержащий по крайней мере один полимер и по крайней мере один растворитель. Предпочтительно носитель представляет собой жидкость с соответствующими вязкостными характеристиками. Пептидный компонент включает инсулинотропный пептид в виде состава частиц, диспергированных в носителе. Обычно состав частиц включает стабилизирующий компонент, состоящий из одного или более стабилизаторов, выбранных из углеводов, антиоксидантов, аминокислот, буферных веществ и неорганических соединений.
Инсулинотропные пептиды по настоящему изобретению, используемые на практике, включают (не ограничиваясь только ими) GLP-1 и эксенатид. В статье Bell G.I. и др., Nature, т.302, сс.716-718 (1983) установлено, что проглюкагон (Lund и др. Proc. Natl. Acad. Sci. U.S.A., т.79, сс.345-349 (1982), Patzelt и др. Nature, т.282, сс.260-266 (1979)) состоит из трех отдельных высокогомологичных фрагментов пептидов, которые относятся к глюкагону, глюкагоноподобному пептиду-1 (GLP-1) и глюкагоноподобному пептиду-2 (GLP-2). В статье Lopez и др. Proc. Natl. Acad. Sci. U.S.A., т.80, сс.5485-5489 (1983), установлено, что пептид GLP-1 состоит 37 аминокислотных остатков, а пептид GLP-2 состоит из 34 аминокислотных остатков.
При изучении структуры проглюкагона крыс был установлен сходный механизм протеолитического расщепления, приводящий к образованию глюкагона, GLP-1 и GLP-2 (Heinrich G. и др. Endocrinol., т.115, сс.2176-2181 (1984)). Было установлено, что последовательности GLP-1 человека, крысы, быка и хомяка характеризуются идентичной структурой (Ghiglione M. и др. Diabetologia, т.27, сс.599-600 (1984)).
При расщеплении проглюкагона сначала образуется GLP-1 (1-37), пептид, состоящий из 37 аминокислотных остатков и обладающий низкой инсулинотропной активностью. Последующее расщепление пептидной связи между 6 и 7 аминокислотными остатками приводит к образованию биологически активного GLP-1, так называемого GLP-1 (7-37) (согласно установленной нумерации N-концевой остаток GLP-1 (7-37) соответствует аминокислотному остатку номер 7, а С-концевой остаток остатку номер 37). Приблизительно 80% GLP-1 (7-37), образующегося в организме млекопитающего, содержит С-концевой остаток в виде амида, который образуется после отщепления С-концевого остатка глицина в L-клетках, что приводит к образованию амида GLP-1 (7-36). Биологическое действие и метаболическое превращение GLP-1 (7-37) в форме кислоты и амида GLP-1 (7-36) в основном происходят по одинаковому механизму. Последовательность амида GLP-1 (7-36) представлена на фиг.1. Было установлено, что GLP-1 (включая три формы пептида, GLP-1 (1-37), GLP-1 (7-37) и амид GLP-1 (7-36), а также аналоги GLP-1) стимулирует секрецию инсулина (т.е. является инсулинотропным), который вызывает потребление клетками глюкозы и приводит к уменьшению уровня глюкозы в сыворотке крови (см., например, статью Mojsov S. Int. J. Peptide Protein Research, т.40, сс.333-343 (1992)). Другим аналогом GLP-1 является устойчивый к ДПП-4 агонист рецептора GLP-1 пролонгированного действия, лираглютид, который характеризуется 97% гомологией с GLP-1 (7-37). Лираглютид также называют NN-2211 и [Arg34, Lys26]-(N-ε-(γ-Glu(N-α-гeкcaдeкaнoил))-GLP-1 (7-37) (см., например, патент US №6969702).
Многие производные и аналоги GLP-1, обладающие инсулинотропным действием, известны в данной области техники (см., например, патенты US №№5118666, 5120712, 5512549, 5545618, 5574008, 5574008, 5614492, 5958909, 6191102, 6268343, 6329336, 6451974, 6458924, 6514500, 6593295, 6703359, 6706689, 6720407, 6821949, 6849708, 6849714, 6887470, 6887849, 6903186, 7022674, 7041646, 7084243, 7101843, 7138486, 7141547, 7144863 и 7199217). Для простоты изложения семейство GLP-1, его производных и аналогов, обладающих инсулинотропной активностью, в данном контексте называется GLP-1.
Желудочный ингибиторный пептид (GIP) также относится к инсулинотропным пептидам (Efendic S. и др. Horm. Metab. Res., т.36, сс.742-746 (2004)). Гормон GIP секретируется слизистой оболочкой двенадцатиперстной кишки и тонкой кишки в ответ на потребление жиров и углеводов, которые стимулируют секрецию инсулина поджелудочной железой. GIP также известен как глюкозозависимый инсулинотропный полипептид. GIP представляет собой пептид, состоящий из 42 аминокислотных остатков и проявляющий регуляторную функциюй желудочно-кишечного тракта, которая заключается в стимуляции секреции инсулина бета-клетками поджелудочной железы в присутствии глюкозы (Tseng С. и др. PNAS, т.90, сс.1992-1996 (1993)).
Эксендины представляют собой пептиды, выделенные из яда ящерицы ядозуба Heloderma suspectum. Эксендин-4 также выделен из яда Heloderma suspectum (Eng J. и др. J. Biol. Chem., т.265, сс.20259-20262 (1990), Eng J. и др. J. Biol. Chem., т.267, сс.7402-7405 (1992), патент US №5424286). Эксендины обладают определенной степенью гомологии с некоторыми членами семейства глюкагоноподобных пептидов, наибольшая степень гомологии - 53% наблюдается по сравнению с амидом GLP-1 (7-36) (Goke и др. J. Biol. Chem., т.268, сс.19650-19655 (1993)).
Эксендин-4 взаимодействует с рецепторами GLP-1 клеток бета-ТС1, секретирующих инсулин, с рассеянными ациноцитами поджелудочной железы морской свинки и с париетальными клетками желудка. Пептид эксендин-4 также стимулирует высвобождение соматостатина и ингибирует высвобождение гастрина в изолированном желудке (Goke и др. J. Biol. Chem., т.268, сс.19650-19655 (1993), Schepp и др. Eur. J. Pharmacol., т.69, сс.183-191 (1994), Eissele и др. Life Sci., т.55, сс.629-634 (1994)). Предполагают, что инсулинотропную активность эксендина-3 и эксендина-4 можно использовать для лечения сахарного диабета и профилактики гипергликемии (патент US №5424286).
В указанной области техники известно множество производных и аналогов эсзендина-4 (включая, например, агонисты эксендина-4), проявляющих инсулинотропную активность (см., например, US патенты №№5424286, 6268343, 6329336, 6506724, 6514500, 6528486, 6593295, 6703359, 6706689, 6767887, 6821949, 6849714, 6858576, 6872700, 6887470, 6887849, 6924264, 6956026, 6989366, 7022674, 7041646, 7115569, 7138375, 7141547, 7153825 и 7157555). Эксенатид является синтетическим пептидом, состоящим из 39 аминокислотных остатков аналогичной последовательности по сравнению эксендином-4. Эксенатид является миметиком инкретина, который обладает глюкорегуляторной активностью, аналогичной гормональной активности семейства инкретинов, глюкагоноподобного пептида-1 (GLP-1) млекопитающих. Гормоны семейства инкретина вызывают возрастание количества высвобождаемого инсулина, когда уровень глюкозы находится в норме или, прежде всего, когда указанный уровень повышен. Гормоны семейства инкретина проявляют также активность, определяемую секрецией инсулина, например они снижают продуцирование глюкагона и замедляют опорожнение желудка. Кроме того, гормоны семейства инкретина могут увеличить чувствительность к инсулину и могут повышать регенерацию островковых клеток.
Для простоты изложения в данном контексте семейство пептидов, эксендинов-4, включая его синтетические аналоги (например, эксенатид), производные и аналоги, обладающие инсулинотропной активностью, называются эксенатидом.
В одном объекте настоящего изобретения предлагается состав частиц инсулинотропных пептидов, который можно использовать для получения суспензионного состава. Инсулинотропные пептиды по настоящему изобретению не ограничиваются способами синтеза или получения и включают пептиды, полученные из природных источников, или синтезированные или полученные рекомбинантным методом (получены с использованием кДНК или геномной ДНК), синтетическим, трансгенным и генно-активированным методами. В предпочтительных вариантах осуществления настоящего изобретения инсулинотропным пептидом является GLP-1 или эксендин (как указано выше), например амид GLP-1 (7-36) или эксенатид. Настоящее изобретение также включает комбинации двух или более инсулинотропных пептидов, например амида GLP-1 (7-36) и GIP.
Состав частиц по настоящему изобретению предпочтительно проявляет химическую и физическую стабильность по крайней мере в течение 1 месяца, предпочтительно по крайней мере 3 месяцев, более предпочтительно по крайней мере 6 месяцев, наиболее предпочтительно по крайней мере 12 месяцев при температуре доставки лекарственного средства. Температура, при которой происходит доставка, обычно составляет нормальную температуру тела человека, например приблизительно 37°С, или немного выше, например приблизительно 40°С. Кроме того, состав частиц по настоящему изобретению предпочтительно характеризуется химической и физической стабильностью в течение по крайней мере 3 месяцев, предпочтительно по крайней мере 6 месяцев, наиболее предпочтительно по крайней мере 12 месяцев при температуре хранения. Типичная температура хранения включает температуру хранения в холодильнике, например приблизительно 5°С, или комнатную температуру, например приблизительно 25°.
Составы частиц являются химически стабильными, если при доставке в течение приблизительно 3 месяцев, предпочтительно приблизительно 6 месяцев, предпочтительно приблизительно 12 месяцев при температуре доставки и при хранении в течение приблизительно 6 месяцев, приблизительно 12 месяцев и предпочтительно приблизительно 24 месяца при температуре хранения образуется менее приблизительно 25%, предпочтительно менее приблизительно 20%, наиболее предпочтительно менее приблизительно 15%, наиболее предпочтительно менее приблизительно 10% и наиболее предпочтительно менее приблизительно 5% продуктов распада частиц пептидов.
Составы частиц являются физически стабильными, если при доставке в течение приблизительно 3 месяцев, предпочтительно приблизительно 6 месяцев при температуре доставки и при хранении в течение приблизительно 6 месяцев, предпочтительно приблизительно 12 месяцев при температуре хранения образуется менее приблизительно 10%, предпочтительно менее приблизительно 5%, наиболее предпочтительно менее приблизительно 3%, наиболее предпочтительно менее приблизительно 1% агрегатов частиц пептидов.
Для повышения стабильности белка, как правило, раствор инсулинотропного пептида хранят в замороженном или лиофилизированном состоянии или в виде твердого вещества, полученного высушиванием при распылении. Тст. (температура стеклования) является одним из факторов, которые необходимо учитывать при получении стабильных композиций пептида. Без использования какой-либо конкретной теории в фармацевтической промышленности используют теорию образования аморфных твердых веществ с высокой Тст. для стабилизации пептидов, полипептидов или белков. Как правило, если Тст. составляет более 100°С, пептидные продукты теряют текучесть при хранении при комнатной температуре или даже при 40°С, т.к. температура хранения ниже Тст. Расчеты с учетом структуры молекул свидетельствуют о том, что если температура стеклования выше температуры хранения при 50°С, то подвижность молекул при указанной температуре снижается до нуля. Отсутствие подвижности молекул коррелирует с отсутствием нестабильности препарата. Тст. также зависит от содержания влаги в продукте. Как правило, чем выше содержание влаги, тем ниже Тст. композиции.
Таким образом, в некоторых объектах настоящего изобретения для увеличения стабильности в состав белкового состава можно включать эксципиенты с более высокой Тст., например сахарозу (Тст. 75°С) и трегалозу (Тст. 110°С). Для образования частиц из состава частиц можно использовать стандартные методики: высушивание при распылении, лиофилизация, обезвоживание, высушивание при замораживании, сублимация, измельчение, грануляция, ультразвуковое каплеобразование, кристаллизация, осаждение или другие известные в данном уровне техники методики. При этом предпочтительно получают частицы с одинаковыми формой и размером.
Типичный процесс высушивания с распылением может включать, например загрузку раствора для распыления, содержащего пептид, например инсулинотропный пептид (например, амид GLP-1 (7-36) или эксенатид), и стабилизирующих эксципиентов в камеру для образцов. В камере для образцов обычно поддерживают требуемую температуру, например от температуры в холодильнике до комнатной темпер