Системы доставки лекарственного средства внутрь глаза
Иллюстрации
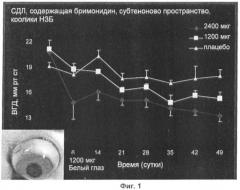
Показать всеИзобретение относится к области медицины, в частности к системам доставки лекарственных средств внутрь глаза. Система включает множество микросфер со средним диаметром от 8 микрон до 14 микрон, водный носитель для микросфер, где микросферы состоят из бримонидина, где бримонидин составляет от примерно 0,5 мас.% до примерно 15 мас.% микросфер, и одного или более чем одного биоразлагаемого полимера, представляющие собой полимеры поли(D,L)лактиды с характеристической вязкостью от 0,4 дл/г до 0,8 дл/г, где полимер ПМК составляет от 85 мас.% до 99,5 мас.% микросфер, и где система доставки лекарственного средства может быть инъецирована в область внутри глаза через иглу шприца калибра 20-26, и микросферы могут высвобождать от примерно 0,5 мкг/сутки до примерно 20 мкг/сутки бримонидина в течение периода времени от примерно 10 суток до примерно 100 суток, что обеспечивает лечение состояния глаза. Область введения внутри глаза представляет собой субтеноново пространство, субконъюнктивальную или ретробульбарную область. Изобретение обеспечивает высвобождение терапевтического агента в терапевтически эффективном количестве в течение между 10 суток и одним годом. 3 н. и 1 з.п. ф-лы, 13 табл., 6 ил.
Реферат
Предшествующий уровень техники
Настоящее изобретение относится к системам доставки лекарственных средств и к способам лечения состояний глаза. В частности, настоящее изобретение относится к системам и способам лечения состояния глаза путем введения в область или точку глаза системы доставки лекарственного средства замедленного высвобождения, которая содержит терапевтический агент и биоразлагаемый полимер.
Состояние глаза может включать заболевание, недомогание или состояние, при котором поражен или вовлечен глаз или одна из частей или областей глаза. В широком смысле глаз включает глазное яблоко, а также ткани и жидкости, которые составляют глазное яблоко, окологлазные мышцы (такие как косая и прямая мышцы глаза) и участок глазного нерва, который находится внутри или вблизи глазного яблока. Состояние переднего отдела глаза представляет собой заболевание, недомогание или состояние, при котором поражена или вовлечена область или точка глаза, такая как окологлазная мышца, веко, либо ткань или жидкость глазного яблока, которая расположена спереди от задней стенки капсулы хрусталика, либо ресничные мышцы. Таким образом, при состоянии переднего отдела глаза, прежде всего, поражены или вовлечены конъюнктива, роговица, передняя камера, радужная оболочка, задняя камера (сзади от радужной оболочки, но спереди от задней стежки капсулы хрусталика), хрусталик и капсула хрусталика, а также кровеносные сосуды, лимфатические сосуды и нервы, которые васкуляризируют, поддерживают или иннервируют переднюю область или точку глаза.
Состояние переднего отдела глаза может включать заболевание, недомогание или состояние, такое как, например, афакия; артифакия; астигматизм; блефароспазм; катаракта; заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язва роговицы; синдромы сухого глаза; заболевания века; заболевания слезной железы; окклюзия слезного протока; миопия; пресбиопия; расстройства зрачка; рефракционные расстройства и страбизм. Глаукому можно рассматривать как состояние переднего отдела глаза, поскольку клинической целью лечения глаукомы может быть снижение гипертензии водной жидкости в передней камере глаза (то есть снижение внутриглазного давления).
Состояние заднего отдела глаза (задней стороны глаза) представляет собой заболевание, недомогание или состояние, при котором, прежде всего, поражена или вовлечена задняя область или точка глаза, такая как хориоидея или склера (в положении сзади от плоскости, проходящей через заднюю стенку капсулы хрусталика), стекловидное тело, стекловидная камера глазного яблока, сетчатка, глазной нерв (то есть оптический диск), а также кровеносные сосуды и нервы, которые васкуляризируют или иннервируют заднюю область или точку глаза.
Таким образом, состояние заднего отдела глаза может включать заболевание, недомогание или состояние, такое как, например, макулярная дегенерация (такая как не экссудативная возрастная макулярная дегенерация и экссудативная возрастная макулярная дегенерация); хороидальная неоваскуляризация; острая макулярная нейроретинопатия; макулярный отек (такой как кистозный макулярный отек и диабетический макулярный отек); болезнь Бехчета, расстройства сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию); окклюзионное поражение ретинальной артерии; окклюзионное поражение ретинальной вены; поражение сосудистой оболочки и сетчатки; отслойка сетчатки; травма глаза, которая поражает заднюю область или положение глаза; состояние заднего отдела глаза, вызванное или возникшее под влиянием лазерной терапии глаза; состояния заднего отдела глаза, вызванные или возникшие под влиянием фотодинамической терапии; фотокоагуляция; лучевая ретинопатия; расстройства эпиретинальной мембраны; окклюзионное поражение ветви ретинальной вены; передняя ишемическая оптическая невропатия; диабетическая дисфункция сетчатки, не являющаяся ретинопатией, пигментный ретинит и глаукома. Глаукому можно также рассматривать как состояние заднего отдела глаза, поскольку терапевтической целью лечения глаукомы является предупреждение потери зрения или уменьшение вероятности потери зрения в результате повреждения или утраты ретинальных клеток или клеток глазного нерва (то есть нейропротекция).
Макулярная дегенерация, такая как возрастная макулярная дегенерация ("ВМД"), является ведущей причиной слепоты в мире. По оценкам тринадцать миллионов американцев имеют симптомы макулярной дегенерации. Макулярная дегенерация приводит в результате к разрушению макулы, светочувствительного участка сетчатки, ответственного за острое, центральное зрение, необходимое для чтения или вождения. Особенно поражено центральное зрение. Макулярную дегенерацию диагностируют либо как сухую (атрофическую), либо как влажную (экссудативную).
Сухая форма макулярной дегенерации является более распространенной, чем влажная форма макулярной дегенерации, поскольку примерно у 90% пациентов с ВМД диагностирована сухая ВМД. Влажная форма этого заболевания обычно приводит к более серьезной потере зрения. Макулярная дегенерация может приводить к медленной или внезапной безболезненной потере зрения. Причина макулярной дегенерации неясна. Сухая форма ВМД может быть результатом старения и утончения макулярных тканей, отложения пигмента в макуле или сочетания этих двух процессов. При влажной ВМД новые кровеносные сосуды растут за сетчаткой, при этом происходит выпотевание крови и жидкости. Этот выпот вызывает гибель ретинальных клеток и образует слепые пятна в центральном зрении.
Макулярный отек ("МО") может быть результатом набухания макулы. Отек вызван жидкостью, выпотевающей из кровеносных сосудов сетчатки. Кровь выпотевает из слабых стенок сосудов в очень небольшое пространство макулы, которое обогащено конусами, нервными окончаниями, которые определяют цвет и от которых зависит зрение в дневное время. Затем происходит размывание в центре или даже сбоку центрального поля зрения. Потеря зрения может прогрессировать в течение нескольких месяцев. Окклюзия кровеносных сосудов сетчатки, воспаление глаза и возрастная макулярная дегенерация все связаны с макулярным отеком. Макула может быть также поражена отеком вследствие удаления катаракты. Симптомы МО включают размытое центральное зрение, искаженное зрение, зрение, окрашенное в розовый цвет, и светочувствительность. Причины МО могут включать окклюзивное поражение ретинальной вены, макулярную дегенерацию, диабетический макулярный выпот, воспаление глаза, идиопатическую центральную серозную хориоретинопатию, передний или задний увеит, pars planitis (средний увеит), пигментный ретинит, лучевую ретинопатию, отслойку стекловидного тела сзади, образование эпиретинальной мембраны, идиопатическую юкстафовеальную ретинальную телеангиэктазию, Nd: YAG капсулотомию или иридотомию. Некоторые пациенты с МО могут иметь в анамнезе применение местного эпинефрина или аналогов простагландина для лечения глаукомы. Терапией первой линии для МО типично являются противовоспалительные капли, применяемые местным путем.
Диабетическая ретинопатия является ведущей причиной слепоты среди взрослых в возрасте от 20 до 74 лет. Макулярная ишемия является основной причиной необратимой острой потери зрения и сниженной контрастной чувствительности у пациентов с диабетической ретинопатией. Отсутствие капиллярной перфузии и сниженный капиллярный кровоток, которые ответственны за данную ишемию, клинически выявляют на флуоресцеиновой ангиограмме как увеличение фовеальной бессосудистой зоны (FAZ) или неправильность наружного контура FAZ. Эти открытия являются прогностическими факторами других, возможно, более хорошо известных, угрожающих зрению осложнений диабетической ретинопатии, включая макулярный отек и пролиферативную ретинопатию. Возможно, важнее, что обширное отсутствие капиллярной перфузии также является прогностическим фактором плохого прогноза для зрения в результате диабетической ретинопатии.
Существуют терапии, доступные или в стадии разработки, для макулярного отека и пролиферативной ретинопатии, такие как лазерная фотокоагуляция, введение кортикостероидов в стекловидное тело и терапии анти-VEGF (против сосудистого эпителиального фактора роста). Хотя лазерная фотокоагуляция исследована для лечения потери зрения, непосредственно связанной с макулярной ишемией, в настоящее время отсутствует известная терапия для данного показания.
Наружная поверхность нормального сферического глаза млекопитающего имеет слой ткани, известный как конъюнктивальный эпителий, под которым находится слой ткани, называемый теноновой фасцией (также называемый конъюнктивальной стромой). Степень растяжения теноновой фасции в обратном направлении через сферу образует фасциальный футляр, известный как тенонова капсула. Под теноновой фасцией находится эписклера. Вместе конъюнктивальный эпителий и тенонову фасцию называют конъюнктивой. Как отмечено, под теноновой фасцией находится эписклера, ниже которой лежит склера, за которой следует хориоидея. Большинство лимфатических сосудов и связанной с ними дренажной системы, которая очень эффективна при удалении терапевтических агентов, помещенных вблизи них, присутствует в конъюнктиве глаза.
Терапевтический агент можно вводить в глаз для лечения состояния глаза. Например, тканью-мишенью для гипотензивного терапевтического агента для лечения повышенного внутриглазного давления, характерного для глаукомы, может быть цилиарное тело и/или трабекулярная сеть. К сожалению, введение глазного местного гипотензивного фармацевтического агента в форме глазных капель может привести к быстрому вымыванию большей части, если не всего терапевтического агента, прежде чем он достигнет ткани-мишени цилиарного тела и/или трабекулярной сети, в результате чего для эффективного лечения гипертензивного состояния необходимо частое повторное дозирование. Кроме того, побочные эффекты для пациентов в результате местного введения лекарственных средств против глаукомы и их консервантов находятся в диапазоне от глазного дискомфорта до угрожающих зрению изменений глазной поверхности, включая конъюнктивальную гиперемию (покраснение глаз), жжение, боль, сниженное продуцирование и функция слез, сниженная стабильность слезной пленки, точечный поверхностный кератит, сквамозно-клеточная метаплазия и изменения в морфологии клеток. Эти вредные эффекты местных глазных капель против глаукомы могут препятствовать лечению глаукомы в результате противодействия пациента соблюдению режима и схемы дозирования, а также в связи с тем, что долгосрочное лечение глазными каплями связано с высокой степенью неудач фильтрующей операции. Asbell P.A., et al., Effects of topical antiglaucoma medications on the ocular surface, Ocul Surf 2005 Jan; 3(1):27-40; Mueller M., et al., Tear film break up time and Schirmer test after different antiglaucomatous medications, Invest Ophthalmol Vis Sci 2000 Mar 15; 41(4): S 283.
Известно введение депо-препарата лекарственного средства в заднюю часть (то есть вблизи макулы) субтенонова пространства. См., например, колонку 4 патента США №6413245. Кроме того, известно введение имплантата на основе полимера молочной кислоты в субтеноново пространство или супрахориоидальное пространство. См., например, опубликованный патент США №5264188 и опубликованную патентную заявку США №20050244463.
Противовоспалительный (то есть иммунодепрессивный) агент можно применять для лечения состояния глаза, такого как состояние заднего отдела глаза, в которое вовлечено воспаление, такое как увеит или макулярный отек. Таким образом, местные или пероральные глюкокортикоиды применяют для лечения увеита. Основной проблемой при местном или пероральном введении лекарственного средства является неспособность лекарственного средства к достижению адекватной (то есть терапевтической) внутриглазной концентрации. См., например, Bloch-Michel E. (1992). Opening address: intermediate uveitis, In Intermediate Uveitis, Dev. Ophthalmol, W.R.F. Boke et al. editors, Basel: Karger, 23:1-2; Pinar, V., et al. (1997). Intraocular inflammation and uveitis" In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmology, pp.57-80, 102-103, 152-156; Boke, W. (1992). Clinical picture of intermediate uveitis, In Intermediate Uveitis, Dev. Ophthalmol. W.R.F. Boke et al. editors, Basel: Karger, 23:20-7; и Cheng C-K et al. (1995), Intravitreal sustained-release dexamethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53.
Системное введение глюкокортикоидов можно применять отдельно или в дополнение к местным глюкокортикоидам для лечения увеита. Однако пролонгированное воздействие высоких концентраций в плазме (введение 1 мг/кг/сутки в течение 2-3 недель) стероида часто необходимо, чтобы в глазах могли быть достигнуты терапевтические уровни.
К сожалению, эти высокие уровни лекарственного средства в плазме обычно приводят к системным побочным эффектам, таким как гипертензия, гипергликемия, повышенная чувствительность к инфекции, пептическим язвам, психозу и другим осложнениям. Cheng C-K et al. (1995), Intravitreal sustainedrelease dexamethasone device in the treatment of experimental uveitis, Invest. Ophthalmol. Vis. Sci. 36:442-53; Schwartz, В., (1966) The response of ocular pressure to corticosteroids, Ophthalmol. Clin. North Am. 6:929-89; Skalka, H.W. et al., (1980), Effect of corticosteroids on cataract formation, Arch Ophthalmol 98:1773-7; и Renfro, L. et al. (1992), Ocular effects of topical and systemic steroids, Dermatologic Clinics 10:505-12.
Кроме того, доставка в глаз терапевтического количества активного агента может быть затруднена, если не невозможна, для лекарственных средств короткого времени полужизни в плазме, поскольку воздействие лекарственного средства на внутриглазные ткани ограничено. Следовательно, более эффективным путем доставки лекарственного средства для лечения состояния заднего отдела глаза является помещение лекарственного средства непосредственно в глаз, как, например, прямое введение в стекловидное тело. Maurice, D.M. (1983) Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Lee, V.H.L. et al. (1989), Drug delivery to the posterior segment' Chapter 25 In Retina. Т.Е.Ogden and A.P.Schachat eds., St. Louis: CV Mosby, Vol.1, pp.483-98; и Olsen, T.W. et al. (1995), Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. Sci. 36:1893-1903.
Методики, такие как введение лекарственного средства в стекловидное тело, показали перспективные результаты, но в связи с коротким временем полужизни внутри глаза активного агента, такого как глюкокортикоиды (примерно 3 часа), инъекции в стекловидное тело необходимо часто повторять для поддержания терапевтического уровня лекарственного средства. В свою очередь, этот повторяющийся процесс повышает потенциал для побочных эффектов, таких как отслойка сетчатки, эндофтальмит и катаракта. Maurice, D.M. (1983), Micropharmaceutics of the eye, Ocular Inflammation Ther. 1:97-102; Olsen, T.W. et al. (1995), Human scleral permeability: effects of age, cryotherapy, transscleral diode laser, and surgical thinning, Invest. Ophthalmol. Vis. Sci. 36:1893-1903; и Kwak, H.W. and D'Amico, D.J. (1992), Evaluation of the retinal toxicity and pharmacokinetics of dexamethasone after intravitreal injection, Arch. Ophthalmol. 110:259-66.
Кроме того, необходим тщательный мониторинг местного, системного и окологлазного лечения глюкокортикоидами вследствие токсичности и долгосрочных побочных эффектов, связанных с хроническими осложнениями системного воздействия лекарственного средства. Rao, N.A. et al. (1997), Intraocular inflammation and uveitis, In Basic and Clinical Science Course. Section 9 (1997-1998) San Francisco: American Academy of Ophthalmology, pp.57-80, 102-103, 152-156; Schwartz, В. (1966), The response of ocular pressure to corticosteroids, Ophthalmol Clin North Am 6:929-89; Skalka, H.W. and Pichal, J.T. (1980), Effect of corticosteroids on cataract formation, Arch Ophthalmol 98:1773-7; Renfro, L and Snow, J.S. (1992), Ocular effects of topical and systemic steroids, Dermatologic Clinics 10:505-12; Bodor, N. et al. (1992), A comparison of intraocular pressure elevating activity of loteprednol etabonate and dexamethasone in rabbits, Current Eye Research 11:525-30.
Известные системы доставки лекарственного средства, которые помещают в стекловидное тело или на склеру, обычно закрепляют на месте швом при склере, либо они имеют какие-либо средства прикрепления для удерживания их на месте, чтобы предотвратить их выдавливание или какую-либо иную миграцию из исходного места вследствие нормального частого движения глаза. Выдавливание может привести в результате к вымыванию системы доставки лекарственного средства через конъюнктиву и к ее потере. Миграция системы доставки лекарственного средства от места ее введения может обладать нежелательным эффектом либо субоптимального количества, либо избыточного количества терапевтического агента, достигающего в этом случае ткани-мишени.
Система доставки лекарственного средства внутрь глаза может быть изготовлена из биоразлагаемого полимера, такого как полимеры ПМК - полилактиды, полимеры ПМГК - сополимеры лактида и гликолида, а также сополимеры полимеров ПМК и ПМГК. Полимеры ПМК и ПМГК разлагаются посредством гидролиза, и продукты разложения, молочная кислота и гликолевая кислота, претерпевают метаболизм до диоксида углерода и воды. Общие свойства некоторых биоразлагаемых полимеров ПМК и ПМГК представлены в таблице 1.
| Таблица 1 | |||
| Общие свойства некоторых биоразлагаемых полимеров | |||
| ПМК эфир | ПМК эфир | 50:50 ПМГК кислота | |
| Распрост-раненные названия | Resomer® 203S, ПМК, сополимер D,L-лактида, полимер молочной кислоты | Resomer® 208, ПМК, сополимер D,L-лактида, полимер молочной кислоты | Resomer® RG 502H, ПМГ концевая кислота, ПМГК концевая кислота, 50:50 поли(сополимер D,L-лактида и гликолида) концевая кислота |
| Структура | |||
| n = среднее число повторяющихся звеньев | n = среднее число повторяющихся звеньев | где | |
| х=у=1 | |||
| R = патентованная алкильная группа | R = патентованная алкильная группа | n = среднее число повторяющихся звеньев | |
| CAS-номер | 26680-10-4 | 26680-10-4 | 26780-50-7 |
| Эмпири-ческая формула | [C6H8O4]n | [C6H8O4]n | [(C6H8O4)x·(C4H4O4)y]OH·х:у=50:50 |
| Характеристическая вязкость, дл/г | 0,25-0,35 | 1,8-2,2 | 0,16-0,24 |
| Описание | Порошок от белого до беловатого цвета | Порошок от белого до беловатого цвета | Порошок от белого до почти белого цвета |
В препараты систем доставки лекарственного средства включают различные активные агенты, например, известно изготовление имплантатов на основе полимера молочной кислоты, содержащего 2-метоксиэстрадиол (таких как штифты и диски), предназначенных для применения внутри глаза, способом экструзии из расплава. См., например, опубликованную патентную заявку США №20050244471. Кроме того, известно изготовление имплантатов и микросфер на основе полимера молочной кислоты, содержащего бримонидин, предназначенных для применения внутри глаза. См., например, опубликованные патентные заявки США №№20050244463 и 20050244506 и патентную заявку США, серийный номер 11/395,019.
Кроме того, известно изготовление имплантатов и микросфер на основе полимера молочной кислоты, содержащего биматопрост, предназначенных для применения внутри глаза. См., например, опубликованные патентные заявки США №№2005 0244464 и 2006 0182781 и патентные заявки США, серийные номера 11/303462 и 11/371118.
Бримонидин представляет собой α2B-селективный адренергический агонист, применяемый для лечения открытоугольной глаукомы путем снижения продуцирования водной тканевой жидкости и увеличение увеосклерального оттока. Химическая структура бримонидина тартрата представляет собой;
Химической формулой для бримонидина тартрата является: F, 5-бром-6-(2-имидазолидинилиденамино)хиноксалина тартрат C15H16N5O6Br или (C11H10BrN5·C4H6O6).
Бримонидина тартрат применяют в глазных растворах в концентрациях 0,2%, 0,15% и 0,1%. Предположили, что бримонидин может демонстрировать нейропротективный эффект на ретинальные клетки. См., например, патенты США №№5856329; 6194415; 6248741 и 6465464.
В патенте США №6217895 обсуждается способ введения кортикостероида в задний сегмент глаза, но не раскрыт биоразлагаемый имплантат. В патенте США №5501856 раскрыты фармацевтические препараты регулируемого высвобождения для внутриглазных имплантатов для применения в области внутри глаза после хирургической операции для лечения расстройств сетчатки/стекловидного тела или глаукомы. В патенте США №5869079 раскрыты комбинации гидрофильных и гидрофобных молекул в биоразлагаемом имплантате пролонгированного высвобождения и описан имплантат на основе сополимера полимолочной кислоты и полигликолевой кислоты (ПМГК), содержащий дексаметазон. Как показано путем тестирования кинетики высвобождения лекарственного средства in vitro, 100-120 мкг раскрытого имплантата 50/50 ПМГК/дексаметазон не проявляли приемлемого высвобождения лекарственного средства вплоть до начала четвертой недели, хотя усилитель высвобождения, такой как ГПМЦ (гидроксипропилметилцеллюлоза), был добавлен в препарат.
В патенте США №5824072 раскрыты имплантаты для введения в супрахориоидальную или в бессосудистую область глаза и описан имплантат на метилцеллюлозной основе (то есть не биоразлагаемый), содержащий дексаметазон. В WO 9513765 раскрыты имплантаты, содержащие активные агенты для введения в супрахориоидальную или в бессосудистую область глаза для терапевтических целей. В патентах США №№4997652 и 5164188 раскрыты биоразлагаемые глазные имплантаты, содержащие микроинкапсулированные лекарственные средства, и описаны имплантируемые микрокапсулы, содержащие гидрокортизона сукцинат, в заднем сегменте глаза.
В патенте США №5164188 раскрыты инкапсулирующие агенты для введения в супрахориоидальную область глаза и описано помещение микрокапсул и пластинок, содержащих гидрокортизон, в pars plana. В патентах США №№5443505 и 5766242 раскрыты имплантаты, содержащие активные агенты для введения в супрахориоидальную или бессосудистую область глаза, и описано помещение микрокапсул и пластинок, содержащих гидрокортизон, в pars plana.
Zhou et al. раскрыт имплантат множества лекарственных средств, содержащий 5-фторуридин, триамцинолон и человеческий рекомбинантный активатор тканевого плазминогена для лечения пролиферативной витреоретинопатии (ПВР) внутри глаза. Zhou, Т, et al. (1998), Development of a multiple-drug delivery implant for intraocular management of proliferative vitreoretinopathy, Journal of Controlled Release 55:281-295.
В патенте США №6046187 раскрыты способы и композиции для модулирования местного анестетика путем введения одного или более чем одного глюкокортикостероидного агента до, одновременно или после введения местного анестетика в точке у пациента. В патенте США №3986510 раскрыты глазные вкладки, имеющие один или более чем один внутренний резервуар лекарственного препарата, изолированный внутри биоразлагаемого материала, регулирующего скорость высвобождения лекарственного средства, в форме, приспособленной для вставки и удерживания в слезном мешке глаза, который показан для связывания поверхностями конъюнктивы и склеры глазного яблока и пальпебральной конъюнктивы века или для помещения над роговичным отделом глаза.
В патенте США №6369116 описывают имплантат с модификатором высвобождения, встроенным в склеральный лоскут. В ЕР 0654256 обсуждают применение склеральной пробки после операции на стекловидном теле для закупоривания разреза. В патенте США №4863457 обсуждают применение биоразлагаемого имплантата для предупреждения неудач фильтрующей операции глаукомы путем помещения этого имплантата либо в субконъюнктивальную область между конъюнктивальной мембраной, перекрывающей ее, и склерой под ней, либо внутри самой склеры в лоскут склеры неполной толщины.
В ЕР 488401 описывают внутриглазные имплантаты, изготовленные из определенных полимеров молочной кислоты, для применения внутри глаза после хирургической операции, проведенной при расстройстве сетчатки/стекловидного тела или глаукоме. В ЕР 430539 обсуждают применение биоразлагаемого имплантата, который встраивают в супрахориоидальную область.
Известны системы доставки лекарств внутрь глаза, которые пришивают или фиксируют на месте. Для наложения шва или иных средств фиксации необходимо, чтобы чувствительные глазные ткани находились в контакте с частями системы доставки лекарственного средства, которые не требуют содержания терапевтического агента в системе или на системе доставки лекарственного средства, или не отвечают за высвобождение терапевтического агента in vivo. Как таковые средства для пришивания или фиксации в глазах имеют исключительно периферическое или вспомогательное значение, и их применение может увеличить время заживления, дискомфорт для пациента и риск инфекции или других осложнений.
Таким образом, существует необходимость в системе доставки внутрь глаза лекарственного средства пролонгированного высвобождения для лечения состояния глаза, где систему доставки лекарственного средства внутрь глаза не пришивают или не фиксируют на месте иным путем, и она обеспечивает эффективную дозу терапевтического агента для желаемой внутриглазной ткани-мишени при небольшой гиперемии поверхности глаза или ее отсутствии, либо без других нежелательных побочных эффектов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение удовлетворяет этим и другим требованиям и предлагает систему доставки лекарственного средства для лечения состояния глаза, которая может обеспечить пролонгированное высвобождение терапевтически эффективного количества терапевтического агента, где введение внутрь глаза этой системы доставки лекарственного средства приводит в результате к небольшой гиперемии поверхности глаза или ее отсутствию.
Определения
Для приведенных ниже терминов определены нижеследующие значения:
"Примерно" означает приблизительно или около, и в контексте числового значения или диапазона, приведенного в данном контексте, означает ±10% этого цитируемого или заявленного числового значения или диапазона.
"Активный агент", "лекарственное средство" и "терапевтический агент" используют здесь взаимозаменяемо, и они относятся к любому веществу, применяемому для лечения состояния глаза.
"Передняя часть области внутри глаза" в отношении места введения системы доставки лекарственного средства для лечения гипертензивного состояния глаза означает субтенонову, супрахориоидальную, интрасклеральную, эписклеральную и подобную область внутри глаза, которая находится на расстоянии не более чем примерно 10 мм (предпочтительно не более чем примерно 8 мм) параллельно кривизне поверхности глаза от лимба роговицы.
"Биосовместимый" в отношении системы доставки лекарственного средства означает, что при введении системы доставки лекарственного средства внутрь глаза млекопитающего либо на поверхности глаза или около поверхности глаза, в который была введена эта система доставки лекарственного средства, не наблюдают гиперемии, либо на поверхности глаза или около поверхности глаза, в который была введена эта система доставки лекарственного средства, наблюдают гиперемию, которая имеет нормальный или субнормальный балл гиперемии поверхности глаза в течение десяти суток после введения внутрь глаза системы доставки лекарственного средства, и гиперемия поверхности глаза сохраняет нормальный или субнормальный балл гиперемии поверхности глаза в течение остального периода, в течение которого система доставки лекарственного средства остается на месте в области внутри глаза. Наблюдаемая гиперемия поверхности глаза (ГПГ) может быть определена с использованием системы баллов ГПГ Таблицы 2.
"Биоэродируемый полимер" означает полимер, который разлагается in vivo. Системы доставки лекарственного средства, содержащие биоэродируемые полимеры, могут иметь трехфазный паттерн высвобождения лекарственного средства: исходный пик от лекарственного средства, связанного с поверхностью; вторая фаза от диффузного высвобождения и высвобождение вследствие разложения полимерного матрикса. Таким образом, эрозия полимера с течением времени необходима для высвобождения всего активного агента. Следовательно, гидрогели, такие как метилцеллюлоза, которые действуют, высвобождая лекарственное средство посредством набухания полимера, специально исключают из термина "биоэродируемый (или биоразлагаемый) полимер". Слова "биоэродируемый" и "биоразлагаемый" являются синонимами, и их используют в данном контексте взаимозаменяемо.
"Кумулятивный профиль высвобождения" относится к кумулятивному суммарному проценту активного агента, высвобожденного из имплантата в область или точку глаза in vivo со временем, или в специфичную среду высвобождения in vitro со временем.
"Система доставки лекарственного средства" означает физическое устройство, из которого терапевтическое количество терапевтического агента может быть высвобождено при введении in vivo этой системы доставки лекарственного средства. Система доставки лекарственного средства может представлять собой имплантат (который может иметь конфигурацию, например, палочки, цилиндра, нити, волокна, диска или пластинки) или совокупность микросфер.
"Глаукома" означает первичную; вторичную и/или врожденную глаукому. Первичная глаукома может включать открытоугольную и закрытоугольную глаукому. Вторичная глаукома может встречаться как осложнение ряда других состояний, таких как травма, воспаление, сосудистое заболевание и диабет.
"Опосредованный воспалением" по отношению к состоянию глаза означает любое состояние глаза, для которого может быть полезно лечение противовоспалительным агентом, и в него подразумевают включать, но не ограничиваясь ими, увеит, макулярный отек, острую макулярную дегенерацию, отслойку сетчатки, глазные опухоли, грибковые или вирусные инфекции, мультифокальный хориоидит, диабетический увеит, пролиферативную витреоретинопатию (ПВР), симпатическую офтальмию, синдром Фогта-Коянаги-Харады (ФКХ), гистоплазмоз и увеальную диффузию.
"Травма" или "повреждение" взаимозаменяемы и относятся к клеточным или морфологическим проявлениям и симптомам, являющимся результатом состояния, опосредованного воспалением, таким как, например, воспаление.
"Внутриглазной" означает внутри или под глазной тканью. Введение системы доставки лекарственного средства внутрь глаза включает введение системы доставки лекарственного средства в субтенонову, субконъюнктивальную, супрахориоидальную, интравитреальную и подобную область. Введение системы доставки лекарственного средства внутрь глаза исключает введение системы доставки лекарственного средства в местную, системную, внутримышечную, подкожную, внутрибрюшинную и подобную область.
"Измеренный в условиях многократных стоков in vitro" означает анализы для измерения высвобождения лекарственного средства in vitro, где эксперимент имеет такую схему, чтобы концентрация лекарственного средства в рецепторной среде никогда не превышала 5% насыщения. Примеры подходящих анализов можно найти, например, в USP (Фармакопея США) 23; NF (Национальный формуляр) 18 (1995) pp.1790-1798.
"Состояние глаза" означает заболевание, недомогание или состояние, которое воздействует на глаз или в которое вовлечен глаз или одна из частей или областей глаза, такое как заболевание сетчатки. Глаз включает глазное яблоко и ткани, а также жидкости, которые составляют глазное яблоко, окологлазные мышцы (такие как косая и прямая мышцы) и часть глазного нерва, которая находится внутри или вблизи глазного яблока.
"Множество" означает два или более чем два.
"Состояние заднего отдела глаза" означает заболевание, недомогание или состояние, которое воздействует на заднюю область или точку глаза или в которое вовлечена задняя область или точка глаза, такая как хориоидея или склера (в положении сзади от плоскости через заднюю стенку капсулы хрусталика), стекловидное тело, камера стекловидного тела, сетчатка, глазной нерв (то есть оптический диск) и кровеносные сосуды и нервы, которые васкуляризируют или иннервируют заднюю область или точку глаза.
"Стероидный противовоспалительный агент" и "глюкокортикоид" используют в данном контексте взаимозаменяемо, и в них подразумевают включать стероидные агенты, соединения или лекарственные средства, которые уменьшают воспаление при их введении на терапевтически эффективном уровне.
"По существу" по отношению к профилю высвобождения или характеристике высвобождения активного агента из биоэродируемого имплантата, как в выражении "по существу постоянная скорость" высвобождения активного агента из имплантата, означает, что скорость высвобождения (то есть количество высвобожденного активного агента/единица времени) не изменяется более чем на 100%, и предпочтительно не изменяется более чем на 50%, за выбранный период времени (то есть число суток). "По существу" по отношению к смешиванию, перемешиванию или диспергированию активного агента в полимере, как в выражении "по существу однородно диспергированный" означает полное отсутствие или, по существу, полное отсутствие частиц (то есть агрегатов) активного агента в такой однородной дисперсии.
"Пригодный для вставки (или имплантации) в (или внутрь) область или точку глаза" в отношении имплантата означает имплантат, который имеет такой размер (габариты), что его можно вставить или имплантировать, не вызывая избыточного повреждения ткани, и без чрезмерного физического вмешательства в существующее зрение пациента, которому имплантируют или вставляют этот имплантат.
"Пролонгированный", как в "пролонгированном периоде" или "пролонгированном высвобождении" означает в течение периода времени, большего чем тридцать суток, предпочтительно в течение по меньшей мере 20 суток (то есть в течение периода времени от 20 суток до 365 суток), и наиболее предпочтительно в течение по меньшей мере 30 суток. Пролонгированное высвобождение может продолжаться в течение года или более.
"Терапевтические уровни" или "терапевтическое количество" означает количество или концентрацию активного агента, которое локально доставлено в область глаза, которая пригодна для безопасного лечения состояния глаза, чтобы уменьшить или предупредить симптом состояния глаза.
Биоэродируемые имплантаты согласно настоящему изобретению могут быть изготовлены с использованием двух или более чем двух различных биоэродируемых полимеров, каждый из которых имеет различные характеристики высвобождения. При одном варианте первое количество лекарственного средства или активного агента смешивают с первым полимером, и полученный в результате материал экструдируют, а затем разрушают до частиц, которые затем смешивают с дополнительным количеством лекарственного средства или активного агента и с тем же или со вторым полимером с образованием конечного биоэродируемого имплантата, либо путем экструзии, либо путем литьевого прессования или прямого прессования. Полученный в результате имплантат имеет профиль высвобождения, отличный от такового для имплантата, полученного путем первоначального смешивания полимеров вместе, и обеспечивает непрерывное или по существу непрерывное высвобождение активного агента на этих уровнях.
Еще в других вариантах активный агент можно по отдельности смешивать с первым и вторым биоэродируемым полимером с образованием первой и второй смеси лекарственное средство - полимер, которые можно совместно экструдировать с получением имплантатов, имеющих первый и второй участок с различными характеристиками высвобождения. Полученный в результате имплантат имеет профиль высвобождения, отличный от такового для имплантата, полученного путем первоначального смешивания двух полимеров вместе, и обеспечивает непрерывное высвобождение лекарственного средства. Этот имплантат может содержать один или более чем один активный агент. Кроме того, два активных агента в имплантате могут быть ковалентно присоединены друг к другу с образованием пролекарства, которое при высвобождении из имплантата диссоциирует на два отдельных активных агента. Кроме того, имплантат может содержать быстрые порообразователи в полимерном матриксе имплантата, например, в результате добавления к полимерному матриксу метилцеллюлозы (полимера с высокой растворимостью), который высвобождается вскоре после имплантации in vivo. Эта порообразующая добавка может действовать таким образом, что образуются поры в полимерном матриксе, увеличивая посредством этого все фазы высвобождения лекарственного