Способ получения водорастворимого пара-аминосалицилата хитозана
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к фтизиатрии, и фармацевтической промышленности и касается созданий лекарственных препаратов для лечения туберкулеза. Способ получения водорастворимого пара-аминосалицилата хитозана заключается в приготовлении водного раствора пара-аминосалициловой кислоты (2,8 мас.%) при температуре 90°С, прибавлении при перемешивании с помощью механической мешалки низкомолекулярного хитозана (средняя молекулярная масса 3,9 и 30 кДа) в количестве 2,8 мас.%, диспергировании реакционной массы при температуре 85°С в течение 40 минут. По окончании процесса реакционную массу вакуумируют, твердый остаток сушат в вакууме при температуре 30°С. 9 ил.
Реферат
Изобретение относится к медицине, а именно к фтизиатрии, и фармацевтической промышленности и может быть использовано при создании лекарственных препаратов с лечебно-профилактическим действием при туберкулезе.
В настоящее время для лечения туберкулеза используют две группы препаратов (Машковский М.Д. Лекарственные средства. М.: Медицина, 1993, ч.1, с.366-367):
первая группа- основные антибактериальные производные изоникотиновой кислоты, пара-аминосалициловой кислоты, антибиотики - стрептомицин, рифампицин;
вторая группа - резервные этионамид, протионамид, этамбутол, циклосерин, канамицин и др.
Препараты первой группы являются высокоэффективными, однако при их применении быстро развивается резистивность туберкулезных бактерий. Широко известны побочные эффекты изониазида - нарушение гемопоэза, функции печени, почек и др.
Пара-аминосалициловая кислота (ПАСК) оказывает бактериостатическое действие только на туберкулезную палочку и слабо влияет на возбудителя, располагающегося внутриклеточно. Он обладает рядом недостатков, к числу которых следует отнести прежде всего высокую токсичность и нерастворимость в воде, невысокую активность, вследствие чего препарат назначают в больших суточных дозах (12-16 г в день) и применяют в комбинации с более активными противотуберкулезными препаратами. Указанные недостатки создают предпосылки для поиска новых производных пара-аминосалициловой кислоты.
Известно, что введение в структуру лекарственных веществ мономеров или полимеров углеводного типа приводит к благоприятной модификации их физических свойств, значительному снижению вредного побочного действия на организм, увеличению биодоступности и пролонгации действия (GB 32135879 - рифампицин-целлюлоза, RU 2146130 изониазид-крахмал, RU 2143900, 2087146, 2327459 изониазид-декстран, RU 2185818 рифампицин-полиалкилцианоакрилаты). В проведенных ранее исследованиях обнаружена иммуностимулирующая активность, радиопротекторный, антацидный и регенерирующий эффекты.
Под действием хитозана усиливается проницаемость наружной мембраны клеток до пределов их жизнеспособности. Было установлено, что деполимеризованный хитозан с молекулярной массой 3,5-250 кДа и степенью деацетилирования 70% может быть использован в виде комплекса с лекарственными веществами в качестве носителя, обеспечивающего замедленное высвобождение лекарственного вещества. Комплекс модифицированного хитозана применяют в качестве системы доставки в таблетках, пленках, порошках, матричных системах, в качестве покрытий или пленок на имплантантах.
Известны способы синтеза полимерных форм лекарств антимикробактериального действия путем иммобилизации изониазида и стрептомицина в структуру низкомолекулярного хитозана с образованием соответствующих ковалентных связей (Сливкин А.И., Лапенко В.Л., Болгов А.А. Синтез лекарственных аналогов хитозана, Вестник ВГУ, серия: Химия. Биология. Фармация. 2005. №2, с.205-208). Получены полимерные производные салициловой и ацетилсалициловой кислот на основе олигохитозана с образованием солевых, ковалентных связей через 2-гидроксипропил спейсер (см. там же).
Задача, на решение которой направлено данное изобретение, заключается в создании препарата, способного проникать внутрь макрофагов.
Технический результат заключается в расширении арсенала веществ, которые можно использовать при создании лекарственных препаратов для эффективного лечения туберкулеза.
Технический результат достигается предложенным способом получения водорастворимого пара-аминосалицилата хитозана, включающим в себя пара-аминосалициловую кислоту и низкомолекулярный хитозан. В соответствии с предлагаемым способом получения указанного комплекса приготавливается водный раствор пара-аминосалициловой кислоты (2,8 мас.%) при температуре 90°С и к нему при перемешивании с помощью механической мешалки прибавляется низкомолекулярный хитозан (средняя молекулярная масса 3,9 и 30 кДа) в количестве 2,8 мас.%. Реакционная масса перемешивается со скоростью 200-300 об/мин при температуре 85°С в течение 40 минут, по окончании процесса реакционную массу вакуумируют, твердый остаток сушат при температуре 30°С в вакууме.
Существенным преимуществом использования хитозана в качестве матрицы для ПАСК является то, что благодаря своей химической природе он имеет значительное сродство к клеточной мембране, что должно способствовать лучшему проникновению внутрь макрофагов.
Пример 1. 2.8 г пара-аминосалициловой кислоты растворяют в 100 мл дистиллированной воды при 90°С. В полученный раствор вводят 3 г хитозана (3 кДа) и перемешивают при 85°С 40 мин. Гомогенную реакционную массу вакуумируют, осадок сушат в сушильном шкафу при 30°С в вакууме. После удаления влаги целевой продукт представляет собой водорастворимое вещество бежевого цвета - пара-аминосалицилат хитозана. Содержание ПАСК в полимерной форме, определенное путем потенциометрического титрования 0.1 н раствором NaOH, составляет 45.1%.
Пример 2. 2.8 г пара-аминосалициловой кислоты растворяют в 100 мл дистиллированной воды при 90°С. В полученный раствор вводят 3 г хитозана (9 кДа) и перемешивают при 85°С 40 мин. Гомогенную реакционную массу вакуумируют, осадок сушат в сушильном шкафу при 30°С в вакууме. После удаления влаги целевой продукт представляет собой водорастворимое вещество бежевого цвета - пара-аминосалицилат хитозана. Содержание ПАСК в полимерной форме, определенное путем потенциометрического титрования 0.1 н раствором NaOH, составляет 44.8%.
Пример 3. 2.8 г пара-аминосалициловой кислоты растворяют в 100 мл дистиллированной воды при 90°С. В полученный раствор вводят 3 г хитозана (30 кДа) и перемешивают при 85°С 40 мин. Гомогенную реакционную массу вакуумируют, осадок сушат в сушильном шкафу при 30°С в вакууме. После удаления влаги целевой продукт представляет собой водорастворимое вещество бежевого цвета - пара-аминосалицилат хитозана. Содержание ПАСК в полимерной форме, определенное путем потенциометрического титрования 0.1 н раствором NaOH, составляет 45.4%.
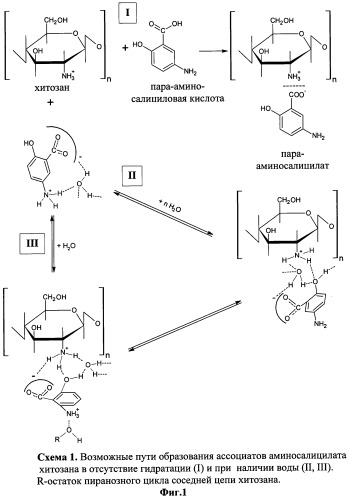
Процесс взаимодействия хитозана с пара-аминосалициловой кислотой (ПАСК) представлен на схеме 1 (Фиг.1).
Образование новых связей можно фиксировать или по сдвигу максимумов поглощения (или пропускания) в ИКС, или при появлении новых полос поглощения. Присутствие функциональных групп и связей должно подтверждаться наличием как валентных, так и деформационных колебаний. Хитозан может быть отнесен к низкоосновным полимерам, в которых функциональная группа -NH2 (согласно теории Бренстеда) способна в кислых средах проявлять катионные функции.
На образование полимерного комплекса указывают данные ИК-спектроскопии, согласно которым происходит изменение интенсивности и смещение расщепленной полосы поглощения, соответствующее валентным колебаниям связи С=O в области 1640-1670 см-1.
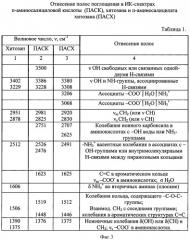
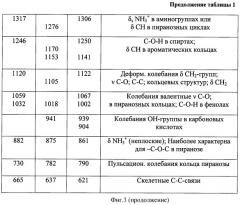
Данные ИК-спектроскопии сведены в таблицу 1 (Фиг.3).
При рассмотрении ИК-спектра хитозана (Фиг.4) обращает внимание наличие максимумов 3402, 3229 см-1, которые характерны валентным колебаниям -ОН и -NH-групп, с ассоциированными водородными связями. При этом наличие аминогрупп подтверждается колебаниями 1606 см-1 (плоские ассиметричные деформационные колебания вторичных аминогрупп NH3 +), 1317 см-1 (симметричные деформационные колебания аминогрупп Н) и 882 см-1 (неплоские деформационные колебания NH3 +). Особо следует отметить, что исходный хитозан находится в форме катиона, обусловленного присутствием NH3 + -групп.
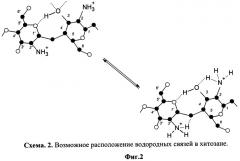
Другой особенностью хитозана является взаимодействие между -NH2 +; -ОН-группами и атомами водорода, связанными с одним и тем же атомом углерода. Это приводит к тому, что большинство колебаний не может быть локализовано в какой-то группе, а их необходимо рассматривать как взаимодействующие колебания нескольких групп. Необходимо подчеркнуть, что интенсивные полосы 3229, 2512 см-1 могут быть обусловлены внутримолекулярными (Фиг.2) и межмолекулярными Н-связями между пиранозными кольцами.
Кроме вышеописанных максимумов, в ИК-спектрах хитозана присутствуют интенсивные пики 1506, 1390, 1375, 1120, 1059, 882, 730 см-1, характерные колебаниям С-О-С; -ОН-спиртовых групп; ν C-O и СН-связям в пиранозных циклах (Фиг.3). Для пара-аминосалициловой кислоты наиболее интенсивные пики наблюдаются в области 3500, 3386 см-1, которые относятся к колебаниям солей аминокислот (ν NH2). Наряду с этим, при ~1600 см-1 проявляются максимумы 1623 см-1 и 1376 см-1, относящиеся к валентным колебаниям νas и νs иного карбоксила -СОО. Исходя из структуры ПАСК, можно предположить, что она может находится в растворе в различных ионных формах. Связано это с тем, что карбоксильные группы являются донорами протона, а аминогруппы - акцепторами протона. В водных средах для таких систем происходит образование биполярных ионов (схема 1, позиция II). Подтверждением протолитических взаимодействий ПАСК в воде служат полосы поглощения в ИКС при 2751, 2526, 2476 см-1 (ν NH3 +, ассоциированных с -ОН-группами воды и -COO--группами) и максимумы 1276 см-1 (δs NH3 +). Необходимо отметить, что биполярные ионы содержаться в большем количестве, чем нейтральные молекулы аминокислот.
Отличительной особенностью спектров ПАСК является наличие группы максимумов 1170, 1153, 1105, 1018 см-1, которые характерны колебаниям фенольных групп -ОН; C-О и СН колебаниям и σ СН в ароматических структурах (Фиг.5).
Ассоциация пара-аминосалициловой кислоты с хитозаном происходит различными путями (Фиг.1). Наиболее вероятным является образование иных ассоциатов между -COO--группами ПАСК и NH3 +-группами хитозана (появление новых максимумов 3206, 3068, 2625 см-1). При этом обязательным условием протекания таких процессов в растворах является образование гидратных структур. Кроме того, наблюдаются отличия в характере спектра и положении максимумов в пара-аминосалицилате хитозана (Фиг.6 и Фиг.7) и ПАСК (Фиг.5). Объяснение этому можно найти, если учитывать образование новых Н-связей между фенольными группами кислоты и аминогруппами хитозана или аминогруппы NH3 + пара-аминосалициловой кислоты со спиртовыми группами хитозана в пиранозных кольцах (2625, 1512, 1306, 1250, 1141 см-1). Следует отметить, что прочность закрепления сорбата (ПАСК) на сорбенте (хитозане) предусматривает не одноточечную связь, а трехточечное взаимодействие.
Таки образом, наиболее вероятным в системе «ПАСК + хитозан» является взаимодействие функциональных групп сорбента -NH3 + с -COO--группами п-сульфосалицилвой кислоты с участием в образовании ассоциатов Н-связей молекул воды, NH3 +-групп и -ОН-групп пиранозных структур хитозана и -ОН-фенольных групп ПАСК.
Противотуберкулезную активность пара-аминосалицилата хитозана (полимерного коньюгата на основе пара-аминосалициловой кислоты и низкомолекулярного хитозана с ММ 3 кДа, 9 кДа, 30 кДа,) оценивали in vitro по уровню минимальной подавляющей концентрации (МПК).
Для определения МПК использовали стандартную методику, рекомендованную для доклинических исследований ("Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ", М., 2000, с.287 -292).
Оценка противотуберкулезной активности исследуемых препаратов произведена на стандартном лабораторном штамме Mycobacterium tuberculosis H37Rv, чувствительном к противотуберкулезным препаратам.
Все этапы эксперимента in vitro проводились в условиях строгого соблюдения стерильности.
Бактериостатическую концентрацию изучаемых препаратов определяли методом серийных разведений в жидкой полусинтетической среде Школьниковой.
Приготовление исходных разведений изучаемых веществ.
Пара-аминосалицилат хитозана, ММ 3 кДа.
I разведение: к навеске 20,2 мг добавили 18,7 мл дистиллированной воды, встряхнули. Получен прозрачный раствор концентрации 1000 мкг/мл, слабой светло-бежевой окраски.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Пара-аминосалицилат хитозана, ММ 9 кДа.
I разведение: к навеске 20,4 мг добавили 18,5 мл дистиллированной воды, встряхнули. Получен прозрачный раствор концентрации 1000 мкг/мл, слабой светло-бежевой окраски.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Пара-аминосалицилат хитозана, ММ 30 кДа.
I разведение: к навеске 20,0 мг добавили 18,6 мл дистиллированной воды. Для достижения растворения встряхивали на шейкере в течение 1 часа. Получен прозрачный раствор концентрации 1000 мкг/мл, слабой светло-бежевой окраски.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл - исходное рабочее разведение.
Пара-аминосалициловая кислота, натриевая соль (контрольное вещество).
I разведение: к навеске 20,3 мг добавили 16,4 мл дистиллированной воды, встряхнули. Получен прозрачный раствор концентрации 1000 мкг/мл.
II разведение: к 1 мл I разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 100 мкг/мл.
III разведение: к 1 мл II разведения добавили 9 мл жидкой питательной среды Школьниковой. Получено 10 мл раствора концентрации 10 мкг/мл -исходное рабочее разведение.
Приготовление опытных рядов разведений изучаемых веществ.
Для исследования выбраны две серии разведении от 4,0 до 0,0125 мкг/мл и от 3,0 до 0,1875 мкг/мл.
Ряды разведений готовили с использованием жидкой питательной среды Школьниковой с добавлением 10% стерильной плазмы крови человека.
Пара-аминосалицилат хитозана, ММ 3 кДа.
Приготовление серии разведений от 4,0 до 0,0125 мкг/мл.
Сформировали ряд из 6 стеклянных пробирок. В первую пробирку добавили 3,0 мл жидкой питательной среды Школьниковой, в остальные 5 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 2,0 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 3 кДа концентрации 4 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 6-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 3 кДа от 4,0 до 0,0125 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 3,0 до 0,1875 мкг/мл.
Сформировали ряд из 5 стеклянных пробирок. В первую пробирку добавили 3,5 мл жидкой питательной среды Школьниковой, в остальные 4 пробирки - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,5 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 3 кДа концентрации 3 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 5-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 3 кДа от 3,0 до 0,1875 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Пара-аминосалицилат хитозана, ММ 9 кДа.
Приготовление серии разведений от 4,0 до 0,0125 мкг/мл.
Сформировали ряд из 6 стеклянных пробирок. В первую пробирку добавили 3,0 мл жидкой питательной среды Школьниковой, в остальные 5 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 2,0 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 9 кДа концентрации 4 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 6-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 9 кДа от 4,0 до 0,0125 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 3,0 до 0,1875 мкг/мл.
Сформировали ряд из 5 стеклянных пробирок. В первую пробирку добавили 3,5 мл жидкой питательной среды Школьниковой, в остальные 4 пробирки - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,5 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 9 кДа концентрации 3 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 5-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 9 кДа от 3,0 до 0,1875 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Пара-аминосалицилат хитозана, ММ 30 кДа.
Приготовление серии разведений от 4,0 до 0,0125 мкг/мл.
Сформировали ряд из 6 стеклянных пробирок. В первую пробирку добавили 3,0 мл жидкой питательной среды Школьниковой, в остальные 5 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 2,0 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 30 кДа концентрации 4 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 6-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 30 кДа от 4,0 до 0,0125 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 3,0 до 0,1875 мкг/мл.
Сформировали ряд из 5 стеклянных пробирок. В первую пробирку добавили 3,5 мл жидкой питательной среды Школьниковой, в остальные 4 пробирки - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,5 мл III разведения, получили 5 мл раствора пара-аминосалицилата хитозана ММ 30 кДа концентрации 3 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 5-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата хитозана ММ 30 кДа от 3,0 до 0,1875 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Пара-аминосалициловая кислота, натриевая соль (контрольное вещество).
Приготовление серии разведений от 4,0 до 0,0125 мкг/мл.
Сформировали ряд из 6 стеклянных пробирок. В первую пробирку добавили 3,0 мл жидкой питательной среды Школьниковой, в остальные 5 пробирок - по 2 мл среды Школьниковой.
В первую пробирку добавили 2,0 мл III разведения, получили 5 мл раствора пара-аминосалицилата натрия концентрации 4 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 6-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата натрия от 4,0 до 0,0125 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление серии разведений от 3,0 до 0,1875 мкг/мл.
Сформировали ряд из 5 стеклянных пробирок. В первую пробирку добавили 3,5 мл жидкой питательной среды Школьниковой, в остальные 4 пробирки - по 2 мл среды Школьниковой.
В первую пробирку добавили 1,5 мл III разведения, получили 5 мл раствора пара-аминосалицилата натрия концентрации 3 мкг/мл. Ряд серийных разведений получили, перенося последовательно из каждой пробирки по 2 мл жидкости в следующую. Из последней, 5-й пробирки, удалили 2 мл жидкости. Из 1-й пробирки удалили 1 мл жидкости. Таким образом, получена серия разведений пара-аминосалицилата натрия от 3,0 до 0,1875 мкг/мл. Количество жидкости в каждой пробирке серии - 2 мл.
Приготовление стандартной бактериальной суспензии.
Культуры микобактерий стандартного лабораторного штамма Mycobacterium tuberculosis H37Rv, чувствительного к противотуберкулезным препаратам, выращенные на плотной питательной среде в течение 4-х недель, снимали одноразовой бактериологической петлей, растирали в стеклянной пробирке и суспендировали в 0,9% растворе хлорида натрия. Полученную суспензию выдерживали при комнатной температуре в течение 30 минут для самопроизвольного осаждения наиболее крупных конгломератов микобактерий.
Затем взвесь микобактерий (надосадочную жидкость) переносили в другую пробирку, добавляли изотонический раствор хлорида натрия, сравнивая с оптическим стандартом мутности №5. Подготовленная таким образом бактериальная взвесь соответствует содержанию 5×108 КОЕ в 1 мл жидкости.
Далее во все пробирки рядов разведений исследуемых препаратов, включая контрольные пробирки, засевали по 0,2 мл бактериальной суспензии, что соответствует 108 КОЕ. Пробирки закрыли силиконовыми пробками и инкубировали в термостате при 37°С, просматривая ежедневно.
На 10-й день инкубации в контрольных пробирках всех рядов без препарата определено визуально начало глубинного роста культуры штамма H37Rv как хлопьевидный осадок на дне пробирки. На 14 день инкубации из осадка всех опытных и контрольных пробирок приготовлены мазки и окрашены по Цилю-Нильсену. Результаты оценивались по количеству кислотоустойчивых микобактерий в полях зрения и по интенсивности «косообразования» при микроскопии мазков по следующей схеме:
| Число полей зрения | Число микобактерий | Интенсивность роста |
| 100 | - | 0 |
| 100 | 1-9 | +- |
| 100 | 10-100 | + |
| 1 | 1-9 | 2+ |
| 1 | 10 и более или наличие микроколоний | 3+ |
На основании полученных результатов определяли минимальную бактериостатическую концентрацию препарата, приводящую к частичному (+-) МПК50 или полному (0) МПК90 подавлению роста микобактерий.
Результаты микроскопии осадков опытных и контрольных пробирок рядов разведений исследуемых препаратов представлены в нижеследующей таблице 2 (Фиг.8).
Как следует из таблицы 2, МПК50 пара-аминосалицилата хитозана ММ 3 кДа, 9 кДа, 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 1,0 мкг/мл, что в 4 раза выше, чем аналогичная концентрация натриевой соли ПАСК (МПК50 натриевой соли ПАСК - 0,25 мкг/мл).
МПК90 пара-аминосалицилата хитозана ММ 3 кДа, 9 кДа, 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 1,5 мкг/мл, что в 4 раза выше, чем аналогичная концентрация натриевой соли ПАСК (МПК90 натриевой соли ПАСК - 0,375 мкг/мл).
Результаты исследования
Результаты определения МПК50 и МПК90 пара-аминосалицилата хитозана ММ 3 кДа, 9 кДа, 30 кДа и натриевой соли ПАСК представлены в таблице 3 (Фиг.9).
Как следует из таблицы, МПК50 пара-аминосалицилата хитозана ММ 3 кДа, 9 кДа, 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 1,0 мкг/мл, что в 4 раза выше, чем аналогичная концентрация натриевой соли ПАСК (МПК50 натриевой соли ПАСК - 0,25 мкг/мл).
МПК90 пара-аминосалицилата хитозана ММ 3 кДа, 9 кДа, 30 кДа для лекарственно-чувствительного лабораторного штамма H37Rv составила 1,5 мкг/мл, что в 4 раза выше, чем аналогичная концентрация натриевой соли ПАСК (МПК90 натриевой соли ПАСК - 0,375 мкг/мл).
Способ получения водорастворимого пара-аминосалицилата хитозана, включающего приготовление водного раствора п-аминосалициловой кислоты (2,8 мас.%) при температуре 90°С, прибавление при перемешивании с помощью механической мешалки низкомолекулярного хитозана (средняя молекулярная масса 3,9 и 30 кДа) в количестве 2,8 мас.%, диспергирование реакционной массы при температуре 85°С в течение 40 мин, по окончании процесса реакционную массу вакуумируют, твердый остаток сушат в вакууме при температуре 30°С.