Способ повышения естественной резистентности телят-гипотрофиков
Иллюстрации
Показать всеИзобретение относится к области ветеринарии. У телят-гипотрофиков проводят пункцию яремной вены иглой с находящимся в ней световодом. Световод подключен к лазерной излучающей головке для внутривенного облучения крови с длиной волны 0,63 мкм и мощностью 1,5 мВт. Процедуру проводят в течение 5 минут один раз в день с интервалом через день пятикратно. Использование способа эффективно и безопасно повышает естественную резистентность телят-гипотрофиков. 7 ил.
Реферат
Изобретение относится к области ветеринарной медицины, а именно к способу повышения естественной резистентности телят-гипотрофиков.
При неполноценном или недоброкачественном кормлении маточного поголовья в период стельности у этих животных развивается патология обмена веществ, приводящая к нарушению морфофункционального развития плода. В результате рождается недоразвитое потомство - гипотрофики. Телята-гипотрофики отличаются морфологическим и функциональным недоразвитием различных органов и их систем. Такие животные имеют вес в 1,5-2 раза ниже, чем сверстники. У таких телят помимо уменьшения концентрации гемоглобина и эритроцитов, белков плазмы крови, расстройства водно-электролитного обмена, нарушения нейроэндокринной регуляции резко уменьшается иммунобиологическая реактивность организма и сопротивляемость его к инфекционным заболеваниям [1]. При гипотрофии понижены защитная функция кожи и слизистых оболочек, барьерная роль лимфатических узлов, активность системы фагоцитирующих микро- и макрофагов, субстанций, оказывающих бактерицидное и противовирусное действие - пропердина, лизоцима, комплемента, интерферона [2]. В результате у телят-гипотрофиков легко развиваются заболевания органов дыхательной системы и желудочно-кишечного тракта, даже вызванные условно-патогенными микроорганизмами.
В настоящее время известны способы повышения естественной резистентности телят-гипотрофиков путем применения различных химиотерапевтических препаратов (тимоген, фоспренил, миксоферон и др.). На основании исследований на телятах различной физиологической зрелости установлено, что парентеральное применение тимогена при гипотрофии способствует восстановлению структурно-морфологических показателей организма, в том числе иммунореактивности и активации энергии роста [3]. Миксоферон обладает способностью стимулировать иммунные процессы и активность иммунокомпетентных клеток, а также повышать неспецифическую резистентность организма животных. Телятам старше 20 дней вводят по 5-10 доз препарата [4]. Установлено также, что препарат фоспренил может быть использован с целью повышения естественной резистентности и привесов у молодняка крупного рогатого скота (особенно "отставшего"). Первое введение осуществляли на 2-й день жизни (2 дозы), далее один раз в 10 дней до отъема по одной дозе [5, 6].
Известно применение иммуностимуляторов в комплексе с витаминными комплексами (Тетрагидровит) и препаратами, содержащими микроэлементы (Седимин) [7, 8, 9].
Недостатками этих способов является высокая стоимость достигаемой иммуностимуляции. К тому же в организм телят-гипотрофиков вводятся чужеродные химические вещества, которые в силу недостаточного развития клеток тканей организма сложно метаболизировать и в последующем выводить из организма.
В гуманной медицине известен способ внутривенного лазерного облучения крови (ВЛОК), осуществляемый через подкожную вену предплечья. Установлено его положительное влияние на повышение уровня неспецифической реактивности организма. При этом воздействие на организм пациента осуществляется только через венозную кровь [10]. Нет данных о каком-либо влиянии внутривенного низкоинтенсивного лазерного облучения крови, в том числе иммунологическом, на организм истощенных людей (гипотрофиков или дистрофиков), с дефицитом массы тела и неокончательно сформированными системами организма, в ранний постнатальный и в последующие периоды жизни.
В ветеринарной медицине запатентован способ стимуляции гемопоэза у животных с использованием инфракрасного диодного лазера в импульсно-периодическом режиме с длиной волны 970 нм. Доставка лазерной энергии осуществлялась контактным путем через сквозные перфорационные отверстия в эпифизах костей грудных и тазовых конечностей. Это вызывало увеличение числа лейкоцитов, эритроцитов, а также количества гемоглобина в крови собак [11].
Недостатком данного метода является повышенная инвазивность и травматичность метода, связанная с остеоперфорацией костей грудных и тазовых конечностей животного. К тому же операция остеоперфорации осуществляется под общим наркозом, введение которого негативно влияет на головной мозг животного.
Известен способ повышения естественной резистентности организма стельных коров с помощью лазерного облучения области позвоночника, тимуса, молочной железы и грудины аппаратом СТП-8 в течение 5 минут 10 сеансов с интервалом 3 дня и путем воздействия на 4 биологически активные точки аппаратом СТП-6 в течение 2-х минут на каждую 7 сеансов с интервалом 3 дня [12].
Недостатком данного способа является сложность нахождения биологически активных точек, расположение которых на теле животного к тому же может иметь некоторые индивидуальные особенности. При этом способе не описаны дозы и время воздействия лазерными аппаратами СТП-6 и СТП-8 для повышения естественной резистентности организма телят.
Наиболее близкое техническое решение - это экстракорпоральное лазерное облучение крови свиней. При выполнении этого метода было изучено влияние лазерного излучения на морфологический, биохимический и цитохимический состав крови свиней при облучении ее in vitro с последующим парентеральным введением в организм свиней уже облученной крови. При этом отмечалось увеличение гамма-глобулиновой фракции белка, титра лизоцима, его активности и количества в плазме крови, установлено увеличение среднего цитохимического коэффициента миелопероксидазы нейтрофилов, что свидетельствует об активизации гранулоцитов. При исследовании неспецифической резистентности организма выявлен ряд существенных изменений со стороны гуморальных факторов защиты (лизоцим), фагоцитарной активности и обеспечивающих ее ферментативно-энергетических систем (миелопероксидаза, гликоген) [13].
Недостатком метода является то, что он трудно выполним в производственных условиях. Для выполнения метода необходима установка со сменными стерильными кюветами, в которых будет облучаться кровь. При осуществлении этого метода в производственных условиях сложно соблюдать меры асептики и антисептики, так как кровь необходимо аспирировать из организма свиней, облучить в стерильных условиях и ввести парентерально в дозе 0,5 мл/кг. Кроме того, способ недостаточно эффективен из-за того, что облучается ограниченное количество клеток крови. Пример: при массе свиньи 50 кг надо извлечь, облучить и вновь ввести в организм 25 мл крови. Это количество является лишь 1/92 от общего объема крови свиньи, который у этих животных равен 4,6% от массы тела.
Техническим результатом изобретения является упрощение способа повышения естественной резистентности телят-гипотрофиков, повышение его инвазивной безопасности для организма животных, а также повышение его эффективности.
Указанный технический результат достигается непосредственным внутривенным лазерным облучением крови телят-гипотрофиков с помощью лазерного терапевтического аппарата, лазерной излучающей головки для внутривенного облучения крови с длиной волны 0,63 мкм (красный спектр) и одноразового стерильного световода с иглой.
Способ осуществляется следующим образом. У телят-гипотрофиков проводят пункцию яремной вены иглой с находящимся в ней световодом, подключенным к лазерной излучающей головке для внутривенного облучения крови с длиной волны 0,63 мкм и мощностью 1,5 мВт. Процедуру проводят в течение 5 минут один раз в день с интервалом через день пятикратно.
Для получения положительного эффекта от лазерного воздействия оказываемого на организм не до конца сформированного животного (теленка-гипотрофика) недостаточно оказывать воздействие только через венозную кровь. Необходим метод более комплексного воздействия. В предложенном методе световод вводится в яремную вену. При этом воздействие на организм животного оказывается не только через венозную кровь, но расположенные рядом с яремной веной морфологические образования, так как лазерные лучи проникают и в окружающие ткани на значительную глубину до 4-х сантиметров. В результате одновременно с венозной кровью облучению подвергаются такие физиологически и иммунологически активные морфологические структуры:
1) артериальная кровь, протекающая в сонной артерии;
2) лимфа, протекающая в трахеальном лимфатическом стволе;
3) шейная часть тимуса - органа иммуногенеза, кроме того, регулирующего еще углеводный, кальциевый обмен и процессы роста;
4) вагосимпатический ствол, в состав которого входят симпатические волокна вегетативной нервной системы и волокна блуждающего нерва; по их волокнам идут сигналы, принимающие участие в управлении работой всех основных систем организма, в том числе органов кроветворения и иммунной защиты;
5) шейные спинномозговые нервы; через восходящие волокна спинномозговых нервов воздействие оказывается на чувствительные ядра продолговатого мозга, в котором расположены различные центры, регулирующие жизнедеятельность организма, кроме этого он осуществляет проводниковую функцию для импульсов, идущих в кору, промежуточный, средний мозг, мозжечок и спинной мозг.
Предложенный способ повышения естественной резистентности телят-гипотрофиков выгодно отличается от известных способов тем, что впервые в ветеринарной медицине использовано именно внутривенное низкоинтенсивное лазерное облучение крови телят-гипотрофиков с длиной волны 0,63 мкм (красный спектр) в течение 5 минут один раз в день с интервалом через день в количестве 5 сеансов. Во время проведения сеанса ВЛОК одновременно с венозной кровью облучается артериальная кровь, лимфа, шейные нервы, вагосимпатический ствол, тимус и щитовидная железа. При этом в организм животного не вносится никаких чужеродных веществ, которые клеткам недоразвитых органов тяжело метаболизировать и выводить из организма. Клетки крови непосредственно получают дополнительно энергию от лазерного излучателя, которая повышает их активность. Время полного кругооборота крови всех млекопитающих животных равно времени 27 сердечных циклов. Сердечный цикл теленка равен 0,75 секунды (60 секунд : 80 ударов в минуту). При этом время полного кругооборота крови будет равно 20,25 секунды (27 циклов × 0,75 секунды). Таким образом, в отличие от прототипа за 5 минут вся кровь организма подвергнется лазерному облучению 14,8 раза.
Предложенный способ успешно устраняет недостатки применяющихся в настоящее время способов повышения естественной резистентности телят-гипотрофиков. Способ прост в выполнении, эффективен, позволяет полноценно соблюдать правила асептики и антисептики, при этом в организм животного не вносится никаких чужеродных веществ.
Применение данного способа дает достоверное повышение естественной резистентности телят-гипотрофиков уже после первого внутривенного лазерного облучения крови. Кроме того, выполнение предложенного способа менее трудоемко, чем взятого за основу прототипа, и обеспечивает реальную возможность соблюдения правил асептики и антисептики при применении в производственных условиях.
Новизна способа заключается в том, что впервые в ветеринарной практике для повышения естественной резистентности телят-гипотрофиков лазерное излучение с длиной волны 0,63 мкм доставлялось непосредственно в кровеносное русло при пункции яремной вены посредством одноразового стерильного световода с иглой.
Все вышеперечисленное позволяет заключить, что предлагаемый способ включает не только параметры лазерного излучения, но и имеющее не менее важное значение место воздействия. В нашем случае это расширяет положительный эффект лазерного излучения через дополнительное влияние его на нейроэндокринную систему и непосредственно иммунокомпетентный орган - тимус.
Пример.
Эффективность способа подтверждена проведенными научными исследованиями. Опыт проводился в ОАО Агрофирма "Новоникольское" Данковского района Липецкой области. В эксперименте были задействованы телята 30-дневного возраста с выраженной гипотрофией, разбитые по принципу парных аналогов на три группы: 1 - опытная (n=10), 2 - опытная (n=10) и 3 - контрольная (n=10).
Телят 1 опытной группы поочередно фиксировали. Кожу в месте предполагаемой пункции яремной вены обрабатывали 70% спиртом. У телят-гипотрофиков проводили пункцию яремной вены иглой с находящимся в ней световодом, подключенным к лазерной излучающей головке для внутривенного облучения крови с длиной волны 0,63 мкм и мощностью 1,5 мВт. Процедуру проводили в течение 5 минут один раз в день с интервалом через день пятикратно.
Телятам 2 опытной группы применяли схему лечения, используемую для стимуляции функций организма телят-гипотрофиков в данном хозяйстве. При этом комплексный препарат Тетрагидровит, в состав которого входят витамины А, Д, Е и С, вводили подкожно в дозе 4 мл на животное 1 раз в 7 дней, В12 (500 мкг) внутривенно в дозе 1 мл с 40% раствором глюкозы 30 мл 1 раз в день 10 дней, Седимин, в состав которого входит Fe, Se, I, внутримышечно в дозе 5 мл однократно, Тимоген внутримышечно в дозе 1 мл 1 раз в день 7 дней.
На телят 3 группы служили контролем. На них не оказывали никакого воздействия.
Общий и биохимический анализ крови проводили через день после каждого лазерного облучения крови и непосредственно перед следующим облучением, а затем через 7 дней после последнего облучения. В результате проведенных экспериментов получены нижеизложенные результаты, при обработке которых учитывался уровень значимости (Р), который рассчитывался с помощью критерия Стьюдента. Уровень значимости (Р) по каждому исследованному показателю крови в начале исследования был <0,05, что указывало на отсутствие достоверных различий между исследуемыми группами животных. В процессе проведения опытов уровень значимости (Р) показателей крови, которые указаны на фигурах, изменялся и стал <0,001.
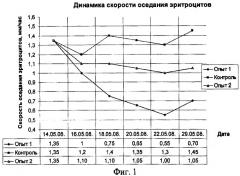
У животных в первой опытной группе к 5 сеансу облучения наблюдалось снижение СОЭ в пределах физиологической нормы с 1,35 мм/час до 0,55 мм/час, что говорит об улучшении реологических свойств крови. При исследовании СОЭ через 7 дней после последнего облучения этот показатель повысился до 0,7 мм/час. У животных во второй опытной группе наблюдалось снижение СОЭ в пределах физиологической нормы с 1,35 мм/час до 1,05 мм/час. У животных контрольной группы оставалось неизменным 1,35 и 1,45 мм/час соответственно (фиг.1).
Количество эритроцитов и гемоглобина в крови у животных в первой и второй опытной, а также контрольной группе достоверно не изменялось. Число эритроцитов в крови у животных первой опытной группы 6,06×1012/л в начале опыта и 6,19×1012/л в конце. У животных второй опытной 6,1×1012 /л и 6,15×1012 /л соответственно. У животных контрольной группы 6,13×1012/л и 6,12×1012/л соответственно. Количество гемоглобина в крови у животных первой опытной группы 106,2 г/л в начале опыта и 107,1 г/л в конце. У животных второй опытной группы 105,5 г/л и 106,3 г/л соответственно. У животных контрольной группы 105,1 г/л и 105,0 г/л соответственно.
Число лейкоцитов в крови у животных первой опытной группы увеличилось до нижней границы физиологической нормы с 6,29×109/л до 8,39×109/л (в среднем на 33%). Число лейкоцитов в крови у животных второй опытной группы увеличилось незначительно с 6,45×109/л до 7,00×109/л (на 8,5%). Тогда как у животных контрольной группы общее количество лейкоцитов в крови не изменялось и оставалось в пределах 6,63×109/л. Через 7 дней после последнего лазерного облучения крови наблюдалась лишь незначительная тенденция к уменьшению общего количества лейкоцитов в крови у животных опытной группы до 8,295×109/л (фиг.2).
Лейкоцитарная формула фонового исследования животных контрольных и опытной групп укладывается в средние значения физиологической нормы для телят 30-дневного возраста за исключением моноцитов, уровень которых был выше в 3 раза.
В последующем после лазерного облучения крови показатели лейкоцитарной формулы у животных первой опытной группы изменялись. Уменьшалось количество моноцитов в 2 раза, количество палочкоядерных и сегментоядерных нейтрофилов стало на 1% и 4% меньше нижней физиологической границы, увеличивалось количество лимфоцитов до верхней физиологической границы. У животных второй опытной и контрольной группы в течение опыта не наблюдалось достоверных изменений в лейкоцитарной формуле.
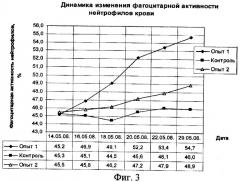
Фагоцитарная активность нейтрофилов у животных первой опытной группы увеличилась с 45,2% до 55% (на 9,8%) к 5 сеансу облучения, а через 7 дней после него до 56,4% (на 11,2%). У животных второй опытной группы фагоцитарная активность нейтрофилов увеличилась с 45,5% до 48,9% (на 3,4%). Тогда как у животных контрольной группы фагоцитарная активность нейтрофилов не изменялась и оставалась в пределах 46% при среднем значении физиологической нормы 52% (фиг.3).
Лизоцимная активность сыворотки крови у животных первой опытной группы увеличилась с 17,6% до 24,7% (на 7,1%) к 5 сеансу облучения, а через 7 дней после него до 24,9% (на 7,3%). У животных второй опытной группы лизоцимная активность увеличилась с 17,5% до 19,6% (на 2,1%). Тогда как у животных контрольной группы лизоцимная активность не изменялась и оставалась в пределах 17,7% при среднем значении физиологической нормы 25% (фиг.4).
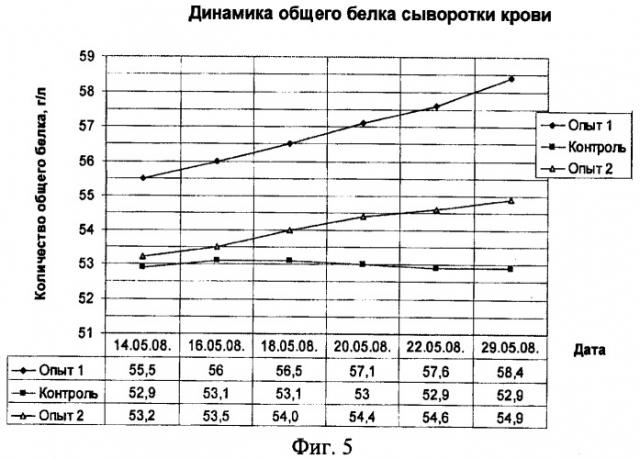
Количество общего белка в сыворотке крови у животных опытной группы повышалось с 55,5 г/л до 57,6 г/л (на 3,8%) к 5 сеансу облучения, а через 7 дней после него до 58,4 г/л (на 5,2%). У животных второй опытной группы с 53,2 г/л до 54,9 г/л (на 3,2%). Тогда как у животных в контрольной группе показатели общего белка и белковых фракций достоверно не изменялись и оставались в пределах 52,9 г/л (физиологическая норма для месячных телят (50,7-67,7 г/л)) (фиг.5).
Увеличение количества общего белка у животных в первой опытной группе происходило за счет увеличения белковых фракций α-глобулинов (с 3,8 г/л до 6,0 г/л к 5 сеансу и до 6,5 г/л через 7 дней после него) и γ-глобулинов (с 7,1 г/л до 9,7 г/л к 5 сеансу и до 10,2 г/л через 7 дней после него). Увеличение количества общего белка у животных второй опытной группы также происходило за счет увеличения белковых фракций α-глобулинов (с 3,6 г/л до 4,0 г/л) и γ-глобулинов (с 7,0 г/л до 7,6 г/л) (фиг.6, 7).
Содержание в крови животных опытной и контрольной групп АсАт, АлАт, билирубина, холестерина, глюкозы, молочной кислоты, мочевины, креатинина, микроэлементов (Р, Са, Fe) в течение опыта достоверно не изменялось.
Исходя из данных, приведенных выше на фигурах, видно, что внутривенное низкоинтенсивное лазерное облучение крови в области яремной вены способствовало повышению уровня неспецифической защиты и оказывало выраженное стимулирующее влияние на организм животных.
На основании всего вышеизложенного следует заключить, что с помощью нашего изобретения расширились возможности ветеринарных специалистов, направленные на повышение естественной резистентности телят-гипотрофиков.
Предложенный способ повышения естественной резистентности телят-гипотрофиков путем непосредственного введения низкоинтенсивного лазерного облучения крови с длиной волны 0,63 мкм с помощью одноразового стерильного световода с иглой впервые использован в ветеринарной медицине.
Опираясь на данные, полученные в результате наших исследований способа повышения естественной резистентности телят-гипотрофиков, можно заключить, что способ:
1. Прост в применении, так как манипуляцию по пунктированию яремной вены может выполнить любой ветеринарный врач.
2. Неинвазивен, так как в ходе опыта и после него у животных не было выявлено никаких осложнений.
3. Эффективен, что подтверждено вышеизложенными морфо-биохимическими показателями крови животных.
Литература
1. Внутренние незаразные болезни сельскохозяйственных животных / Б.М.Анохин и др. Под ред. В.М.Данилевского. - М.: Агропромиздат, 1991. - 575 с.
2. Бояренцев Л.Е. Иммуномодулирующая активность лигаверина при гипотрофии телят / Л.Е.Бояренцев // Ветеринария. - 2002. - №9. - С.41-44.
3. Лютинский С.И. Пептидные биорегуляторы в лечении гипотрофии молодняка разных видов животных / С.И. Лютинский // Тез. докл. научн. конф. профессорско-преподават. состава, научн. сотрудников и аспирантов ЛВИ "Актуальные проблемы ветеринарии". - Л., 1991. - С.47.
4. Григорян А.А. Схемы применения миксоферона при лечении телят / А.А. Григорян, В.Н. Прохоров // Ветеринария 1996. - №2. - С.9-11.
5. RU 2177788 С2, 10.03.2000.
6. Применение иммуномодуляторов продуктивным животным / А.В.Деева, Т.Н.Ракова, Т.П.Лобанова и др. // Ветеринария, 2004. - №6. - С.15-17.
7. Рекомендации. Научно обоснованная система получения здорового молодняка и профилактики желудочно-кишечных болезней новорожденных телят. Рассмотрены на Бюро Отделения ветеринарной медицины Российской академии сельскохозяйственных наук 26.06.2002 г.
8. Наставление по применению Тетрагидровита. Регистрационный номер ПВР-2-0,2/01061.
9. Временное наставление по применению Седимина. Утверждено департаментом ветеринарии 06.02.2003 года.
10. Гейниц А.В., Москвин С.В., Азизов Г.А. Внутривенное лазерное облучение крови. - Тверь, 2006. - 144 с.
11. RU 2290231 С1, 27.12.2006.
12. Лазер повышает иммунитет / В.Анзоров, В.Титова, С.Хилькевич, Д.Никулин // Животноводство России. - 2005. - №9. - С.21.
11. Издепольский В.И. Использование активированной лазером крови при гнойных артритах / В.И.Издепольский // Ветеринария. - 1990. - №6. - С.50-52.
Способ повышения естественной резистентности телят-гипотрофиков, в ходе которого проводят пункцию яремной вены иглой с находящимся в ней световодом, подключенным к лазерной излучающей головке для внутривенного облучения крови с длиной волны 0,63 мкм и мощностью 1,5 мВт; процедуру проводят в течение 5 мин один раз в день с интервалом через день, пятикратно.