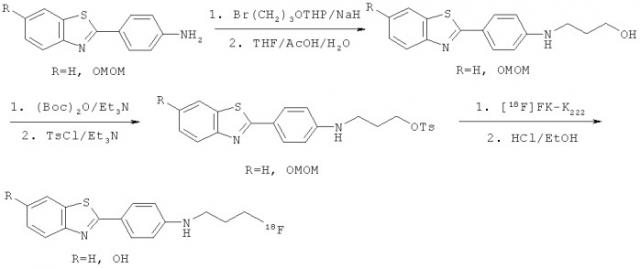
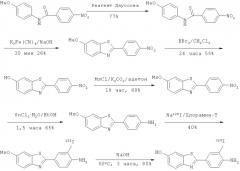
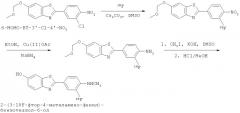
Производные бензотиазола, фармацевтическая композиция, обладающая свойством связывать амилоид, и способ детекции отложений амилоида у млекопитающего
Иллюстрации
Показать всеИзобретение относится к производным бензотиазола общей формулы (I), в которой R1 представляет собой -ОН; R2 представляет собой радиоактивный фтор; R3 представляет собой водород и R4 представляет собой C1-С6 алкил; и к их фармацевтически приемлемым солям. Также изобретение относится к фармацевтической композиции, обладающей свойством связывать амилоид, для детекции отложений амилоида, содержащей в эффективном количестве производное бензотиазола формулы (I) и фармацевтически приемлемый носитель, и к способу детекции отложений амилоида у млекопитающего путем введения определяемого количества производного бензотиазола формулы (I), способного к специфическому связыванию с амилоидными отложениями, с последующей детекцией его связанного количества. Технический результат - производные бензотиазола для визуализации отложений амилоида у больных при жизни. 3 н. и 2 з.п. ф-лы, 18 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области органической химии, медицины и фармакологии, конкретно к специфическим тиофлавиновым производным, которые пригодны для визуализации отложений амилоида у больных при жизни. В частности, данное изобретение относится к способу визуализации отложений амилоида в головном мозге in vivo с целью получения прижизненного диагноза болезни Альцгеймера при использовании этих тиофлавиновых производных.
Уровень техники
Болезнь Альцгеймера ("AD") представляет собой нейродегенеративное заболевание, характеризующееся потерей памяти и другими недостатками познавательной способности. См. статью McKhann и соавт., Neurology, 34: 939, (1984). Она является распространенной причиной деменции в Соединенных Штатах. AD может поражать людей в таком молодом возрасте, как 40-50 лет, хотя, поскольку наличие заболевания трудно установить без проведения опасной биопсии головного мозга, время его начала неизвестно. Распространенность AD с возрастом повышается, при этом по приблизительной оценке пораженная популяция достигает такого уровня, как 40-50% в возрасте 85-90 лет. См. статьи Evans и соавт., JAMA, 262: 2551, (1989); Katzman, Neurology, 43: 13, (1993).
Исследования предполагают, что отложение амилоида в головном мозге представляет собой раннее причинное событие в патогенезе болезни Альцгеймера (AD). Развитие отложения амилоида приводит в результате к образованию невритных бляшек и нейрофибриллярных клубочков в областях головного мозга, которые участвуют в обучении и памяти. Типичная невритная бляшка Альцгеймера содержит дистрофические невриты, окружающие ядро амилоидного материала. Основным компонентом амилоидного ядра является белок, называемый амилоидом-β (Аβ).
Практически окончательный диагноз AD ставят на основании исследования ткани головного мозга, обычно при аутопсии. См. статьи Khachaturian, Arch. Neurol., 42: 1097, (1985); McKhann и соавт., Neurology, 34: 939, (1984). С точки зрения невропатологии данное заболевание характеризуется присутствием невритных бляшек (NP), нейрофибриллярных клубочков (NFT) и потерей нейронов наряду с множеством других признаков. См. статью Mann, Mech. Ageing Dev., 31: 213, (1985). Посмертные срезы ткани головного мозга жертв болезни Альцгеймера демонстрируют присутствие амилоида в форме белковых экстрацеллюларных ядер невритных бляшек, характерных для AD.
Амилоидные ядра данных невритных бляшек состоят из белка, называемого β-амилоид (Аβ), который имеет в основном конфигурацию β-складчатого листа. См статьи Mori и соавт., Journal of Biological Chemistry, 267: 17082, (1992); Kirschner и соавт., PNAS, 83: 503, (1986). Невритные бляшки являются ранним и инвариантным аспектом заболевания. См. статьи Mann и соавт., J. Neurol. Sci., 89: 169; Mann, Mech. Ageing Dev., 31: 213, (1985); Terry и соавт., J. Neuropathol. Exp. Neurol., 46: 262, (1987).
Изначальное отложение Аβ, вероятно, происходит задолго до того, как становятся заметными клинические проявления. Основой рекомендуемых в настоящее время "минимальных микроскопических критериев" для диагностики AD является число невритных бляшек, обнаруженных в головном мозге. См. статью Khachaturian, Arch. Neurol., supra, (1985). Однако оценка числа невритных бляшек должна быть отложена до смерти.
Содержащие амилоид невритные бляшки являются ведущим признаком избранных участков головного мозга при AD, а также при синдроме Дауна и у субъектов, гомозиготных по аллелю аполипопротеина Е4, у которых с большой долей вероятности разовьется AD. См. статьи Corder и соавт., Science, 261: 921 (1993); Divry P., J. Neurol. Psych., 27: 643-657 (1927); материал Wisniewski и соавт. в монографии Развитие невропатологии (Progress in neuropathology) под ред. Zimmerman H.M. (Grune and Stratton, N.Y., 1973) стр.1-26. Амилоид головного мозга легко продемонстрировать путем окрашивания срезов головного мозга тиофлавином S или Конго красным. См. статью Puchtler и соавт., J. Histochem. Cytochem., 10:35 (1962). Амилоид, окрашенный Конго красным, характеризуется дихроическим видом, демонстрируя желто-зеленое поляризационное окрашивание. Дихроическое связывание является результатом структуры β-складчатого листа белков амилоида. См. статью Glenner G.N., Eng. J. Med., 302: 1283, (1980). Детальное обсуждение биохимии и гистохимии амилоида можно найти в статье Glenner G.N., Eng. J. Med., 302: 1333, (1980).
До сих пор диагностику AD осуществляли в основном посредством оценки клинических критериев, биопсии головного мозга и посмертных исследований тканей. Усилия исследователей разработать способы диагностики болезни Альцгеймера in vivo включают (1) генетическое тестирование, (2) способы иммуноанализа и (3) методики визуализации.
Доказательство того, что аномалии в метаболизме Аβ необходимы и достаточны для развития AD, основано на обнаружении точечных мутаций в белке-предшественнике Аβ в ряде редких семей с аутосомной доминантной формой AD. См. статьи Hardy, Nature Genetics, 1: 233 (1992); Hardy и соавт., Science, 256: 184 (1992). Данные мутации присутствуют около N- и С-концевых точек расщепления, необходимых для образования Аβ из его белка-предшественника. См. статьи St. George-Hyslop и соавт., Science, 235: 885, (1987); Kang и соавт., Nature, 325: 733 (1987); патентную заявку Potter, WO 92/17152. Однако генетический анализ большого числа семей, подверженных AD, продемонстрировал генетическую гетерогенность AD. См. статью St. George-Hyslop и соавт., Nature, 347: 194 (1990). Сцепление с маркерами хромосомы 21 показано только для нескольких семей с ранним началом развития AD и не показано для семей с поздним началом развития AD. Совсем недавно ген на хромосоме 14, продукт которого, как предсказано, содержит множество трансмембранных доменов и напоминает интегральный мембранный белок, был идентифицирован Sherrington и соавт., Nature, 375: 754-760 (1995). Действием данного гена можно объяснить до 70% случаев раннего развития аутосомного доминантного AD. На основании предварительных данных предполагают, что данная мутация на хромосоме 14 вызывает повышение продукции Аβ. См. статью Scheuner и соавт., Soc. Neurosci. Abstr., 21: 1500, (1995). Мутация очень близкого гена была идентифицирована на хромосоме 1 на протяжении поколений в семьях поволжских немцев, у которых рано развивается AD. См. статью Levy-Lahad и соавт., Science, 269: 973-977, (1995).
Полагают, что скрининг генотипа аполипопротеина Е помогает в диагностике AD. См. статьи Scott, Nature, 366: 502, (1993); Roses, Ann., Neurol., 38: 6-14, (1995). Однако в данной методике возникают сложности, поскольку аллель аполипопротеина Е4 представляет собой только фактор риска развития AD, а не маркер заболевания. Он отсутствует у многих больных AD и присутствует у многих пожилых людей, не пораженных деменцией. См. статью Bird, Ann. Neurol., 38: 2-4, (1995).
Для детекции присутствия нейрохимических маркеров у больных AD и детекции связанного с AD белка амилоида в спинномозговой жидкости были разработаны способы иммуноанализа. См. статью Warner, Anal. Chem., 59: 1203А, (1987); Международная заявка 92/17152, принадлежащая Potter; Патент США NO 4666829, выданный Glenner и соавт. Данные способы диагностики AD, как было доказано, не выявляют AD у всех больных, в особенности на ранних стадиях заболевания, и они относительно инвазивны, поскольку требуют спинномозговой пункции. Были также предприняты попытки создания моноклональных антител для использования в качестве зондов для визуализации Аβ. См. статью Majocha и соавт., J. Nucl. Med., 33: 2184, (1992); патентную заявку Majocha и соавт. WO 89/06242 и Патент США 5231000, выданный Majocha и соавт. Основной недостаток зондов на основе антител состоит в трудности переноса данных крупных молекул через гематоэнцефалический барьер. Использование антител для диагностики AD in vivo потребовало бы наличия заметных аномалий в гематоэнцефалическом барьере для того, чтобы создать избыток в головном мозге. Не существует убедительных функциональных доказательств, что аномалии в гематоэнцефалическом барьере достоверно существуют при AD. См. статью Kalaria, Cerebrovascular & Brain Metabolism Reviews, 4: 226, (1992).
Пептид Аβ с радиоактивной меткой использовали для мечения бляшек диффузного, компактного и невритного типа в срезах головного мозга, пораженного AD. См. заявку Maggio и соавт. WO 93/04194. Однако данные пептиды сохраняли все недостатки антител. В частности, пептиды в количествах, необходимых для визуализации, нормально не проникали через гематоэнцефалический барьер и, поскольку данные зонды реагируют с диффузными бляшками, они могут не иметь специфичности в отношении AD.
Невритные бляшки и нейрофибриллярные клубочки (NFT) представляют собой два наиболее характерных патологических признака AD. См. статью Klunk и Abraham, Psychiatric Development, 6:121-152, (1988). Бляшки ранее всего возникают в новой коре головного мозга, в которой они распределены относительно равномерно. См. статью Thal и соавт., Neurology, 58:1791-1800, (2002). Клубочки сначала появляются в лимбических областях, таких как трансенторинальная кора головного мозга, и развиваются как предсказуемый топографический тип в новой коре головного мозга. См. статью Braak и Braak, Acta Neuropathologica, 82:239-259, (1991). Arnold и соавт. картировали распределение NFT и невритных бляшек в головном мозге пациентов с AD. См. статью Arnold и соавт., Cereb. Cortex, 1:103-116, (1991). По сравнению с NFT невритные бляшки были, как правило, более равномерно распределены в коре головного мозга за исключениями заметно меньшего количества невритных бляшек в лимбическом периаллокортексе и аллокортексе (области с наибольшей плотностью NFT). При окрашивании тиофлавином-S височные и затылочные доли имели самую высокую плотность невритных бляшек, лимбические и лобные доли имели самую низкую, и теменная доля была средней. См. статью Arriagada и соавт., Neurology, 42:1681-1688, (1992). Arriagada и соавт. изучали топографическое распределение патологических изменений AD-типа в головном мозге пожилых субъектов с доказанным отсутствием деменции. Данные результаты предполагают, что у большинства субъектов в возрасте свыше 55 лет имеется по меньшей мере немного NFT и бляшек. Иммуногистохимически определенные подтипы SP имели определенные типы распределения, причем Аβ-иммунореактивные бляшки присутствуют в областях новой коры головного мозга в значительно большем количестве, чем в лимбических областях, и Alz-50-иммунореактивные бляшки встречаются реже и ограничены теми областями, которые содержат Alz-50-положительные нейроны и NFT. Данные типы предполагают наличие общности в патологических процессах, которая ведет к NFT и SP как при старении, так и при AD.
Остается обсудить вопрос, являются ли бляшки и клубочки побочными продуктами нейродегенеративного процесса, обнаруженного при AD, или они представляют собой причину гибели нервных клеток. См. статьи Ross, Current Opinion in Neurobiol., 96:644-650, (1996); Terry, J. of Neuropath. & Exp. Neurol., 55:1023-1025, (1996); Terry, J. Neural Transmission-Suppl., 53:141-145, (1998). Имеется явное доказательство того, что потеря синапсов новой коры головного мозга и гиппокампа хорошо коррелирует с преморбидным когнитивным статусом. Некоторые исследователи предполагают, что нарушение структуры и функции микротрубочек, вызываемое гиперфосфорилированием белка tau, связанного с микротрубочками, играет ключевую этиологическую роль в потере синапсов, в частности, и AD, в целом. См. статьи Terry, J. of Neuropath. & Exp. Neurol., 55:1023-1025, (1996); Terry, J. of Neural Transmission-Suppl., 53:141-145, (1998). Было сделано предположение, что окислительное повреждение и разрушение мембран играют важные роли в AD. См. статьи Perry, Free Radical Biology & Medicine, 28:831-834, (2000); Pettegrew и соавт., Annals of the New York Academy of Sciences, 826:282-306, (1997). Сосудистые факторы, включая замедленную хроническую церебральную гиперфузию, также участвуют в патогенезе AD. См. статьи De la Torre, Annals of the New York Academy of Sciences, 903:424-436, (2000); Di lorio и соавт., Aging (Milano), 11:345-352, (1999). Хотя все данные факторы, вероятно, играют определенную роль в патогенезе AD, увеличивается количество фактов, указывающее на аномалии в процессировании пептида амилоида-β (Аβ), пептида молекулярной массы 4 кД, который агрегируется с образованием фибриллярной структуры β-складчатой поверхности. См. статью Glenner и Wong, Biochemical & Biophysical Research Communications, 120:885-890, (1984). Предполагают, что Аβ играет важную роль в патогенезе AD по ряду причин: 1) отложения Аβ представляют собой самые ранние нейропатологические маркеры AD при синдроме Дауна и могут предшествовать формированию NFT за несколько десятилетий, см. статью Mann и соавт., Neurodegeneration, 1:201-215, (1992); Naslund и соавт., JAMA, 283:1571-1577, (2000). 2) β-амилоидоз относительно специфичен для AD и близкородственных нарушений; см. статью Selkoe, Trends in Neurosciences, 16:403-409, (1993); 3) Аβ токсичен для культуры нейронов, Yankner Neurobiol. Aging, 13:615-616, (1992); Mattson и соавт., J. Neuroscience, 12:376-389, (1992); Shearman и соавт., Proc. Natl. Acad. Sci. USA, 91:1470-1474, (1994), причем токсичность, по-видимому, зависит от вторичной структуры β-складки и агрегации в по меньшей мере олигомеры. См. статьи Lambert и соавт., Рrос. Natl. Acad. Sci. USA, 95:6448-6453, (1989); Pike и соавт., J. Neuroscience 13:1676-1687, (1993); Simmons
и соавт., Molecular Pharmacology, 45:373-379, (1994). Хотя Аβ, несомненно, находится в виде равномерно распределенных мономерных, олигомерных и фибриллярных/бляшечных фракций, олигомерная форма Аβ в значительной степени действует как ключевой нейротоксический компонент. См. Selkoe в монографии Болезнь Альцгеймера (Alzheimer заболевание) под ред. R.D.Terry и соавт., с. 293-310, Lippincott Williams и Wilkins, Philadelphia (1999); статью Selkoe, Science 298, 789-91, (2002). Понимание токсических эффектов олигомерного Аβ создало основу для дискредитации ряда оппонентов "гипотезы амилоидного каскада" в развитии AD. См. статью Terry, Ann. Neurol., 49:684, (2001). Возможно, самое сильное доказательство роли Аβ в патогенезе AD исходит из обнаружения мутаций в гене белка предшественника амилоида (АРР), которые приводят к некоторым формам раннего начала семейной формы AD. См. статью Goate и соавт., Nature, 349:704-706, (1991). Кроме того, все семейные формы аутосомной доминантной AD обычно характеризуются повышенным уровнем ускоренно агрегирующейся формы Аβ из 42 аминокислот. См. статью Younkin Rinsho Shinkeigaku, Clinical Neurology, 37:1099, (1997). Напротив, показано, что никакие мутации в белке tau не вызывают AD. Вместо этого мутации в tau (хромосома 17) сцеплены с лобновисочной деменцией, связанной с Паркинсонизмом. См. статью Goedert и соавт., Neuron, 21:955-958, (1998). Недавно полученные факты показали хорошую корреляцию между уровнями Аβ в головном мозге и снижением когнитивной способности при AD, и отложение амилоида, по-видимому, представляет собой очень раннее, возможно, первое событие в патогенезе AD, предшествующее какому-либо когнитивному нарушению. См. статью Naslund и соавт., JAMA 283:1571-1577, (2000). Его наличие может модулировать ряд биохимических путей, которые приводят в результате к отложению еще других белков, активации астроглии и микроглии и в конечном счете гибели нервных клеток и последующему когнитивному расстройству.
На основании имеющихся данных можно предположить, что связывающие амилоид соединения будут обладать терапевтической активностью при AD и сахарном диабете типа 2. Все морфологические реакции, включая присутствие реактивных астроцитов, дистрофические невриты, активированные клетки микроглии, потерю синапсов и полную активацию комплемента, которые обнаруживают вокруг невритных бляшек, указывают на то, что нейротоксические и дегенеративные в отношении клеток процессы происходят на участках, прилежащих к данным отложениям Аβ. См. статьи Joachim и соавт., Am. J. Pathol., 136: 309, (1989); Masliah и соавт., loc. cit., 137: 1293 (1990); Lue и Rogers, Dementia, 3: 308, (1992). Индуцированные Аβ нейротоксичность и дегенерация клеток были показаны для ряда типов клеток in vitro. См. статьи Yankner и соавт., Science, 250: 279, (1990); Roher и соавт., BBRC, 174: 572, (1991); Frautschy и соавт., Proc. Natl. Acad. Sci., 88: 83362, (1991); Shearman и соавт., loc. cit., 91: 1470, (1994). Было показано, что агрегация пептида Аβ необходима для проявления нейротоксичности in vitro. См. статью Yankner, Neurobiol. Aging, 13: 615, (1992). Недавно были представлены результаты работы трех лабораторий, которые предполагают, что Конго красный ингибирует индуцируемую Аβ нейротоксичность и дегенерацию клеток in vitro. См. статьи Burgevin и соавт., NeuroReport, 5: 2429, (1994); Lorenzo и Yankner, Proc. Natl. Acad. Sci., 91: 12243, (1994); Pollack и соавт., Neuroscience Letters, 197: 211, (1995). По-видимому, механизм включает как ингибирование образования фибрилл, так и предупреждение нейротоксических проявлений образованных фибрилл. См. статью Lorenzo and Yankner, Proc. Natl. Acad. Sci., 91: 12243, (1994). Конго красный, как также было показано, защищает клетки островков поджелудочной железы от токсичности, обусловленной амилином. См. статью Lorenzo и Yankner, Proc. Natl. Acad. Sci., 91: 12243, (1994). Амилин представляет собой фибриллярный пептид, близкий Аβ, который накапливается в поджелудочной железе при сахарном диабете типа 2. В уровне техники известно, что некоторые азокрасители, такие как Конго красный, могут быть канцерогенными. См. статью Morgan и соавт., Enviromental Health Perspectives, 102 (допол.), 2: 63-78, (1994). Данная потенциальная канцерогенность, по-видимому, в основном базируется на том факте, что азокрасители широко метаболизируются кишечными бактериями до исходных свободных аминов. См. статью Cerniglia и соавт., Biochem. Biophys. Res. Corn., 107: 1224-1229, (1982). В случае бензидиновых красителей (и многих других замещенных бензидинов) данный свободный амин является канцерогеном. Данные факты не имеют большого значения для исследований, связанных с визуализацией амилоида, в которых очень маленькое количество красителя с радиоактивной меткой, обладающего высокоспецифической активностью, должно инъекционно вводиться непосредственно в кровоток. В данном случае введенное количество было бы незначительным, и краситель не вступал бы в контакт с кишечными бактериями.
В случае терапевтического применения данные факты имеют важное значение. Выделение известного канцерогена из терапевтического соединения является неприемлемым. Вторая проблема, касающаяся метаболизма диазокрасителей, состоит в том, что значительная часть введенного лекарственного соединения метаболизируется кишечными бактериями до всасывания. Недостаток в виде данной пониженной биодоступности сохраняется даже, когда выделяемые метаболиты являются безвредными.
Тиофлавин Т
представляет собой основной краситель, описанный как избирательный краситель для амилоида в 1959 г. Vassar и Culling (см. Arch. Pathol., 68: 487, (1959)). Schwartz и соавт. (см. Zbl. Path., 106: 320, (1964)) впервые продемонстрировали в 1964 г. применение кислого красителя Тиофлавина S (структурную формулу см. на Фиг.1) в качестве красителя для амилоида. С тех пор свойства как Тиофлавина Т, так и Тиофлавина S были детально изучены. См. статьи Kelenyi, J. Histochem. Cytochem., 15: 172, (1967); Burns и соавт., J. Path. Bact., 94:337, (1967); Guntern и соавт., Experimentia, 48: 8, (1992); LeVine, Meth. Enzymol., 309: 274, (1999).
Тиофлавин S обычно используют в посмертных исследованиях отложения амилоида в головном мозге, пораженном AD, в которых окрашивание им, как было показано, является одной из наиболее чувствительных методик для демонстрации сенильных бляшек. См. статью Vallet и соавт., Acta Neuropathol., 83:170, (1992). Тиофлавин также часто использовали в качестве реагента для изучения агрегации растворимых белков амилоида с образованием фибрилл со структурой β-складки. См. статью LeVine, Prot. Sci., 2: 404, (1993).
Производные четвертичного амина, относящиеся к Тиофлавину Т, рассматривали как агенты для визуализации амилоида, хотя не было представлено никаких доказательств поглощения данных агентов головным мозгом. См. Патент США 6001331, выданный Caprathe и соавт. (прототип).
Поскольку отложение амилоида может происходить задолго до того, как клинические симптомы AD становятся заметными, выявление и количественное определение отложений амилоида могло бы облегчить диагностику AD на ее ранних предсимптоматических стадиях. См. Патент США No. 6417178. Методики визуализации, такие как эмиссионная позитронная томография (PET) и однофотонная эмиссионная компьютерная томография (SPECT), эффективны при мониторинге накопления отложений амилоида в головном мозге и их корреляции с развитием AD.
Однако применение данных методик требует разработки радиолигандов, которые легко проходят в головной мозг и селективно связываются с отложениями амилоида in vivo.
Отсутствие возможности оценить отложение амилоида при AD до наступления смерти затрудняет изучение данной разрушающей болезни.
Способ количественной оценки отложения амилоида до наступления смерти необходим как в качестве диагностического инструмента при умеренных проявлениях или в клинически неясных случаях, так и для мониторирования эффективности терапевтических средств, направленных на предупреждение отложения Аβ.
Несмотря на то что предпринимались различные попытки диагностировать AD in vivo, в настоящее время не имеется зондов для определения амилоида в головном мозге при жизни.
Ни в каком из способов не используют высокоаффинный зонд для амилоида, который имеет низкую токсичность, может проходить через гематоэнцефалический барьер и более эффективно связывается с головным мозгом, пораженным AD, чем с нормальным головным мозгом, с целью прижизненной идентификации отложений амилоида при AD в головном мозге больного. Ни один из способов диагностики AD in vivo не продемонстрировал соответствия данным критериям.
Таким образом, имеется потребность в амилоид-связывающих соединениях, которые нетоксичны и могут проходить через гематоэнцефалический барьер и, следовательно, могут быть использованы в диагностике, что составляет изобретательскую задачу данного изобретения.
Также имеется потребность в новых разработанных амилоид-связывающих радиолигандах, которые нетоксичны, способны селективно связываться с отложениями амилоида и могут проходить через гематоэнцефалический барьер и, следовательно, могут быть использованы в эффективных методиках визуализации, таких как эмиссионная позитронная томография (PET) и однофотонная эмиссионная компьютерная томография (SPECT), что также составляет изобретательскую задачу данного изобретения.
Далее, разработка безопасного и специфического прижизненного (в условиях in vivo) способа диагностики путем визуализации амилоида в паренхиме головного мозга с помощью новых разработанных радиолигандов также сохраняет чрезвычайную важность и также составляет изобретательскую задачу.
Сущность изобретения
Таким образом, изобретательской задачей является поиск новых производных тиофлавина Т (производных бензотиазола), которые могли бы в силу их специфичности к связыванию амилоидных белков, нетоксичности, способности проникать через внутренние барьеры организма, быть использованы для визуализации отложений амилоида в условиях in vivo, предпочтительно в виде радиолигандов в таких эффективных методиках визуализации, как эмиссионная позитронная томография (PET) и однофотонная эмиссионная компьютерная томография (SPECT), предпочтительно для диагностики заболеваний, при которых преобладает кумуляция невритных бляшек, таких как болезнь Альцгеймера, семейная форма болезни Альцгеймера, синдром Дауна и гомозиготы по аллелю Е4 аполипопротеина.
В этом плане авторы данного изобретения установили, что варьирование замещений в различных положениях может повышать аффинность связывания в зависимости от положения заместителя.
Кроме того, авторы данного изобретения разработали серию незаряженных производных тиофлавина Т как агентов для визуализации амилоида, которые обладают высокой аффинностью в отношении отложений амилоида и высокой способностью проникновения через гематоэнцефалический барьер.
Широкие исследования in vitro и in vivo данных агентов для визуализации амилоида показали, что они способны специфически связывать отложения амилоида в концентрациях, которые обычно используются при исследованиях с использованием эмиссионной позитронной томографии.
В сложной среде головного мозга неспецифическое связывание данных соединений для визуализации амилоида является низким, даже в контрольном мозге, не имеющим отложений амилоида. В наномолярных концентрациях данные соединения, по-видимому, не связываются с нейрофибриллярными клубочками.
Соединения, используемые для указанных выше целей, соответствуют следующей формуле:
где Z представлено S, NR', О или C(R')2, в таком случае таутомерной формой гетероциклического кольца может стать индол, в котором R' означает Н или группу низшего алкила:
где Y - NR1R2, OR2 или SR2;
где атом азота в азольном или тиазольном ядре не является азотом четвертичного амина ,
при этом каждое из R1 и R2 независимо друг от друга выбраны из группы, состоящей из Н, группы низшего алкила, (CH2)n2OR' (где n=1, 2 или 3), СF3, CH2-CH2X, CH2-CH2-CH2X (где X=F, Cl, Br или I), (C=O)-R', Rph и (CH2)nRph (где n=1, 2, 3 или 4 и Rph представляет собой незамещенную или замещенную фенильную группу с фенильными заместителями, выбранными из любых нефенильных заместителей, определенных ниже для R3-R10, и R' представляет собой Н или группу низшего алкила);
каждое из R3-R10 независимо выбраны из группы, состоящей из Н, F, Cl, Br, I, группы низшего алкила, (CH2)nOR' (где n=1, 2 или 3), СF3, CH2-CH2X, О-СН2-СН2Х, СН2-СН2-СН2X, O-CH2-CH2-CH2X (где X=F, Cl, Br или I), CN, (C=O)-R', N(R')2, NO2, (C=O)N(R')2, O(CO)R', OR', SR', COOR' Rph, CR'=CR'-Rph, CR2'-CR2'-Rph (где Rph представляет собой незамещенную или замещенную фенильную группу с фенильными заместителями, выбранными из любых нефенильных заместителей, определенных для R1-R10, и где R' представляет собой Н или группу низшего алкила); триалкилолово и хелатирующей группы (содержащей или не содержащей хелатированную группу металла) формы W-L или V-W-L, в которой V выбрано из группы, состоящей из -СОО-, -СО-, -CH2O- и -CH2NH-; W представляет собой -(СН2)n, где n=0, 1, 2, 3, 4 или 5, и L представляет собой
, , ,
, , , или
где М выбрано из группы, состоящей из Тc и Re.
Другой вариант осуществления относится к соединениям формулы
или фармацевтически приемлемой соли, гидрату, сольвату или пролекарственной форме соединения, в которой
R1 представляет собой водород, -ОН, -NO2, -CN, -COOR, -OCH2OR, C1-C6алкил, C2-C6алкенил, C2-C6алкинил, C1-C6алкоксигруппу или галоген, где один или более атомов R1 может представлять собой радиоактивно меченный атом;
R представляет собой C1-C6алкил, в котором один или более атомов углерода может представлять собой радиоактивно меченный атом;
R2 представляет собой водород, нерадиоактивный галоген или радиоактивный галоген;
R3 представляет собой водород, C1-C6алкил, C2-C6алкенил или C2-C6алкинил и
R4 представляет собой водород, C1-C6алкил, C2-C6алкенил или C2-C6алкинил, где алкил, алкенил или алкинил содержит радиоактивный углерод или замещен радиоактивным галогеном, когда R2 представляет собой водород или нерадиоактивный галоген,
при условии, что, когда R1 представляет собой водород или -ОН, R2 представляет собой водород и R4 означает -11СН3, то R3 представляет собой C2-C6алкил, C2-C6алкенил или C2-C6алкинил, и
при дальнейшем условии, что, когда R1 представляет собой водород, R2 означает водород и R4 представляет собой -CH2CH2CH2 18F, то R3 представляет собой C2-C6алкил, C2-C6алкенил или C2-C6алкинил.
Другой вариант осуществления относится к соединениям, выбранным из группы, состоящей из структур 1-45, которые используют в описанных способах:
Еще один вариант осуществления относится к амилоид-связывающему соединению, имеющему структуру, выбранную из группы, состоящей из:
В еще одном варианте осуществления амилоид-связывающие соединения, соответствующие изобретению, связываются с Аβ с константой диссоциации (KD) от 0,0001 до 10,0 мкМ при измерении по связыванию с синтетическим пептидом Аβ или тканью головного мозга болезни Альцгеймера.
Другой вариант осуществления изобретения относится к способу синтеза амилоид-связывающих соединений, соответствующих изобретению, имеющих по меньшей мере один из заместителей, выбранный из группы, состоящей из 131I, 125I, 123I, 76Вr, 75Вr, 18F и 19F, который предусматривает стадию мечения амилоид-связывающего соединения, в котором по меньшей мере один из заместителей представляет собой триалкилолово, путем реакции соединения с 131I, 125I, 123I, 76Br, 75Br, 18F и 19F-содержащей субстанцией.
Следующий вариант осуществления данного изобретения относится к фармацевтической композиции для визуализации in vivo отложений амилоида, содержащей (а) связывающее амилоид соединение, соответствующее данному изобретению, и (b) фармацевтически приемлемый носитель.
В другом варианте осуществления изобретения предложен способ in vivo обнаружения отложений амилоида у субъекта, предусматривающий стадии: (а) введения определяемого количества фармацевтической композиции, содержащей меченое связывающее амилоид соединение, и (b) детекции связывания соединения с отложением амилоида в организме субъекта. В предпочтительном аспекте данного варианта осуществления отложение амилоида находится в головном мозге субъекта. В особенно предпочтительном аспекте данного варианта осуществления у субъекта предполагают наличие заболевания или синдрома, выбранного из группы, состоящей из болезни Альцгеймера, семейной формы болезни Альцгеймера, синдрома Дауна и гомозиготного состояния по аллелю аполипопротеина Е4. В другом особенно предпочтительном аспекте данного варианта осуществления метод детекции выбран из группы, состоящей из визуализации с помощью γ-лучей, визуализации с помощью магнитного резонанса и спектроскопии магнитного резонанса. В предпочтительном аспекте данного варианта осуществления визуализация с помощью γ-лучей представлена либо PET (эмиссионной позитронной томографией), либо SPECT (однофотонной эмиссионной компьютерной томографией). В другом предпочтительном аспекте данного варианта осуществления фармацевтическую композицию вводят посредством внутривенной инъекции. В следующем предпочтительном аспекте данного варианта осуществления соотношение (i) связывания соединения с областью головного мозга, отличной от мозжечка, и (ii) связывания соединения с мозжечком в организме субъекта сравнивают с данным соотношением у нормального субъекта.
В другом варианте осуществления выявление отложений амилоида in vivo используют в диагностике болезни Альцгеймера.
Другой вариант осуществления касается способа обнаружения отложений амилоида в биоптате или полученной посмертно ткани человека или животного, который предусматривает стадии: (а) инкубирования фиксированной в формалине или свежезамороженной ткани с раствором связывающего амилоид соединения, соответствующего данному изобретению, для образования меченого отложения с последующей стадией (b) детекции меченых отложений. В предпочтительном аспекте данного варианта осуществления раствор содержит 25-100% этанола, в котором остальную часть раствора составляет вода, при этом раствор насыщен связывающим амилоид соединением, соответствующим данному изобретению. В особенно предпочтительном аспекте данного варианта осуществления раствор состоит из водного буфера (такого как трис или фосфатный буфер), содержащего 0-50% этанола, при этом раствор содержит 0,0001-100 мкМ связывающего амилоид соединения, соответствующего данному изобретению. В особенно предпочтительном аспекте данного варианта осуществления детекцию осуществляют методами на основе микроскопии, выбранными из группы, состоящей из светлопольной, флуоресцентной, лазе