Производные докозагексаеновой кислоты и их применение в качестве лекарственных средств
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I), где X является карбоновой кислотой, карбоксилатом, карбоксильным ангидридом, диглицеридом, триглицеридом, фосфолипидом, или карбоксамидом, или к их любой фармацевтически приемлемой соли. Изобретение, в частности, относится к (4Z, 7Z, 10Z, 13Z, 16Z, 19Z)-этил 2-этилдокоза-4,7,10,13,16,19-гексаноату. Изобретение также относится к пищевой липидной композиции и к композиции для лечения диабета, для снижения уровня инсулина, уровня глюкозы в крови, уровня триглицерида в сыворотке крови, для лечения дислипидемии, для снижения уровней холестерина в крови, для снижения веса тела и для лечения периферической резистенции к инсулину, включающим такие соединения. Кроме того, изобретение относится также к способам лечения и/или профилактики диабета, дислипидемии, периферической резистенции к инсулину, снижения массы тела и/или предупреждения прибавления в весе, снижения уровня инсулина, уровня холестерина в крови, уровня глюкозы в крови и/или уровня триглицерида в сыворотке крови. 18 н. и 43 з.п. ф-лы, 4 табл., 16 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Изобретение относится к соединениям общей формулы (I):
и их использованию в качестве лекарственных средств, в особенности для лечения сахарного диабета 2-го типа и преддиабетических состояний. Также настоящее изобретение относится к фармацевтической композиции, включающей соединения формулы (I), и к композиции жирных кислот, включающей соединения формулы (I).
ПРЕДПОСЫЛКИ К СОЗДАНИЮ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Повышение частоты заболеваемости сахарным диабетом 2-го типа во всем мире является огромной медицинской проблемой и ставит необходимость внедрения успешных профилактических и лечебных мер. Повышение частоты случаев ожирения и избыточной массы тела, которые сильно коррелируют с диабетом 2-го типа, негативным образом сказывается на лечении диабета и повышает вероятность заболеваний, связанных с гипертонией, дислипидемией и атеросклерозом.
Патофизиологическое состояние, предшествующее развитию диабета 2-го типа, связано с пониженным влиянием инсулина на периферические ткани, это явление называется резистентностью к инсулину. Этими тканями являются главным образом мышечные, жировые ткани и ткани печени. При диабете 2-го типа резистентность к инсулину наиболее характерна для мышечной ткани. Синдром, при котором наблюдаются резистентность к инсулину, повышенное кровяное давление, дислипидемия и провоспалительное состояние, называется метаболическим синдромом. Распространенность метаболического синдрома во взрослой популяции в развитых странах составляет 22-39% (Meighs 2003).
В настоящее время наиболее обещающим способом уменьшения метаболического синдрома является изменение стиля жизни, заключающееся в снижении веса, снижении потребления насыщенного жира, увеличении физической активности в комбинации с соответствующей фармакотерапией. При здоровых диетах, которые позволяют избегать излишнего потребления энергии, насыщенные жиры заменяются на моно- и полиненасыщенные жирные кислоты. В предупреждении диабета 2-го типа особенно свою эффективность доказали омега-3 полиненасыщенные жирные кислоты, которые содержатся в жирной рыбе, эйкозапентаеновая кислота (ЕРА) и докозагексаеновая кислота (DHA).
ЕРА и DHA оказывают влияние на различные физиологические процессы, такие как регуляция уровня липидов в плазме, сердечно-сосудистая и иммунная функции, действие инсулина, развитие нервной системы и зрительная функция. Существуют доказательства роли этих кислот в предупреждении и коррекции ишемической болезни сердца, дислипидемии, диабета 2-го типа, инсулиновой резистентности и гипертонии (Simonopoulos 1999; Geleijnse 2002; Storlien 1998). Недавние исследования показали, что омега-3 полиненасыщенные жирные кислоты являются важными медиаторами генной экспрессии, действуя через ядерные рецепторы, такие как рецепторы, активирующие пролиферацию пероксисом (PPARs), контролируя экспрессию генов, имеющих отношение к углеводному и липидному обмену и липогенезу (Jump 2002). Рецепторы PPARs являются ядерными рецепторами, которые играют важную роль в развитии связанных с ожирением нарушений обмена веществ, таких как гиперлипидемия, резистентность к инсулину и ишемическая болезнь.
Три подтипа рецепторов, α, γ и δ, имеют различный характер экспрессии и распознают компоненты различных липопротеинов, и регулируют липидный гомеостаз на основании потребностей специфических тканей. PPARα усиливает катаболизм жирных кислот в печени и является молекулярной мишенью фибратов, понижающих уровень липидов. PPARγ играет роль в дифференциации адипоцитов и опосредует активность инсулин-сенсибилизаторов - тиазолидиндионов (глитазоны), механизмы этого опосредования мало изучены (Chih-Нао 2003; Yki-Jarvinen 2004).
Недавно лекарственные средства, действующие как лиганды PPARγ рецептора, стали использоваться в лечении диабета 2-го типа (Yki-Jarvinen 2004). Эти соединения, называемые тиазолидиндионами или глитазонами, являются лекарственными средствами, которые реверсируют резистентность к инсулину, которая является патофизиологической базой для развития метаболического синдрома и диабета 2-го типа. Эти соединения, из которых розиглитазон и пиоглитазон выпускаются как лекарственные средства, понижают концентрацию глюкозы натощак и постпрандиальную концентрацию глюкозы (как было показано с помощью теста толерантности к глюкозе), уровень инсулина в плазме, а также концентрацию свободных жирных кислот. В этом отношении глитазоны действуют как инсулин-сенсибилизаторы.
Однако эти улучшения обычно сопровождаются прибавлением в весе и повышением массы подкожной жировой ткани (Adams 1997). Применение тиазолидиндионов не только связано с прибавлением в весе, но у части пациентов также наблюдается задержка жидкости и увеличение объема плазмы, что приводит к периферическим отекам. Увеличение массы тела и отеки могут приводить к нарушениям сердечной деятельности, это послужило причиной того, что Управление по контролю за продуктами и лекарствами (FDA) включило предостережение в информацию о розиглитазоне (Avandia) и пиоглитазоне (Takeda). Эти неблагоприятные эффекты ограничивают применение глитазонов особенно у пациентов с ишемической болезнью сердца. Очевидно, что существует необходимость в разработке новых лекарственных средств, которые оказывают положительное влияние на резистентность к инсулину, но снижают вес тела и не способствуют задержке воды в организме.
Эффект полиненасыщенных жирных кислот (PUFAs) на рецепторы PPARs является не только результатом структуры жирных кислот и сродства к рецептору. Также важны факторы, влияющие на концентрацию неэстерифицированных жирных кислот (NEFA). На пул NEFA влияет концентрация экзогенных жирных кислот, поступающих в клетку, и количество эндогенных синтезированных жирных кислот, их удаление через включение в липиды, а также их пути окисления (Pawar 2003).
Хотя омега-3 жирные кислоты являются слабыми агонистами PPARs по сравнению с такими фармакологическими агонистами как тиоглитазоны, эти жирные кислоты показали улучшение усвоения глюкозы и повышение чувствительности к инсулину (Storlien 1987). Было сделано сообщение о том, что адипоциты были более чувствительны к инсулину и транспортировали больше глюкозы, когда в диете было повышено отношение полиненасыщенных жирных кислот к насыщенным жирным кислотам (Field 1990). Вместе эти данные указывают на то, что С20 и С22 жирные кислоты, называемые ЕРА и DHA, могут играть определенную роль в предупреждении развития резистентности к инсулину.
Из-за их ограниченной стабильности in vivo и отсутствия биологической специфичности PUFAs не являются действительно широко используемыми терапевтическими агентами. Несколькими исследовательскими группами были выполнены химические модификации п-3 полиненасыщенных жирных кислот с целью изменить или повысить их метаболические эффекты.
Например, гиполипидемический эффект ЕРА был усилен путем введения метильной или этильной в α- или β-положение ЕРА (Vaagenes 1999). Эти соединения также снижают уровень свободных жирных кислот в плазме, тогда как этиловый эфир ЕРА не оказывает такого эффекта.
В недавней работе, опубликованной L. Larsen (Larsen 2005), авторы показывают, что α-метил производные ЕРА и DHA повышают активацию ядерного рецептора PPARα и таким образом экспрессию L-FABP по сравнению с EPA/DHA. ЕРА с этильной группой в α-положении активирует PPARα с такой же силой, как α-метил-ЕРА. Авторы полагают, что замедленный катаболизм этих α-метил жирных кислот может способствовать их повышенным эффектам из-за уменьшенного β-окисления в митохондриях, ведущего к пероксисомальному окислению.
Было показано, что альфа-метил-ЕРА является более сильным ингибитором агрегации тромбоцитов, чем ЕРА, как in vitro (Larsen 1998), так и in vivo (Willumsen 1998). В реферате патента Японии, номер публикации 05-00974, сообщается о DHA, замещенной в альфа-положении ОН-группой, однако только в качестве промежуточного продукта. Об исследованиях возможных фармацевтических эффектов этого соединения не сообщается.
Компания Laxdale Limited также описала применение альфа-замещенных производных ЕРА в лечении психиатрических расстройств и нарушений со стороны центральной нервной системы (US 6689812).
Ни одна из этих модифицированных жирных кислот не имела, однако, удовлетворительной фармацевтической активности и ни одна из них не вышла на фармацевтический рынок.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение новых производных DHA, имеющих терапевтический эффект.
На основании настоящего изобретения представлен ряд аспектов в прилагаемых пунктах формулы изобретения. Некоторыми из этих аспектов являются следующие аспекты:
1. Новые соединения, т.е. некоторые α-замещенные производные полиненасыщенной жирной кислоты.
2. Новые соединения для применения в качестве лекарственных средств и для применения в терапии.
3. Композиция жирных кислот или фармацевтическая композиция, включающая новые соединения.
4. Композиция жирных кислот, включающая новые соединения для применения в качестве лекарственного средства и для применения в терапии.
5. Применение новых соединений для получения лекарственного средства для профилактики и/или лечения диабета у человека или у животных.
6. Применение новых соединений для получения лекарственного средства для лечения и/или профилактики ожирения или избыточной массы тела.
7. Применение новых соединений для получения лекарственного средства для контроля снижения массы тела и/или для профилактики прибавления в весе.
8. Применение новых соединений для получения лекарственного средства для лечения и/или профилактики заболеваний, связанных с амилоидозом.
9. Применение новых соединений для получения лекарственного средства для лечения или профилактики множественных факторов риска сердечно-сосудистых заболеваний.
10. Применение новых соединений для получения лекарственного средства для профилактики нарушения мозгового кровообращения, церебральных или транзиторных ишемических атак, связанных с атеросклерозом некоторых артерий.
11. Способ специфического лечения диабетического заболевания, предпочтительно диабета 2-го типа.
12. Способ контролирования снижения массы тела, профилактики прибавления в весе и/или лечения и/или профилактики ожирения или избыточной массы тела.
13. Способ лечения и/или профилактики заболеваний, связанных с амилоидозом
14. Способ лечения или профилактики множественных факторов риска сердечно-сосудистых заболеваний.
15. Способ профилактики нарушения мозгового кровообращения, церебральных или транзиторных ишемических атак, связанных с атеросклерозом некоторых артерий.
16. Способы получения новых аналогов жирных кислот, соответствующих настоящему изобретению
Настоящее изобретение относится к соединению формулы (I):
где - R1 и R2 являются одинаковыми или различными и могут быть выбраны из группы, состоящей из атома водорода, гидроксильной группы, алкильной группы, атома галогена, алкоксигруппы, ацилоксигруппы, ацильной группы, алкенильной группы, алкинильной группы, арильной группы, алкилтиогруппы, алкоксикарбонильной группы, алкилсульфинильной группы, алкилсульфонильной группы, аминогруппы, алкиламиногруппы; и
- Х означает карбоксильную группу, карбоксилатную группу или карбоксамидную группу или любую фармацевтически приемлемую соль, сольват, их комплекс или пролекарство при условии, что:
- соединение формулы (I) не является (полностью-Z)-4,7,10,13,16,19-докозагексаеновой кислотой (DHA), альфа-метил-DHA, метиловым эфиром альфа-метил-DHA, этиловьм эфиром альфа-метил-DHA или этиловым эфиром альфа-гидрокси-DHA.
Условия относятся к следующим случаям:
- когда R1 является атомом водорода, R2 не является атомом водорода;
- когда R2 является атомом водорода, R1 не является атомом водорода;
- когда R1 является метильной группой, R2 не является атомом водорода и Х не является карбоксильной группой, метилкарбоксилатом или этилкарбоксилатом;
- когда R2 является метильной группой, R1 не является атомом водорода, и Х не является карбоксильной группой, метилкарбоксилатом или этилкарбоксилатом;
- когда R1 является гидроксильной группой, R2 не является атомом водорода и Х не является этилкарбоксилатом; и
- когда R2 является гидроксильной группой, R1 не является атомом водорода и Х не является этилкарбоксилатом.
В соединении, соответствующем настоящему изобретению, указанная алкильная группа может быть выбрана из группы, состоящей из метильной, этильной, н-пропильной, изопропильной, н-бутильной, втор-бутильной, n-гексильной и бензильной групп; указанный галогеновый атом может быть выбран из группы, состоящей из фтора, хлора, брома и йода; указанная алкоксигруппа может быть выбрана из группы, состоящей из метокси-, этокси-, пропокси-, изопропокси-, втор-бутокси-, фенокси-, бензилокси-, ОСН2СF3 и ОСН2СН2ОСН3 групп; указанная ацилоксигруппа может быть выбрана из ацетокси-, пропионокси- и бутироксигрупп; указанная алкенильная группа может быть выбрана из группы, состоящей из аллильной, 2-бутенилыюй и 3-гексенильной групп; указанная алкинильная группа может быть выбрана из группы, состоящей из пропаргильной, 2-бутинильной и 3-гексенильной групп; указанная арильная группа является фенильной группой; указанная алкилтиогруппа может быть выбрана из группы, состоящей из метилтио-, этилтио-, изопропилтио- и фенилтиогрупп; указанная алкоксикарбонильная группа может быть выбрана из группы, состоящей из метоксикарбонильной, этоксикарбонильной, пропоксикарбонильной и бутоксикарбонильной групп; указанная алкилсульфинильная группа может быть выбрана из группы, состоящей из метансульфинильной, этансульфинильной и изопропансульфинильной групп; указанная алкилсульфонильная группа может быть выбрана из группы, состоящей из метансульфонильной, этансульфонильной и изопропансульфонильной групп; указанная алкиламиногруппа может быть выбрана из группы, состоящей из метиламино-, диметиламино-, этиламино- и диэтиламино групп; указанная карбоксилатная группа может быть выбрана из группы, состоящей из этилкарбоксилата, метилкарбоксилата, н-пропилкарбоксилата, изопропилкарбоксилата, н-бутилкарбоксилата, втор-бутилкарбоксилата и н-гексилкарбоксилата; указанная карбоксамидная группа может быть выбрана из группы, состоящей из первичной карбоксамидной, N-метилкарбоксамидной, N,N-диметилкарбоксамидной, N-этилкарбоксамидной и N,N-диэтилкарбоксамидной групп.
В одном варианте осуществления настоящего изобретения R1 и R2 выбраны из группы, состоящей из атома водорода, гидроксигруппы, алкильной группы, атома галогена, алкоксигруппы, алкилтиогруппы, алкилсульфинильной группы, алкилсульфонильной группы, аминогруппы и алкиламиногруппы.
В другом варианте осуществления настоящего изобретения R1 и R2 выбраны из группы, состоящей из атома водорода, гидроксигруппы, C1-C7 алкильной группы, атома галогена, C1-C7 алкоксигруппы, C1-C7алкилтиогруппы, C1-C7 алкилсульфинильной группы, C1-C7 алкилсульфонильной группы, аминогруппы и C1-C7 алкиламиногруппы. Указанная C1-C7 алкильная группа может быть метильной, этильной или бензильной группой; указанный атом галогена может быть фтором или йодом: указанная C1-C7 алкоксигруппа может быть метокси- или этоксигруппой; указанная C1-C7 алкилтиогруппа может быть метилтио-, этилтио- или фенилтиогруппой; указанная C1-C7 алкилсульфинильная группа может быть этансульфинильной группой; указанная C1-C7 алкилсульфонильная группа может быть этансульфонильной группой; указанная C1-C7 алкиламиногруппа может быть этиламино- или диэтиламиногруппой; и Х может означать этилкарбоксилатную или карбоксамидную группу.
В другом варианте осуществления настоящего изобретения R1 и R2 выбраны из группы, состоящей из атома водорода, С2-С7 алкильной группы, атома галогена, C1-C7 алкоксигруппы, C1-C7 алкилтиогруппы, C1-C7алкилсульфинильной группы, C1-C7 алкилсульфонильной группы, аминогруппы и C1-C7 алкиламиногруппы; и Х означает карбоксилат. Указанная С2-С7 алкильная группа может быть этильной или бензильной группой; указанный атом галогена может быть фтором или йодом; указанная C1-C7 алкоксигруппа может быть метокси- или этоксигруппой; указанная C1-C7 алкилтиогруппа может быть метилтио-, этилтио- или фенилтиогруппой; указанная C1-C7 алкилсульфинильная группа может быть этансульфинильной группой; указанная C1-C7 алкилсульфонильная группа может быть этансульфонильной группой; указанная C1-C7 алкиламиногруппа может быть этиламино- или диэтиламиногруппой; и Х может означать этилкарбоксилат.
В соединении, соответствующем формуле (I) настоящего изобретения, R1 и R2 могут быть одинаковыми или разными. Когда они разные, соединения формулы (I) способны существовать в стереоизомерных формах. Это понимается таким образом, что настоящее изобретение включает все оптические изомеры соединений формулы (I) и их смеси, включая рацематы.
Следовательно, где R1 отличается от R2, настоящее изобретение включает соединения формулы (I), которые являются рацемическими или энантиомерно чистыми, или как (S) или (R) энантиомер. Следовательно, где R1 отличается от R2, настоящее изобретение включает соединения формулы (I), которые являются рацемическими или энантиомерно чистыми, или как (S) или (R) стереоизомер.
В пределах настоящего изобретения находятся энантиомеры соединений формулы (I), как определено выше. Кроме того, энантиомеры производных DHA, соответствующих настоящему изобретению, могут находиться в форме карбоновой кислоты или ее фармацевтически приемлемой соли, любого эфира, ангидрида или амида (первичного, вторичного, третичного). Производное кислоты может быть в форме фосфолипида или три-, ди- или моноглицерида.
В одном варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает С2-С7 алкильную группу, например, этил или бензил, и другой означает атом водорода. Предпочтительно, алкильная группа является этилом.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает алкоксигруппу, например, этокси- или метоксигруппу, и другой означает атом водорода.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает атом галогена, например, фтор или йод, и другой означает атом водорода.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает алкилтиогруппу, например этилтио-, метилтил- или фенилтиогруппу, и другой означает атом водорода. Предпочтительно алкилтиогруппа является этилтиогруппой.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает алкилсульфонильную группу, например этилсульфонильную, и другой означает атом водорода.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает аминогруппу, и другой означает атом водорода.
В другом варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, один из R1 и R2 означает алкиламиногруппу, например, этиламино- или диэтиламиногруппу, и другой означает атом водорода.
В дальнейшем варианте осуществления соединения формулы (I), соответствующем настоящему изобретению, R1 и R2 являются одинаковыми и означают C1-C7 - алкильные группы, предпочтительно метильные или этильные группы.
В предпочтительных вариантах осуществления соединения формулы (I), X означает карбоксилат, например, этилкарбоксилат.
Соединение, соответствующее настоящему изобретению, может существовать в форме фосфолипида, три-, ди- или моноглицерида или в форме свободной кислоты.
Альфа-замещенные производные DHA, соответствующие настоящему изобретению, фармацевтически были очень активны. В частности, производные жирной кислоты, соответствующие настоящему изобретению, обладают огромным потенциалом для использования в лечении и/или профилактике диабета и преддиабетических состояний.
Другой аспект настоящего изобретения относится к соединению формулы (I) для применения в качестве лекарственного средства.
Настоящее изобретение также относится к способу получения соединения формулы (I). К примеру, соединение формулы (I) может быть получено из (полностью-Z)-4,7,10,13,16,19-докозагексаеновой кислоты (DHA). DHA может быть растительного, микробного и/или животного происхождения (к примеру, жир морской рыбы). Другим важным преимуществом с соединениями формула (I) является то, что аналоги жирной кислоты могут быть получены непосредственно на основе (полностью-Z)-4,7,10,13,16,19-докозагексаеновой кислоты (DHA).
В предпочтительном варианте осуществления настоящего изобретения аналоги жирной кислоты формулы (I) получены на основе DHA, где указанная DHA получена по меньшей мере из одного источника растительного, микробного и животного происхождения или их комбинации. Настоящее изобретение включает, следовательно, производные, полученные из жира микробного происхождения, содержащего DHA. Указанная DHA получена из морского жира, такого как рыбий жир.
Другой аспект настоящего изобретения связан с фармацевтической композицией, включающей соединение формулы (I) в качестве активного ингредиента. Фармацевтическая композиция может включать фармацевтически активный носитель. Соответственно фармацевтическая композиция, соответствующая настоящему изобретению, создана для перорального введения, например, в форме капсулы или саше-порошка. Соответствующая дневная дозировка соединения формулы (I), соответствующего настоящему изобретению, составляет от 10 мг до 10 г, в частности, от 100 мг до 1 г указанного соединения.
Кроме того, настоящее изобретение относится к композиции жирных кислот, включающей соединение формулы (I). По меньшей мере 60% или по меньшей мере 90% веса композиции жирных кислот может составлять указанное соединение. Композиция жирных кислот может дополнительно включать (полностью-Z)-5,8,11,14,17-эйкозапентаеновую кислоту (ЕРА), (полностью-2)-4,7,10,13,16,19-докозагексаеновую кислоту (DHA), (полностью-Z)-6,9,12,15,18-генэйказапентаеновую кислоту (НРА), и/или (полностью-Z)-7,10,13,16,19-докозапентаеновую кислоту (DPA). Жирные кислоты могут присутствовать в форме производных. Композиция жирных кислот, соответствующая настоящему изобретению, может дополнительно включать фармацевтически приемлемый антиоксидант, например токоферол. В пределах настоящего изобретения находится также композиция жирных кислот, описанная выше, для применения в качестве лекарственного средства.
В добавочном аспекте настоящее изобретение относится к применению соединения, соответствующего формуле (I), для производства лекарственного средства для контроля снижения массы тела и/или предупреждения прибавления в весе; для производства лекарственного средства для лечения и/или профилактики ожирения или избыточной массы тела; для производства лекарственного средства для профилактики и/или лечения диабета у животных, особенно диабета 2-го типа; для производства лекарственного средства для лечения и/или профилактики заболеваний, связанных с амилоидозом; для производства лекарственного средства для лечения или профилактики множественных факторов риска сердечно-сосудистых заболеваний, особенно для лечения повышенного уровня липидов в крови, для производства лекарственного средства профилактики нарушения мозгового кровообращения, церебральных или транзиторных ишемических атак, связанных с атеросклерозом некоторых артерий.
Кроме того, настоящее изобретение относится к способу контроля снижения массы тела и/или предупреждения прибавления в весе; способу лечения и/или профилактики ожирения или избыточной массы тела; способу профилактики и/или лечения диабета, особенно диабета 2-го типа; способу лечения и/или профилактики заболеваний, связанных с амилоидозом; способу лечения или профилактики множественных факторов риска сердечно-сосудистых заболеваний; способу профилактики нарушения мозгового кровообращения, церебральных или транзиторных ишемических атак, связанных с атеросклерозом некоторых артерий, где фармацевтически эффективное количество соединения формулы (I) вводится человеку или животному. Соответственно соединение формулы (I) применяется перорально у человека или животных.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 является схематическим описанием теории пула свободных жирных кислот.
На фигуре 2 представлено описание моделей и способов, использовавшихся в настоящем изобретении для демонстрации эффектов на метаболический синдром и диабет 2-го типа.
На фигуре 3 отображены концентрации свободных жирных кислот различных соединений, соответствующих настоящему изобретению, в ткани печени животных, получавших эти соединения в концентрации 1,5% от общего содержания жира.
На фигуре 4 отображены внутриклеточные концентрации DHA в ткани печени животных, получивших различные соединения, соответствующие настоящему изобретению, в концентрации 1,5% от общего содержания жира.
На фигуре 5 отображено сродство связывания для рецептора PPARγ различных соединений, соответствующих настоящему изобретению.
На фигуре 6 отображено сродство связывания для рецептора PPARα различных соединений, соответствующих настоящему изобретению.
На фигуре 7 отображено сродство связывания для рецептора RXRα различных соединений, соответствующих настоящему изобретению.
На фигуре 8 отображено высвобождение люциферазы из трансфецированных клеток, обработанных различными соединениями, соответствующими настоящему изобретению,
На фигуре 9 показан план эксперимента блока 4.
На фигуре 10 показано изменение массы тела в течение 2 недель экспериментальной диеты после 8 недель диеты с высоким содержанием жиров.
На фигуре 11 показаны результаты люциферазной активности, т.е. эндогенной активности PPARγ.
На фигуре 12 показана эндогенная люциферазная активность при различных соединениях, соответствующих настоящему изобретению, по сравнению с DHA.
На фигуре 13 показана типичная кривая снижения в крови уровня глюкозы до и после того, как животным с резистентностью к инсулину было дано соединение, уменьшающее резистентность к инсулину.
На фигурах 14, 15 и 16 показаны различные эффекты производных DHA, соответствующих настоящему изобретению, на метаболический синдром и резистентность к инсулину.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В исследовательской работе, приведшей к настоящему изобретению, были получены новые производные DHA, показавшие высокую фармацевтическую активность.
Жирные кислоты проникают в клетку пассивно или посредством Г-белок сопряженных транспортных систем, таких как транспортные белки жирных кислот. Внутри клеток они временно связываются связывающими белками (белки, связывающие жирные кислоты, FABP), которые играют важную роль в направлении жирных кислот к различным местам клетки для метаболизма и генной экспрессии (Pawar & Jump 2003). (Фигура 1 клетка печени).
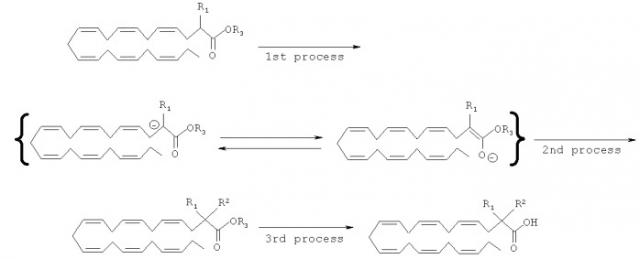
Эстерификация жирных кислот в триглицериды, полярные липиды, холестериновые эфиры и их бета-окисление (митохондриальное и пероксисомальное) требует преобразования жирных кислот в ацил СоА тиоэфиры. Другие пути метаболизма, как микросомальное NADPH-зависимое моноокисление и синтез эйкозаноидов используют неэстерифицированные жирные кислоты в качестве субстратов. Все эти реакции, по всей видимости, влияют на концентрацию в клетке свободных жирных кислот (неэстерифицированных) и, таким образом, на количество и тип жирных кислот, которые могут быть использованы в качестве лигандов к ядерным рецепторам. Поскольку известно, что рецепторы PPARs связываются с неэстерифицированными жирными кислотами, представляется справедливым предположение, что состав пула жирных кислот является важным фактором в активности PPAR.
На состав пула свободных жирных кислот влияет концентрация экзогенных жирных кислот, поступающих в клетки, и скорость их удаления посредством путей метаболизма, перечисленных выше. Поскольку жирные кислоты с короткими и средними цепями требуются для этих путей метаболизма, практически только полиненасыщенные жирные кислоты с длинными цепями будут свободны для связывания с ядерными рецепторами. Кроме того, важным фактором может также являться структура жирной кислоты. Даже если серии моно- и полиненасыщенных жирных кислот показали сродство к рецептору PPARα, ЕРА и DHA показали наивысшую способность связывания в экспериментах с клетками печени крысы (Pawar & Jump 2003).
Поиск кандидатов жирных кислот, доступных для генетической модификации белков путем взаимодействия с ядерными рецепторами, подобными PPARs, важен для того, чтобы подтвердить, что соответствующие жирные кислоты обогатят пул свободных жирных кислот.
DHA, которая входит в клетки, быстро преобразуется в ацил-СоА тиоэфиры и включается в фосфолипиды, вследствие чего внутриклеточная концентрация DHA относительно низка. Эти DHA-СоА являются также субстратом для β-окисления первоначально в пероксисомах, что приводит к ретроконверсии DHA ЕРА, см. фигуру 1. Из-за быстрого включения в нейтральные липиды и окисления DHA не задержится долгое время в пуле свободных жирных кислот. Вследствие этого влияние DHA на генную экспрессию, возможно, ограничено.
Настоящее изобретение имеет целью скорее накопление производных жирных кислот в пуле свободных жирных кислот, чем включение в фосфолипиды. Изобретатели с удивлением обнаружили, что введение по меньшей мере одного заместителя в α-положение DHA дает в результате более низкую скорость окисления и меньшее включение в нейтральные липиды. Это приводит к повышенному влиянию на генную экспрессию, так как производные DHA будут накапливаться в тканях печени, мышечной ткани, жировых клетках и стимулировать активность ядерных рецепторов в большей степени, чем DHA.
Различные заместители, соответствующие настоящему изобретению, дадут различную степень сродства производных к рецепторам. Также возможно, что изменения в сродстве к белкам, связывающим жирные кислоты, ведут к изменениям биологической активности этих α-замещенных производных DHA формулы (I). В целом эти изменения приводят к повышению терапевтического эффекта производных DHA, соответствующих настоящему изобретению, по сравнению с DHA.
ЕРА (полностью-Z)-5,8,11,14,17-эйкозапентаеновая кислота) ранее была алкилирована в α- и β-положении с целью ингибирования митохондриального β-положения. DHA не окисляется в митохондриях, а включается в фосфолипиды. В пероксисомах некоторое количество DHA реконвертируется в ЕРА. Заместитель в α-положении ЕРА и DHA будет влиять на различные метаболические пути. Ранее было показано, что α-метил-ЕРА и β-метил-ЕРА включаются в фосфолипиды и триглицериды, а α-этил-ЕРА нет (Larsen 1998). В этом исследовании производные были испытаны, как субстраты и/или ингибиторы ферментов, играющих роль в каскаде эйказаноидов. Поскольку большинство субстратов для этих ферментов является жирными кислотами, освобожденными из фосфолипидов, было желаемым, чтобы производные были включены в фосфолипиды. В противоположность этому, как упоминалось выше, мы хотели, чтобы производные не были включены в липиды, а накапливались в пуле NEFA.
В этом описании аббревиатура "PRB-x", где x является целым числом, будет использоваться при описании специфических соединений, соответствующих настоящему изобретению. Ниже приводятся структурные формулы и обычные названия этих соединений.
PRB-1 этиловый эфир α-метилдокозагексаеновой кислоты
PRB-2 этиловый эфир α-этилдокозагексаеновой кислоты
PRB-3 этиловый эфир α-этоксидокозагексаеновой кислоты
PRB-4 этиловый эфир α-фтородокозагексаеновой кислоты
PRB-5 этиловый эфир α,α-диметилдокозагексаеновой кислоты
PRB-6 этиловый эфир α-тиометилдокозагексаеновой кислоты
PRB-7 этиловый эфир α-тиоэтилдокозагексаеновой кислоты
PRB-8 этиловый эфир α,α-диэтилдокозагексаеновой кислоты
PRB-9 этиловый эфир α-бензилдокозагексаеновой кислоты
PRB-10 этиловый эфир α-этансульфенилдокозагексаеновой кислоты
PRB-11 этиловый эфир α-тиофенилдокозагексаеновой кислоты
PRB-12 этиловый эфир α-гидроксидокозагексаеновой кислоты
PRB-13 амид α-метилдокозагексаеновой кислоты
PRB-14 этиловый эфир α-метоксидокозагексаеновой кислоты
PRB-15 этиловый эфир α-йододокозагексаеновой кислоты
PRB-17 этиловый эфир α-аминодокозагексаеновой кислоты
PRB-18 (4R,5S)-3-докозагексаеноил-4-метил-5-фенил-оксазолидин-2-он
PRB-19 (4R,5S)-3-[(S)-α-этилдокозагексаеноил]-4-метил-5-фенил-оксазолидин-2-он
PRB-20 этиловый эфир (S)-(+)-α-этилдокозагексаеновой кислоты
PRB-21 (4S,5R)-3-докозагексаеноил-4-метил-5-фенил-оксазолидин-2-он
PRB-22 (4S,5R)-3-[(R)-α-этилдокозагексаеноил]-4-метил-5-фенил-оксазолидин-2-он
PRB-23 этиловый эфир (R)-(-)-α-этилдокозагексаеновой кислоты
PRB-24 этиловый эфир 2-(1,3-Диоксо-1,3-дигидро-изоиндол-2-ил)-докозагексаеновой кислоты
PRB-25 этиловый эфир α-этиламинодокозагексаеновой кислоты
PRB-26 этиловый эфир α-диэтиламинодокозагексаеновой кислоты
PRB-1 соответствует соединению формулы (I), где R1 или R2 означает метил и второй означает водород, и Х означает этилкарбоксилат.
PRB-2 соответствует соединению формулы (I), где R1 или R2 означает этил и второй означает водород, и Х означает этилкарбоксилат.
PRB-3 соответствует соединению формулы (I), где R1 или R2 означает этоксигруппу и второй означает водород, и Х означает этилкарбоксилат.
PRB-4 соответствует соединению формулы (I), где R1 или R2 означает фтор, и другой является водородом, и Х означает этилкарбоксилат.
PRB-5 соответствует соединению формулы (I), где R1 и R2 означает метил, и Х означает этилкарбоксилат.
PRB-6 соответствует соединению формулы (I), где R1 или R2 означает метилтиогруппу, и Х означает этилкарбоксилат.
PRB-7 соответствует соединению формулы (I), где R1 или R2 означает этилтиогруппу и другой является водородом, и Х означает этилкарбоксилат.
PRB-8 соответствует соединению формулы (I),