Способ оценки деформируемости клеток крови и устройство для его реализации
Иллюстрации
Показать всеГруппа изобретений относится к медицине и биологии и может быть использовано для оценки изменений состояний клеток крови, их деформируемости и точной диагностике расстройств микроциркуляции крови при различных заболеваниях и патологических состояниях. При осуществлении способа к прикрепленным к дну проточной микрокамеры клеткам крови прикладывается сдвиговое напряжение за счет движения суспензионной жидкости. Причем движение суспензионной жидкости обеспечивается наклоном проточной микрокамеры к уровню горизонта под углом, задаваемым в пределах от 0 до 90°. Устройство для реализации способа включает установленную на основании платформу, прикрепленную к платформе проточную микрокамеру, причем платформа шарнирно прикреплена к основанию и снабжена фиксатором с возможностью фиксирования угла наклона платформы в пределах от 0 до 90°. Достигается повышение точности и производительности анализа. 2 н. и 2 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к медицине и биологии и может быть использовано для оценки изменений состояний мембран эритроцитов, их деформируемости и точной диагностике расстройств микроциркуляции крови при различных заболеваниях и патологических состояниях. В настоящее время нет единого универсального метода, позволяющего адекватно оценить изменения состояния деформируемости эритроцитов. Обычно используют несколько методов в совокупности.
Известен способ оценки деформируемости эритроцитов путем лазерной эктоцитометрии [1]. Он заключается в нагружении и вытягивании эритроцитов в потоке вязкой жидкости, помещенной в зазор ротационного вискозиметра типа «конус-плоскость». Степень удлинения клеток регистрируется при помощи лазерного луча, направленного перпендикулярно сдвигу жидкости, проходящего через прозрачную часть «конус» ротационного устройства. Использования этого метода позволяет получить быстро и удобно индекс деформации эритроцитов. Однако способ не позволяет визуализировать и анализировать форму клеток и тем самым оценивать ее изменения при деформации эритроцитов.
Способ реализуется устройством, включающим ротационный вискозиметр типа «конус-плоскость» и лазерное микрометрическое устройство. Недостатком данного устройства является то, что применяемые в нем приборы очень дорогостоящие и поэтому они не получили широкого распространения в клинических лабораториях.
Известен способ оценки состояния деформируемости эритроцитов по измерению вязкости цельной крови или суспензии эритроцитов в неагрегирующей среде [2] с последующим расчетом индекса ригидности эритроцитов.
Для реализации способа применяется ротационный вискозиметр.
Способ достаточно прост в реализации, однако данный способ не позволяет оценить вклад функциональной геометрии клеток в величину их деформации. Все это затрудняет интерпретацию результатов вискозиметрического измерения суспензий клеток крови в терминах их деформируемости.
Недостатком устройства для реализации способа является высокая стоимость за счет весьма дорогого ротационного вискозиметра.
Известен способ оценки деформируемости эритроцитов, взятый нами за прототип [3], заключающийся в помещении отмытых в изотоническом растворе NaCl эритроцитов в проточную микрокамеру и последующем вытягивании, прикрепленных «одной» точкой мембраны клеток сдвиговым потоком строго дозированной известной величины. О состоянии деформируемости судят по степени удлинения эритроцитов в сдвиговом потоке.
Устройство, реализующее способ, включает основание, на котором установлена платформа (например, микроскоп), к платформе прикреплена проточная микрокамера, к проточной микрокамере посредством патрубка присоединен резервуар, содержащий суспензионную жидкость, резервуар установлен на основании с возможностью вертикального перемещения. Нагружение и вытягивание клеток происходит путем создания ламинарного потока суспензионной жидкости в проточной микрокамере. Создание потока жидкости в проточной микрокамере обеспечивается за счет вертикального смещения резервуара, содержащего суспензионную жидкость. При этом создается избыточное (при подъеме резервуара) или пониженное (при снижении резервуара) давление жидкости на входе проточной микрокамеры. Присоединенный с противоположной стороны проточной микрокамеры свободно открытый патрубок позволяет свободное движение жидкости в камере.
Недостатком способа является низкая производительность вследствие необходимости зарегистрировать и измерить размеры не менее 100 прикрепленных эритроцитов, для чего многократно повторяется течение суспензионной жидкости с последующей остановкой и видеорегистрацией деформированных клеток крови. Также недостатком способа является невысокая точность задания нагрузки на клетки крови вследствие неравномерности распределения давления по проточной микрокамере и динамических колебаний давления в ней.
Целью изобретения является повышение производительности и точности оценки деформируемости клеток крови.
Поставленная цель достигается тем, что в способе оценки деформируемости клеток крови, заключающемся в том, что к прикрепленным к дну проточной микрокамеры клеткам крови прикладывается сдвиговое напряжение за счет движения окружающей клетки суспензионной жидкости. Новым в способе является то, что движение суспензионной жидкости обеспечивается наклоном проточной микрокамеры к уровню горизонта под углом, задаваемым в пределах от 0 до 90°.
В устройстве для реализации способа оценки деформируемости клеток крови поставленная цель достигается тем, что устройство включает установленную на основании платформу, прикрепленную к платформе проточную микрокамеру. Новым в устройстве является то, что платформа шарнирно прикреплена к основанию и снабжена фиксатором с возможностью фиксирования угла наклона платформы в пределах от 0 до 90°.
Другим отличием устройства является то, что с целью точного задания угла наклона платформы в устройство введен угломер.
Третьим отличием устройства является то, что к проточной микрокамере присоединены подающий и принимающий резервуары.
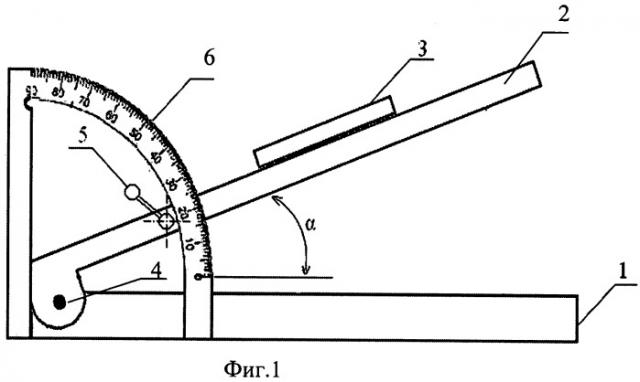
На фиг.1 представлено устройство для оценки деформируемости клеток крови (вид сбоку).
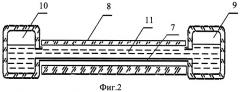
На фиг.2 представлена проточная микрокамера в разрезе.
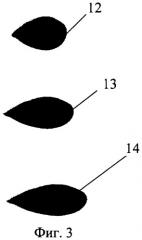
На фиг.3 представлена зависимость степени удлинения эритроцитов, прикрепленных к дну проточной микрокамеры эритроцитов, от угла наклона микрокамеры.
Устройство для реализации способа оценки деформируемости клеток крови включает основание 1, установленную на основании платформу 2 и прикрепленную к платформе проточную микрокамеру 3. Платформа прикреплена к основанию посредством шарнира 4 и снабжена фиксатором 5 с возможностью фиксирования угла наклона платформы. Дополнительно к устройству прикреплен угломер 6.
Проточная микрокамера включает основание микрокамеры 7, покровное стекло 8, подающий резервуар 9 и принимающий резервуар 10. Полость между основанием проточной микрокамеры 7 и покровным стеклом 8 герметично соединена с подающим 9 и принимающим 10 резервуарами, и заполнена суспензионной жидкостью 11, содержащей клетки крови (не показаны).
Способ реализуется следующим образом.
Суспензия, содержащая исследуемые клетки крови, помещается в полость проточной микрокамеры 3 и частично в подающий 9 и принимающий 10 резервуары. Проточная микрокамера 3 устанавливается на платформе 2 и фиксируется, например, специальными зажимами (не показаны). Платформа 2 находится в горизонтальном положении некоторое время, например пять минут. За этот период времени клетки крови оседают на основание микрокамеры 7 и прикрепляются к нему. Затем платформа 2 поворачивается на заданный угол α, величина которого определяется по угломеру 6 и фиксируется фиксатором 5. Под действием гравитационной силы суспензионная жидкость начинает течь, создавая напряжение сдвига на клетки крови. Так как клетки крови прикреплены одной точкой к основанию, они начинают деформироваться, принимая каплевидную форму. На фиг.3 приведены примеры деформации клеток при различном угле наклона платформы:
13 - угол наклона платформы 30°;
14 - угол наклона платформы 45°;
15 - угол наклона платформы 60°.
Вытекающая из проточной микрокамеры суспензионная жидкость 11 компенсируется из подающего резервуара 9, собирается в принимающем резервуаре 10.
Дальнейшая оценка деформируемости клеток крови осуществляется, например, как в известном способе [3], в виде определения индекса удлинения эритроцита (ИУЭ) по формуле
ИУЭ=(L-W)/(L+W),
где L - длина вытянутой клетки, W - ширина вытянутого эритроцита.
С целью проверки чувствительности способа измерения деформируемости эритроцитов отмытые эритроциты подвергали различной предварительной обработке.
Для снижения эластичности клеточной мембраны эритроциты подвергали тепловой прединкубации (10 минут при 49°С). В этих условиях происходит необратимое плавление белков цитоскелета и выраженное снижение деформируемости эритроцитов.
Для изменения деформируемости эритроцитов в целом их разделяли в градиенте плотности на молодые, зрелые и старые клетки и измеряли степень деформируемости каждой фракции предлагаемым способом.
Ряд фармакологических препаратов известен своим позитивным влиянием на деформируемость эритроцитов. К ним в первую очередь относится пентоксифиллин. Клетки предварительно инкубировали с данным препаратом в концентрации 0,02 мг/мл, в течение 15 мин, при 37°С. Затем проводили сравнительное измерение степени деформируемости эритроцитов, обработанных пентоксифиллином и клеток, инкубированных в той же среде (изотонический раствор NaCl, с 5 мМ глюкозы), без препарата.
Пример 1. Оценка изменений состояния мембран эритроцитов, обработанных тепловым воздействием.
Обработку проводили путем инкубации 0,5% суспензии эритроцитов в течение 10 мин при 49°С. Контрольная суспензия выдерживалась в течение того же периода времени при 37°С. После инкубации эритроциты помещали в проточную микрокамеру и проводили измерение деформируемости описываемым способом. Были получены данные, свидетельствующие о более низкой деформируемости эритроцитов, подвергнутых тепловой обработке. Эритроциты после тепловой обработки практически не деформировались.
Пример 2. Оценка изменений деформируемости эритроцитов, разделенных в градиенте плотности на молодые, зрелые и старые клетки.
После отмывания в изотоническом растворе NaCl эритроциты центрифугировали 30 мин при 30000 g, затем делили на фракции. 10% верхней фракции после центрифугирования составляли молодые эритроциты, 10% нижней фракции - старые клетки и средняя фракция - это зрелые эритроциты.
Регистрировали описываемым способом деформируемость эритроцитов из каждой фракции и сравнивали полученные результаты. Оказалось, что молодые эритроциты были на 22% более деформируемы, чем зрелые и на 32% (р<0,01) отличались от старых клеток большей эластичностью.
Пример 3. Оценка изменений состояния деформируемости эритроцитов, инкубированных с пентоксифиллином.
Пентоксифиллин ингибирует активность фосфодиэстераз в эритроцитах, способствует накоплению циклического аденозинмонофосфата (цАМФ) и приросту деформируемости эритроцитов. После 15 минут инкубации при 37°С было найдено достоверное повышение деформируемости эритроцитов, полученное описываемым способом.
Пример 4. Оценка изменений деформируемости эритроцитов при блокировании входа Са2+ в эритроциты при помощи верапамила.
Суспензию отмытых эритроцитов также делили на две аликвоты:
1) эритроциты инкубировали с верапамилом (10 мкМ), в качестве блокатора кальциевых каналов мембраны клетки в течение 15 мин, при 37°С;
2) эритроциты инкубировали в изотоническим растворе NaCl, в котором не содержался верапамил, это был контрольный раствор.
Было получено значительное увеличение деформируемости эритроцитов, сопоставимое с приростом этой характеристики при инкубации клеток с пентоксифиллином. Разница с контролем составила 34%.
По сравнению с известным способом время оценки деформируемости клеток крови предложенным способом сокращается в четыре раза, с 40 мин в прототипе до 10 мин в предложенном способе.
Таким образом, применение предложенного способа и устройства обеспечивает повышение производительности, за счет сокращения времени анализа и точность оценки степени деформации за счет равномерности распределения нагрузки на клетки крови.
Источники информации
1. М. Hademan et al., Clin. Hemorheol. 1994. - Vol.l4. - P.619-630.
2. L. Dintenfass, In.: The Rheology of blood, bloodvessels and associated tissues. - Oxford Press, 1981. - P.22-50.
3. G.M. Artmann. Microscopic photometric quantification of stiffness and relaxation time of red blood cells in a flow chamber // Biorheology. - 1995. - Vol.32. - P.553-570.
1. Способ оценки деформируемости клеток крови, заключающийся в приложении к прикрепленным к дну проточной микрокамеры клеткам крови сдвигового напряжения за счет движения окружающей клетки суспензионной жидкости, отличающийся тем, что движение суспензионной жидкости обеспечивается наклоном проточной микрокамеры к уровню горизонта под углом, задаваемым в пределах от 0 до 90°.
2. Устройство для реализации способа оценки деформируемости клеток крови, включающее установленную на основании платформу, прикрепленную к платформе проточную микрокамеру, отличающееся тем, что платформа шарнирно прикреплена к основанию и снабжена фиксатором с возможностью фиксирования угла наклона платформы от 0 до 90°.
3. Устройство по п.2, отличающееся тем, что, с целью точного задания угла наклона платформы, в устройство введен угломер.
4. Устройство по п.2, отличающееся тем, что к микрокамере присоединены подающий и принимающий резервуары.