Применение композиции, состоящей из низкомолекулярных фрагментов пептидогликана грамотрицательных бактерий, для лечения и профилактики заболеваний человека
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии. Описана фармацевтическая композиция, включающая три компонента бактериальной природы: β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелиновой кислоты (ГМтри), β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелоил-D-аланина (ГМтетра) и димера ГМтетра (диГМтетра), в котором связь между мономерными остатками ГМтетра осуществляется за счет карбоксильной группы терминального D-аланина одного остатка ГМтетра и ω-аминогруппы мезо-диаминопимелиновой кислоты другого остатка ГМтетра. Предложено применение описанной композиции для получения лекарственного средства, предназначенного для профилактики или лечения состояний и заболеваний, вызываемых бактериями, при которых требуется повышение неспецифической резистентности организма к бактериям, заболеваний, вызываемых вирусом иммунодефицита человека (ВИЧ) или вирусом простого герпеса, или заболеваний и состояний, требующих усиления способности организма к отторжению злокачественной опухоли, или стимуляции миелопоэза. Также представлен набор для лечения или профилактики указанных заболеваний или состояний, включающий описанную композицию в дозированной форме. Изобретение позволяет расширить арсенал лекарственных средств. 4 н. и 12 з.п. ф-лы, 8 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области фармацевтики и к области медицины. В частности, раскрывается применение биологически активной композиции (далее называемой полимурамил, сокращенно ПМ), предназначенной для стимулирования иммунной системы млекопитающих и состоящей из трех компонентов бактериальной природы, а именно: (1) β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелиновой кислоты (ГМтри), (2) β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелоил-D-аланина (ГМтетра) и (3) димера ГМтетра (диГМтетра), в котором связь между мономерными остатками ГМтетра осуществляется за счет карбоксильной группы терминального D-аланина одного остатка ГМтетра и ω-аминогруппы мезо-диаминопимелиновой кислоты другого остатка ГМтетра. Изобретение относится также к фармацевтически приемлемым солям ПМ. ПМ и его соли по данному изобретению пригодны для лечения и профилактики заболеваний млекопитающих, при которых необходимо стимулирование иммунной системы.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Заявка RU 2008144644 раскрывает композицию и способ получения ПМ. Данный текст включен в настоящую заявку в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ
Снижение резистентности человека к инфекционным агентам, наблюдаемое в настоящее время во многих странах мира, ведет к повышению распространенности хронических инфекционно-воспалительных заболеваний, трудно поддающихся традиционным методам лечения. Примерами таких заболеваний служат хронический бронхит, хронический простатит, хронические рецидивирующие пиодермии, хроническая рецидивирующая герпес-вирусная инфекция. При этих заболеваниях требуется стимуляция иммунной системы, с тем чтобы усилить эффекты традиционной антимикробной терапии и добиться либо искоренения персистирующего инфекционного агента, либо снижения частоты, длительности и тяжести обострений.
Все большее значение в последнее время приобретает проблема биотерроризма. В качестве биологического оружия могут использоваться патогенные бактерии, такие как Yersinia pestis, Bacillus anthracis, Salmonella typhi и др. При угрозе биологической атаки могут потребоваться мероприятия, позволяющие быстро повысить резистентность населения к бактериальному заражению. Защита, даваемая традиционными вакцинами, развивается медленно (в течение недель после начала курса вакцинации), поскольку в ее основе лежит активация медленно реагирующей адаптивной иммунной системы. В условиях биологической угрозы предпочтительнее использование иммуностимуляторов, активирующих врожденную иммунную систему и дающих быструю, хотя и преходящую, защиту от широкого круга патогенных микроорганизмов.
Другой важной проблемой медицины и общества в целом является синдром приобретенного иммунодефицита (СПИД), вызываемый вирусом иммунодефицита человека (ВИЧ). Хотя применяемая в настоящее время высокоактивная антиретровирусная терапия (highly active anti-retroviral therapy, HAART) позволяет длительное время контролировать ВИЧ-инфекцию у больных, она является дорогостоящей и высокотоксичной. Не до конца решен и вопрос профилактики ВИЧ-инфекции у групп риска. Поэтому применение новых классов лекарственных препаратов, в частности иммуностимуляторов, для профилактики и лечения ВИЧ-инфекции является оправданным и актуальным.
Важной проблемой современной иммунологии является неэффективность иммунного ответа против злокачественных опухолей. Злокачественная опухоль, как правило, вырабатывает целый ряд факторов, которые подавляют активность клеток врожденной иммунной системы, призванных бороться с опухолью. В последнее время ведутся интенсивные работы по поиску иммуностимуляторов, способных «реактивировать» клетки иммунной системы, подавленные опухолевым процессом [Krieg AM. CpG motifs in bacterial DNA and their immune effects. Annu Rev Immunol 2002; 20: 709-760].
Таким образом, иммуностимуляторы имеют несколько важных сфер применения в современной медицине. Поиск новых, эффективных иммуностимуляторов, обладающих минимумом побочных действий, является актуальной задачей иммунофармакологии.
Большинство известных на сегодня иммуностимуляторов является либо веществами бактериального происхождения, либо их (полу)синтетическими аналогами. Среди них можно отметить олигодезоксинуклеотиды (ОДН), содержащие неметилированные тандемы цитозин-гуанин (CpG-ОДН), непирогенные липополисахариды (ЛПС), а также производные пептидогликана (ПГ) клеточной стенки бактерий.
ПГ - это гетерополимер, образованный линейными полисахаридными цепочками, в которых остатки N-ацетил-D-глюкозамина (GlcNAc) чередуются с остатками N-ацетил-D-мурамовой кислоты (MurNAc) и соединены друг с другом β-(1→4)-гликозидными связями. С лактильными группами остатков MurNAc связаны короткие пептиды, которые в случае грамотрицательных бактерий, как правило, являются трипептидами вида L-аланил-D-изоглутаминил-мезо-диаминопимелиновая кислота либо тетрапептидами вида L-аланил-D-изоглутаминил-мезо-диаминопимелоил-D-аланин. Тетрапептиды, отходящие от соседних полисахаридных цепей, могут соединяться между собой ковалентными связями (образующимися между карбоксильной группой остатка D-аланина одного тетрапептида и ω-аминогруппой остатка мезо-диаминопимелиновой кислоты другого тетрапептида), чем обеспечивается стабильность трехмерной структуры ПГ.
Иммуностимулирующая активность ПГ обеспечивается как цельными макромолекулами ПГ, так и сравнительно небольшими его фрагментами (муропептидами), возникающими либо в процессе ферментативного гидролиза ПГ в клетках человека, либо в ходе биосинтеза или деградации ПГ в самих бактериях. Первым из таких фрагментов была открыта N-ацетилмурамил-L-аланил-D-глутаминовая кислота (мурамилдипептид, МДП)[Ellouz AF, Ciorubaru R, Lederer E. Minimal structural requirements for adjuvant activity of bacterial peptidoglycan subunits. Biochem Biophys Res Commun 1974; 59: 1317-25]. МДП обладает мощным иммуностимулирующим и адъювантным действием, но оказался непригодным для клинического применения из-за выраженной пирогенности. Позже были описаны другие высокоактивные естественные муропептиды, в частности N-ацетилмурамил-L-аланил-D-изоглутаминил-мезо-диаминопимелиновая кислота (мурамилтрипептид) [Girardin SE, Boneca IG, Carneiro LA, Antignac A, Jehanno M, Viala J, Tedin K, Taha MK, Labigne A, Zahringer U, Coyle AJ, DiStefano PS, Bertin J, Sansonetti PJ, Philpott DJ. Nod1 detects a unique muropeptide from gram-negative bacterial peptidoglycan. Science 2003; 300: 1584-7]. Был получен также ряд (полу)синтетических непирогенных муропептидов, получивших разрешение на медицинское применение или проходящих в настоящее время клинические испытания [Werner GH, Jolles P. Immunostimulating agents. Eur J Biochem 1996; 242: 1-19]. К таким муропептидам могут быть отнесены 6-О-тетрадецилгексадеканоил-N-ацетилмурамил-L-аланил-D-изоглютамин (B30-MDP); препарат MTP-PE, в котором к мурамилтрипептиду ковалентно присоединен дипальмитоилфосфатидилэтаноламин, и весь этот комплекс включен в липосомы; N-ацетилмурамил-L-аланил-D-изоглютамин-a-n-бутиловый эфир (мурабутид); N-ацетилмурамил-L-аланил-D-изоглютамин-стеароил-L-лизин (ромуртид); β-N-ацетилглюкозаминил-(1→4)-N-ацетилмурамил-L-аланил-D-изоглютамин (ГМДП или Ликопид).
В отличие от описанных выше соединений, которые являются полностью или частично синтетическими, мы решили создать муропептидный иммуностимулятор полностью естественной природы. Мы исходили из того, что иммунная система человека и млекопитающих в процессе эволюции «настроилась» на распознавание именно веществ естественного происхождения, а потому и воздействие такого рода веществ на иммунную систему будет более эффективным и сбалансированным по соотношению терапевтического и побочного действий.
В качестве источника ПГ нами был взят классический грамотрицательный микроорганизм Salmonella typhi (S. typhi). Поскольку естественный ПГ нерастворим, требовалась его солюбилизация путем гидролиза в присутствии лизоцима, который расщепляет полисахаридные цепи ПГ. На начальном этапе работы путем частичного лизоцимного гидролиза было получено вещество, представляющее собой полимерные фрагменты ПГ, где число повторяющихся звеньев GlcNAc-MurNAc составляло от 5 до 20. Способ получения и некоторые свойства этого вещества описаны в заявке RU 2006124330. Несмотря на выраженное иммуностимулирующее действие, данное вещество обладало существенными недостатками, а именно: 1) трудность в подборе времени инкубации ПГ с лизоцимом, в связи с чем продукты реакции могли содержать в среднем как >20, так и <5 повторяющихся звеньев, 2) неопределенность химической структуры, в частности неопределенность содержания пептидных цепей в веществе, что затрудняло приготовление препарата со стандартными свойствами.
В дальнейшем мы стали стремиться к тому, чтобы гидролиз ПГ проходил до конца, что достигалось путем пролонгированной обработки лизоцимом. Это привело к получению биологически активной иммуностимулирующей композиции, состоящей всего из трех компонентов (муропептидов) с определенной химической структурой:
соединение 1: β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелиновая кислота (ГМтри),
соединение 2: β-N-ацетил-D-глюкозаминил-(1→4)-N-ацетил-D-мурамоил-L-аланил-D-изоглютаминил-мезо-диаминопимелоил-D-аланин (ГМтетра),
соединение 3: димера ГМтетра (диГМтетра), в котором связь между мономерными остатками ГМтетра осуществляется за счет карбоксильной группы терминального D-аланина одного остатка ГМтетра и ω-аминогруппы мезо-диаминопимелиновой кислоты другого остатка ГМтетра.
Указанная композиция именуется в настоящей заявке «Полимурамил» (сокращенно ПМ). Способ получения и некоторые свойства ПМ были раскрыты в заявке RU 2008144644, где они упомянуты как низкомолекулярные продукты гидролиза ПКС, например, с молекулярной массой 1-2 кДа. При направленном выделении ПМ в качестве целевого продукта необходимо проводить процесс ферментативного гидролиза при температуре не менее 35-37°С, весовом соотношении ПКС : лизоцим 10:0,3-1,0, в течение не менее 3 суток с периодическим прибавлением свежей порции фермента и, как описано в указанной выше заявке, с постоянным удалением низкомолекулярных продуктов гидролиза, причем их дальнейшая очистка осуществляется с помощью препаративной гель-хроматографии. Однако детальное изучение влияния ПМ на различные звенья иммунной системы не было проведено. В итоге конкретная фармакологическая активность ПМ не была определена. Это явилось причиной того, что в заявке RU 2008144644 был представлен к защите только способ получения ПМ.
На момент подачи заявки RU 2008144644 иммуностимулирующая активность ПМ была изучена фрагментарно. Было известно, что ПМ индуцирует выработку фактора некроза опухолей-альфа (ФНО-α) мононуклеарными клетками крови человека, а также усиливает гуморальный ответ экспериментальных мышей на Т-зависимый антиген (эритроциты барана). Однако этой информации, раскрытой в заявке RU 2008144644, было недостаточно для обоснования способа применения ПМ при конкретных нозологических формах. Исходя из имеющихся данных и из свойств известных аналогов ПМ, можно было предполагать широкую сферу применения препарата, в частности, для лечения и/или профилактики инфекционных заболеваний различной этиологии. Однако оказалось, что ПМ не индуцирует выработку интерферона-альфа (ИФН-α) - цитокина, играющего центральную роль в защите от большинства известных вирусов, патогенных для человека и млекопитающих, что делало проблематичным применение ПМ для неспецифической терапии или профилактики вирусных инфекций. Эти отрицательные данные послужили причиной для детального изучения иммунотропных свойств ПМ, которое позволило четко определить спектр заболеваний, при которых препарат способен оказать лечебное действие, исходя из экспериментально подтвержденных видов его активности. Данные этого исследования, определяющие сферу и способы применения ПМ, положены в основу настоящей заявки.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению ПМ и фармацевтических композиций на его основе для лечения и профилактики заболеваний, при которых необходимо стимулирование иммунной системы. Список этих заболеваний определен, исходя из установленных нами видов активности ПМ. По данным исследований, проведенных нами после подачи заявки RU 2008144644, ПМ обладает следующими видами активности: 1) индуцирует выработку активационных цитокинов (интерлейкин [ИЛ]-1β, ИЛ-6, ИЛ-17, ИФН-γ, ФНО-α) и воспалительных хемокинов (IP-10, ИЛ-8, MIP-1α, MIP-1β, RANTES) клетками врожденной иммунной системы, что ведет к быстрому повышению противоинфекционной резистентности организма; 2) усиливает способность лейкоцитов крови убивать бактерии; 3) усиливает выработку естественных антител к общим антигенным детерминантам бактерий; 4) защищает экспериментальных животных от летальных инфекций, вызванных грамположительными и грамотрицательными бактериями; 5) индуцирует выработку миелопоэтинов и усиливает миелопоэз; 6) индуцирует выработку хемокинов, являющихся естественными антагонистами вируса иммунодефицита человека; 7) повышает функциональную активность NK-клеток, играющих одну из ключевых ролей в защите организма от вирусных инфекций и злокачественных новообразований; 8) замедляет рост перевиваемых злокачественных опухолей у экспериментальных животных. При этом ПМ не обладает пирогенным и другими серьезными побочными эффектами при парентеральном введении человеку в дозе до 10 мкг/кг/сут. В примерах будут проиллюстрированы наиболее важные свойства ПМ, обосновывающие способы и сферу применения препарата и фармацевтических композиций на его основе. Эти свойства действующего вещества не были описаны в документации уровня техники, в т.ч. и в RU 2008144644.
Настоящая заявка относится также к применению ПМ для получения фармацевтических композиций, предназначенных для лечения и профилактики заболеваний, при которых необходимо стимулирование иммунной системы. ПМ, являясь смесью амфотерных соединений, может применяться в нейтральной, анионной и катионной формах. В анионной форме все или часть протонов в концевых карбоксильных группах замещены другими катионами, в качестве которых могут быть использованы, например, катионы натрия, калия, аммония, триэтиламмония. В катионной форме все или часть свободных аминогрупп переведены в аммонийную форму, а в качестве противоиона могут быть использованы, например, хлорид-, сульфат- или ацетат-анионы.
Предпочтительной фармацевтической композицией для применения ПМ является готовый стерильный раствор для парентерального введения. Концентрация ПМ в указанном растворе может варьировать от 0,01 до 20 мг/мл. Раствор необязательно может содержать фармакологически приемлемые добавки, в том числе вещества, повышающие стабильность препарата, регуляторы pH, регуляторы тоничности. Раствор фасуется в стерильные ампулы или готовые к употреблению инъекторы, содержащие ПМ в количестве от 0,01 до 20 мг на ампулу/инъектор. Инъекторы для парентерального введения описаны в уровне техники и поставляются на рынок различными фирмами. Эти инъекторы снаряжаются раствором для введения, проходят при необходимости стерилизацию и упаковываются в коробки, контейнеры и т.п.
Достоинство инъектора состоит в том, что он представляет собой готовое для применения устройство, использовать которое может даже неподготовленный человек.
В ходе исследований было установлено, что муропептидные препараты, к числу которых относится и ПМ, могут проникать через эпителиальные барьеры в кровоток [Андронова Т.М., Пинегин Б.В. Ликопид (ГМДП) - современный отечественный высокоэффективный иммуномодулятор. Россия, 2005]. Этим обусловлена возможность выпуска ПМ в виде фармацевтических композиций для трансмукозального и чрескожного применения. Так, ПМ может выпускаться в виде фармацевтических композиций для перорального и орального применения, в частности, в виде таблеток, капсул, растворов для перорального приема, пастилок и трансбуккальных форм. Капсулы могут содержать смеси ПМ с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы, сахара, синтетические подслащивающие агенты, порошкообразные целлюлозы, различные типы муки, желатины, камеди. Пригодные таблетированные препараты могут быть изготовлены общепринятыми способами прессования, мокрой грануляции или сухой грануляции с применением фармацевтически приемлемых эксципиентов, разбавителей, связующих, лубрикантов, дезинтегрантов, модификаторов поверхности (включая поверхностно-активные вещества), суспендирующих или стабилизирующих агентов. Пероральный препарат может состоять также из активного ингредиента, который вводят в воде или фруктовом соке, содержащем, если нужно, подходящие растворители или эмульгаторы. Фасовка препарата может варьировать от 0,01 до 20 мг на таблетку или капсулу или от 0,01 до 20 мг на 1 мл раствора.
ПМ может выпускаться в виде раствора для интраназального применения с концентрацией активного вещества от 0,01 до 20 мг/мл в сочетании с фармакологически приемлемыми добавками.
Фармацевтические композиции ПМ для наружного применения включают в себя мази и кремы, содержащие ПМ в концентрации от 0,01 до 20 мг/мл, необязательно в сочетании с традиционными веществами, улучшающими проникновение препарата через кожный барьер (пенетраторами).
Наконец, еще одной формой выпуска ПМ могут быть суппозитории для ректального или вагинального применения, содержащие ПМ в дозе от 0,01 до 20 мг на суппозиторий, в сочетании с фармакологически приемлемыми добавками. Состав композиций-носителей для суппозиториев известен из уровня техники.
Готовые формы препаратов и композиций на основе ПМ упаковываются в коробки, пакеты, тубы, флаконы и т.п. в зависимости от традиций и потребностей рынка.
Например, таблетки могут быть упакованы в блистер из расчета на одну или несколько курсовых доз. Блистер может содержать напечатанную на нем инструкцию по применению и быть упакованным в контейнер или коробку, в которую отдельно вложена инструкция по применению.
Различные варианты упаковок известны из уровня техники и не требуют дополнительного описания.
Назначение ПМ или фармацевтических композиций на его основе, а также контроль состояния больного в ходе лечения осуществляются лечащим врачом. Исходя из открытого авторами механизма действия препарата, ПМ или фармацевтические композиции на его основе показаны при перечисленных ниже группах заболеваний.
I. Лечение и профилактика заболеваний, вызванных бактериями:
1) лечение острых и хронических заболеваний кожи, мягких тканей, дыхательных путей и легких, желудочно-кишечного тракта, почек, мочевыводящих путей, женских половых органов и предстательной железы, вызванных бактериями;
2) профилактика и лечение гнойных осложнений хирургических операций;
3) профилактика заразных инфекционных заболеваний, вызванных патогенными бактериями и проявляющихся в виде эпидемий.
Применение ПМ для лечения и профилактики заболеваний бактериального генеза обосновано следующими видами его активности: 1) усиление способности фагоцитов убивать бактерии; 2) индукция выработки цитокинов (ИЛ-1β, ИЛ-6, ИЛ-17, ИФН-γ, ФНО-α) и хемокинов (IP-10, ИЛ-8, MIP-1α, MIP-1β, RANTES), необходимых для развития оптимального врожденного иммунного ответа против бактерий; 3) индукция выработки антимикробных пептидов - дефензинов; 4) усиление выработки естественных антител к общим антигенным детерминантам бактерий; 5) индукция выработки миелопоэтинов (Г-КСФ, ГМ-КСФ) и усиление выхода миелоидных клеток (моноцитов, гранулоцитов) из костного мозга; 6) защита экспериментальных животных от инфекции летальными дозами патогенных грамположительных и грамотрицательных бактерий. Как будет продемонстрировано в Примерах, эффект ПМ развивается быстро, появляясь уже на 1-е - 3-и сутки ежедневного введения, что важно при использовании препарата в профилактических целях в группах риска.
II. Лечение заболеваний кожи, мягких тканей, дыхательных путей и легких, желудочно-кишечного тракта, почек, мочевыводящих путей и женских половых органов, вызванных патогенными и условно патогенными грибами.
Применение ПМ для лечения и профилактики заболеваний грибкового генеза обосновано следующими видами его активности: 1) индукция выработки цитокинов (ИЛ-1β, ИЛ-6, ИЛ-17) и хемокинов (ИЛ-8), необходимых для развития оптимального врожденного иммунного ответа против грибов; 2) индукция выработки антимикробных пептидов - дефензинов; 3) индукция выработки миелопоэтинов (Г-КСФ, ГМ-КСФ) и усиление выхода миелоидных клеток (моноцитов, гранулоцитов) из костного мозга.
III. Профилактика и лечение заболеваний, вызванных вирусами:
профилактика и лечение ВИЧ-инфекции;
лечение хронической рецидивирующей герпес-вирусной инфекции (ХРГВИ), вызванной вирусом простого герпеса 1 и 2 типов (ВПГ-1 и -2).
Применение ПМ при инфекциях указанными вирусами обусловлено способностью препарата повышать активность NK-клеток, являющихся одним из ключевых эффекторов противовирусного иммунитета, индуцировать выработку хемокина IP-10, который является хемоаттрактантом для естественных интерферонпродуцирующих клеток - важнейших эффекторов противовирусного иммунитета, а также индуцировать выработку дефензинов - антимикробных пептидов, способных ингибировать проникновение ВПГ и ВИЧ в клетки-мишени и/или внутриклеточную репликацию этих вирусов [Mackewicz C et al. alpha-Defensins can have anti-HIV activity but are not CD8 cell anti-HIV factors. AIDS 2003; 17: F23-32. Hazrati E et al. Human α- and β-defensins block multiple steps in herpes simplex virus infection. J Immunol 2006; 177: 8658-66]. Кроме того, ПМ индуцирует секрецию хемокинов RANTES, MIP-1α и MIP-1β, которые блокируют клеточные корецепторы для ВИЧ и препятствуют проникновению ВИЧ в клетки.
IV. Адъювантная иммунотерапия солидных злокачественных новообразований различной локализации. Применение ПМ для лечения злокачественных образований обусловлено следующими видами активности: 1) подавление роста солидных злокачественных опухолей у экспериментальных животных; 2) индукция выработки цитокинов, участвующих в отторжении опухоли, в частности ФНО-α; 3) повышение активности NK-клеток.
V. Лечение состояний, сопровождающихся подавлением миелопоэза (острая и хроническая лучевая болезнь, отравления миелотоксическими субстанциями, состояния при или после лучевой терапии или химиотерапии злокачественных новообразований). Применение ПМ при данной группе заболеваний обусловлено способностью препарата вызывать выработку колониестимулирующих факторов (Г-КСФ, ГМ-КСФ), необходимых для дифференцировки клеток миелоидного ряда в костном мозге, что ведет к повышению уровней нейтрофилов и моноцитов в кровотоке.
Представленные ниже примеры, основанные на использовании адекватных и доказательных для данной области моделей, подтверждают предложенный объем применений препаратов и композиций ПМ.
Однако приведенный перечень заболеваний не носит ограничительного характера. Выбор конкретных состояний, при которых требуется назначение ПМ или фармацевтических композиций на его основе, находится в пределах компетенции специалиста, исходя из выявленной и описанной биологической активности ПМ.
Предпочтительным способом применения ПМ при большинстве нозологических форм является парентеральный. Как правило, ПМ вводят внутримышечно, однако в зависимости от нозологической формы, тяжести состояния больного и прочих факторов возможно внутрикожное, подкожное и внутривенное введение препарата. Экспериментально установлено, что при внутримышечном введении препарат безопасен в дозе приблизительно до 10 мкг/кг/сут. Эта дозировка может варьировать в пределах приблизительно от 0,1 до 100 мкг/кг/сут в зависимости от состояния пациента и индивидуальной переносимости ПМ.
В некоторых случаях, например для лечения воспалительно-инфекционных заболеваний и злокачественных новообразований желудочно-кишечного тракта, ПМ может применяться в виде таблеток, капсул или растворов для перорального применения. Дозировка препарата при пероральном приеме составляет, как правило, от 0,1 до 300 мкг/кг/сут в зависимости от состояния пациента и индивидуальной переносимости ПМ.
Для лечения заболеваний прямой кишки, простаты и женских половых органов, а также для профилактики заражения ВИЧ ПМ может применяться в виде ректальных и вагинальных суппозиториев.
Для лечения заболеваний кожи ПМ может применяться наружно в виде кремов и мазей.
Для лечения заболеваний верхних дыхательных путей ПМ может применяться в виде капель для интраназального применения.
При назначении ПМ придерживаются традиционной тактики выбора доз. Факторами, влияющими на выбор параметров лечения, являются вид и тяжесть основного заболевания, индивидуальная восприимчивость к действию ПМ, наличие сопутствующих заболеваний. Длительность применения препарата в лечебных целях составляет, как правило, 5-7 суток, однако в зависимости от нозологической формы, состояния и реактивности больного может варьировать от 1 до 30 суток. Длительность применения препарата в профилактических целях составляет, как правило, 1-5 суток. Всю суточную дозу препарата, как правило, дают однократно, однако возможно разделение суточной дозы на 2-3 приема. ПМ может применяться в комплексе с антимикробными лекарственными средствами для лечения или профилактики инфекционных заболеваний, а также в комплексе со стандартными противоопухолевыми химиотерапевтическими и иммунотерапевтическими средствами. Препарат совместим с антимикробными, противоспалительными и противоопухолевыми лекарственными средствами, которые были доступны авторам, из числа традиционно применяемых при лечении вышеуказанных заболеваний и допущенных к применению в РФ по состоянию на март 2009 г. (см. Реестр лекарственных средств).
Примеры
Следующие примеры, приведенные в целях детализации и иллюстрации изобретения, не имеют цели ограничения притязаний настоящего изобретения.
Пример 1. Получение действующего вещества
Действующее вещество (ПМ) получали на основе способа, раскрытого в заявке RU 2008144644. Контроль полученной партии осуществляли методом масс-спектрометрии (MALDI-TOF). Из данных MALDI-TOF следовало, что партия препарата содержит три компонента - ГМтри, ГМтетра и диГМтетра с мол. массами (рассчитанные значения в скобках) 868,4 (868,8), 939,4 (939,8) и 1860,8 (1861,7), соответственно.
Полученное действующее начало характеризуется низкой реакционной способностью из-за отсутствия в нем высокореакционных групп. Это дает основание ожидать, что полученное вещество будет обладать хорошими свойствами при хранении и допускать различные манипуляции с ним. Это предположение было проверено и подтверждено при получении и оценке характеристик полученных препаратов, композиций и лекарственных форм.
Из полученного препарата ПМ готовили различные варианты лекарственных композиций и форм.
В частности, в асептических условиях получали раствор ПМ в физиологическом растворе.
Раствор фасовали в ампулы и флаконы. Проверка активности через 6 месяцев хранения, а также после ускоренного старения для эквивалентного периода показала отсутствие осадка и продуктов деструкции ПМ.
Кроме того, на основе полученного ПМ готовили сухие препараты, включая лиофилизат для восстановления перед инъекцией (с добавкой и без добавки лактозы), сухую порошкообразную композицию с наполнителями, из которой затем готовили капсулы, таблетки и саше, предназначенные для перорального приема.
Сухой препарат ПМ смешивали с композицией для приготовления суппозиториев на основе масла какао, получая формы для ректального и вагинального применения.
Традиционным образом получали кремы и эмульсии на основе ПМ, используя обычные в данной области жировые носители и эмульсии. В качестве активаторов проникания (пенетрантов) использовали глицерин и диметилсульфоксид.
Пастилки для рассасывания готовили с использованием трагаканта и камедей.
Все приготовленные формы через 6 месяцев хранения при нормальных климатических условиях показали сохранение своих функциональных свойств как в части биологической активности, так и в части сохранения характеристик лекарственной формы.
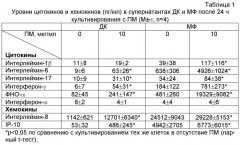
Пример 2. ПМ индуцирует выработку широкого спектра активационных цитокинов и хемокинов дендритными клетками (ДК) и макрофагами (МФ) человека in vitro.
В заявке RU 2008144644 была раскрыта способность ПМ вызывать выработку цитокина ФНО-α - одного из основных активационных цитокинов - мононуклеарными клетками крови (МНКК). Однако эффективный иммуностимулятор должен индуцировать не единичный цитокин, а определенный набор цитокинов и хемокинов, передающих активационный сигнал на разные звенья иммунной системы. В данном примере исследовали способность ПМ индуцировать синтез цитокинов и хемокинов дендритными клетками и макрофагами, которые являются одними из основных мишеней иммуностимуляторов in vivo. Данная модель является адекватной для оценки влияния иммуностимуляторов на цитокиновый статус in vivo. ДК и МФ получали из МНКК здоровых доноров in vitro, используя общепринятую методику [Sallusto F, Lanzavecchia A. Efficient presentation of soluble antigen by cultured human dendritic cells is maintained by granulocyte/macrophage colony-stimulating factor plus interleukin 4 and downregulated by tumor necrosis factor alpha. J Exp Med 1994; 179: 1109-18]. ДК и МФ культивировали без ПМ или с ПМ концентрации 10 мкг/мл в течение 24 ч, после чего собирали супернатанты и анализировали в них уровни цитокинов методом мультиплексного анализа (таблица 1).
Данные в таблице 1 показывают, что уже в первые 24 ч контакта с клетками иммунной системы ПМ индуцирует выработку набора цитокинов и хемокинов дендритными клетками и/или макрофагами. Указанные цитокины необходимы для успешного ответа иммунной системы на бактериальные, грибковые и некоторые вирусные инфекции. Так, интерлейкин-1β активирует различные клетки врожденной и адаптивной иммунной системы, а также эндотелий; интерлейкин-6 индуцирует выработку антимикробных белков острой фазы в печени и необходим для индукции оптимального адаптивного иммунного ответа; интерлейкин-17 индуцирует выработку хемокинов, необходимых для привлечения клеток-эффекторов антибактериального и антифунгального иммунитета (нейтрофилов, макрофагов), а также вызывает продукцию гранулоцитарного колониестимулирующего фактора (Г-КСФ), усиливающего образование нейтрофилов в костном мозге; интерферон-γ обеспечивает активацию макрофагов и цитотоксических Т-клеток; ФНО-α активирует эндотелий, различные клетки врожденной иммунной системы, а также - косвенно - клетки адаптивной иммунной системы, усиливает выработку хемокинов. Хемокины, индуцируемые ПМ, необходимы для привлечения эффекторных популяций лейкоцитов в место введения препарата, что важно при местном применении ПМ. Так, ИЛ-8 привлекает нейтрофилы, макрофаги, Т-клетки, IP-10 - Т-клетки и естественные интерферонпродуцирующие клетки, известные также как плазмацитоидные дендритные клетки. Данные по индукции хемокинов RANTES, MIP-1α и MIP-1β будут приведены в Примере 6.
Из таблицы 1 видно также, что ПМ не индуцирует выработку противовирусного цитокина ИФН-альфа, в связи с чем не ожидается высокая эффективность препарата при большинстве вирусных инфекций. Исключение составляют ВИЧ- и ВПГ-инфекции, применение ПМ для лечения и/или профилактики которых обосновывается в данной заявке.
Пример 3. ПМ усиливает бактерицидную активность лейкоцитов крови у здоровых добровольцев in vivo.
Одним из основных механизмов, с помощью которых иммунная система борется с бактериальными и грибковыми инфекциями, является фагоцитоз - поглощение микробов лейкоцитами с последующим уничтожением (киллингом) микробов внутри лейкоцита. Внутриклеточный киллинг микроорганизмов играет важнейшую роль в защите от бактериальных и грибковых инфекций. Прямой иллюстрацией этого является хроническая гранулематозная болезнь (ХГБ), при которой лейкоциты из-за генетического дефекта не могут убивать микробы, что ведет к развитию хронических бактериальных и грибковых инфекций и в итоге к гибели больного. Стимуляция бактерицидной активности лейкоцитов является одной из основных задач применения иммуностимуляторов при лечении и профилактике инфекционных заболеваний. Чтобы изучить влияние ПМ на данный аспект иммунитета, препарат вводили 6-ти здоровым добровольцам внутримышечно в дозе 400 мкг в виде водного раствора. Еще 4 здоровых добровольца вместо ПМ получили плацебо (воду для инъекций). У всех исследуемых брали кровь до инъекции (0 ч), а также через 4, 24 и 120 ч после инъекции. Бактерицидную активность полученных лейкоцитов крови оценивали по ранее опубликованной методике [Dambaeva SV, Mazurov DV, Golubeva NM, D'yakonova VA, Pinegin BV, Khaitov RM. Effect of Polyoxidonium on the Phagocytic Activity of Human Peripheral Blood Leukocytes. Russ J. Immunol 2003; 8: 53-60], измеряя процент клеток золотистого стафилококка, убитых внутри лейкоцитов за 1 ч инкубации in vitro. Данная методика является классическим методом оценки фагоцитарного звена иммунитета. ПМ достоверно усиливал бактерицидную активность лейкоцитов, что проявлялось в повышении способности лейкоцитов убивать стафилококк спустя 4 и 24 ч после инъекции (таблица 2). Важно отметить, что введение ПМ в указанной дозе не сопровождалось каким-либо пирогенным действием (повышение температуры тела выше 37,5°С не отмечено ни у одного из 6-ти испытуемых, до 37,5°С - у 1 испытуемого) и другими побочными эффектами.
Пример 4. ПМ стимулирует миелопоэз
Способностью к поглощению и внутриклеточному киллингу микробов (см. пример 3) обладают в основном так называемые миелоидные клетки - нейтрофилы, моноциты и макрофаги. В частности, падение уровней нейтрофилов в крови ниже 1000/мм3 (нейтропения) резко усиливает риск локальных и системных бактериальных и грибковых инфекций, который тем выше, чем выраженнее и длительнее нейтропения. В отсутствие лечения такое состояние ведет к гибели больного. Причинами нейтропении являются лучевая болезнь, отравления миелотоксическими субстанциями, а также проведенная лучевая или химиотерапия злокачественных новообразований. Для лечения нейтропении относительно успешно применяют ростовые факторы, необходимые для дифференцировки миелоцитов в костном мозге: гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ, молграстим) и гранулоцитарный колониестимулирующий фактор (Г-КСФ, филграстим). Оба препарата являются крайне дорогостоящими, т.к. их получение основано на рекомбинантной технологии. Индукция тех же факторов in vivo представляется адекватной и менее дорогостоящей заменой рекомбинантных белков.
Мы установили, что ПМ вызывает значимую выработку Г-КСФ и ГМ-КСФ дендритными клетками и макрофагами in vitro (таблица 3). Опыты проводили, как в Примере 2.
Чтобы убедиться, что ПМ не только индуцирует выработку КСФ in vitro, но и действительно влияет на миелопоэз in vivo, препарат вводили здоровым добровольцам, как в примере 3. Перед инъекцией, а также через 24 и 120 ч после инъекции определяли уровни нейтрофилов, моноцитов и лимфоцитов в крови. Приведенные в таблице 4 данные показывают, что через 24 ч после внутримышечной инъекции ПМ в дозе 400 мкг происходит избирательное и статистически достоверное повышение уровней моноцитов и молодых (палочкоядерных) нейтрофилов при неизменном содержании лимфоцитов и «старых» (сегментоядерных) нейтрофилов. Приведенные данные подтверждают способность ПМ стимулировать миелопоэз за счет индукции соответствующих КСФ, что обосновывает применение препарата при депрессии кроветворения и для лечения инфекционных заболеваний бактериальной и грибковой природы.
| Таблица 4Содержание различных популяций лейкоцитов у здоровых лиц, получивших ПМ и плацебо (×109/л, M±m) | ||||||||
| ПМ (n=6) | Плацебо (n=5) | |||||||
| Нейтрофилы | Лимфоциты | Моноциты | Нейтрофилы | Лимфоциты | Моноциты | |||
| Палочко-ядерные | Сегменто-ядерные | Палочко-ядерные | Сегменто-ядерные | |||||
| 0 ч | 0,05±0,03 | 3,0±0,04 | 1,8±0,03 | 0,22±0,04 | 0,12±0,04 | 3,4±0,17 | 2,1±0,11 | 0,36±0,03 |
| 24 ч | 0,29±0,06 | 3,7±0,16 | 1,9±0,14 | 0,50±0,10 | 0,17±0,04 | 3,3±0,16 | 2,1±0,16 |