Получение биологически активных белков
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана эукариотическая клетка-хозяин для экспрессирования слитого белка, которая содержит рекомбинантный слитый белок в рекомбинантных подобных белковым тельцам упорядоченных структурах (RPBLA). Указанный слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом, где индуцирующая белковые тельца последовательность содержит последовательность проламина. Указанный биологически активный полипептид природно обнаруживается во втором типе клеток, который отличается от указанной эукариотической клетки-хозяина. Представлены рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA) для сборки слитого белка, которые содержат заключенный в мембрану слитый белок. Также предложен способ получения биологически активного полипептида и вакцина или инокулят, содержащие иммуногенно эффективное количество рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), которые содержат рекомбинантный слитый белок, растворенный или диспергированный в фармацевтически приемлемом разбавителе. 5 н. и 33 з.п. ф-лы, 8 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Эта заявка заявляет преимущество предварительной заявки с порядковым номером 60/776391, которая была подана 23 февраля 2006 года.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение рассматривает получение биологически активных рекомбинантных пептидов и белков, совокупно называемых полипептидами, в эукариотических клетках и организмах в качестве систем-хозяев. Более конкретно, биологически активный полипептид сливают с индуцирующей образование белковых телец последовательностью (PBIS), которая опосредует индукцию рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA) с образованием слитого белка, который стабильно экспрессируется и накапливается в системе-хозяине в виде RPBLA после трансформации клеток-хозяев подходящим вектором.
УРОВЕНЬ ТЕХНИКИ
Получение рекомбинантных белков для терапевтического, нутрицевтического или промышленного применения успешно развивалось на протяжении последнего десятилетия. Введение гетерологичных генов, имеющих желаемую нуклеотидную последовательность, приводит к экспрессии полипептида или белка, имеющего соответствующую желаемую последовательность аминокислотных остатков или первичную структуру. Однако во многих случаях этот экспрессируемый белок или полипептид имел последовательность аминокислотных остатков природно продуцируемого материала, но не имел биологической активности этого материала.
Биологической активностью при условии правильной первичной структуры экспрессированного продукта может быть функция этого продукта, имеющего правильную укладку и образование внутренних водородных, ван-дер-ваальсовых, ионных и дисульфидных связей, а также имеющего правильную посттрансляционную модификацию, например гликозилирование. Например, образование дисульфидных связей происходит самопроизвольно в просвете эндоплазматического ретикулума (ER), но не в цитозоле прокариотов, что делает бактериальные клетки, такие как E. coli, плохими хозяевами для синтеза правильно уложенных белков млекопитающих, которые обычно стабилизированы дисульфидными связями. Образование дисульфидных связей может происходить в периплазматическом пространстве E. coli, где PDI-подобные белки являются функциональными (Fernandez, et al., 2001. Mol. Microbiol. Apr 40(2): 332-346), однако эта окислительно-восстановительная система является не очень эффективной.
Конкретный рассматриваемый случай относится к эритропоэтину (ЕРО), белку, который стимулирует образование эритроцитов. Рекомбинантный ЕРО описан в Патенте США № 4703008, Lin. Этот патент описывает активности для белка ЕРО, экспрессируемого в E. coli, S. cerevisiae и млекопитающих: в клетках яичника китайского хомячка (СНО) и почки африканской зеленой мартышки (COS-1). Хотя антисыворотки против ЕРО иммунореагировали с ЕРО, экспрессированным каждым типом клеток, только белки, экспрессированные клетками млекопитающих, проявляли существенную биологическую активность в качестве ЕРО in vivo и сходные концентрации в анализе антител, анализах in vitro и in vivo. Именно экспрессируемый млекопитающими белок используется для лечения людей.
Считается, что эти различия в биологической активности зависели от гликозилирования, так как E. coli, прокариот, не может гликозилировать экспрессируемые ею белки. Клетки дрожжей являются эукариотами, но их картина гликозилирования для секретируемых белков отличается от картины гликозилирования млекопитающих. С другой стороны, клетки СНО и COS-1, используемые для обеспечения белка с существенной активностью, были клетками млекопитающих и экспрессируемый ими белок был применимым. Опубликованные исследования гликозилированного и негликозилированного ЕРО показывают, что гликозилирование играет решающую роль в стабилизации эритропоэтина против денатурирующих условий. Narhi et al., (1991) J. Biol. Chem., 266(34):23022-23026. Кроме того, сообщалось, что период полувыведения in vivo и активность ЕРО могут быть связаны с гликозилированием этой молекулы.
Таким образом, эукариотические клетки являются в значительной степени предпочтительными для рекомбинантного получения терапевтических, промышленных и других применимых белков эукариотического происхождения. Было показано, что различные эукариотические клетки и организмы способны продуцировать активные терапевтические средства на основе белков. К сожалению, высокие стоимости, часто вызываемые низкими уровнями получения рекомбинантных белков и/или процедурами выделения и очистки белков, могут свести на нет возможность их промышленного применения. Проводится активное исследование для улучшения как уровней получения, так и процедур очистки с использованием различных подходов.
Одним путем улучшения эффективности выделения рекомбинантных белков является путь внутриклеточного концентрирования. Одним из этих подходов является рандомизированная агрегация рекомбинантных белков в несекретируемые внутриклеточные тельца (включения), которые могут быть выделены из лизированных клеток способами очистки на основе плотности. Тельца включений являются отложениями аморфного белка, обнаруживаемыми в бактериях. Исследования структурных свойств показали, что нерастворимый характер этих телец включений может быть обусловлен гидрофобными межмолекулярными взаимодействиями неприродно уложенных белков (Seshadri et al., 1999, Methods Enzymol. 309: 559-576). Общая стратегия, используемая для извлечения активных белков из телец включений, требует солюбилизации этого белка для разрушения этих случайных агрегатов с последующими одной или несколькими химическими стадиями рефолдинга. Это является важной проблемой, которая должна быть решена, так как эффективность ренатурации денатурированных белков может быть ограниченной, обычно, если этот белок содержит дисульфидные связи (Clark, Ed., Apr. 2001 Curr. Opin. Biotechnol. 12(2):202-207).
Более конкретно, используют сильные денатурирующие агенты, например высокую концентрацию хаотропных агентов (т.е. мочевины и гидрохлорида гуанидиния), для солюбилизации неуложенных белков, которые накапливаются в агрегатах. После этого эти денатурирующие агенты диализуют из агрегатов в попытке рефолдинга белка в природной конформации. Биологическая активность таких повторно уложенных белков обычно является гораздо меньшей, чем биологическая активность нативно-образованного белка.
Белковые тельца (РВ) являются природно-встречающимися структурами в семенах некоторых растений, которые эволюционировали для концентрирования запасных белков внутриклеточно в эукариотических клетках при сохранении правильного фолдинга и биологической активности. Белковые тельца (РВ) имеют некоторые общие свойства с тельцами включений из бактерий. Они являются плотными и содержат большое количество агрегированных белков, которые плотно упакованы гидрофобными взаимодействиями [Momany et al., 2006 J Agric. Food Chem. Jan 25; 54(2):543-547 и Garrat et al., 1993 Proteins et al., 1993 Proteins Jan; 15(1):88-99]. Кроме того, присутствие большого количества дисульфидных связей в некоторых из этих PBIS, например RX3, [Ludevid et al., 1984 Plant Mol Biol. 3: 227-234 и Kawagoe et al., 2005 Plant Cell Apr 17(4): 1141-1153], которые, возможно, участвуют в образовании и стабилизации РВ, могли бы представлять дополнительную трудность в получении биологически активного, нативно-уложенного белка, в частности белка, который содержит остатки цистеина.
Таким образом, наблюдение биологической активности без необходимости рефолдинга и ренатурации большого разнообразия белков, получаемых в синтетических РВ в недрожжевых эукариотических клетках, было неожиданным.
Новая технология, основанная на слиянии домена запасного белка семени растения с представляющим интерес белком (WO 2004/003207), была разработана для увеличения стабильности и накапливания рекомбинантных белков в высших растениях. Эти запасные белки являются специфическими для семян растений, где они стабильно накапливаются в белковых тельцах (Galili et al., 1993, Trends Cell Biol 3:437-442).
Эти запасные белки встраиваются в просвет эндоплазматического ретикулума (ER) через сигнальный пептид и собираются либо в развивающих эндоплазматический ретикулум специфических органеллах, называемых ER-происходящими белковыми тельцами (ER-PB), или в запасающих белки вакуолях (PSV) (Okita et al., 1996 Annu. Rev. Plant Physiol Mol. Biol. 47:327-350; Herman et al., 1999 Plant Cell 11:601-613; Sanderfoot et al., 1999 Plant Cell 11:629-642). Полноразмерные рекомбинантные запасные белки были также описаны для сборки в РВ-подобные органеллы в системах-хозяевах, не являющихся растениями, таких как ооциты Xenopus.
Экспрессия проламинов зерновых культур (наиболее обильных зерновых запасных белков) была описана в ооцитах Xenopus после инъекции соответствующих мРНК. Эта система была использована в качестве модели для исследования нацеливающих свойств этих запасных белков (Simon et al., 1990, Plant Cell 2:941-950; Altschuler et al., 1993, Plant Cell 5:443-450; Torrent et al., 1994, Planta 192:512-518) и для испытания возможности модификации α-зеина 19 кДа, проламина кукурузы, введением незаменимых аминокислот лизина и триптофана в его последовательность без изменения его стабильности (Wallace et al., 1988, Science 240:662-664).
Зеины, комплексную группу проламинов кукурузы, получали в дрожжах с различными целями. Corragio et al., 1988, Eur J Cell Biol 47:165-172, экспрессировали нативные и модифицированные α-зеины в дрожжах для исследования нацеливающих детерминант этого белка. Kim et al., 2002, Plant Cell 14: 655-672, исследовали возможные взаимодействия α-, β-, γ- и δ-зеинов, которые приводят к образованию белковых телец. Для решения этого вопроса они трансформировали дрожжевые клетки кДНК, кодирующей эти белки. Кроме того, эти авторы сконструировали слитые белки зеин-GFP для определения субклеточной локализации зеиновых белков в клетках дрожжей, но не наблюдали образования плотных концентрированных структур, характерных для bona fide РВ. Следует отметить, что Kim et al., 2002, Plant Cell 14:655-672, сделали вывод, что дрожжи не являются хорошей моделью для исследования взаимодействий зеинов, так как зеины сами по себе слабо накапливались в трансформированных дрожжах. Клетки дрожжей также использовали в качестве модели для исследования механизмов, которые контролируют транспорт и отложение белковых телец запасных белков пшеницы, называемых глиадинами (Rosenberg et al., 1993, Plant Phesiol 102:61-69).
Биологическая активность является особенно важной для вакцин, которые должны индуцировать корректную иммунную реакцию в иммунизированном человеке или другом животном. Несколько новых вакцин состоят из синтетических, рекомбинантных или высокоочищенных субъединичных иммуногенов (антигенов), которые, как считается, являются более безопасными, чем полностью инактивированные или живые аттенуированные вакцины. Однако отсутствие вспомогательных (адъювантных) иммуномодуляторных компонентов, ассоциированных с аттенуированными или убитыми вакцинами, часто приводит к более слабой иммуногенности таких вакцин.
Иммунологическими адъювантами являются агенты, которые усиливают специфические иммунные реакции на вакцины. Иммунологический адъювант может быть определен как любое вещество или любая композиция, которая при включении в вакцину, действует обычно, ускоряя, пролонгируя или усиливая качество специфических иммунных реакций на антигены вакцины. Слово «адъювант» произведено от латинского глагола adjuvare, который означает помогать или способствовать. Механизмы действия адъювантов включают в себя следующее: (1) увеличение биологического или иммунологического полупериода существования в организме иммуногенов вакцины; (2) улучшение доставки антигена к антигенпрезентирующим клеткам (АРС), а также процессирования и презентации антигена этими АРС; и (3) индукцию продуцирования иммуномодуляторных цитокинов.
Фагоцитоз включает в себя внедрение больших частиц, таких как апоптотические клетки или целые микробы. Способность клеток поглощать большие частицы, по-видимому, является функцией питания в одноклеточных организмах; однако сложные организмы используют преимущество фагоцитарного аппарата для выполнения дополнительных функций. Например, фагоцитоз антигенов, предпринимаемый макрофагами, В-клетками или дендритными клетками, представляет ключевой процесс в адоптивном и врожденном иммунитете. Действительно, фагоцитоз и последующее убивание микробов в фагосомах образует основу врожденной защиты организма против внутриклеточных патогенов. Кроме того, деградация патогенов в полости фагосомы и продуцирование антигенных пептидов, которые презентируются фагоцитарными клетками для активации специфических лимфоцитов, также связывает фагоцитоз с адоптивным иммунитетом (Jutras et al., 2005 Annual Review in Cell Development Biology. 21:511-27).
Белки, присутствующие на поглощенных частицах, сталкиваются с рядом деградирующих протеаз в фагосомах. Однако эта деструктивная среда генерирует пептиды, которые способны связывать молекулы МНС класса II. Новообразованные комплексы антиген-МНС класса II доставляются к клеточной поверхности для презентации CD4+ Т-клеткам (Boes et al., 2002. Naturе 418:983-988). Активация этих клеток индуцирует ТН2-субпопуляцию цитокинов, таких как IL-4 и IL-5, которая способствует пролиферации и дифференцировке В-клеток и связана с иммунными реакциями гуморального типа.
Большое количество доказательств указывает на то, что кроме явного участия пути МНС класса II в иммунной реакции против фагоцитированных патогенов антигены против патогенов, в том числе микобактерий, Salmonella, Brucella и Leishmania, могут индуцировать перекрестную презентацию антигенов. То есть можно сказать, что презентация поглощенного антигена фагоцитозом посредством зависимой от МНС класса I реакции стимулирует пролиферацию цитотоксических CD8+ Т-клеток (Ackerman et al., 2004 Nature Immunology 5(7):678-684 Kaufmann et al., 2005 Current Opinions in Immunology 17(1):79-87).
Дендритные клетки играют центральную роль презентации антигенов для индукции иммунной системы (Blander et al., Nature Immunology 2006 10:1029-1035). Хотя и редкие, дендритные клетки являются наиболее высокоспециализированными АРС, способными как провоцировать, так и регулировать иммунную реактивность (Lau et al., 2003 Gut 52:307-314). Хотя дендритные клетки являются важными в презентации антигенов, в частности для инициирования первичных иммунных реакций, макрофаги являются типом АРС, наиболее важным в участках воспаления и специализированным для клиренса некротического и апоптотического материала. Макрофаги могут не только действовать в качестве АРС, но могут также выполнять про- или антивоспалительную роль в зависимости от способа, посредством которого они активированы.
С учетом того, что АРС играет центральную роль в индукции и регуляции адоптивного иммунитета (гуморального или клеточного), узнавание и фагоцитоз антигена этими клетками может рассматриваться как ключевая стадия в процессе иммунизации. Большое разнообразие способов на основе поглощения флуоресцентных частиц были разработаны для исследования фагоцитоза макрофагами (Vergne et al., 1998 Analytical Biochemistry 255:127-132).
Важным аспектом в ветеринарных вакцинах является генетическое разнообразие рассматриваемых видов и необходимость общих систем, которые работают в различных видах. До значительной степени, это разнообразие ограничивает применение молекулярных способов нацеливания на маркеры клеточной поверхности и иммуномодуляторы, такие как цитокины, так как для многих видов, в том числе диких животных, доступны лишь минимальные данные в отношении этих молекул. Таким образом, предпочтительными являются адъюванты, которые основаны на универсальных сигналах активации врожденной иммунной реакции (т.е. которые являются идентичными в различных видах). С учетом этих требований состоящие из частиц системы доставки вакцин являются вполне подходящими для стратегий вакцин для ветеринарии и диких животных (Scheerlinck et al., 2004 Methods 40: 118-124).
Как обсуждается более подробно далее, данное изобретение показывает, что экспрессия слитого белка, состоящего из (i) последовательности белка, которая опосредует индукцию рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA), связанной с (ii) биологически активным полипептидом (представляющим интерес белком или мишенью), индуцирует накапливание этих RPBLA в клетках эукариотических организмов, таких как растения, грибы, водоросли и животные, с получением биологически активной мишени (белка).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает систему и способ для получения слитого белка, содержащего индуцирующую белковые тельца последовательность (PBIS) и представляющий интерес биологически активный пептид или белок (часто в совокупности называемый здесь полипептидом или мишенью), в эукариотических клетках. Эти слитые белки, содержащие представляющий интерес полипептид, накапливаются в виде рекомбинантных подобных белковым тельцам упорядоченных структур (RPBLA) в эукариотических клетках, которыми могут быть клетки растения, животного, грибов или водорослей.
Клетки высших растений являются предпочтительными эукариотическими клетками-хозяевами в некоторых вариантах осуществления, в то время как клетки низших растений, таких как водоросли, являются предпочтительными в других вариантах осуществления, клетки животных, таких как млекопитающие и насекомые, являются предпочтительными эукариотическими клетками-хозяевами в других вариантах осуществления, и грибы являются предпочтительными эукариотическими клетками-хозяевами в других вариантах осуществления. Этот слитый белок может экспрессироваться конститутивно или преимущественно в конкретных клетках в многоклеточных эукариотах. Эти PBIS способны опосредовать индукцию образования RPBLA и вхождение и/или накапливание слитого белка в этих органеллах с подходящим фолдингом и/или подходящими посттрансляционными модификациями, такими как базальное гликозилирование и образование дисульфидных связей, для обеспечения биологической активности представляющему интерес экспрессируемому пептиду или белку (мишеням).
Таким образом, эукариотическая клетка-хозяин, которая содержит биологически активный рекомбинантный слитый белок в рекомбинантных подобных белковым тельцам упорядоченных структурах (RPBLA), рассматривается в качестве одного аспекта данного изобретения. Слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является последовательностью из по меньшей мере 20 аминокислотных остатков биологически активного полипептида. Биологически активный полипептид, как обнаруженный в природе, может быть гетерологичным относительно указанных эукариотических клеток-хозяев и, следовательно, экспрессируется во втором типе клеток, которые отличаются от первой упомянутой выше эукариотической клетки-хозяина, или его получают синтетически. Кроме того, эта эукариотическая клетка-хозяин не продуцирует РВ в отсутствие этого слитого белка. Таким образом, именно экспрессия слитого белка и PBIS заставляет клетку-хозяина образовывать подобные белковым тельцам упорядоченные структуры или RPBLA.
В конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для трансформации, содержит (i) последовательность нуклеиновой кислоты, кодирующую PBIS, и (ii) последовательность нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую представляющий интерес продукт. В одном варианте осуществления, 3'-конец последовательности нуклеиновой кислоты (i) связан с 5'-концом указанной последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец последовательности нуклеиновой кислоты (i) связан с 3'-концом указанной последовательности нуклеиновой кислоты (ii). Таким образом, последовательность PBIS может находиться на N-конце или С-конце этого слитого белка. Должно быть понятно, что все из ДНК-связей, обсуждаемые здесь для экспрессии слитого белка, являются такими, что эти два компонента слитого белка экспрессируются в рамке считывания.
Биологически активный полипептид этого слитого белка обнаруживает по меньшей мере 25 процентов, предпочтительно по меньшей мере 50 процентов, более предпочтительно 75 процентов и наиболее предпочтительно по меньшей мере 90 процентов биологической активности одного и того же полипептида, выделенного из вышеуказанного второго типа клеток, в анализе активности этого полипептида.
В другом конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для трансформации, содержит, кроме вышеупомянутых последовательностей нуклеиновых кислот (i) и (ii), последовательность нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую линкерную или спейсерную аминокислотную последовательность. Эта спейсерная аминокислотная последовательность может быть аминокислотной последовательностью, расщепляемой или не расщепляемой, ферментативными или аутопротеолитическими или химическими средствами. В конкретном варианте осуществления, эта последовательность нуклеиновой кислоты (iii) помещена между последовательностями нуклеиновых кислот (i) и (ii), например, 3'-конец последовательности нуклеиновой кислоты (iii) связан с 5'-концом указанной последовательности нуклеиновой кислоты (ii). В другом варианте осуществления, 5'-конец указанной последовательности нуклеиновой кислоты (iii) связан с 3'-концом последовательности нуклеиновой кислоты (ii).
Кроме того, в конкретном варианте осуществления, последовательность нуклеиновой кислоты, используемая для целей трансформации, кодирует последовательность в соответствии с заявкой на патент WO 2004/003207, где эта последовательность нуклеиновой кислоты, кодирующая аминокислотную последовательность, которая является специфически расщепляемой ферментативными или химическими средствами, присутствует или отсутствует. В следующем варианте осуществления, эти слитые белки могут быть прямым слиянием между PBIS и представляющим интерес пептидом или белком.
В следующем варианте осуществления, способ этого изобретения дополнительно предусматривает выделение и очистку биологически активного слитого белка.
В другом варианте осуществления, способ этого изобретения дополнительно предусматривает выделение и очистку этого слитого белка и получение биологически активного слитого белка. Таким образом, когда этот слитый белок плотно собран и заключен в мембране, трудно показать, что этот полипептид является биологически активным. Вследствие этого, биологическая активность может анализироваться после удаления этой мембраны и, если требуется, солюбилизации слитого белка. Таким образом, обсуждается способ получения биологически активного полипептида.
В этом способе, обеспечивают рекомбинантные подобные белковым тельцам упорядоченные структуры (RPBLA), которые содержат заключенный в мембрану слитый белок. Эти RPBLA обычно присутствуют в основном в сферической форме, имеющей диаметр приблизительно 0,5 - приблизительно 3 мкм, но в некоторых случаях являются аморфными по форме и могут широко варьироваться в размерах, но все еще происходят из ER. Этот слитый белок содержит две последовательности, связанные вместе, где одна последовательность является индуцирующей белковые тельца последовательностью (PBIS), а другая является биологически активным полипептидом. Эти RPBLA контактируют в водном буфере, содержащем разрушающее упорядоченную структуру мембраны количество детергента (поверхностно-активного вещества). Этот контакт поддерживают в течение периода времени, достаточного для разрушения упорядоченной структуры мембраны, и температуре, которая не денатурирует биологически активный полипептид, для разделения мембраны и слитого белка. После этого отделенный слитый белок собирают обычным способом, или он может действовать в дальнейшем без его сбора.
В некоторых вариантах осуществления, отделенный слитый белок обнаруживает биологическую активность биологически активного полипептида. В других вариантах осуществления, биологическая активность этого полипептида проявляется, после того как этот слитый белок растворяют или диспергируют в подходящем буфере. В других вариантах осуществления, этот слитый белок должен быть расщеплен на составляющие его части перед проявлением биологической активности этого полипептида. Таким образом, биологически активный полипептид может быть связан с PBIS спейсерной аминокислотной последовательностью, которая является расщепляемой ферментативными или химическими средствами. Затем, после расщепления, этот биологически активный полипептид проявляет биологическую активность при отщеплении от PBIS этого слитого белка. В некоторых вариантах осуществления этот слитый белок сохраняет его активность даже тогда, когда он еще включен в интактные RPBLA.
В другом варианте осуществления, биологически активный полипептид содержит по меньшей мере две N-связанные последовательности гликозилирования.
Еще в одном варианте осуществления, представляющий интерес полипептид слит с природным или модифицированным запасным белком, например с природными или модифицированными проламинами или доменами проламинов.
В другом варианте осуществления, RPBLA, содержащие биологически активный полипептид, используют в качестве системы доставки биологически активного полипептида. Эти преимущества этого изобретения могли бы применяться в доставке лекарственных средств, вакцин и питания.
Еще в одном варианте осуществления, RPBLA, содержащие полипептидный антиген, могут быть использованы в качестве системы доставки для обеспечения адъювантности (увеличения иммунной реакции). Введение этих RPBLA может представлять улучшение в параметрах иммунизации, таких как скорость, количество, качество и длительность иммунизации. Предпочтительное действие введения антигенов в RPBLA может достигаться, так как (i) антиген является инкапсулированным и остается дольше в крови или в желудочно-кишечном тракте (эффект медленного высвобождения), и/или (ii) антиген лучше экспонирован иммунной системе (RPBLA в качестве носителя презентации антигена), и/или (iii) в препаратах RPBLA присутствуют молекулы адъюванта, и/или (iv) RPBLA являются носителями, способными пересекать мембраны, которые сами обеспечивают адъювантность, и т.д.
Таким образом, другим аспектом этого изобретения является вакцина или инокулят (иммуногенная композиция), которые содержат иммуногенное эффективное количество RPBLA, которые содержат в качестве биологически активного вещества рекомбинантный слитый белок, растворенный или диспергированный в фармацевтически приемлемом разбавителе. Этот рекомбинантный слитый белок содержит две последовательности, связанные вместе, где одна последовательность является PBIS, а другая является биологически активным полипептидом, к которому должна быть индуцирована иммунологическая реакция указанной вакциной или инокулятом. Фармацевтически приемлемая композиция разбавителя содержит также воду. В другом варианте осуществления RPBLA, не включающую в себя антиген, но имеющую активные адъювантные свойства, доставляют совместно с выделенным антигеном для индукции иммунологической реакции.
В другом варианте осуществления, последовательность PBIS может быть использована в качестве носителя для пересечения мембран. В конкретном варианте осуществления, PBIS является ZERA (RX3) или его фрагментом.
Данное изобретение имеет несколько выгодных эффектов действий и преимуществ.
Одним выгодным эффектом является то, что применение этого изобретения делает возможной относительно простую и быструю экспрессию желаемого рекомбинантного биологически активного белка в выбранной эукариотической клетке.
Преимущество этого изобретения заключается в том, что оно обеспечивает источник легко получаемого и очищаемого рекомбинантного биологически активного белка вследствие уникальных свойств экспрессии в RPBLA.
Другим выгодным эффектом этого изобретения является то, что содержащие слитый белок RPBLA могут быть использованы для доставки вакцин, в том числе вакцин для пероральной доставки.
Другим преимуществом данного изобретения является то, что содержащие слитый белок RPBLA могут быть использованы в иммуногене в инъецируемой вакцине.
Другим преимуществом данного изобретения является то, что RPBLA могут быть использованы в качестве изолирующих агентов, мембраносвязанных структур, которые изолируют экспрессируемый полипептид от остальных компонентов клетки. Эти изолирующие агенты защищают клетку от активности этого полипептида и полипептид от этой клетки, увеличивая скорость накапливания. Таким образом, могут быть успешно экспрессированы создающие трудности биологически активные полипептиды, которые являются токсичными и/или лабильными.
Дополнительные выгодные эффекты и преимущества будут очевидными для квалифицированного в данной области специалиста из следующего ниже обсуждения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На чертежах, образующих часть этого описания:
Фиг. 1, панель А является схематическим представлением конструкций, используемых для исследований трансфекций клеток СНО. Конструкция pECFP-N1 соответствует контролю, экспрессирующему ECFP в цитозоле. pRX3-ECFP и pRX3-Gx5-ECFP являются конструкциями, экспрессирующими слитый белок RX3-ECFP, в отсутствие или в присутствии спейсера, образованного пятью аминокислотными остатками глицина (Gx5), соответственно. Р22аZ-ECFP является конструкцией, кодирующей альфа-зеин кукурузы (22 кДа), слитый с ECFP. В нижней части представлены векторы на основе рсDNA3.1 (-) (Invitrogen) вместе с несколькими конструкциями, обсуждаемыми здесь далее. Панель В показывает схематическое представление бинарных векторов для трансформации растений (верхняя часть) и бакуловирусных векторов для инфицирования насекомых (нижняя часть). “RX3” = N-концевая богатая пролином последовательность гамма-зеина; “(Gly)x5” = спейсер, образованный пятью глицинами; “ECFP” = ген усиленного сине-зеленого флуоресцентного белка; “PCMV” = промотор цитомегаловируса человека; “PPH” = промотор полиэдрина; “PSV40” = ранний промотор SV40; “CaMV35S x2” = двойной промотор вируса мозаичной болезни цветной капусты; “Pcbh1” = промотор целлюлазы 1; “t35S” = терминатор вируса мозаичной болезни цветной капусты; “TEV” = трансляционный энхансер вируса табачной гравировки; “SV40 ter” = терминатор SV40; “HSV ter” = сигнал полиаденилирования тимидинкиназы вируса простого герпеса; “cbh1 ter” = сигнал полиаденилирования целлюлазы 1; “Kana/Neo” = ген устойчивости к канамицину/неомицину; “Amp R” = ген устойчивости к ампициллину; “гентамицин” = ген устойчивости к гентамицину; “SPcbh1” = сигнальный пептид целлюлазы 1; “Ori f1” = сайт инициации репликации одноцепочечной ДНК f1; “Ori pUC” = сайт инициации репликации плазмиды; “BGH ter” = терминатор бычьего гормона роста; “PBLA” = промотор гена бета-лактамазы; “GFP” = зеленый флуоресцентный белок; “hGH” = гормон роста человека; “EGF” = эпидермальный фактор роста человека; “EK” = бычья энтерокиназа; “GUS” = глюкуронидаза; “RTB” = лектиновая субъединица рицина (Ricinus communis); “Casp2” = каспаза 2 человека; “Casp3” = каспаза 3 человека; “Int” = интеин Ssp DNAb из New England Biolabs; “mInt” = мутированная версия интеина Ssp DNAb (замена Asp154 → Ala).
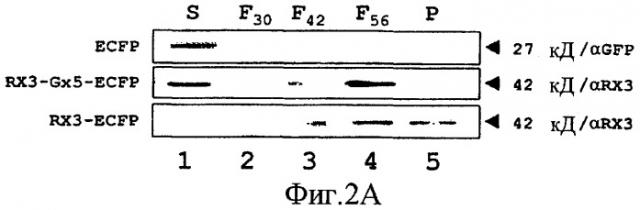
Фиг. 2 показывает иммуноблоты из исследований субклеточного фракционирования клеток СНО, трансфицированных рRX3-ECFP, рRX3-G-ECFP и рECFP-N1 в качестве контроля (Панель А); плазмиды р3.1-RX3-hGH, р3.1-RX3, р3.1-RX3-ЕК, р3.1-RX3-С3, р3.1-RX3-С2, р3.1-RX3-GUS и р3.1-RX3-I-hGH (Панель В). В панели В показан также иммуноблот из исследований субклеточного фракционирования растений табака, агроинфильтрированных рВ-RX3-RTB. Панель С соответствует исследованиям субклеточного фракционирования личинок насекомых, инфицированных pF-RX3-DsRED и pF-DsRED, в качестве контроля. Трансфицированные гомогенаты клеток наносили на ступенчатые градиенты сахарозы и после центрифугирования накапливание соответствующих слитых белков анализировали при помощи иммуноблота во фракциях супернатанта, границы раздела и осадка. Молекулярные массы и антитело, используемое в иммуноблоте, указаны справа. Н, гомогенат, нанесенный в градиенте плотности; S, супернатант; FX, нижняя граница раздела Х% м/м подушки сахарозы; Р, осадок под 56% сахарозной подушкой.
Фиг. 3 является фотографией конфокальной микроскопии в шести панелях, показывающей локализацию слитых белков RX3-ECFP (панель А), RX3-Gx5-ECFP (панель В), 22aZ-ECFP (панель D), RX3-GFP (панель Е) и RX3-DsRED (панель F) в RPBLA в трансфицированных клетках СНО. Некоторые из RPBLA-структур, содержащих активные (флуоресцентные) слитые белки, указаны стрелками. Локализация ECFP в цитозоле и ядре (панель С) в клетках СНО, трансфицированных рECFP-N1, показана в качестве контроля. “N” = ядро.
Фиг. 4 является фотографией конфокальной микроскопии в четырех панелях, показывающей локализацию флуоресцентных RX3-слитых белков в различных хозяевах. В панели А показаны конфокальные оптические срезы эпидермальной ткани листа из растений табака, ко-агроинфильтрированных рВ-RX3-GFP и бинарным вектором, кодирующим HсPRO, супрессором сайленсинга генов. Можно наблюдать множество флуоресцентных RPBLA, содержащих активный слитый белок RX3-GFP. Справа, в панели В, слияние флуоресценции RX3-GFP и контрастная фаза показывают высокий процент транзиторно трансфицированных клеток. Проекция оптических срезов клеток SF9 насекомых, инфицированных pF-RX3-DsRED, показана в панели С. Оптические срезы 1 мкм жировой ткани из личинки насекомого, инфицированного pF-RX3-DsRED, показаны в панели D. Некоторые из этих структур RPBLA, содержащие активные (флуоресцентные) слитые белки, указаны стрелками.
Фиг. 5 является фотографией в шести панелях (A-F), показывающей локализацию слитых белков RX3 в RPBLA в клетках СНО, спустя четыре дня после их трансфекции. Оптическую микроскопию использовали для демонстрации клеток СНО, экспрессирующих RX3-hGH (панели А и В), иммунолокализованных с использованием анти-RX3- и анти-hGH-сыворотки, соответственно. Панель С показывает иммунолокализацию с RX3-антисывороткой. Анти-hGH-сыворотку использовали в панели D для иммунолокализации слитого белка RX3-I-hGH. Инкубация клеток СНО, экспрессирующих слитый белок RX3-GUS, с RX3-антисывороткой показана в панели Е. Меньшие RPBLA наблюдали в клетках СНО, экспрессирующих RX3-ЕК, инкубированных с анти-RX3-сывороткой (панель F). Эндоплазматический ретикулум (ER) и RPBLA указаны.
Фиг. 6 показывает вестерн-блоты, которые иллюстрируют индукцию саморасщепления интеина Ssp DNAb после солюбилизации слитого белка RX3-I-hGH из препарата RPBLA низкоскоростным центрифугированием. Панели А и В иллюстрируют саморасщепление слитого белка RX3-I-hGH (интеина Ssp DNAb дикого типа), после солюбилизации. Слитый белок RX3-Im-hGH (мутированный интеин Ssp DNAb) был включен в качестве отрицательного контроля. Эквивалентные объемы этих проб наносили на дорожку и вестерн-блоты получали с анти-RX3-сывороткой (панель А) или анти-hGH-сывороткой (панель В). Полноразмерные слитые белки указаны белыми остриями стрелок, а продукты саморасщепления интеина Ssp DNAb (RX3-I в панели А и hGH в панели В) указаны черными остриями стрелок. Панель С иллюстрирует сравнение эффективности саморасщепления слитого белка RX3-I-hHG после солюбилизации 0,1% ДСН (S1) и двухфазной (S2) солюбилизации. Инкубация с анти-hGH-сывороткой показывает полноразмерный слитый белок RX3-I-hGH (белое острие стрелки) и высвобожденный hGH (черное острие стрелки). “S” = растворимая фракция; “U” = нерастворимая фракция; “T0” = проба перед индукцией саморасщепления интеина.
Фиг. 7 содержит микрофотографии, которые показывают поглощение и процессирование RPBLA RX3-DsRED из личинок насекомых макрофагами. В панели А показан анализ с использованием конфокальной микроскопии макрофагов спустя 1 час после инкубации с RPBLA RX3-DsRED. Слева, 2 макрофага можно наблюдать с использованием фазово-контрастной микроскопии. Справа, показаны возникшее изображение флуоресценции DsRED (черные острия стрелок) и самофлуоресценция макрофагов (белые острия стрелок) из оптического среза 1 мкм тех же самых клеток. Наблюдение ядра (N) в этом оптическом срезе указывает на то, что эти RPBLA были поглощены и являются теперь внутриклеточными. Панель В показывает исследование временного хода (1 час и 10 часов) флуоресценции DsRED, испускаемой этими макрофагами, после инкубации в течение 1 часа с RPBLA, содержащими RX3-DsRED. Слева, фазово-контрастная микроскопия показывает присутствие макрофагов. Справа, флуоресценция DsRED оптических срезов 1 мкм п