Способ получения субстанции рекомбинантной l-аспарагиназы erwinia carotovora
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и биотехнологии. Предложен способ получения субстанции рекомбинантной L-аспарагиназы Erwinia carotovora, согласно которому осуществляют ковалентную модификацию полиэтиленгликолем рекомбинантной L-аспарагиназы, выделенной из микробной массы генно-инженерного штамма-продуцента Escherichia coli BL(DE3)/pACYS-LANS(KM), у которого в плазмиде p/ACYS-LANS делетирован ген резистентности к ампициллину, модификацию осуществляют путем присоединения N-гидроксисукцинимидного эфира монометоксиполиэтиленгликоль-гемисукцината (mPEG-suc-NHS) к аминогруппам лизина аспарагиназы, полученный конъюгат подвергают хроматографической очистке и лиофилизации. Способ также предусматривает стабилизацию модифицированного и очищенного продукта. Изобретение обеспечивает получение новой эффективной субстанции ПЭГилированной аспарагиназы на основе фермента из Erwinia carotovora, которая может быть использована в качестве противоопухолевого средства. 3 з.п. ф-лы, 5 ил, 5 табл.
Реферат
Изобретение относится в области фармацевтики и биотехнологии и может быть использовано для получения противоопухолевого химиотерапевтического лекарственного препарата L-аспарагиназы Ervinia carotovora.
Бактериальные аспарагиназы 2-го класса (К.Ф. 3.5.1.1) относятся к периплазматическим ферментам, осуществляющим гидролиз L-аспарагина с образованием L-аспарагиновой кислоты и аммония. Аспарагиназы катализируют также гидролиз L-глутамина, но с меньшей скоростью по сравнению с L-аспарагином. Бактериальные аспарагиназы применяются в качестве противоопухолевых препаратов при комбинированной химиотерапии острого лимфобластного лейкоза, миелобластной лейкемии, болезни Ходжкина и не-Ходжкинской лимфомы, меланосаркомы и множественной миеломы. В лейкозных клетках активность аспарагинсинтазы снижена или полностью отсутствует. В этом случае синтез белка и, соответственно, рост клеток опухоли зависит от уровня экзогенного аспарагина. Введение препарата аспарагиназы приводит к уменьшению уровня аспарагина в крови и тканях и, как следствие, к избирательному ингибированию пролиферации опухолевых клеток. Использование препаратов аспарагиназы в противоопухолевой терапии ограничено различными побочными эффектами. Одной из установленных причин токсичности аспарагиназы является L-глутаминазная активность фермента. Поэтому поиск новых бактериальных аспарагиназ с низкой глутаминазной активностью является важной задачей современной медицинской биотехнологии.
В настоящее время два наименее токсичных фермента, а именно нативный препарат L-аспарагиназы из Escherichia coli (EcA), а также модифицированный полиэтиленгликолем «пегилированный» («Oncaspar») и нативный фермент (ErA) Erw. chrysanthemi, нашли применение в онкотерапии (Umesh K.Narta, Shamsher S.Kanwar and Wamik Azmi, Pharmacological and clinical evaluation of l-asparaginase in the treatment of leukemia. Critical Reviews in Oncology/Hematology. 2007, 61(3):208-221).
Наименее токсичными признаны препараты, полученные из Erw. chrysanthemi, что указывает на важность исследования аспарагиназ рода Erwinia. Тем не менее, даже аспарагиназы штаммов Erwinia вызывают развитие иммунологической гиперчувствительности к L-аспарагиназе, проявляющееся в диапазоне от слабых аллергических реакций до анафилактического шока.
Известны способы очистки нативных аспарагиназ из штаммов Erwinia, включающих экстракцию фермента либо из микробных клеток при pH от 11,3 до 11,5 с последующим подкислением экстракта до pH 4,8, либо из ацетонового порошка с последующей хроматографической очисткой на различных сорбентах (например, US 5310670, 10.05.1994).
К недостаткам подобных способов выделения аспарагиназ Erwinia следует отнести трудности обработки больших объемов фракций на начальных стадиях очистки (щелочной лизис, получение ацетонового порошка), многостадийность процесса очистки и относительно невысокий выход очищенного целевого продукта.
Ранее нами был разработан генно-инженерный продуцент аспарагиназы Erwinia carotovora - (ECAR-LANS), продуцируемый штаммом Escherichia coli BL(DE3)/pACYS_LANS и разработан способ выделения и очистки фермента (RU 2224797, 27.02.2004).
Однако процесс выделения и очистки занимает значительное время, при этом выход целевого продукта следует признать недостаточно высоким, что приводит в высокой стоимости продукта.
Следует также отметить, что эффективность применения аспарагиназ в противоопухолевой терапии ограничена быстрой протеолитической деградацией фермента в крови. В связи с этим актуальным является получение модифицированных форм аспарагиназ штаммов Erwinia, устойчивых к протеолитической деградации в крови, обладающих низкой иммуногенностью при сохранении высокой ферментативной активности.
Известен препарат ПЭГ-L-аспарагиназы Escherichia coli, в котором аспарагиназа ковалентно связана с моно-метокси-ПЭГ (Keating M.J., Holmes R., Lerner S. Но D.H. (1993) Leuk. Lymphoma 10 Suppl. 153-157).
В сравнении с нативной аспарагиназой Е.coli ПЭГ-L-аспарагиназа обладает более низкой иммуногенностью и в 5 раза более длительным временем полувыведения из организма.
Однако в литературе отсутствуют данные о применении для химиотерапии острых лейкозов ПЭГилированной аспарагиназы, полученной на основе фермента из штаммов Erwinia.
Задачей настоящего изобретения является разработка способа получения субстанции ПЭГилированной аспарагиназы (ПЭГ-аспарагиназы) на основе фермента из Erwinia carotovora, который пригоден для промышленного масштабирования, а полученный продукт может быть использован для химиотерапии лейкозов.
Поставленная задача решается описываемым способом получения субстанции рекомбинантной L-аспарагиназы Erwinia carotovora, который включает модифицикацию L-аспарагиназы полиэтиленгликолем, при этом модифицикации подвергают рекомбинантную L-аспарагиназу, выделенную из микробной массы генно-инженерного штамма-продуцента Escherichia coli BL(DE3)/pACYS_LANS(KM), у которого в плазмиде p/ACYS_LANS делетирован ген резистентности к ампициллину, модификацию осуществляют путем присоединения N-гидроксисукцинимидного эфира монометоксиполиэтиленгликоль-гемисукцината (mPEG-suc-NHS) к аминогруппам лизина аспарагиназы, после модификации проводят хроматографическую очистку полученного конъюгата рекомбинантной L-аспарагиназы Erwinia carotovora с полиэтиленгликолем (ПЭГ-аспарагиназы) и его лиофилизацию.
Предпочтительно очищенную ПЭГ-аспарагиназу подвергают стабилизации с использованием в качестве стабилизатора соединения, выбранного из ряда: белки, аминокислоты, поливинилпирролидоны, поли- или моносахариды, полиалкиленоксиды, аминосахара, соли.
Способ предусматривает использование в качестве источника L-аспарагиназы микробной массы штамма, депонированного в ВКМП под коллекционным номером №В-10370, при этом выделение L-аспарагиназы осуществляют путем разрушения клеток на Френч-Прессе с последующим высаливанием целевого продукта сернокислым аммонием и хроматографической очисткой.
В предложенном способе используют рекомбинантную L-аспарагиназу Erwinia carotovora, нуклеотидная последовательность гена которой lanS, a также аминокислотная последовательность L-аспарагиназы представлены на фиг.1.
Использование для модификации рекомбинантной L-аспарагиназы, полученной с помощью штамма-продуцента Escherichia coli BL(DE3)/pACYS_LANS(XM), обеспечивает получение микробной массы штамма-продуцента, в клетках которого содержание аспарагиназы достигает 20% от тотального белка, что позволяет далее использовать высокоэффективные приемы разрушения клеток на Френч-Прессе с высаливанием целевого продукта из бесклеточного экстракта, что, в свою очередь, интенсифицирует процесс выделения и дальнейшей очистки L-аспарагиназы. Все эти приемы позволяют повысить выход фермента и удешевить стоимость полученной субстанции аспарагиназы.
Что касается выбора метода ковалентной модификации, то он основан на следующем.
Как известно, для модификации молекул белков наиболее подходящим и часто используемым производным полиэтиленгликоля является монометиловый эфир полиэтиленгликоля (мПЭГ), который может быть использован как в виде линейной молекулы с предпочтительной молекулярной массой от 2000 до 5000, так и в виде разветвленной молекулы большого молекулярного веса (см., например, Ton G.N., Fineb J.P., Kwonc G.S. Methoxypoly(ethylene glycol)-conjugated carboxypeptidase A for solid tumor targeting Part I: Synthesis and characterization. Journal of Controlled Release 2005, vol.104, pp.129-139, или Alexandre Learth Scares, Gledson Manso Guimarães, Bronislaw Polakiewicz, Ronaldo Nogueira de Moraes Pitombo and Jose Abrahão-Neto. Effects of polyethylene glycol attachment on physicochemical and biological stability of E.coli L-asparaginase International Journal of Pharmaceutics, 2002, vol.237(1-2), pp.163-170). Использование для получения ПЭГ-аспарагиназы импортных коммерческих препаратов монометокси-ПЭГ-п-нитрофенилкарбамата (mPEG-NPh) не представляется возможным ввиду их дороговизны.
Нами предложен другой подход к получению ПЭГ-аспарагиназы. Предварительно проводят синтез N-гидроксисукцинимидного эфира монометоксиполиэтиленгликоль-гемисукцината (mPEG-suc-NHS), а затем осуществляют его присоединение к аминогруппам аспарагиназы. Данный реагент выгодно отличается от монометилового эфира полиэтиленгликоль-п-нитрометилкарбамата тем, что сложноэфирная связь, соединяющая янтарный ангидрид и полиэтилгликоль, более стабильна, чем уреидильная связь, соединяющая карбоксильную группу и полиэтиленоксид в mPEG-NPh.
Перечень чертежей, иллюстрирующих изобретение:
на фиг.1 - нуклеотидная последовательность гена lanS и аминокислотная последовательность L-аспарагиназы Erwinia carotovora;
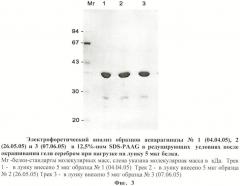
на фиг.2 - электрофоретический анализ образцов аспарагиназы в редуцирующих условиях после окрашивания геля красителем Кумасси - 250;
на фиг.3 - электрофоретический анализ образцов аспарагиназы в редуцирующих условиях после окрашивания геля серебром при нагрузке на лунку 5 мкг белка;
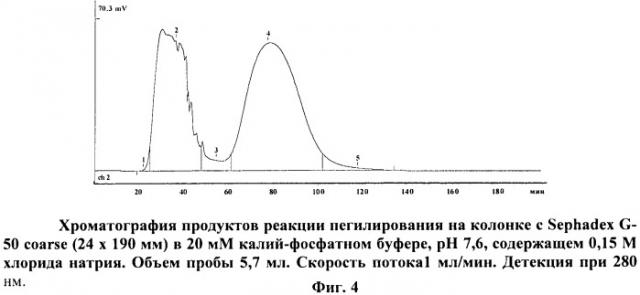
на фиг.4 - хроматограмма продуктов реакции пегилирования;
на фиг.5 (а, б, в) - противоопухолевая цитотоксическая активность субстанций L-аспарагиназ.
Ниже представлены примеры, иллюстрирующие осуществление изобретения и технический результат, достигаемый при его использовании.
Пример 1.
Стадия 1 - Выращивание продуцента Escherichia coli BL(DE3)/pACYS_LANS(KM) в 300-литровом ферментере
Штамм продуцент получают путем трансформации компетентных клеток реципиентного штамма E.coli BL21(DE3), («Novagen», Cat. №69387-3) плазмидой pACYC_LANS(KM).
Для создания банка клеток используют отдельные клоны трансформантов E.coli BL21(DE3)/pACYC_LANS(ICM), полученные на LB-агаре с канамицином. Для закладки на хранение колонию продуцента выращивают в LB-бульоне до середины логарифмической фазы роста и полученную суспензию вносят в криовиалы, содержащие 30%-ный раствор глицерина, в соотношении 1:1. Смесь тщательно перемешивают и быстро замораживают при температуре -70°С.
Для отработки методики приготовления посевного материала для ферментации в 300-литровом ферментере используется схема, обеспечивающая оптимальные временные характеристики ведения процесса культивирования в сочетании с минимальным количеством пассажей продуцента на этапе масштабирования. В качестве исходного материала для ферментации используют ночную культуру продуцента, выращенную на среде с глюкозой и канамицином, которую после пересева в свежую питательную среду выращивают до середины экспоненциальной фазы роста и вносят в 30-литровый инокулятор, после культивирования в котором продуцент поступает в 300-литровый ферментер. Культивирование осуществляют в питательной среде на основе LB-M9 бульона, при температуре 37°С, pH 7,0, при аэрации воздухом с расходом 150-70 л/мин. По окончании культивирования культуральную жидкость охлаждают до температуры 14-15°С проточной водопроводной водой, концентрируют в течение 3-х часов на мембранной установке (размер пор у мембран 0,25 мкм) до объема 30 л и сепарируют на сепараторе АСГ-3М при 9000 об/мин для получения влажной биомассы. Уровень активности аспарагиназы определяют методом прямой несслеризации.
В таблице 1 приведены результаты выращивания штамма-продуцента на колбах.
| Таблица 1 | |||
| Условия выращивания продуцента на колбах | |||
| Время индукции | ОП 560 нм | Активность МЕ/мг | *(%) аспарагиназы в клетке |
| Вариант №1 40 мл LB, 180 об/мин | |||
| 5 час | 4,8 | 6,7 | 7,4 |
| 21 час | 4,2 | 1,7 | 6,6 |
| Вариант №2 160 мл LB, 90 об/мин | |||
| 5 час | 2,7 | 6,5 | 9,0 |
| 21 час | 4,0 | 35,0 | 20,3 |
| 25 час | 3,8 | 25,0 | 18,2 |
| *содержание аспарагиназы в клетке (% от суммарного белка) |
В таблице 2 приведены результаты культивирования штамма в 300-литровом ферментере.
| Таблица 2 | ||
| Результаты культивирования штамма в 300-литровом ферментере | ||
| Объем культуральной среды (л) | Выход биомассы (г) | Уровень активности аспарагиназы (МЕ/мл) |
| 260 | 2500 | 140 |
| 260 | 1900 | 150 |
Стадия 2 - Очистка rec-ECAR_LANS из выращенной в ферментере биомассы и характеристика фермента
Вначале проводят получение бесклеточного экстракта.
Разрушение биомассы проводят на Френч-Прессе в лизирующем буфере (10 мМ ЭДТА, pH 9,5) при соотношении клеток и лизирующего буфера 1:4 и рабочем давлении 1580-1600 бар. Выход активности фермента на стадии бесклеточного экстракта составляет 80-93%.
Стадия 3 - Фракционирование сульфатом аммония и обессоливание
Процесс солевого фракционирования проводят при температуре +4°С. При насыщении бесклеточного экстракта сульфатом аммония до 20% удается избавиться центрифугированием от части балластных белков, при дальнейшем насыщении сульфатом аммония надосадочной жидкости в интервале от 20 до 60% образуется осадок, который содержит почти всю аспарагиназную активность.
Для обессоливания используют колонку с Sephadex G-50 (coarse) объемом 5,5 л (14,0×35,5 см) в 20 мМ калий-фосфатном буфере, содержащем 1 мМ глицина и 1 мМ ЭДТА, pH 5,6. Обессоливание проводят при скоростях потока около 30 мл/мин.
Стадия 4 - Ионообменная хроматография на CM-Sepharose FF
Обессоленную фракцию сульфат-аммонийного осадка разбавляют этим же буфером вдвое и наносят на колонку с CM-Sepharose FF (10×3,2 см), уравновешенную 20 мМ калий-фосфатным буфером, содержащим 1 мМ глицина и 1 мМ ЭДТА, pH 5,6 со скоростью около 400 мл/час. Проскок контролируют, определяя ферментативную активность качественно (микрометодом) с использованием реактива Несслера. После нанесения образца колонку промывают 20 мМ калий-фосфатным буфером, pH 6,3 с целью удаления балластных белков. Элюцию целевого вещества проводят 20 мМ калий-фосфатным буфером, pH 7,0 и 7,6. Завершающий этап хроматографической очистки полуфабриката аспарагиназы представляет собой стадию концентрирования образца, одновременно сопровождающуюся более глубокой степенью его очистки.
Стадия 5 - Подготовка препарата к лиофилизации
Концентрирование проводят на колонке с CM-Sepharose FF (2,5×10,0 см), уравновешенной 20 мМ калий-фосфатным буфером, pH 6,3. В качестве предколонки используют колонку с DEAE-сорбентом CnC-DEAE-Био (5×6 см). Колонки с DEAE-сорбентом также уравновешивают 20 мМ калий-фосфатным буфером, pH 6,3.
Целевую фракцию, полученную с 250-миллилитровой колонки с CM-Sepharose FF, разбавляют равным объемом 20 мМ KH2PO4, при этом pH фракции снижается с 7,0 до 6,3-6,4. Нанесение образца осуществляют через предколонку с DEAE-сорбентом на основную колонку с CM-Sepharose FF со скоростью потока 8 мл/мин. После нанесения образца колонку тщательно отмывают 20 мМ калий-фосфатным буфером, pH 6,3 до базовой линии, а затем элюируют белок 20 мМ калий-фосфатным буфером, pH 7,6.
Выход целевого вещества на этой стадии составляет 95-97%.
В качестве стабилизирующей добавки используют глюкозу, которую добавляют в препарат перед лиофилизацией до конечной концентрации 0,5%.
Стадия 6 - лиофилизация.
Лиофилизацию проводят на лиофильной сушке Alpha ("Christ", Switzerland). В одних опытах концентраты, содержащие 0,5% глюкозы, лиофилизируют на полке при -10°С в течение 2 суток, затем полку нагревают до температуры 30°С. В других лиофилизацию проводят в колбах при комнатной температуре. Потери аспарагиназной активности при лиофилизации в обоих случаях составляют от 5 до 10%.
Таким образом, получен полупродукт - субстанция аспарагизазы, не подвергнутая модификации полиэтиленгликолем.
Характеристики полученной субстанции аспарагиназы
Протокол выделения образца субстанции представлен в таблице 3.
| Таблица 3 | ||||
| Протокол выделения аспарагиназы | ||||
| Этап очистки | Белок общий | Активность аспарагиназы | Выход, % | |
| Общая (ME) | Удельная (МЕ/мг белка) | |||
| Суспензия клеток | - | 971 960 | - | 100 |
| Бесклеточный экстракт | - | 894 800 | - | 92 |
| Сульфат-аммонийная фракция (20-60%) + Обессоливание (103 г сульф. осадка) | 7437 | 855 324 | 115 | 88 |
| Хроматография на СМ-Sepharose | 1339 | 641 493 | 479 | 66 |
| Концентрирование на СМ-Sepharose при pH 6,3 | 1308 | 612 334 | 468 | 63 |
| Лиофилизация | 1277,6 | 544 297 | 426 | 56 |
| *Количество биомассы - 128 г (984 718 ME). Лизирующий буфер 10 мМ ЭДТА, pH 9,5 Соотношение биомасса: лизирующий буфер 1:4 Рабочее давление 1580-1600 бар |
Выход фермента на конечном этапе очистки составил 56%, что примерно на 20% ниже, чем при использовании лабораторной методики, что связано с масштабированием процесса выделения целевого продукта и увеличением количества этапов очистки.
Определение чистоты, гомогенности и молекулярной массы препарата рекомбинантной аспарагиназы Erwinia carotovora
- По данными электрофореза в SDS-PAGE при нагрузке белка 10 или 40 мкг на лунку и окраске геля красителем Кумасси R-250 препараты аспарагиназы представлены в основном одной полосой (фиг.2). В случае окраски геля серебром при нагрузке белка 5 мкг на лунку также выявляется одна основная полоса с молекулярной массой 34-35 кДа и несколько минорных полос с меньшим молекулярным весом (от 15 до 30 кДа) (фиг.3), а также в растворе аспарагиназы E.coli производства немецкой фирмы «Medac». Эти низкомолекулярные компоненты, количество которых возрастает при хранении фермента, являются, по-видимому, продуктами деградации аспарагиназы.
- В денатурирующих условиях по результатам электрофореза в SDS-PAGE аспарагиназа представлена мономером с молекулярной массой 34±2 кДа.
- В нативных условиях по данным гель-фильтрации на колонке с "SuperoseR 12" аспарагиназа имеет молекулярную массу 67,6±3 кДа.
Очищенная субстанция rec-ECAR-LANS полностью удовлетворяет требованиям, предъявляемым к иммунобиологическим рекомбинантным препаратам (содержание примесных бактериальных белков E.coli и эндотоксинов) (см. таблицу 4).
| Таблица 4 | |
| Характеристика полуфабриката L-аспарагиназы | |
| Параметры | Значения |
| Концентрация (мг/мл) | 36,8 |
| Содержание мономера по данным SDS-ЭФ (%) | 92 |
| Гомогенность L-аспарагиназы в нативных условиях по данным гель-фильтрационной хроматографии | 98,10 |
| Содержание эндотоксинов (еЭ/мг) | 1,63 |
| Содержание белков Е.coli (нг/мг) | 58 |
| Специфическая удельная активность (МЕ/мг белка) | 386,9 |
Rec-ECAR-LANS получена в близком к гомогенному состоянии, с удельной активностью, соответствующей бактериальной аспарагиназе Erwinia carotovora. L-глутаминазная активность rec-ECAR-LANS составляет примерно 5% от L-аспарагиназной, что позволит минимизировать побочные токсические эффекты при использовании субстанции, связанные с гидролизом L-глутамина.
Стадия 7 - Получение исходных реагентов для синтеза ПЭГилированной формы rec-ECAR_LANS
1) Синтез монометокси-ПЭГ5000-гемисукцината. Для получения ПЭГ-гемисукцината 50 г монометокси-ПЭГ (мПЭГ) растворяют в абсолютном бензоле и тщательно упаривают бензол в вакууме водоструйного насоса. Благодаря способности бензола образовывать азеотропную смесь с водой при этом происходит удаление следов воды из полимера. Эту процедуру повторяют трижды, после чего полимер растворяют в абсолютном хлороформе и добавляют 10-кратный молярный избыток янтарного ангидрида и абсолютного триэтиламина. Реакционную смесь выдерживают в течение 3-х суток при 60°С, после чего фильтруют через стеклянный фильтр и упаривают хлороформ на роторном испарителе. Далее полученный карбоксилированный мПЭГ растворяют в 30 мл 1 М соляной кислоты, промывают диэтиловым эфиром и экстрагируют модифицированный мПЭГ в хлороформ (300 мл). Хлороформный слой промывают несколько раз 1 М HCl для удаления янтарной кислоты. Затем хлороформный раствор полимера сушат над безводным сульфатом натрия и упаривают на роторном испарителе. На последней стадии полученный продукт растворяют в воде и диализуют против воды, используя бензоилированные мембраны, не пропускающие вещества с молекулярным весом более 2 кДа. Полученный раствор лиофильно высушивают. Полученный продукт представляет собой белый порошок без запаха. Выход продукта составляет 50%.
2) Для получения N-гидроксисукцинимидного эфира ПЭГ-гемисукцината 50 г препарата полиэтиленгликоль-гемисукцината растворяют в 100 мл абсолютного бензола и упаривают в вакууме. Процедуру повторяют трижды для удаления следов воды в препарате ПЭГ. Далее полученный препарат растворяют в 200 мл свежеперегнанного хлористого тионила, кипятят 4 часа с обратным холодильником, выдерживают еще 20 часов при комнатной температуре, после чего хлоритый тионил отгоняют на роторном испарителе. Получившийся продукт представляет собой хлорангидрид mPEG-suc, mPEG-suc-Cl, который сразу же пускают в синтез N-гидроксисукцинимидного эфира. Препарат растворяют в 300 мл абсолютного хлористого метилена и помещают в капельную воронку, присоединенную к трехгорлой колбе. В колбу помещают раствор 1,5 г (8,7 ммоль) N-гидроксисукцинимида и 1 мл (7 ммоль, 0,7 г) абсолютированного триэтиламина в хлористом метилене и охлаждают в ледово-солевой бане до -10°С. Раствор mPEG-suc-Cl осторожно прибавляют к раствору N-гидроксисукцинимида при интенсивном перемешивании, следя за тем, чтобы температура не поднималась выше -5°С. После прибавления всего хлорангидрида реакционную смесь оставляют перемешиваться при комнатной температуре еще на 18 часов, после чего продукт высаживают гексаном и осадок выделяют на центрифуге. Далее продукт промывают трижды гексаном и высушивают в вакуум-эксикаторе в вакууме водоструйного насоса над щелочью. Продукт хранят в эксикаторе над щелочью во избежание контакта с парами воды.
Стадия 8 - Получение ПЭГилированной формы аспарагиназы
Сухой лиофилизованный порошок препарата аспарагиназы помещают в сосуд, снабженный магнитной мешалкой. К препарату фермента с концентрацией 35 мг/мл в 20 мМ K2PO4 добавляют 0.5 М борат pH 9.5 (1/5 по объему) для доведения pH среды до 8,5 (оптимально для модификации N-гидроксисукцинимидными эфирами), после чего раствор фермента прибавляют к сухому mPEG-suc-NHS. Раствор интенсивно перемешивают в течение 30 мин при комнатной температуре до полного растворения препарата, после чего охлаждают до +4°С и продолжают инкубацию на холоду при постоянном перемешивании в течение 4 час. После этого фермент отделяют от ПЭГ с помощью гель-хроматографии на колонке с Sephadex G-50.
Стадия 9 - Удаление компонентов реакционной смеси с получением очищенной ПЭГ-аспарагиназы
Очистку ПЭГ-аспарагиназы проводят в три этапа: реакционную смесь после реакции пегилирования подвергают диализу через мембраны с исключенной молекулярной массой 100 кДа против калий-фосфатного буфера, pH 7,2, в течение суток, после чего полученный препарат подвергают двухстадийной хроматографической очистке на колонке с DEAE-Sepharose FF и на колонке с Диасфером СТ-150.
Хроматография на колонке с DEAE-Sepharose FF: пробу после диализа объемом 41 мл, содержащую около 500 мг ПЭГ-аспарагиназы, наносят на колонку размером 25×20 мм (объем 10 мл), уравновешенную 20 мМ калий-фосфатным буфером, pH 7,2. Скорость потока 1 мл/мин. После пропускания пробы элюцию ПЭГ-аспарагиназы проводят тем же буфером. Целевое вещество определяется в проскоке и составляет фракцию объемом 46 мл.
Хроматография на колонке с Диасфером СТ-150: пробу объемом 42 мл наносят на колонку размером 25×70 мм (объем 37 мл), уравновешенную 20 мМ калий-фосфатным буфером, pH 7,2. Скорость потока 3 мл/мин. После нанесения пробы элюцию осуществляют тем же буфером. Целевое вещество определяется в проскоке и составляет фракцию объемом 38 мл с концентрацией белка 6,8 мг/мл и удельной активностью ПЭГ-аспарагиназы 350 МЕ/мг.
Таким образом, выход целевого вещества после стадии хроматографической очистки составляет около 50%.
Пример 2 - Стабилизация очищенной ПЭГ-аспарагиназы с использование различных стабилизаторов
Объединенные фракции, содержащие очищенную ПЭГ-аспарагиназу, диализуют против 20 объемов 20 мМ натрий фосфатного буфера, pH 7,2 при температуре 6±3°С. Полученный диализат помещают в пластиковые или стеклянные флаконы с силиконизированной поверхностью, добавляют твин-80 или твин-20 до конечной концентрации 0,002% и стабилизаторы.
В качестве стабилизаторов опробованы белки, аминокислоты, поливинилпироллидоны, полисахариды, полиалкиленоксиды, моносахариды, аминосахара, соли (данные сведены в табл.5).
В конкретных примерах использованы следующие вещества. В качестве поливинилпиролидона используют поливинилпирролидон-12000 в концентрации 3-6%, в качестве белка - человеческий сывороточный альбумин в концентрации 1%, в качестве аминокислоты используют L-аргинин в концентрации 2-6%, в качестве полиалкиленоксида используют полиэтиленгликоль 1500 в концентрации 2-5%, в качестве полисахарида используют декстран-60 в концентрации 3-6%, в качестве моносахарида используют маннит в концентрации 4-7%, в качестве аминосахаров используют глюкозамин в концентрации 6-10%, в качестве соли используют натрий хлористый в концентрации 0,9%.
Стабильность полученных композиций исследована методом ускоренного хранения при температуре (36±2)°С в течение 2 недель. Через 2 недели отбирают аликвоты и анализируют биологическую активность ПЭГ-аспарагиназы. Длительность хранения при температуре (36±2)°С пересчитывают на длительность хранения при температуре (6±2)°С по формуле
Tx=TexpxA(texp-tk)/10,
где Tx - ориентировочный срок хранения (недели) при температуре (6±2)°С;
Texp - срок хранения в эксперименте (36±2)°С;
texp - температура хранения в эксперименте (36±2)°С;
tk - температура хранения (6±2)°С;
А - константа, равная 3.
Из формулы следует, что 2 недели хранения при температуре (36±2)°С соответствуют 54 неделям (около года) хранения при температуре (6±2)°С.
В таблице 5 приведены данные по хранению препаратов стабилизированной ПЭГ-аспарагиназы разными стабилизаторами.
| Таблица 5 | |||
| Влияние различных веществ на стабильность препарата ПЭГ-аспарагиназы в 20 мМ Na-фосфатном буфере, содержащем 0,002% Твина-80 при хранении в течение 2 недель при температуре (36±2)°С. | |||
| Исходная активность ПЭГ-аспарагиназы, серия 251109 (МЕ/мг) | Добавляемое вещество | Концентрация (%) (W/V) | Активность после хранения (%) |
| 320 | NaCl | 0,9 | 350 |
| Декстран 60 | 3-6 | 400 | |
| Полиэтиленгликоль 1500 | 2-5 | 293 | |
| Поливинилпирролидон 12000 | 3-6 | 376 | |
| Маннитол | 4-7 | 370 | |
| Глюкозамин | 6-10 | 239 | |
| Человеческий сывороточный альбумин | 1-2 | 260 | |
| L-аргинин | 2-6 | 320 |
Полученный нами целевой продукт был исследован на возможность его применения для химиотерапии.
Проведена оценка противоопухолевой цитотоксической активности субстанции ПЭГилированной рекомбинантной аспарагиназы в отношении эукариотических клеток.
В экспериментах использованы линии лейкозных клеток человека К-562 (хронический миелоидный лейкоз), Jurkat и Molt-4 (острый лимфобластный лейкоз). При определении противоопухолевой активности препарата ПЭГ-аспарагиназы и L-аспарагиназы Erwima carotovora препаратом сравнения служит L-аспарагиназа E.coli («Medac», Германия).
В опытах использована ПЭГ-аспарагиназа, полученная при молярном соотношении ПЭГ/белок, равным 1:25, очищенная на колонке с Sephadex G-50. Удельная активность субстанции 314 МЕ/мг белка. Концентрация белка 1,38 мг/мл.
Противоопухолевую активность L-аспарагиназ определяют через 72 часа инкубации клеток К-562, Jurkat и Molt-4 с субстанцией аспарагиназ. Результаты, представленные на фиг.5 (а, б, в), показывают, что противоопухолевая активность ПЭГ-аспарагиназы несколько ниже, чем противоопухолевая активность других L-аспарагиназ. Значительное снижение числа жизнеспособных клеток К-562 и Jurkat наблюдается уже при концентрации ферментов Erwinia carotovora и E.coli 0,5 МЕ/мл, тогда как ПЭГ-аспарагиназы вызывает аналогичное подавление роста клеток при концентрации 5,0 МЕ/мл для линии клеток К-562 и 2,0 МЕ/мл для Jurkat. Линия клеток Molt-4 оказалась менее чувствительной к действию препарата ПЭГ-аспарагиназы по сравнению с К-562 и Jurkat.
Из представленных данных следует, что полученная заявленным способом ПЭГ-аспарагиназа Erwinia carotovora обладает противоопухолевой цитотоксической активностью в отношении исследованных линий лейкозных клеток человека.
Эффективность субстанции, полученной заявленным способом, позволяет рекомендовать ее в качестве основы для создания противоопухолевых лекарственных средств, при этом разработанный нами способ является простым и пригодным для промышленного масштабирования.
1. Способ получения субстанции рекомбинантной L-аспарагиназы Erwinia carotovora, заключающийся в том, что осуществляют ковалентную модификацию L-аспарагиназы полиэтиленгликолем, причем модификации подвергают рекомбинантную L-аспарагиназу, выделенную из микробной массы генно-инженерного штамма-продуцента Escherichia coli BL(DE3)/pACYS-LANS(KM), у которого в плазмиде p/ACYS-LANS делетирован ген резистентности к ампициллину, модификацию осуществляют путем присоединения N-гидроксисукцинимидного эфира монометоксиполиэтиленгликоль-гемисукцината (mPEG-suc-NHS) к аминогруппам лизина аспарагиназы, проводят хроматографическую очистку полученного конъюгата рекомбинантной L-аспарагиназы Erwinia carotovora с полиэтиленгликолем (ПЭГ-аспарагиназы) и лиофилизацию.
2. Способ по п.1, отличающийся тем, что очищенную ПЭГ-аспарагиназу дополнительно подвергают стабилизации с использованием в качестве стабилизатора соединения, выбранного из ряда: белки, аминокислоты, поливинилпирролидоны, поли- или моносахариды, полиалкиленоксиды, аминосахара, соли.
3. Способ по п.1, отличающийся тем, что в качестве источника L-аспарагиназы используют микробную массу штамма, депонированного в ВКМП под коллекционным номером №В-10370, при этом выделение L-аспарагиназы осуществляют путем разрушения клеток на Френч-Прессе с последующим высаливанием целевого продукта сернокислым аммонием и хроматографической очисткой.
4. Способ по п.1, отличающийся тем, что ковалентной модификации полиэтиленгликолем подвергают рекомбинантную L-аспарагиназу Erwinia carotovora, нуклеотидная последовательность гена которой lanS и аминокислотная последовательность L-аспарагиназы представлены на фиг.1.