Способ прогнозирования повышения индивидуального риска развития хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца
Иллюстрации
Показать всеИзобретение относится к области медицины и касается способа прогнозирования повышения индивидуального риска возникновения хронической обструктивной болезни легких (ХОБЛ), ассоциированной с ишемической болезнью сердца (ИБС). Сущность способа заключается в том, что рассчитывают индекс курящего человека и число пачка-лет, определяют степень никотин-ассоциированного риска и соответственно интенсивность курения. Затем методом ПЦР осуществляют анализ полиморфных локусов генов GSTM 1 и GSTT 1. У лиц - носителей гомозиготных делеций GSTs - с высокой степенью никотин-ассоциированного риска прогнозируют повышение индивидуального риска возникновения хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца. Использование способа позволяет прогнозировать повышение индивидуального риска развития ХОБЛ, ассоциированной с ИБС, до развития патологического процесса или на ранних стадиях заболевания. 2 ил., 2 табл.
Реферат
Изобретение относится к области предиктивной (предсказательной) медицины, а именно к способам прогнозирования риска развития различных заболеваний дыхательной и сердечно-сосудистой систем человека, в частности к выявлению риска развития хронической обструктивной болезни легких (ХОБЛ), ассоциированной с ишемической болезнью сердца (ИБС). Изобретение может быть использовано в области предиктивной (предупредительной), диагностической и профилактической медицины.
ХОБЛ является одной из ведущих причин заболеваемости и смертности взрослого населения во всем мире и приводит к значительному экономическому и социальному ущербу [1]. Эта патология легких является широко распространенной среди лиц трудоспособного возраста во всем мире, включая контингент от 30 лет и старше. ИБС - наиболее распространенное заболевание сердечно-сосудистой системы. Удельный вес ИБС среди причин смерти от сердечно-сосудистых заболеваний (ССЗ) составляет 43-88% и резко возрастает у лиц старше 45 лет [2]. Это одна из причин временной и стойкой утраты трудоспособности населения в развитых странах мира. По данным крупных популяционных исследований риск смерти от ССЗ у больных ХОБЛ повышен в 2-3 раза и составляет примерно 50% от общего количества смертельных случаев. Учитывая общность факторов риска, наличие коморбидной патологии в виде ХОБЛ, ассоциированной с ИБС, чаще является правилом, чем исключением [3]. Сочетаемость ИБС и ХОБЛ по данным различных исследований у лиц старших возрастных групп достигает более 60%, а 15-летняя выживаемость таких пациентов составляет не более 25% [2]. Нарушение функции внешнего дыхания больных ХОБЛ с сопутствующей ИБС характеризуется более тяжелым характером респираторных расстройств, чем у больных "чистой" ХОБЛ и сопровождается более ранним развитием эмфиземы [4]. Таким образом, в связи с высоким распространением сочетания ИБС и ХОБЛ, особенно у лиц пожилого возраста, и доказанным взаимоотягощающим действием этих заболеваний необходимы более глубокие исследования в этой области с целью разработки эффективных и безопасных мер лечения и профилактики прогрессирования обоих патологических процессов.
В настоящее время диагностика ХОБЛ и ИБС осуществляется путем относительно длительных клинических наблюдений при проведении соответствующих анализов [5]. Диагностика ХОБЛ включает сбор анамнеза, учет клинических проявлений, лабораторные и инструментальные методы исследования. Цитологическое исследование мокроты, клинический анализ крови, рентгенография органов грудной клетки, анализ вентиляционной и газообменной функции легких относятся к необходимой диагностической программе обследования больных ХОБЛ. Ведущее значение в диагностике ХОБЛ имеет исследование функции внешнего дыхания, поскольку одним из главных и обязательных признаков ХОБЛ является наличие и прогрессирование бронхиальной обструкции. Спирометрия является золотым стандартом в диагностике ХОБЛ, так как ее показатели лучше всего стандартизируются, воспроизводятся и являются наиболее объективными. Согласно «Глобальной стратегии диагностики, лечения и профилактики хронической обструктивной болезни легких» [1] в настоящее время в клинической практике «золотым стандартом» диагностики процессов необратимой и обратимой обструкции бронхов остается способ функционального исследования функции внешнего дыхания (ФВД) с постбронходилятационным тестом, в частности оценка объема форсированного выдоха за 1 сек (ОФВ1) [6]. В соответствии с этим OФB1 считают своеобразным «золотым стандартом» для диагностики ХОБЛ при скрининговых исследованиях. Недостатком данного способа является то, что диагностически значимые изменения ОФВ1 выявляются гораздо позже, когда уже запущены патоморфологические процессы в бронхах, лежащие в основе ремоделинга, также имеется многообразие причин снижения ОФВ1 (кроме ХОБЛ), в частности снижение ОФВ1 может быть обусловлено внелегочными причинами: нарушением регуляции дыхания, повышением сопротивления грудной клетки, слабостью дыхательной мускулатуры и др. Для диагностики ИБС могут быть использованы различные методики: регистрация ЭКГ в покое, холтеровское ЭКГ-мониторирование, ЭхоКГ, различные нагрузочные тесты (тредмил-тест и велоэргометрия), фармакологические пробы, стресс-ЭхоКГ, радиоизотопные методы, метод серийных компьютерных томограмм, магнитно-резонансная томография с контрастированием коронарных артерий, коронароангиография. В настоящее время в клиническую практику внедрены клинические протоколы диагностики и лечения отдельно по ХОБЛ и ИБС. Однако стандарты диагностики и лечения сочетанной патологии не разработаны. Поэтому врачу в клинической практике приходится ориентироваться на диагностические критерии изолированной патологии, хотя современный уровень диагностики показал реальную возможность сочетания ХОБЛ и ИБС. К тому же в обществе имеются серьезные социальные предпосылки к одновременному развитию указанных заболеваний: широкая распространенность курения, загрязнение атмосферы различными поллютантами, стрессогенные факторы, недостаточная физическая активность, неправильное питание. Течение сочетанной патологии характеризуется определенными клиническими особенностями и неблагоприятным прогнозом. Поэтому главная задача врача на этапе диагностики - раннее выявление у больного ХОБЛ диагностических критериев ИБС. Диагностика должна носить целенаправленный характер и предиктивную направленность, осуществляться с использованием дополнительных методов исследования.
В возникновении и прогрессировании ХОБЛ и ИБС большую роль играют генетическая предрасположенность и общие факторы риска, основным из которых является курение [3]. Ключевыми звеньями при этих заболеваниях являются перекисные окисления липидов и белков, активация цитокиновых механизмов (увеличение С-протеина, интерлейкинов, фактора некроза опухоли-альфа) с вовлечением в патологический процесс иммунной, эндокринной систем с выбросом в кровь гормонов и нейромедиаторов, что сопровождается повышенным расходом энергозависимых пластических биологических субстратов в слизистых бронхов и эндотелии сосудов [7-11]. На фоне окислительного стресса происходит стимуляция надпочечников с выбросом в кровь адреналина, приводящая к вазоконстрикции, увеличению объема циркулирующей крови, общего периферического сопротивления сосудов и повышение АД, суммарно ведущих к развитию ИБС. На фоне длительно текущего патологического процесса (воспаление) в легком, в результате которого происходит перестройка бронхиального дерева и развитие эмфиземы, постепенно формируется гипертензия малого круга кровообращения с гипертрофией миокарда правого желудочка, так называемое «легочное сердце». Дыхательная гипоксемия, увеличение пред- и постнагрузки (основа ИБС) также способствуют гипертрофии и формированию соединительнотканного кардиосклероза левого желудочка с утяжелением течения ХОБЛ и ИБС [7, 9, 11, 12].
Проблема предиктивной диагностики ХОБЛ и ИБС чрезвычайно актуальна, что подтверждается следующими фактами. ХОБЛ и ИБС относится к часто встречающимся заболеваниям, причем отмечается отчетливая тенденция к увеличению. По данным Европейского респираторного общества только 25% случаев заболевания диагностируются своевременно. В США заболеваемость ХОБЛ приближается к 15 млн. человек и является одним из наиболее распространенных заболеваний, при котором смертность продолжает увеличиваться. По официальным данным в России насчитывается около 1 млн пациентов ХОБЛ, но в действительности их количество на порядок выше. Кроме того, коварство ХОБЛ заключается в медленном, но неуклонном прогрессировании, выраженная клиническая симптоматика появляется лишь в развернутой стадии заболевания. На ранних стадиях ХОБЛ протекает скрытно без постоянной клинической симптоматики. Актуальной проблемой ХОБЛ является ее предиктивная диагностика с целью своевременной профилактики, направленной на ключевые звенья патогенеза ХОБЛ. К сожалению, предиктивная диагностика и диагностика ранних стадий данной патологии в нашей стране практически отсутствует, т.к. не существует специфических генетических или биохимических маркеров определения ранних стадий этого заболевания.
Ранее некоторыми исследователями делались попытки разработать способы прогнозирования ХОБЛ с помощью лабораторных [13, 14], инструментальных [15, 16] и лабораторно-инструментальных методов [17]. Известен способ прогноза прогрессирования ХОБЛ на основе определения уровня секреции трансформирующего ростового фактора β1 (TGF-β1) и фактора роста фибробластов (bFGF) [13]. Для оценки риска развития ХОБЛ у длительно курящих лиц был предложен способ прогнозирования заболевания, основанный на определении уровня активности α1-антитрипсина и α2-макроглобулина в мокроте [14]. Способ прогнозирования стабильного течения ХОБЛ был разработан на основе учета результатов измерения ОФВ1 в л, изменения объема форсированного выдоха за первую секунду в % от исходной величины после бронхопровокационной фармакологической пробы с 0,1% раствором ацетилхолина хлорида [15]. Также был предложен способ прогноза ХОБЛ на основе измерения показателей денситометрии и планиметрии в % обоих легких, определения величины ОФВ1 в % к должному [16]. Известен способ прогнозирования бронхиальной обструкции при хроническом бронхите, который заключается в том, что используют количественные лабораторные критерии риска развития нарушений бронхиальной проходимости, включающие определение уровня ИЛ-1β в сыворотке крови, слюне и бронхоальвеолярной жидкости [17].
Существуют также способы прогнозирования течения ИБС, основанные на определении общего холестерина [18] и липидов сыворотки крови [19]. Известны способы прогнозирования течения ИБС и степени тяжести хронической сердечной недостаточности у больных ИБС на основании определения титров антигена вируса простого герпеса и противогерпетических антител и определения концентрации IgG к вирусу простого герпеса 1 типа в сыворотке крови больного [20, 21]. Существуют способы прогнозирования риска развития ИБС на основе определения типа конституции и соматических признаков дисбаланса половых гормонов путем расчета индекса соматической половой дифференциации (у женщин детородного возраста) или только инструментального метода исследования (определение сосудодвигательной функции эндотелия) [22, 23]. Известен также способ прогнозирования ИБС у шахтеров с хроническим пылевым бронхитом, учитывая следующие показатели (группа крови системы АВО, рост, конституционально-морфологический тип, наличие диагональной складки мочки уха, наличие артериальной гипертонии, курение, отягощенность по ИБС) [24].
Все выше обозначенные способы обладают существенными недостатками: они трудоемки, длительны, ограничены в использовании биологического материала, не позволяют определить предрасположенность до развития патологического процесса и на ранних стадиях заболевания. Для некоторых из них существует необходимость многократных исследований, т.к. результаты меняются на протяжении всей жизни. Эти методы также имеют один существенный недостаток - они не позволяют прогнозировать индивидуальный риск развития ХОБЛ, ассоциированной с ИБС. Кроме того, среди уже известных способов прогнозирования авторам настоящего изобретения не удалось найти способов прогноза ХОБЛ и ИБС, основанных на оценке степени никотин-ассоциированного риска в сочетании с молекулярно-генетическими показателями.
Известно, что одним из ведущих модифицируемых факторов риска развития ХОБЛ и ИБС является курение [3]. Индивидуализация ответной реакции организма на продукты сгорания табака может определяться полиморфизмом генов детоксикации ксенобиотиков. Глютатион-опосредованная детоксикация имеет ключевое значение в обеспечении резистентности клеток к перекисному окислению липидов, свободным радикалам, алкилированию белков и предотвращении поломок ДНК [25-28]. Гены глютатионтрансфераз (GSTs), в частности GSTM1 и GSTT1, играют важную роль в биотрансформации химических веществ, входящих в состав сигарет [27, 28]. В изученных доступных литературных источниках авторы не нашли упоминание о способе прогнозирования индивидуального риска развития ХОБЛ, ассоциированной с ИБС. Но в литературе имеется информация об изменении GSTs при ХОБЛ. В проведенных ранее работах иностранных и отечественных авторов изучались группы больных ХОБЛ, но без ассоциации с ИБС [1, 3, 25-28]. В статьях [29-31] изучены гены GSTM1 и GSTT1, которые играют важную роль в биотрансформации химических веществ, входящих в состав сигарет, и представляют наибольший интерес в раскрытии механизма развития ХОБЛ. Высказано предположение, что гомозиготные делеции гена GSTT1 не являются специфическими предрасполагающими факторами, но могут иметь отношение к неонкологическим легочным заболеваниям [31]. В работах [25, 26] было показано, что гомозиготная делеция (нулевой генотип) GSTM1 не всегда имеет самостоятельное значение, но в совокупности с делециями других генов (в т.ч. и глютатионтрансфераз) существенно увеличивает риск развития патологического состояния и отягощает его течение. Результаты, полученные Sram R.C. свидетельствуют в пользу большей подверженности лиц-носителей гомозиготной делеции GSTM1 риску заболеть ХОБЛ [32]. При проведении когортного исследования SAPALDIA по изучению ассоциации генов глютатионтрансфераз (GSTT1 и GSTM1) у пациентов с ХОБЛ была выявлена статистически значимая связь между изолированной гомозиготной делецией GSTT1 (или в комбинации с гомозиготной делецией GSTM1) и снижением ОФВ1 у мужчин независимо от статуса курения [25]. Исследования показали связь между полиморфизмами глютатионтрансфераз с риском развития ХОБЛ, снижением легочной функции, генотоксичным эффектом при курении табака [26, 30, 33].
В основу настоящего изобретения положена задача создать способ прогнозирования индивидуального риска развития ХОБЛ, ассоциированной с ИБС.
Учитывая то, что курение является наиболее важным фактором риска, авторы исследовали гомозиготные делеции двух генов глютатионтрансфераз GSTM1 и GSTT1, обеспечивающих детоксикацию продуктов сгорания табака. Известно, что для определения никотин-ассоциированного риска используются такие показатели как индекс курящего человека (ИКЧ) и число пачка-лет (ЧПЛ) [1]. Поэтому для выделения групп риска и проведения адекватной профилактики ХОБЛ и ИБС авторами настоящего изобретения были изучены молекулярно-генетические маркеры GSTM1 и GSTT1 в сочетании с показателями ИКЧ и ЧПЛ в группах больных с ранними стадиями ХОБЛ и ХОБЛ, ассоциированной со стабильной стенокардией, и у здоровых лиц. Анализ полиморфных локусов этих генов был выполнен с использованием метода ПЦР. Установлена высокая частота встречаемости гомозиготных делеций GSTM1 и GSTT1 у пациентов с ХОБЛ и ХОБЛ, ассоциированной с ИБС, причем нулевой генотип (гомозиготная делеция) GSTT1 достоверно связан только с наличием и с тяжестью ХОБЛ, ассоциированной со стабильной стенокардией (р менее 0.05). При наличии сочетанного нулевого генотипа глютатионтрансфераз GSTM1 и GSTT1 (а именно гомозиготная делеция по обоим генам) повышен относительный риск возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС (р менее 0.05). При сравнении же частот встречаемости гомозиготных делеций генов GSTT1 и GSTM1 у больных с ХОБЛ I-II стадий достоверных различий не обнаружено. Следовательно, выявление молекулярно-генетических маркеров может позволить использование их для выделения групп риска и проведения адекватной профилактики ХОБЛ, ассоциированной с ИБС.
Заявляемый способ заключается в том, что вначале рассчитывают такие показатели никотин-ассоциированного риска как индекс курящего человека (ИКЧ) и число пачка-лет (ЧПЛ), затем осуществляют забор биологического материала, далее выделяют ДНК, проводят детекцию нулевых генотипов GSTM1 и GSTT1 методом ПЦР с последующим гель-электрофорезом. Амплификацию ДНК проводят с использованием наборов реагентов для детекции полиморфных маркеров GSTM1 и GSTT1. Продукты амплификации анализируют с помощью электрофореза и визуализируют при помощи трансиллюминирующей гель-документирующей системы и у лиц-носителей гомозиготных делеций GSTs с высокой степенью никотин-ассоциированного риска (при ИКЧ более 120 и ЧПЛ более 20 пачка-лет) прогнозируют повышение относительного риска возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС.
При этом: а) наличие гомозиготной делеций GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска говорит о наличии относительного риска возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС; б) наличие гомозиготной делеций GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска говорит также о высоком относительном риске возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС; в) наличие гомозиготных делеций GSTM1 и GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска свидетельствует о высоком относительном риске возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС; г) наличие гомозиготных делеций GSTM1 и GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска свидетельствует об очень высоком относительном риске возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС.
Процесс исследования включал в себя следующие этапы.
1) Определение ИКЧ, ЧПЛ для оценки интенсивности курения по формулам:
ИКЧ = количество сигарет, выкуриваемых в день * число месяцев в год, в течение которого человек курит. ИКЧ более 120 - злостный курильщик.
ЧПЛ = количество сигарет, выкуриваемых в день/20 * стаж курения (годы).
ЧПЛ более 10 пачка-лет - постоянный, ЧПЛ более 20 пачка-лет - злостный курильщик.
2) Забор крови.
3) Выделение нуклеиновых кислот. ДНК выделяют из лейкоцитов периферической крови с использованием фенольно-хлороформной экстракции.
4) Собственно ПЦР или амплификация. В раствор, содержащий смесь нуклеотидов, ПЦР-буфер, полимеразу и праймеры (последовательности олигонуклеотидных праймеров и методы идентификации полиморфных аллелей уже изученных полиморфизмов GSTM1 и GSTT1 приведены в работах 27 и 28), добавляют ДНК, выделенную на первом этапе. ПЦР проводят следующим образом: сначала реакционную смесь нагревают до температуры 90-94°С, вызывая этим денатурацию ДНК; затем температуру снижают до 50-70°С в зависимости от нуклеотидной последовательности праймеров, чтобы отжиг происходил в строго комплементарных участках; наконец, в смеси устанавливают температуру, оптимальную для работы ДНК-полимеразы. При повторении этих циклов количество копий участка ДНК, находящегося между местами посадки праймеров, возрастает в геометрической прогрессии. Амплификацию ДНК проводят на амплификаторе с использованием наборов реагентов для детекции полиморфных маркеров гена GSTM1 и гена GSTT1.
5) Учет результатов. Продукты амплификации выявляют путем гель-электрофореза и визуализируют при помощи трансиллюминирующей гель-документирующей системы. Для генотипов GSTM1 и GSTT1 гомозиготные делеции определялись наличием одного амплификационного фрагмента длиной 350 п.н., а гетерозиготы и нормальные гомозиготы - двух амплификационных фрагментов длиной 480 и 350 п.н.
Авторами заявляемого способа были обследованы пациенты с ХОБЛ I-II стадий и ХОБЛ II и III стадий, ассоциированной со стабильной стенокардией напряжения I-II ФК, с фенотипическими проявлениями европейской расы, обоего пола, проживающие на территории Приморского края более 20 лет. Диагноз «ХОБЛ» установлен в соответствии с международной классификацией GOLD 2008 г. [1], диагноз «стабильная стенокардия напряжения» - в соответствии с национальными рекомендациями (2008 г.).
Согласно постбронходилатационным значениям ОФВ1 пациенты были разделены на группы: I группа - 30 пациентов с ХОБЛ I стадии (ОФВ1 более 80% от должного), II группа - 30 пациентов с ХОБЛ II стадии (ОФВ1 - от 50 до 80% от должного); III группа - 30 пациентов с ХОБЛ II стадии (ОФВ1 - от 50 до 80% от должного), ассоциированной с ИБС;
IV группа - 30 пациентов с ХОБЛ III стадии (ОФВ1=30-49% от должного), ассоциированной с ИБС. Критерии исключения: инфаркт миокарда, инсульт и другие тяжелые заболевания; злоупотребление алкоголем; лица старческого возраста и лица, неспособные понять цели и задачи исследования; отказ пациента от участия в исследовании.
Контрольная группа (n=30) сформирована из условно здоровых некурящих добровольцев с нормальными значениями ОФВ1, ОФВ1/ФЖЕЛ, АД, не являющихся родственниками добровольцев основной группы, и соответствующих основной группе по возрасту, полу, этнической принадлежности, не имеющие в анамнезе патологии бронхолегочной системы, аллергических и других хронических заболеваний.
Достоверность различий в распределении частот аллелей и генотипов между группами больных и здоровых индивидов оценивают по тесту χ2 с помощью программы BIOSTAT. Статистически значимыми считали различия при р менее 0.05. Относительный риск заболевания по конкретному признаку вычисляют как отношение шансов (ОШ): ОШ=(а×d)/(b×с), где а - частота аллеля (генотипа) в выборке больных, b - частота аллеля (генотипа) в контрольной выборке, с - сумма частот остальных аллелей (генотипов) в выборке больных и d - сумма частот остальных аллелей (генотипов) в контроле.
Среди пациентов с ХОБЛ I стадии все были злостными курильщиками с ЧПЛ более 20 пачка-лет. Среди пациентов с ХОБЛ II стадии 50% обследуемых являлись постоянными курильщиками с ЧПЛ более 10 пачка-лет, 50% - злостными курильщиками с ЧПЛ более 20 пачка-лет. Среди курильщиков без признаков ХОБЛ 25% - непостоянные курильщики (ЧПЛ менее 10 пачка-лет), 36% - постоянные (ЧПЛ более 10 пачка-лет), 39% - злостные курильщики (ЧПЛ более 20 пачка-лет). У обследованных пациентов с ХОБЛ, ассоциированной с ИБС, средний анамнез курения, а также индекс курения и число пачка-лет достоверно повышались параллельно нарастанию тяжести заболевания и снижению ОФВ1 (р менее 0.05) соответственно. Это также подтверждается данными литературы о прямой зависимости интенсивности курения и падения функции легких у курильщиков [25, 26]. Индекс курящего человека (ИКЧ) у пациентов был в среднем 153 (более 140), число пачка-лет - 26.2 пачка лет (более 20) соответственно, что свидетельствует о высокой степени никотин-ассоциированного риска и свидетельствует о высокой интенсивности курения.
Исследование полиморфизма гена GSTT1 при ХОБЛ I-II стадий. При сравнении частоты встречаемости гомозиготной делеции гена GSTT 1 была выявлена следующая распространенность: у лиц без признаков ХОБЛ 14%, при ХОБЛ I стадии 14.2%, при ХОБЛ II стадии 20%. При этом относительный риск заболеть более тяжелой стадией ХОБЛ (II стадия) возрастал в 1.5 раза согласно отношению шансов. Однако достоверности вышеуказанных различий получено не было (χ2 менее 2). При сравнении групп «злостных курильщиков» по частоте встречаемости делеции гена GSTT1, несмотря на увеличение относительного риска заболеть ХОБЛ II стадии по сравнению с неболеющими курильщиками в 1.7 раз, достоверных различий также не было найдено.
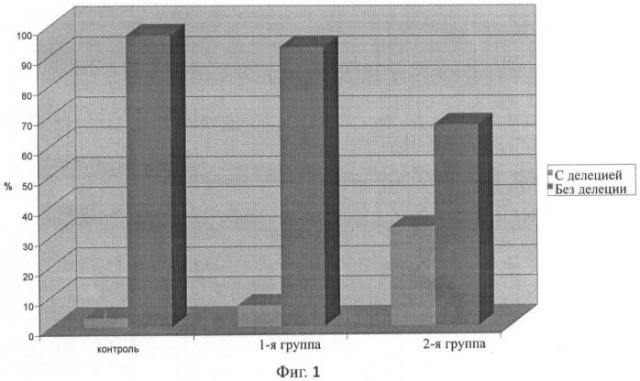
Исследование генотипа GSTT1 при ХОБЛ, ассоциированной с ИБС, показало, что в контрольной группе гомозиготная делеция выявлена у 1 человека, что составило 3.33%. В III группе наличие гомозиготной делеции GSTT1 наблюдалось у 2 пациентов (6.67%). Наибольшая же частота гомозиготной делеции GSTT1 зарегистрирована в IV группе (практически у каждого третьего пациента). Различие по частоте встречаемости делеционного генотипа GSTT1 между III и IV группами было достоверно (χ2=10, р=0.01). На фиг.1 и в таблице 1 представлено распределение генотипа по наличию/отсутствию гомозиготной делеции гена GSTT1 у больных ХОБЛ по сравнению с контролем.
| Таблица 1 | |||
| Распределение генотипа по наличию/отсутствию гомозиготной делеции гена GSTT1 у больных ХОБЛ по сравнению с контролем | |||
| Генотип GSTT1/группы | Контроль (n=30) | III группа - ХОБЛ II, ассоциир. с ИБС (n=30) | IV группа - ХОБЛ III, ассоциир. с ИБС (n=30) |
| гомозиготная делеция | 3.33% (n=1) | 6.67% (n=2) | 33.33% (n=10) |
| норма/гетерозиготная делеция | 96.67% (n=29) | 93.3% (n=28) | 66.67% (n=20) |
Примененный статистический метод ОШ показал, что нулевой генотип (гомозиготная делеция) GSTT1 существенно увеличивает относительный риск возникновения ХОБЛ по сравнению с III группой и контролем (ОШ=1.93, ОШ=0.9, ОШ=0.55 соответственно).
Исследование гомозиготной делеции GSTM1 при ХОБЛ I-II стадий. При сравнении частоты встречаемости гомозиготной делеции гена GSTM1 среди тех же групп достоверных различий выявлено не было.
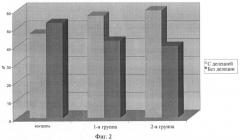
Исследование гомозиготной делеции GSTM1 при ХОБЛ, ассоциированной с ИБС, показало, что гомозиготная делеция наблюдается почти у половины (46.67%) здоровых. Нулевой генотип (гомозиготная делеция) GSTM1 выявляется в достоверно большем числе случаев в III и IV группах, чем в контроле (56.67%, 60%, 46.67% соответственно; р=0.01). Максимальное количество гомозиготных делеций GSTM1 установлено в IV группе и достоверно превышает частоту аналогичного генотипа у здоровых на 13% и на 3% у пациентов с III стадией ХОБЛ (χ2=6, р=0.01) (фиг.2).
На фиг.2 и в таблице 2 представлено распределение генотипа по наличию/отсутствию гомозиготной делеции гена GSTM1 у больных ХОБЛ по сравнению с контролем.
| Таблица 2 | |||
| Распределение генотипа по наличию/отсутствию гомозиготной делеции гена GSTM1 у больных ХОБЛ по сравнению с контролем | |||
| Генотип GSTM1/группы | Контроль(n=30) | III группаХОБЛ II, ассоциир. с ИБС (n=30) | IV группаХОБЛ III, ассоциир. с ИБС (n=30) |
| гомозиготная делеция | 46.67% (n=14) | 56.67% (n=17) | 60% (n=18) |
| норма/гетерозиготная делеция | 53.33% (n=16) | 43.33% (n=13) | 40% (n=12) |
Относительный риск заболевания (вычисленный как ОШ) был практически одинаков в III и IV группах и примерно равен единице (ОШ=0.99, ОШ=0.96% соответственно; р=0.01). Это указывает на существование равного риска заболеть ХОБЛ и ИБС при наличии гомозиготной делении GSTM1. При этом наличие нулевого генотипа (гомозиготная делеция) GSTM1, в отличие от нулевого генотипа (гомозиготная делеция) GSTT1, не связано с тяжестью ХОБЛ.
При сравнении частоты встречаемости делеции генов GSTT1 и GSTM1 у больных с ХОБЛ I-II стадий и курильщиков без признаков ХОБЛ в целом и, в частности, у курильщиков с ЧПЛ более 25 пачка-лет, достоверных различий не обнаружено. Наличие сочетанного нулевого генотипа GSTM1 и GSTT1 (гомозиготные делеции по обоим генам) встречалось у четырех больных (все больные из IV группы), что приводит к полному отсутствию соответствующих ферментов детоксикации продуктов сгорания табака.
Таким образом, полученные результаты свидетельствуют в пользу большей подверженности лиц-носителей гомозиготных делеции GSTM1 и GSTT1 риску заболеть ХОБЛ в сочетании с ИБС. Носительство гомозиготных делеций, обнаруживаемое у обследованных, более значительно и может объяснить неблагоприятное течение болезни, связанное с нарушением второй стадии обезвреживания ксенобиотиков. Наличие сочетанного нулевого генотипа GSTM1 и GSTT1 (гомозиготные делеции по обоим генам) встречалось у четырех больных (все больные из IV группы), что указывает на риск развития патологического состояния в виде сочетанной патологии - ХОБЛ, ассоциированной с ИБС, - и значительно отягощает состояние.
Технический результат, обеспечиваемый заявляемым способом, заключается в возможности прогнозирования индивидуального риска развития ХОБЛ, ассоциированной с ИБС, до развития патологического процесса или на ранних стадиях заболевания, а также в снижении трудоемкости (рассчитывают ИКЧ, ЧПЛ и ставят реакцию ПЦР), инвазивности, а как следствие, - безопасности и болезненности (производится лишь однократный забор крови); нет необходимости многократных исследований (т.к. результаты не меняются на протяжении всей жизни), отсутствуют ограничения в использовании биологического материала, таким образом, происходит уменьшение стоимости обследования в сравнении с общеклиническими традиционными методами исследования.
Сущность заявляемого способа поясняется клиническими примерами конкретного выполнения.
Пример 1.
Больная И. 44 лет, рост 166 см, вес 74 кг, с фенотипическими проявлениями европейской расы, проживающая на территории Приморского края более 20 лет. Диагноз: ХОБЛ II стадии, ассоциированной со стабильной стенокардией напряжения II ФК. ИКЧ - 143 (более 140), ЧПЛ - 21.6 пачка-лет (более 20), что свидетельствует о высокой степени никотин-ассоциированного риска (высокая интенсивность курения). При обследовании генетического статуса обнаружена гомозиготная делеция GSTT1, что свидетельствует о невозможности биотрансформации химических веществ, входящих в состав сигарет, ферментом GSTT1. Наличие гомозиготной делеции GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска (по ИКЧ и ЧПЛ) говорит о высоком относительном риске возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС, относительно среднего популяционного уровня. Если будут предприняты соответствующие меры, направленные на снижение воздействия внешних неблагоприятных факторов, то величина этого риска будет снижена.
Рекомендации: 1. Полный отказ от курения или постепенное ограничение количества выкуриваемых сигарет в день. 2. Избегать вдыхания вредных, промышленных газов, автомобильных выхлопов, не находиться в дымных, пыльных помещениях, регулярно проветривать свой дом; больше бывать на свежем воздухе.
Пример 2.
Больной Н. 54 лет, рост 168 см, вес 75 кг, пациент с фенотипическими проявлениями европейской расы, проживающий на территории Приморского края более 20 лет. Диагноз: ХОБЛ III стадии, ассоциированной со стабильной стенокардией напряжения II ФК. ИКЧ - 153 (более 140), ЧПЛ - 26.2 пачка-лет (более 20), что свидетельствует о высокой степени никотин-ассоциированного риска (высокая интенсивность курения). При обследовании генетического статуса обнаружена сочетанная гомозиготная делеция GSTT1 и GSTM1, что свидетельствует о невозможности биотрансформации химических веществ, входящих в состав сигарет, ферментами GSTT1 и GSTM1. Наличие гомозиготных делеций GSTM1 и GSTT1 в сочетании с высокой степенью никотин-ассоциированного риска (по ИКЧ и ЧПЛ) свидетельствует об очень высоком относительном риске возникновения сочетанной патологии - ХОБЛ, ассоциированной с ИБС, относительно среднего популяционного уровня. Если будут предприняты соответствующие меры, направленные на снижение воздействия внешних неблагоприятных факторов, то величина этого риска будет меньше.
Рекомендации: 1. Полный отказ от курения или постепенное ограничение количества выкуриваемых сигарет в день. 2. Избегать вдыхания вредных, промышленных газов, автомобильных выхлопов, не находиться в дымных, пыльных помещениях, регулярно проветривать свой дом; больше бывать на свежем воздухе.
Источники информации
1. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Last update 2008. www.goldcopd.org/.
2. Бова А.А., Лапицкий Д.В. Современные подходы к диагностике и лечению ишемической болезни сердца у больных хронической обструктивной болезнью легких. Медицинские новости. - 2007. - №9. - С.7-14.
3. Huiart L., Ernst P., Suissa S. Cardiovascular morbidity and mortality in COPD. Chest 2005; 128: 2640-2646.
4. Козлова Л.И. Хронические обструктивные заболевания легких и ишемическая болезнь сердца: некоторые аспекты функциональной диагностики. Пульмонология, 2001, т.11, №2, 9-12.
5. Справочник практического врача. Под ред. А.И.Воробьева, М.: Медицина, 1982, с.96-123.
6. Хронические обструктивные болезни легких. М., ЗАО Издательство Бином, СПб., Невский диалект, 1998, с.512.
7. Василькова Т., Попова Т. Медведева И. Метаболический синдром и бронхообструкция - две составляющие системного воспаления // Врач. 2008. №8, 19-21.
8. Вахрушев Я.М., Ермаков Г.И., Шараев П.Н. Оценка метаболизма основного вещества соединительной ткани при хронической обструктивной болезни легких // Тер. архив. 2006. 78 (3), 13-16.
9. Миронов Г.Е., Кривошапкина З.Н., Величковский Б.Т. Изменения функционального состояния печени в течение хронического обструктивного бронхита // Вестник Российской академии медицинских наук. 2004. 3, 13-16.
10. Шаймеева Л.О. Роль метаболических нарушений у больных с хронической бронхиальной обструкцией // Новые Санкт-Петербургские врачебные ведомости. 2002. 3, 91-93.
11. Шепеленко А.Ф., Миронов М.Б. Сидоров Ю.О. Комплексное лечение обострений хронической обструктивной болезни легких // Лечащий Врач. 2006. №8, 14-16.
12. Шляхов У.И. Хроническая обструктивная болезнь легких // Пульмонология, избранные вопросы. 2001, №2, 1-9.
13. RU 2370773 C1, 20.10.2009.
14. RU 2359618 C1, 27.06.2009.
15. RU 2262889 C1, 27.10.2005.
16. RU 2382597 C1, 27.02.2010.
17. RU 2245550 C2, 27.01.2005.
18. RU 2210078 C2, 10.08.2003.
19. RU 2210076 C2, 10.08.2003.
20. RU 2356056 C2, 20.05.2009.
21. RU 2353931 C1, 27.04.2009.
22. RU 2161441 C2, 10.01.2001.
23. RU 2241226 С1, 27.11.2004.
24. RU 2224466 C1, 27.02.2004.
25. Imboden M. et al. Glutation S-transferase genotypes modify lung protection decline in the general population: SAPALDIA cohort study. Respir. Res. 2007; 8: 2.
26. Palma S. et al. Influence of glutation-S-transferase polymorphisms on genotoxic effects induced by tobacco smoke. Mutat. Res. 2007; 633 (1): 1-12.
27. Pemble S., Schroeder K.R., Spencer S.R. Meyer D.J., Hallier E., Bolt H.M., Ketterer В., Taylor J.B. Human glutathione S-transferase Theta (GSTT1): cDNA cloning and the characterization of a genetic polymorphism. (1994) Biochem. J., 300, 271-276.
28. Seidegard J., Worachek W.R., Pero R.W., Pearson W.R. Hereditary differences in the expression of the human glutathione transferase active on trans-stilbene oxide are due to a gene deletion (1988) Proc. Natl. Acad. Sci. USA, 85, 7293-7297.
29. Chan-Yeung M. et al. Polymorfisms of glutation-S-transferase genes and functional activity in smokers with and without COPD. Int. J. Tuberc. Lung Dis. 2007; 11 (5): 508.
30. Jian-Qing He, Jian Ruan, John E. Conneff et al. Antioxidant gene polimorphisms and susceptibility to a rapid decline in lung function in smokers. Am. J. of Resp. and Crit. Care Med: 2002; 166: 323-328.
31. Ye Z., Song H., Higgins J.P.T. et al. Five glutation-S-transferase gene variants in 23,452 cases of lung cancer and 30,397 controls: meta-analysis of 130 studies. PLoS Med. 2006; 3 (4): 0524-0534.
32. Sram R.C. Effect of glutation-S-transferase Ml polymorfism on biomarkers of exposure. Environ. Hlth. Perspect. 1998; 106: 231-239.
33. Yanchina E.D., Ivtchik T.V. Associations of glutation-S-transferase M1 0/0 (GSTM1 0/0), GST1 0/0 and - 1562 C/T matrix metalloproteinase 9 (MMP9 CT) genotypes with a risk and clinical features of COPD. European Human Genetics Conference: Final Programme and Abstracts. 2006.
34. Jeffery P.K. Remodelling and inflammation of bronchi in asthma and chronic obstructive pulmonary disease. Proceeding of the ATS 2004; 1: 176-183.
Способ прогнозирования повышения индивидуального риска возникновения хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца, характеризующийся тем, что рассчитывают показатели никотин-ассоциированного риска, такие как индекс курящего человека и число пачка-лет, затем осуществляют забор крови, далее выделяют ДНК, затем методом ПЦР осуществляют анализ полиморфных локусов генов GSTM1 и GSTT1, далее продукты амплификации анализируют с помощью электрофореза, визуализируют при помощи трансиллюминирующей гель-документирующей системы и у лиц - носителей гомозиготных делеций GSTs с высокой степенью никотин-ассоциированного риска прогнозируют повышение относительного риска возникновения сочетанной патологии - хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца.