Система магнитного распознавания
Иллюстрации
Показать всеИзобретение относится к меткам магнитного распознавания и касается метки для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающей: (а) распознающую составляющую для присоединения метки к аналиту и (b) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества; причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок или металлсвязывающий домен белка. Изобретение обеспечивает улучшенную метку для аналита, которую можно выгодно использовать, например, в микрофлюидном или нанофлюидном устройстве. 7 н. и 18 з.п. ф-лы, 21 ил., 3 табл.
Реферат
Настоящее изобретение относится к меткам магнитного распознавания, способным присоединять небольшие количества магнитного (или намагничиваемого) вещества к аналиту при помощи распознающего агента для этого аналита. Такие метки обладают значительными преимуществами в том, что они способны присоединить очень небольшой объем магнитного вещества к аналиту, так что аналит может подвергаться воздействию магнитных полей, даже в ограниченном пространстве, таком как в микрофлюидной системе. Наличие магнитного вещества делает возможным более сложное пространственное манипулирование аналитом, что особенно благоприятно в микрофлюидной системе. Изобретение также относится к продуктам, способам и применениям, имеющим отношение к таким меткам.
Хорошо известно, что магнитные «бусы» можно использовать для контроля за молекулами, которые вовлечены в способы тестирования (см., например, US 2006/084089). Как правило, такие бусы присоединяют к молекуле (такой как антитело), которая может распознавать аналит и связываться с ним. Магнитные свойства бус используют для управления или пространственного манипулирования аналитом, например для отделения аналита от других молекул в образце.
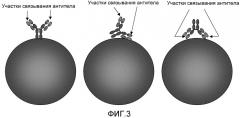
Однако магнитные бусы не подходят для всех систем. Совсем недавно появилась возможность работать со сверхмалыми количествами образца, используя микрофлюидные или нанофлюидные устройства. Такие устройства способны анализировать определенные вещества в очень маленьком образце, таком как капля крови от укола. Размеры каналов в таких устройствах зачастую могут быть слишком небольшими для того, чтобы удовлетворительно вмещать магнитные бусы, даже несмотря на то, что такие бусы можно сделать в микрометровом масштабе, либо из-за того, что они больше, чем каналы, либо из-за того, что они приводят к забиванию или закупорке каналов. Это описано подробнее на сайте www.deas.harvard.edu/projects/weitzlab/wyss.preprint.2006.pdf. Хотя небольшие бусы обладают большим отношением площади поверхности к объему (Таблица 1), особенно небольшие бусы или частицы могут испытывать стерическое затруднение, при котором присоединенный белок блокирует присоединение другого белка. Это становится особенно проблематичным из-за беспорядочной пространственной организации антител или других распознающих сущностей, демонстрируемой при их присоединении к частице. Это дополнительно усугубляется, так как при соединении белка с поверхностью магнитной бусины или частицы необходимая ориентация белка может быть неоптимальной (смотри Фиг. 3).
| Таблица 1Сравнение отношения площади поверхностик объему для бус 3 мкм и 50 нм | |||
| Площадь поверхности(SA) (4πr2) | Объем (V) ([4/3] πr3) | Отношение SA:V | |
| бусы 3 мкм | 4π(1,5)2=28 мкм2 | (4/3)xπx(1,5)3 =14 мкм3 | 2:1 |
| бусы 50 нм (или 0,05 мкм) | 4π(0,025)2=7,8×10-3 мкм2 | (4/3)π(0,025)3=6,5×10-5 мкм3 | 120:1 |
Предпринимались попытки связывания меньших магнитных частиц с белками, несмотря на то, что это пока не получило большого внимания для микрофлюидных и нанофлюидных целей. Например, опубликованная PCT-заявка WO 2006/104700 описывает магнитные белковые наносенсоры, которые можно использовать в матрицах для детектирования аналитов в жидком образце. В этой системе используют слитый белок, как правило, содержащий ген хвостового отростка фага T4, модифицированный для содержания дополнительных функциональных групп (например, лигандов пептидного дисплея), которые будут связывать парамагнитные наночастицы.
Подобным образом, WO 2004/083902 раскрывает зонды магнитных наночастиц для внутриклеточного магнитного отображения. Как правило, эти зонды формируют из самособирающихся покрывающих материалов, окружающих магнитный материал, таких как мицеллы, липосомы или дендримеры. Поверхность инкапсулированных магнитных частиц можно присоединить к доставляющему лиганду, такому как пептид. Аналогичная система раскрыта в патенте США 5958706, который относится к магнитным частицам, инкапсулированным внутри органической мембраны (такой как фосфолипидная мембрана) и присоединенным к белку мембраны. В работе Томоко Йосино и др. (Tomoko Yoshino et al.) “Efficient and stable display of functional proteins on bacterial magnetic particles using mms13 as a novel anchor molecule”, Applied and Environmental Microbiology, Jan. 2006, p. 465-471, раскрыт способ белкового отображения на бактериальных магнитных частицах. Магнитные частицы также покрывают липидной бислойной мембраной, и новый белок mms13 связывается с этими частицами.
Была проведена некоторая работа по вирусной инкапсуляции магнитных наночастиц. US 2006/0240456 раскрывает инкапсуляцию магнитного кобальта внутри белковой оболочки вирусного капсида бактериофага T7.
В отдельной разработке было открыто, что некоторые белки обладают способностью непосредственно связываться с ионами металлов. Мелдрум и др. (Meldrum F.C. et al.) сообщили о таких белках в Science, 257(5069) 522-3, 1992 “Magnetoferritin: in vitro synthesis of a novel magnetic protein”. Другая работа из этой области включает Martinez, J. S., et al. 2000. “Self-Assembling Amphiphilic Siderophores from Marine Bacteria.” Science 287 1245-47. Более отдаленная работа включает следующую: Zborowski et al. 1996. “Immunomagnetic isolation of magnetoferritin-labelled cells in a modified ferrograph.” Cytometry 24:251-259 раскрывает, что биотинилированные антитела к различным клеточным мишеням и биотинилированный магнетоферритин были соединены при помощи авидинового мостика.
Другие раскрытия в этой области включают: Inglis, et al. 2004. “Continuous microfluidic immunomagnetic cell separation.” Applied physics letters. 85 (21) 5093-5; Inglis et al. 2006. “Microfluidic high gradient magnetic cell separation.” Journal of Applied Physics 99; Lambert et al. 2005. “Evolution of the transferrin family: Conservation of residues associated with iron and anion binding.” Comparative Biochem and Physiol, (B) 142 129-141; Gider et al. 1995. “Classical and quantum magnetic phenomena in natural and artificial ferritin proteins.” Science. 268 77-80; Haukanes, B.I. and Kvam, C. 1993. “Application of magnetic beads in bioassays.” Biotechnology (N Y). 11 (1) 60-3; Olsvik, O. et al. 1994. “Magnetic separation techniques in diagnostic microbiology.” Clin Microbiol Rev. 7 (1) 43-54; Archer, M.J. et al. 2006, “Magnetic bead-based solid phase for selective extraction of genomic DNA.” Anal Biochem. doi:10.1016/j.ab.2006.05.005; Schneider, T. et al. 2006. “Continuous flow magnetic cell fractionation based on antigen expression level.” J Biochem Biophys Methods. 68 (1) 1-21; Ramadan, Q. et al. 2006, “An integrated microfluidic platform for magnetic microbeads separation and confinement.” Biosens Bioelectron. 21 (9) 1693-702; Cotter, M.J., et al. 2001. “A novel method for isolation of neutrophils from murine blood using negative immunomagnetic separation.” Am J Pathol. 159 (2) 473-81; http://www.newscientist.com/article.ns?id=dn3664; и Chang, C.C., et al. 2006, “Mn,Cd-metallothionein-2: a room temperature magnetic protein.” Biochem Biophys Res Commun. 340 (4) 1134-8. В этой последней статье манипулировали небольшим ионсвязывающим белком металлотионеином-2 (MT) для связывания кадмия и марганца вместо цинка, тем самым делая белок магнитным.
Другое предшествующее раскрытие включает: Odette et al. 1984, “Ferritin conjugates as specific magnetic labels.” Biophys. J. 45 1219-22; Yamamoto et al. 2002, “An iron-binding protein, Dpr, from Streptococcus mutans prevents iron-dependent hydroxyl radical formation in vitro.” J Bacteriol. 184 (11) 2931-9; и Ishikawa et al. 2003, “The iron-binding protein Dps confers hydrogen peroxide stress resistance to Campylobacter jejuni.” J Bacteriol. 185 (3) 1010-17.
CA 2521639 раскрывает применение ферритина для удаления загрязняющих ионов из раствора. Ферритин образует часть большей структуры, которая также содержит другие ионообменные вещества (например, порфирины или краун-эфир). Другие ионообменные вещества предназначены для удаления загрязнений, в то время как магнитные свойства ферритина используются для удаления этих веществ из раствора.
Патент Соединенных Штатов 7097841 раскрывает слитые с ферритином белки для применения в вакцинах, помимо других применений.
Несмотря на обширные открытия в области магнитных частиц и наночастиц, изложенные выше, существует постоянная потребность в более простых и эффективных метках магнитных частиц для применения в микрофлюидных и нанофлюидных системах.
Цель настоящего изобретения состоит в том, чтобы решить вышеописанные проблемы и улучшить известные продукты и способы, такие как охарактеризованные в общих чертах выше. Другая цель настоящего изобретения состоит в том, чтобы предложить улучшенную метку для аналита, которую можно было бы выгодно использовать, например, в микрофлюидном или нанофлюидном устройстве. Еще одна цель настоящего изобретения состоит в том, чтобы предложить способы, наборы и применения, в которых используются такие метки.
Таким образом, настоящее изобретение предлагает метку для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающую:
(a) распознающую составляющую для присоединения метки к аналиту; и
(b) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид.
Авторы изобретения неожиданно установили, что количества магнитного или намагничиваемого вещества, достаточно небольшие для того, чтобы быть пригодными для использования в микрофлюидных и/или нанофлюидных устройствах, можно присоединить к выбранному аналиту путем включения атомов или ионов металлов (или содержащих их соединений) в металлсвязывающий белок, полипептид или пептид, который присоединен к распознающему агенту, который, в свою очередь, может присоединяться к аналиту. Таким образом, метки по настоящему изобретению включают по меньшей мере две составляющие: распознающую составляющую для присоединения метки к желаемому аналиту и составляющую для связывания магнитного или намагничиваемого вещества. Эти метки просто очищать с использованием устоявшихся методик, таких как аффинная очистка или очистка в магнитном поле.
Когда распознающие составляющие являются одновалентными, они исключают проблемы, возникающие из-за перекрестного связывания с рецепторами на поверхностях клеток (в отличие от антител). Авторы изобретения также преодолели проблемы «забивания», встречающиеся в известных способах, путем присоединения белков-мишеней непосредственно (или опосредованно) к намагничиваемым белкам с использованием устоявшихся подходов молекулярной биологии.
Метки по настоящему изобретению обладают тем дополнительным преимуществом, что их можно намагничивать или размагничивать с использованием простых химических методик.
Особенно предпочтительным является то, что эти метки представляют собой слитые белки. В контексте настоящего изобретения слитый белок представляет собой белок, который был экспрессирован как рекомбинантный белок с единой целостностью. Слитые белки обладают рядом дополнительных преимуществ. Ориентация распознающего плеча слитого белка (например, scFv) в рамках изобретения будет контролироваться, и, соответственно, белок с большей вероятностью будет связываться со своей мишенью. Слитые белки также облегчают возможность включения множества распознающих составляющих в один слитый белок. Эти участки распознавания могут быть направлены на одну и ту же мишень или на различные мишени. Если присутствуют две или более распознающих составляющих, то можно задавать и контролировать пространственную организацию распознающих составляющих на магнитном веществе, уменьшая проблемы, вызываемые стерическим затруднением и случайным связыванием в случае с общепринятыми бусами. Тщательным разнесением каждой распознающей составляющей внутри слитого белка (например, путем включения спейсера нуклеиновых кислот в систему экспрессии) третичную структуру конечного белка можно контролировать для размещения распознающих составляющих в выбранных пространственно зонах по поверхности белка. Другим преимуществом использования слитых белков является то, что число распознающих составляющих внутри каждой метки может быть точно заданным и будет идентичным для каждой молекулы метки. Это контрастирует с общепринятыми средствами присоединения распознающих составляющих к магнитным бусам, где из-за случайного характера присоединения значительно более сложно точно задать число распознающих составляющих, и поэтому будет иметь место значительное варьирование по их числу, которые присоединены к каждой магнитной бусинке.
Под термином «присоединенный к» в настоящем контексте подразумевают, что присоединение представляет собой присоединение любого типа, включая специфическое и неспецифическое связывание, а также инкапсуляцию. Таким образом, составляющая для связывания магнитного или намагничиваемого вещества должна быть способна связывать или инкапсулировать (или как-то иначе присоединять специфическим или неспецифическим образом) вещество в форме частиц, или агрегатов, или им подобных. Эти частицы или агрегаты являются много меньшими, чем общепринятые магнитные бусы, как правило, имея менее чем 100000 атомов, ионов или молекул, более предпочтительно, менее чем 10000 атомов, ионов или молекул, а наиболее предпочтительно, менее чем 5000 атомов, ионов или молекул, в целом связанных или инкапсулированных с упомянутой (или каждой) составляющей. Наиболее предпочтительные вещества способны к связыванию до 3000 атомов, ионов или молекул и, в частности, приблизительно 2000 или менее, или 500 или менее таких частиц.
В одном конкретном примере, использованном в изобретении, металлическая компонента ферритина (белковая оболочка из 24 субъединиц) состоит из 8-нанометрового (8×10-9 м) неорганического ядра. Каждое ядро содержит приблизительно 2000 атомов Fe. В другом примере, Dpr, из мутантов Streptococcus (оболочка из 12-субъединиц), состоит из 9-нанометровой оболочки, содержащей 480 атомов Fe. В другом примере лактоферрин связывает 2 атома Fe и содержит железо, связанное с гемом (в противоположность ферритину, который связывает молекулы железа внутри своего ядра). Металлотионеин-2 (MT) связывает 7 двухвалентных переходных металлов. Ионы цинка внутри MT замещаются Mn2+ и Cd2+ с образованием магнитного белка при комнатной температуре. MT может быть модифицирован для включения еще одного или более дополнительных металлсвязывающих участков, что усиливает магнетизм Mn,Cd-белка MT.
В соответствии с этими окружениями связывания общий объем вещества, связанного с или инкапсулированного в одной составляющей, как правило, не превышает 1×105 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 58 нм или менее). Более предпочтительно, вещество может иметь общий объем не более 1×104 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 27 нм или менее). Еще более предпочтительно, вещество может иметь общий объем не более 1×103 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 13 нм или менее). Наиболее предпочтительно, вещество может иметь общий объем не более 100 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 6 нм или менее). Однако размер частиц можно определить по среднему диаметру как альтернативе объему. Таким образом, в настоящем изобретении также предпочтительно, чтобы средний диаметр связанных частиц составлял 50 нм или менее, 40 нм или менее, 30 нм или менее, 20 нм или менее или, наиболее предпочтительно, 10 нм или менее. В данном контексте «средний» означает сумму диаметров у данного числа частиц, деленную на число частиц.
Настоящее изобретение далее будет описано более подробно только в качестве примера со ссылкой на следующие фигуры:
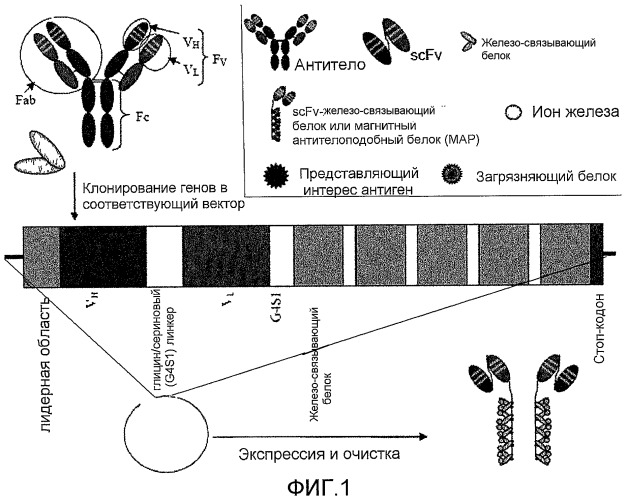
Фиг. 1: данная фигура демонстрирует, каким образом соответствующие гены клонируют в вектор с целью получения меток по настоящему изобретению. Число единиц намагничиваемого белка в конечной метке можно контролировать путем включения стольких копий соответствующего гена, сколько необходимо. В данный пример включены только гены для VH- и VL-областей антитела, так что в конечный предпочтительный химерный белок включена scFv-часть антитела, а не полное антитело.
VH- и VL-области можно клонировать путем амплификации соответствующих генов (матричной РНК), используя обратную транскрипцию с последующей полимеразной цепной реакцией (ПЦР) с клонов моноклональной гибридомы, или генных библиотек (фагового дисплея) в соответствующем экспрессионном векторе. Гены соединены при помощи серии небольших аминокислот (например, четыре остатка глицина и один остаток серина) для обеспечения корректного совмещения родственных друг другу полипептидов и образования участка связывания без помехи со стороны области линкера. Ген(ы) для намагничиваемого белка затем клонируют либо непосредственно после scFv, либо отделяют линкером из аминокислот, как описано выше. При необходимости с целью выделения слитого белка можно включить очистку при помощи тэг (такого как гексагистидин, глутатион-s-трансфераза, β-галактозидаза, гемаглютинин, зеленый флуоресцентный белок и т.д.). В конец гена слитого белка вставляют стоп-кодон, а затем - участок полиаденилирования. Если выбранный намагничиваемый белок состоит из многих субъединиц (такой как ферритин или Dpr), то предусматривается, что гены, кодирующие эти субъединицы, будут следовать за или предшествовать scFv. Также может быть целесообразным встроить гены scFv внутрь генов намагничиваемого белка, чтобы локализовать аминокислотную последовательность scFv на удобно расположенной части намагничиваемого белка, которая находится не на амино- или карбоксильном конце. Если выбран мономерный белок (такой как MT), множественные копии scFv и/или генов металлсвязывающих составляющих можно клонировать тандемно в экспрессионный вектор (как на Фиг. 1). Положение scFv и металлсвязывающих составляющих внутри экспрессированного слитого белка можно задать и контролировать по генетической последовательности. Что касается мультимерных белков, то может быть целесообразно встроить гены scFv внутрь генов намагничиваемого белка, чтобы локализовать аминокислотную последовательность scFv на удобно расположенной части намагничиваемого белка, которая находится не на амино- или карбоксильном конце. Затем вектор вводят в систему экспрессии, такую как линия клеток млекопитающего или насекомого, или в хозяина на основе дрожжей или бактерий для экспрессии. Слитый белок собирают соответствующими способами (седиментация, иммунопреципитация, аффинная очистка, жидкостная хроматография высокого давления или быстрого разрешения и т.д.). Очищенный слитый белок затем модифицируют, используя устоявшиеся способы намагничивания белков (Chang et al., Meldrum et al.).
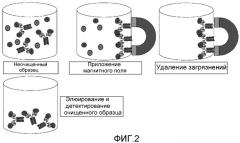
Фиг. 2: эта фигура схематически демонстрирует способ очистки с использованием меток по настоящему изобретению. Представляющий интерес аналит метят с использованием меток по настоящему изобретению, которые связаны с ионами. Магнитное поле прикладывают для предохранения связанного аналита от вымывания, в то время как все загрязнения удаляются. Остается очищенный образец, который можно анализировать (например, детектировать), если требуется.
Фиг. 3: эта фигура демонстрирует, что поскольку доступные в настоящее время коммерческие покрытые антителами бусы производят путем ковалентного сопряжения антител с бусами, существует возможность неправильной ориентации антител, в связи с чем уменьшается эффективность связывания.
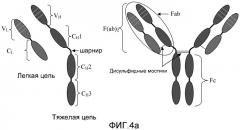
Фиг. 4a и 4b: эти фигуры схематически иллюстрируют упрощение структуры антител, таких как IgG. После протеазной обработки при помощи ферментов, таких как папаин, антитела расщепляются на 3 части близко к области шарнира. Поскольку часть антител с эффекторной функцией (шарнир, CH2 и CH3) относительно легко кристаллизовать для рентгенографического дифракционного анализа, эта часть стала известна как область кристаллизующегося фрагмента (Fc). Связывающиеся с антигеном части антител известны как фрагмент антитела (Fab). После ферментативного расщепления Fab-фрагменты можно соединить в области шарнира, вследствие чего образуется F(ab)2-фрагмент. Другие антитела могут отличаться по числу доменов в Fc-области и вариациями в области шарнира.
Фиг. 5a и 5b: эти фигуры демонстрируют конструирование слитого белка scFv-ферритин.
Фиг. 6a и 6b: эти фигуры демонстрируют конструирование слитого белка scFv-MT2.
Фиг. 7: эта фигура демонстрирует конструирование scFv-фрагмента.
Фиг. 8: эта фигура демонстрирует конструирование кДНК-библиотеки. Для того чтобы сконструировать кДНК-библиотеку из образца ткани, мРНК экстрагируют, превращают в кДНК при помощи обратной транскрипции и лигируют в плазмидные векторы. Эти векторы затем используют для трансформации бактериальных клеток. Трансформированные клетки хранят замороженными до тех пор, пока они потребуются. Замороженные клетки можно размножать путем наращивания в соответствующей среде и очищать плазмиды. Представляющие интерес гены для дальнейшего анализа можно затем амплифицировать при помощи ПЦР с использованием специфических пар праймеров.
Фиг. 9a и 9b: эти фигуры демонстрируют ПЦР-ампликоны генов тяжелой (H) и легкой (L) цепи ферритина и частично перекрывающиеся ПЦР-продукты генов тяжелой и легкой цепи ферритина соответственно. Фиг. 9c демонстрирует результаты ПЦР с колоний, клоны 1, 3 и 4 были отобраны для секвенирования.
Фиг. 10a и 10b: эти фигуры показывают гель, демонстрирующий продукты ПЦР-амплификации scFv против фибронектина и полигена тяжелой и легкой цепи ферритина (помечено стрелкой), и гель, демонстрирующий перекрывающиеся ПЦР-продукты, соответственно.
Фиг. 11: эта фигура показывает гель, демонстрирующий результаты ПЦР-скрининга числа клонов, трансформированных плазмидами, которые были лигированы со слитыми конструкциями scFv:ферритин.
Фиг. 12: эта фигура демонстрирует окрашенный Кумасси синим гель и Вестерн-блот клеточных лизатов соответственно. Обозначения: 1. Ферритин 2 часа индукции; 2. Ферритин 3 часа индукции; 3. Ферритин 4 часа индукции; 4. Белковый маркер Benchmark (Invitrogen).
Фиг. 13: эта фигура показывает гель, демонстрирующий продукт ПЦР-амплификации MT2 из библиотеки печени человека.
Фиг. 14: эта фигура демонстрирует анализ колоний клонов, трансформированных плазмидой, содержащей конструкцию scFv:MT2.
Фиг. 15: эта фигура демонстрирует (соответственно) окрашенный Кумасси гель и Вестерн-блот scFv:MT2 (помечено стрелкой).
Фиг. 16: эта фигура демонстрирует фотографии окрашенного Кумасси синим геля и Вестерн-блот (соответственно) повторно растворенных слитых белков scFv:ферритин и scFv:MT2. Слитые белки обведены кружками - ферритин присутствует в дорожке 2 на обоих гелях и MT2 присутствует в дорожке 3 на обоих гелях. Белковый маркер молекулярных масс представлен в дорожке 1.
Фиг. 17a и 17b: эти фигуры демонстрируют наложенные сенсограммы SPR-анализа связывания слитых белков MT2 и ферритина соответственно.
Фиг. 18: эта фигура демонстрирует магнитный характер магнетоферритина, производимого для применения в настоящем изобретении.
Фиг. 19: эта фигура демонстрирует концентрацию ферритина при производстве и концентрацию магнетоферритина. Обозначения: MF; Магнетоферритин: ft; фильтрат: Pre; концентрированный на колонке Macs® магнетоферритин перед диализом: post; концентрированный на колонке Macs® магнетоферритин после диализа.
Фиг. 20: эта фигура демонстрирует связывание scFv:ферритин и прогретого scFv:ферритин с фибронектином.
Фиг. 21a и 21b: эти фигуры демонстрируют измеренные значения оптической плотности, зарегистрированные при помощи прибора Varioskan Flash, на намагниченном слитом белке. После концентрирования белок по-прежнему распознается моноклональными антителами к ферритину (21a) и намагниченный слитый белок анти-фибронектин:ферритин сохраняет способность связывания со своим антигеном-мишенью (21b).
Составляющая для связывания магнитного или намагничиваемого вещества особо не ограничена, при условии, что она способна связывать это вещество и не мешает связыванию с аналитом. Составляющая для связывания магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид (или металлсвязывающий домен такого белка, полипептида или пептида). Как правило, эта составляющая способна связываться с или связывается с одним или более атомами и/или ионами переходного металла и/или лантаноида или любым соединением, содержащим такие ионы. Такие ионы включают, но не ограничиваются ими, любые один или более ионов Fe, Co, Ni, Mn, Cr, Cu, Zn, Cd, Y, Gd, Dy или Eu.
В более предпочтительных вариантах осуществления изобретения упомянутые один или более ионов металла включают любой один или более из Fe2+, Fe3+, Co2+, Co3+, Mn2+, Mn3+, Mn4+, Cd2+ и Ni2+. Наиболее предпочтительными ионами для применения в настоящем изобретении являются ионы Fe2+ и Fe3+ и Cd2+ и Mn2+. Как правило, эти ионы связываются лактоферрином, трансферрином и ферритином в случае железа и металлотионеином-2 в случае кадмия и марганца. Связывание Fe2+ предпочтительно ускоряется при использовании кислых условий, в то время как связывание Fe3+ предпочтительно ускоряется при использовании нейтральных или щелочных условий.
В предпочтительных вариантах осуществления изобретения металлсвязывающая составляющая включает белок или металлсвязывающий домен белка, выбранный(ого) из лактоферрина, трансферрина, ферритина (апоферритина), металлотионеина (MT1 или MT2), белка, связывающего ионы трехвалентного железа (FBP, например, из Haemophilus influenzae), фратаксина и сидерофоров (очень небольших пептидов, функция которых состоит в транспорте железа через бактериальные мембраны).
В некоторых вариантах осуществления метки по изобретению могут включать множество составляющих для связывания магнитного или намагничиваемого вещества. Число таких составляющих можно контролировать так, чтобы контролировать магнитные свойства метки. Как правило, в таких вариантах осуществления метки могут включать от 2 до 100 таких составляющих, предпочтительно, от 2 до 50 таких составляющих, а наиболее предпочтительно, от 2 до 20 таких составляющих для связывания магнитного или намагничиваемого вещества. В конечном химерном белке каждая копия металлсвязывающего белка может для гибкости присоединяться к следующей линкерными последовательностями незаряженных аминокислот.
Также в изобретение включены наборы меток, причем каждая метка в наборе обладает отличным (уникальным) числом металлсвязывающих составляющих. Эти наборы меток выгодны потому, что они могут давать возможность обрабатывать множество аналитов из одного или более образцов одновременно.
Распознающая составляющая особо не ограничена, при условии, что она способна связывать представляющий интерес аналит. Как правило, аналиты, с которыми эта составляющая должна связываться, выбирают из биологической молекулы (натуральной или синтетической), возбудителя инфекции или компонента возбудителя инфекции (такого как вирус, или частица вируса, или компонент вируса), клетки или клеточного компонента, и небольшой молекулы, такой как эндогенная или экзогенная небольшая молекула (например, метаболит, или фармацевтический препарат, или лекарственное средство). В настоящем контексте небольшая молекула означает молекулярный химикат, такой как биологически активная молекула, который не является полимером или олигомером (в отличие от белка, нуклеиновой кислоты, полипептида или других биологических олигомеров и полимеров), таким как метаболит, фармацевтический препарат, лекарственное средство, углеводород, липид, жир или подобный. Как правило, небольшая молекула обладает массой 2000 Да или менее. Точнее, является предпочтительным, чтобы аналиты, с которыми эта составляющая должна связываться, включали вирус, или частицу вируса, или компонент вируса, белок, полипептид, гликопротеин, нуклеиновую кислоту, такую как ДНК или РНК, олигонуклеотид, метаболит, углеводород, такой как сложный углеводород, липид, жир или фармацевтический препарат или лекарственное средство. Эти аналиты включают остатки сахаров, производимые бактериями (например, сиаловая кислота), и сахаридные оболочки многих бактерий/вирусов, а также измененные сахара, присутствующие в некоторых опухолях на их гликопротеинах. Любые один или более из этих аналитов предпочтительны для применения в способах по настоящему изобретению.
Распознающая составляющая, которая способна связываться с вышеуказанными аналитами, сама по себе может являться любого типа веществом или молекулой, при условии, что она пригодна для связывания с представляющим интерес аналитом. Как правило, распознающую составляющую выбирают из антитела или фрагмента антитела, рецептора или фрагмента рецептора, белка, полипептида, пептидомиметика, нуклеиновой кислоты, олигонуклеотида и аптамера. В более предпочтительных вариантах осуществления изобретения распознающую составляющую выбирают из вариабельной полипептидной цепи антитела (Fv), рецептора T-клеток или фрагмента рецептора T-клеток, авидина и стрептавидина. Наиболее предпочтительно, распознающую составляющую выбирают из одной цепи вариабельной части антитела (sc-Fv).
Антитела представляют собой молекулы иммуноглобулинов, вовлеченные в распознавание чужеродных антигенов и экспрессируемые у позвоночных. Антитела продуцируются специализированным типом клеток, известным как В-лимфоцит или B-клетка. Индивидуальная B-клетка продуцирует только один вид антител, который нацелен на единственный эпитоп. При встрече B-клетки с антигеном она распознает, она делится и дифференцируется в продуцирующую антитела клетку (или плазматическую клетку).
Основная структура большинства антител состоит из четырех полипептидных цепей двух различных типов (Фиг. 4). Меньшая (легкая) цепь обладает молекулярной массой 25 килодальтонов (кДа), а большая (тяжелая) цепь - молекулярной массой 50-70 кДа. Легкие цепи имеют одну вариабельную (VL) и одну константную (CL) область. Тяжелые цепи имеют одну вариабельную (VH) и 3-4 константных (CH) области, в зависимости от класса антитела. Первая и вторая константные области на тяжелой цепи отделены шарнирной областью переменной длины. Две тяжелые цепи соединены вместе в шарнирной области через дисульфидные мостики. Области тяжелой цепи после шарнира также известны как Fc-область (кристаллизующийся фрагмент). Комплекс легкой цепи и тяжелой цепи до шарнира известен как область Fab (фрагмент антитела) с двумя участками связывания антител, вместе известными как область F(ab)2. Константные области тяжелой цепи способны связываться с другими компонентами иммунной системы, включая молекулы системы комплемента и рецепторы антител на клеточных поверхностях. Тяжелые и легкие цепи антител образуют комплекс, часто связанный дисульфидным мостиком, который вариабельным концом способен связываться с некоторым данным эпитопом (Фиг.4).
Вариабельные гены антител образуются путем мутации, соматической рекомбинации (также известной как перетасовка генов), генной конверсии и событий добавления нуклеотидов.
Антитела ScFv могут образовываться против огромного числа мишеней, включая:
1. Вирусы: Torrance et al. 2006. Oriented immobilisation of engineered single-chain antibodies to develop biosensors for virus detection. J Virol Methods. 134 (1-2) 164-70;
2. Вирус гепатита C: Gal-Tanamy et al. 2005. HCV NS3 serine protease-neutralizing single-chain antibodies isolated by a novel genetic screen. J Mol Biol. 347 (5):991-1003), and Li and Allain. 2005. Chimeric monoclonal antibodies to hypervariable region 1 of hepatitis C virus. J Gen Virol. 86 (6) 1709-16;
3. Злокачественные опухоли: Holliger and Hudson. Engineered antibody fragments and the rise of single domains. Nat Biotechnol. 23 (9) 1126-36,
и могут использоваться для различных применений, включая протеомику (Visintin et al. 2004. Intracellular antibodies for proteomics. J Immunol Methods. 290 (l-2):135-53).
Таким образом, в своих наиболее предпочтительных вариантах осуществления настоящее изобретение использует многосоставляющую метку, как правило, образованную из одного или более антигенсвязывающих плеч одного или более антител для распознавания одного или более аналитов и одной или более копий металлсвязывающего белка, присоединенного к антигенсвязывающему плечу. Как правило, используемый фрагмент антитела включает вариабельные области тяжелой и легкой цепей, VH и VL, соединенные гибким линкером с образованием одноцепочечного пептида (sc), обычно обозначаемого scFv. Когда обе составляющие в метке образованы из белка и/или полипептидов (т.е. метка включает химерный белок), метка может быть образована с использованием рекомбинантных методик, которые хорошо известны в данной области. Иллюстрация этого представлена на Фиг. 1. Однако, если любая из составляющих будет образована из других видов веществ, метки могут быть получены путем простого присоединения одного вещества к другому.
Таким образом, настоящее изобретение также предлагает способ образования охарактеризованной выше метки для аналита, включающий соединение вместе распознающей составляющей для присоединения метки к аналиту и составляющей для связывания магнитного или намагничиваемого вещества.
Далее, настоящим изобретением предлагается способ обработки образца, причем этот способ включает:
(a) контактирование образца с меткой для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающей:
- распознающую составляющую для присоединения метки к аналиту; и
- составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
(b) подвергание метки магнитному полю для воздействия на метку;
(c) необязательно анализирование метки и/или аналита для получения информации об аналите, который может быть присоединен к метке,
при этом составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид.
В одном предпочтительном примере вышеуказанного способа магнитное поле можно использовать для отделения, очистки и/или выделения метки и/или любого аналита, который может быть присоединен к метке, от/из одного или более дополнительных веществ в образце. В этом случае стадия анализа не существенна, поскольку цель очистки может быть достигнута без анализа. В других предпочтительных способах стадия анализа осуществляется и, как правило, включает детектирование наличия, отсутствия, идентичности и/или количества присоединенного к метке аналита.
Настоящее изобретение также предлагает применение охарактеризованной выше метки в способе очистки нуклеиновой кислоты, олигонуклеотида, белка, полипептида, возбудителя инфекции (например, вируса, частицы вируса или компонента вируса) или клетки. Метки предпочтительно используют в сэндвич-тестах, таких как тесты, проводимые в микрофлюидном устройстве и/или биосенсоре.
К тому же, настоящим изобретением предложено применение составляющей для связывания магнитного или намагничиваемого вещества, причем эта составляющая включает металлсвязывающий белок, полипептид или пептид, и при этом применение осуществляют с использованием микрофлюидного или нанофлюидного устройства.
Различные составляющие, включая металлсвязывающие белки, антитела и слитые белки, используемые в настоящем изобретении, далее будут описаны более подробно.
Два металлсвязывающих белка были определены в качестве хороших примеров для дальнейшей иллюстрации настоящего изобретения. Ими были ферритин и металлотионеин II (MT2). Предпочтительным является, чтобы слитые белки были образованы любым из этих металлсвязывающих белков, которые включают вариабельные домены антитела мыши, экспрессированного как единая цепь Fv (scFv), генетически слитые либо с ферритином, либо с металлотионеином II с образованием рекомбинантного белка.
Металлсвязывающие белки
Число описанных в литературе металлсвязывающих белков все время возрастает. Многие белки запасают железо (Fe) в виде фосфата метагидроксида трехвалентного железа или в виде гема, что усложняет способы намагничивания. Белки, такие как ферритин, способны запасать тысячи ионов железа внутри клеткоподобной структуры.
Поскольку эндогенное железо внутри ферритина не является парамагнитным, его, как правило, необходимо удалять и заменять парамагнитной формой без повреждения белка. Другие металлсвязывающие белки, такие как металлотионеин II (MT2), удерживают меньше ионов металла в неплотной решетчатой компоновке, и переместить и заменить эти ионы может быть проще, чем в случае с ферритином.
Ферритин
Ферритин представляет собой большой белок, диаметром 12 нм, с молекулярной массой 480 кДа. Белок содержит большую полость (диаметром 8 нм), которая заключает внутри себя железо. Полость образуется при самопроизвольной сборке 24 полипептидов ферритина, свернутых в четырехспиральные пучки, удерживаемые нековалентными связями. При физи