Устройство для лучевой терапии быстрыми нейтронами
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к устройствам для лучевой терапии злокачественных опухолей быстрыми нейтронами. Устройство включает генератор нейтронов, окруженный сверху защитой от рассеянного излучения из борированного полиэтилена. Генератор расположен вплотную к биологической защите на одной оси с встроенным в нее нейтронным каналом. В устройство также введена функциональная защита. Биологическая и функциональная защиты выполнены в виде установленных вплотную друг к другу усеченных конусов, с большим основанием со стороны выходного отверстия нейтронного канала и меньшим - со стороны генератора нейтронов. Защиты выполнены однородными из одного материала или составными, из частей в виде усеченных конусов, вставленных один в другой, при этом части биологической и/или функциональной защиты выполнены однородными или имеют чередующиеся слои. Биологическая и функциональная защиты или их части выполнены из металлов, или гидридов металлов, или металлоподобных веществ, или пористых материалов, содержащих легкие ядра, или водородосодержащих соединений. При этом радиус входного отверстия нейтронного канала и толщины биологической и функциональной защит выбраны из условия обеспечения терапевтической эффективности устройства, определяемой формулой F=D/L, где D - расстояние от среза выходного отверстия нейтронного канала на поверхности защиты до точки, в которой керма составляет 20% от кермы в центре пучка, a L - расстояние, прошедшее быстрым нейтроном без взаимодействия с материалами защиты до точки, в которой керма составляет 20% от кермы в центре пучка. Использование изобретения позволит улучшить эксплуатационные характеристики устройства за счет создания оптимального формирователя радиационных полей и необходимой радиационной защиты пациента. 8 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Изобретение относится к области лучевой терапии злокачественных опухолей быстрыми нейтронами. Нейтроны генерируют на ускорителях заряженных частиц.
Лучевая терапия является основным методом лечения для 70% больных онкологическими заболеваниями. Причем для 20% из них, страдающих резистентными опухолями, целесообразно использовать плотно-ионизирующие излучения - нейтроны, протоны, пи-мезоны, тяжелые ионы. Эти излучения обладают более высокой эффективностью воздействия на резистентные виды опухолей, плохо поддающиеся лечению гамма-, рентгеновским и электронным излучениями. В настоящее время из плотно-ионизирующих излучений наиболее перспективными и доступными в клинической практике являются нейтроны, как быстрые в области энергий 0,5-30 МэВ, используемых в дистанционной терапии, так и эпитепловых энергий 1 эВ - 30 кэВ - для нейтрон-захватной терапии.
В нейтронной терапии в последние годы 20 века в США, странах ЕС, Японии, Южной Корее, Саудовской Аравии, ЮАР наибольшее распространение получили источники быстрых нейтронов с энергиями 21-29 МэВ интенсивностью (2÷5)·1012 н./(см2·с), получаемые на ускорителях бомбардировкой протонами (или дейтронами) бериллиевой мишени. Глубинное распределение поглощенной дозы в ткани для этих энергий быстрых нейтронов подобно высоковольтному рентгеновскому излучению, половинная доза расположена в диапазоне 8÷15 см при расстоянии источник-пациент (РИП)=1-1,5 м. Использование таких источников позволяет лечить глубоколежащие опухоли. Для энергий нейтронов 6 МэВ глубина половинной дозы расположена в диапазоне 8,5 см для РИП=1,25 м. Как правило, равномерный поток нейтронов по полю облучения удается достичь на расстоянии ~1 м от источника нейтронов.
В МРНЦ РАМН накоплен уникальный опыт физико-дозиметрических, клинических и радиобиологических исследований с различными источниками нейтронного излучения - ядерными реакторами, ускорителями, генератором ИНГ-031 и изотопным источником калифорния-252 [1]. 1 грамм 252Cf испускает мощный поток нейтронов ~2,3×1012 н./с. Средняя энергия нейтронов спектра деления 252Cf составляет 2,15 МэВ при соотношении доз гамма-излучения и нейтронов ~35% и 65%. При этом используются внутритканевые источники двух видов: штырьковые, представляющие собой линейные источники излучения, и гибкие сборки из точечных источников. Разработаны аппараты для дистанционной подачи источников к месту облучения: АНЕТ-1 для внутритканевой и АНЕТ-В для внутриполостной терапии. К настоящему времени эффективность контактной терапии с использованием излучения 252Cf изучена по отношению к широкому кругу опухолей. Апробированы различные варианты методик применения излучения 252Cf в лучевой терапии. Приобретенный к настоящему времени клинический опыт показывает, что применение излучения 252Cf открывает дополнительные возможности в плане местного усиления противоопухолевого воздействия. Анализ биофизических факторов приводит к выводу о высокой опасности нейтронов 252Cf.
Одним из основных недостатков, возникающих при применении источников из 252Cf для контактной лучевой терапии, является обеспечение удовлетворительной защиты медицинского, обслуживающего и технического персонала.
Известно устройство для терапии быстрыми нейтронами на базе циклотрона У-120 в НИИ онкологии Томского научного центра РАМН [2]. Быстрые нейтроны со средней энергией 6,5 МэВ интенсивностью 6,5·109 н./(стерадиан·мкА·с) на выходе коллиматора размерами 15×15 см2 генерируют с помощью ядерной реакции 9Be(d,n)l0B. Пучок нейтронов, сформированный специальным коллиматором длиной 85 см из железа и борированного полиэтилена, введен в медицинский блок. Мониторирование интенсивности нейтронного пучка во время терапевтического сеанса осуществляется ионизационной камерой. Мощность дозы на поверхности фантома составляет 15 сГр/мин для РИП=100 см при максимальном токе дейтронов на мишени. Планирование нейтронной терапии для различных локализаций злокачественных новообразований осуществляется с помощью пары ионизационных камер и фантома.
Недостатком устройства является отсутствие возможности его свободного перемещения в различные медицинские учреждения.
Известно устройство для дистанционной нейтронной терапии (ДТБН) с использованием нейтронов исследовательского ядерного реактора FRM в г. Мюнхене (ФРГ) [3]. В этом методе кресло пациента располагается в пучке нейтронов ядерного реактора в медицинском блоке. В помещении ядерного реактора устанавливается фильтр, который выводит из пучка нейтроны малых энергий и спектр нейтронов пучка становится жестче. Сеанс нейтронной терапии осуществляют при открытом шибере (заслонке) нейтронов, а при закрытом - проводят подготовку пациента к лечению.
К настоящему времени исследовательский ядерный реактор FRM выведен из эксплуатации.
Известно устройство для терапии на основе генератора быстрых нейтронов с энергией 14 МэВ на вакуумных трубках с использованием ядерной реакции 3T(d,n)4He с выходом 5·1012 н./с. Устройство планировалось установить в Германском исследовательском онкологическом центре (г. Гейдельберг) [4]. Это устройство содержит источник нейтронов, испускаемых мишенью, окруженный радиационной защитой. В защите расположен нейтронный канал (коллиматор). Мишень расположена вблизи торца коллиматора. Система формирования радиационного поля в этой установке выполнена из железа, борированного полиэтилена и свинца. Сменные коллиматоры в форме усеченных пирамид из специальной стали формируют поля квадратного или прямоугольного сечения размерами 8×8, 10×10, 12×12, 13×13 и 15,5×10 см2. Мощность дозы (кермы) для РИП=100 см составляет >15 сГр/мин и 20 сГр/мин для РИП=85 см. Половинная доза расположена на глубине 10,8 см. Качество радиационной защиты Н, определяемое как расстояние от края нейтронного канала на поверхности защиты со стороны пациента, на котором керма уменьшается с 80% до 20%, составляет 2,5 см. Для измерения дозы во время терапевтического сеанса используется измерительная система с детектором на основе тканеэквивалентной ионизационной камеры, которая расположена в центре пучка нейтронов внутри нейтронного канала. Такой же детектор используется для исследования дозовых распределений в водном фантоме с клиновидным фильтром при планировании нейтронной терапии злокачественных новообразований сложной геометрической формы.
Недостаток устройства заключается в отсутствии его практического исполнения.
На пучке нейтронов Б-3 реактора БР-10 ГНЦ РФ ФЭИ впервые в мире был доведен до клинического использования способ ДТБН [5]. В реакторном зале на выходе канала Б-3 помещали фильтр нейтронов из борированного полиэтилена толщиной 1 см или из 2 см полиэтилена + 3 см титана, при этом средняя энергия нейтронов составляла 0,85 МэВ и 0,95 МэВ для каждого фильтра соответственно. Пучок быстрых нейтронов выводили в медицинский блок. Кресло пациента располагали в медицинском блоке вблизи коллиматора на расстоянии ~10 м от активной зоны, плотность потока быстрых нейтронов на номинальной мощности реактора 7,6 МВт составляла ~2,3·108 н./(см2·с). Коллиматор с профилем пучка нейтронов прямоугольной формы выполнен из чередующихся слоев свинца и борированного полиэтилена. Размеры профиля пучка нейтронов плавно менялись от 4×4 см2 до 10×10 см2. Мощность кермы на поверхности фантома достигала 18 сГр/мин при ее половинной глубине - 5,5 см. В последнее время эксплуатации реактора БР-10 мощность снижали до 4,3 МВт, а мощность кермы соответственно до ~10 сГр/мин, что не препятствовало успешному проведению ДТБН.
Недостаток - к настоящему времени исследовательский ядерный реактор БР-10 выведен из эксплуатации.
Прототипом предложенного технического решения является устройство Уральского центра нейтронной терапии (УЦНТ). Нейтронная терапия осуществляется на генераторе "НГ-12И" с использованием ядерной реакции 3T(d,n)4He. Интенсивность потока нейтронов с энергией 14 МэВ из мишени ускорителя составляет 1,5·1012 н./с [6]. При этом диаметр мишени составляет 25 мм. Пучок нейтронов выводят в медицинский блок. В зависимости от локализации онкологического заболевания пациент может располагаться в двух положениях: на кресле или на кровати на расстоянии 85 см и 105 см от источника нейтронов, соответствующих каждому положению. Составной коллиматор расположен в защите и выполнен в определенной последовательности: 45 см железа + 15 см борированного полиэтилена + 5 см железа. Мощность кермы на поверхности фантома составляет 5,5 сГр/мин для РИП=105 см. Половинная керма расположена на глубине 9 см. Вклад гамма-излучения в суммарную керму составляет 4-8%.
Главный недостаток прототипа заключается в отсутствии его мобильности.
Технический результат предлагаемого изобретения заключается в улучшении эксплуатационных характеристик устройства для лечения быстрыми нейтронами, включая его мобильность. При этом должны быть обеспечены клинические требования, направленные на уменьшение ожидаемых лучевых повреждений и повышение терапевтической эффективности. Обозначенный технический результат может быть получен за счет создания оптимального формирователя радиационных полей и необходимой радиационной защиты пациента для источника нейтронов с энергией 14 МэВ с выходом 1011 н./c.
В настоящее время во ВНИИА им. Н.Л.Духова разрабатывается портативный генератор НГ-24 - источник нейтронов с энергией 14 МэВ с использованием ядерной реакции 3T(d,n)4He интенсивностью ~1011 н./с для лучевой терапии. При этом следует отметить, что известные стационарные источники нейтронов с энергией 14 МэВ превышают выход нейтронов из мишени генератора НГ-24 в 15÷50 раз [2, 4, 6]. Для удовлетворения клинических требований с источником нейтронов НГ-24 к мощности дозы на объект 8-18 сГр/мин и качеству защиты необходимо РИП уменьшить до 15-25 см.
Однако такие условия, в свою очередь, требуют новое техническое решение для формирования радиационных полей с минимальной толщиной защиты.
Для обеспечения оптимального формирования радиационных полей нами были проведены физико-дозиметрические исследования по поиску материалов защиты и созданию конструкции терапевтической установки. При расчете радиационных полей использован метод Монте-Карло [7], применяемый для проектирования активных зон ядерных реакторов и радиационной защиты. Расчетные исследования показали, что известные защитные материалы (железо, борированный полиэтилен, свинец), а также специальный материал, используемый для радиационной защиты при работе и транспортировке отработанных тепловыделяющих сборок с атомных станций [8], по своим характеристикам не удовлетворяют клиническим требованиям. Поэтому был расширен спектр поиска материалов, включая соли металлов, металлоподобные соединения, органические материалы, растворители и некоторые заполнители пористых материалов. Всего было рассмотрено ~140 соединений.
Наши теоретические исследования показали, что наиболее приемлемой конструкцией, обеспечивающей клинические условия, является установка с генератором нейтронов и нейтронным каналом, встроенным в биологическую защиту. В качестве материалов с высокой эффективностью, замедляющих быстрые нейтроны, могут быть использованы вольфрам, бориды, нитриды, карбиды вольфрама; тантал, бориды, нитриды, карбиды тантала; вещества с высокой ядерной плотностью водорода (BeH2, LiBH4, NH3BH3, H2B(NH3)2BH4 [9], Li[AlH4], AlH3, B3N3H6, LiNH2 и т.д.), BN [10], Li3N, Be3N2, гидрид мишметалла, гидрид циркония, фторид циркония, гидриды тантала (см. таблицу).
Сущность изобретения заключается в том, что в известное по прототипу устройство, включающее генератор нейтронов, окруженный сверху защитой из борированного полиэтилена, расположенный вплотную к биологической защите и на одной оси с встроенным в нее нейтронным каналом, дополнительно введена функциональная защита, прилегающая вплотную к биологической защите. Обе защиты выполнены в виде усеченных конусов, вставленных один в другой, с большим основанием со стороны выходного отверстия нейтронного канала и меньшим - со стороны генератора нейтронов. При этом части биологической и/или функциональной защиты выполнены однородными - из одного материала или составными - из разных материалов в виде чередующихся слоев. Обе защиты или их части выполнены из любой комбинации материалов: W, Та, гидридов металлов - ТаН, ТаН2, ТаН3, TaD, TaD2, TaD3, гидрида мишметалла, ZrH2 и металлоподобных веществ: WB, W2B, WB2, W2B5, WN, WC, W2C, Та2В, ТаВ2, Та3В2, Та3В4, TaN, TaC, а также из веществ, содержащих легкие ядра (водород, дейтерий, бериллий, литий, бор, углерод, азот, кислород, фтор и т.д.) BN, Li3N, LiH, Be3N2, ZrF4. В качестве высокоэффективных материалов, замедляющих нейтроны, использованы водородосодержащие вещества: NH3BH3, Н2В(NH3)2ВН4, LiBH4, BeH2, Li[AlH4], AlH3, B3N3H6, LiNH2, а также раствор бора-10, лития-6 в легкой или тяжелой воде.
Пористые материалы заполнены жидкими органическими веществами, выбранными из веществ с большой проникающей способностью и с максимальным содержанием ядер водорода (дейтерия).
При малой толщине защиты предлагаемого устройства терапевтическая эффективность обеспечивает защиту здоровых участков тела пациента, зависит от размеров входного отверстия нейтронного канала и источника нейтронов, а также суммарной толщины обеих защит. Эффективность определена соотношением F=D/L, где D - расстояние от среза выходного отверстия нейтронного канала на поверхности защиты до точки, в которой керма составляет до 20% от кермы в центре пучка нейтронов, a L - расстояние, прошедшее нейтроном любой энергии без взаимодействия с материалами защиты.
При лечении злокачественных новообразований гортани, молочной железы очаг заболевания располагают вблизи выходного отверстия нейтронного канала. В этом случае в функциональной защите имеется выемка в соответствии с анатомией тела или облучаемого органа пациента.
Для увеличения мощности дозы до 25% в водородосодержащей защите внутри нейтронного канала вставлен вкладыш из неводородосодержащих материалов.
Перечень фигур
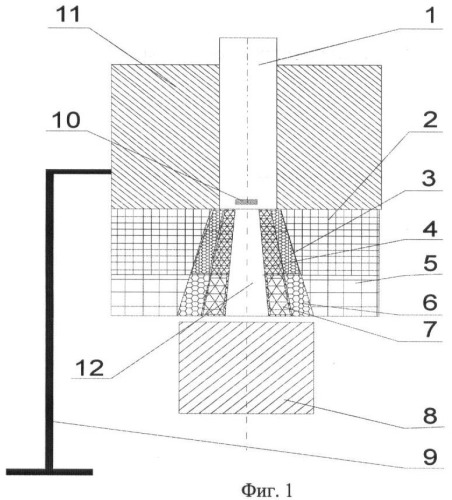
Фиг.1. Конструкция многофункционального терапевтического устройства: 1 - генератор нейтронов НГ-24, 2 - биологическая защита из материала А, 3 - биологическая защита из материал Б, 4 - биологическая защита из материала В, 5 - функциональная защита из материала А, 6 - функциональная защита из материала Б, 7 - функциональная защита из материала В, 8 - водный фантом, 9 - кронштейн, 10 - источник нейтронов, 11 - борированный полиэтилен, 12 - нейтронный канал.
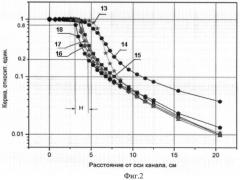
Фиг.2. Распределение кермы на глубине 0,5 см в фантоме по радиусу нейтронного канала и в тени защиты в установке с функциональной защитой: 13 - (65 - УЦНТ), 14 - (25 - ТаН), 15 - (15 - ТаН+ТаН), 16 - (20 - ТаН+ТаН), 17 - (20 - W2B5+ZrH2), 18 - (25 - Устройство), Н - качество радиационной защиты.
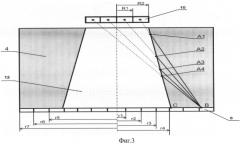
Фиг.3. Схема для расчета терапевтической эффективности устройства: 4 - биологическая защита, 8 - водный фантом, 10 - источник нейтронов, 12 - нейтронный канал.
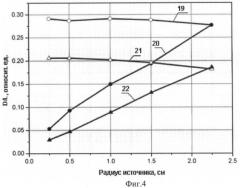
Фиг.4. Зависимость терапевтической эффективности устройства от радиуса источника нейтронов: 19 - Rист.≤Rвх. при толщине защиты 15 см; 20 - Rист.=Rвх. при толщине защиты 15 см; 21 - Rист.≤Rвх. при толщине защиты 20 см; 22 - Rист.=Rвх. при толщине защиты 20 см. Rист. - радиус источника нейтронов, Rвх. - радиус входного отверстия нейтронного канала.
Описание устройства
Генератор нейтронов НГ-24 (1) (Фиг.1) расположен вплотную к биологической защите (3, 4) на одной оси с нейтронным каналом (12), выполненным в форме усеченного конуса. Его большее основание (выходное отверстие нейтронного канала) обращено к пациенту, а меньшее (на входе) диаметром 2,3 см - к НГ-24. При этом диаметр активной части источника нейтронов составлял 2,25 см. Диаметр выходного отверстия канала может быть выбран в зависимости от размеров полей облучения опухолей: от 4 см до 10 см. Биологическая защита (2, 3, 4) выполнена в виде составных частей из различных материалов (А, Б, В). Каждая часть выполнена в форме усеченного конуса, которые вставлены друг в друга. Функциональная защита (5, 6, 7) выполнена в такой же конусной форме из различных или таких же материалов и установлена вплотную к биологической защите на одной оси нейтронного канала (12). Для исследования распределения дозовых полей использован водный фантом (8) размерами 30×30×30 см3.
Рассматриваемое устройство крепят к полу или стене с помощью кронштейна (9). Мишень генератора нейтронов (10) располагают на расстоянии 0,5-1 см от начала нейтронного канала (12). Для защиты пациента от рассеянного излучения генератор сверху окружен борированным полиэтиленом (11) с наружным диаметром 80 см и высотой 120 см.
Обоснование параметров установки
На начальном этапе проектирования терапевтической установки были проведены расчетные исследования качества защиты прототипа УЦНТ с источником нейтронов с энергией 14 МэВ интенсивностью 1,5·1012 н./с [6]. Его биологическая защита выполнена из чередующихся слоев: 45 см железа + 15 см борированного полиэтилена (BCH2) + 5 см железа - общая толщина защиты составляет 65 см. Источник нейтронов выполнен в форме диска диаметром 2,5 см, расположен на расстоянии 1 см от входного отверстия нейтронного канала диаметром 3 см. Выходной диаметр нейтронного канала конической формы составляет 6 см. Водный фантом размерами 30×30×30 см3 располагали на расстоянии 20 см от защиты - РИП=86 см. Результаты расчетных исследований представлены в п.1 таблицы и на Фиг.2 - (13). Мощность кермы на поверхности фантома составляет 9 сГр/мин с источником нейтронов энергией 14 МэВ, интенсивностью 1,5·1012 н./с для РИП=86 см, Н=1,5 см, Кор=1,4%, что удовлетворяет медицинским требованиям и соответствует европейскому протоколу.
В таблице приведены результаты расчетных исследований. В первом столбце указан порядковый номер расчета, во втором - толщина биологической защиты и ее материал, в третьем - материал функциональной защиты, в четвертом - мощность кермы, в пятом столбце - качество защиты - Н. В последнем столбце представлены значения кермы - Кор (на критические органы - глаза, головной мозг и т.д.) на расстоянии 15-20 см от центральной оси пучка относительно величины кермы - К в центре.
В нашей малогабаритной установке (см. Фиг.1) с генератором нейтронов НГ-24 - (1) и выходом нейтронов 1011 н./с проведены расчетные исследования. Толщину биологической защиты изменяли в интервале 15-20-25 см - (2, 3, 4) и толщина функциональной защиты - (5, 6, 7) составляла 10 см. Результаты расчетов приведены в п.п.2-69 таблицы и некоторые композиции защит на Фиг.2.
При проектировании малогабаритной радиационной защиты рассматривали различные материалы и их сочетания. В качестве одной из комбинаций рассматривали тантал и его гидриды: ТаН, ТаН2, ТаН3. Результаты расчетов с биологической защитой толщиной 20 см из Та и ТаН приведены в п.2 и п.3 таблицы. Гидрид тантала, ввиду его пористости, пропитан керосином с объемной долей 10% - ТаНК - п.4 и TAH2K с такой же долей керосина - п.5. Дозиметрические характеристики защиты из тантала и из гидридов тантала с увеличением относительной доли ядер водорода приближаются к защитным характеристикам прототипа с материалом ТаН2К. Такой результат объясняется тем, что количество ядер в металлическом тантале с удельным весом d=16,6 г/см3 nTa=0,055·10 яд./см3, а в соединении с водородом - ТаН (точнее TaH0,78=15,04 г/см3) nTa=0,0498·1024 яд./см3 - в этом соединении ядерная плотность тантала меньше на ~10%, но добавилось существенное количество ядер водорода nH=0,0388·1024 яд./см3. Для ТаН2К nTa=0,044·1024 яд./см3, nH=0,0851·1024 яд./см3.
| Состав материалов устройства и его характеристики | ||||||
| № п/п | Толщина, см, и материал биологической защиты | Материал функциональной защиты | Расстояние от защиты до фантома - РИП, см | Керма - К, сГр/мин (для 1011 н./с) | Н, см | Кор, % |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | УЦНТ 65-(45 см Fe | нет | 20-86 | 9(1,5·1012 н/c) | 1,5 | 1,4 |
| +15 см BCH2 + 5 см Fe) | нет | 35-100 | 5,5(1,5·1012 н/с) | |||
| 2 | 20 - Та | нет | 1-21 | 12,5 | 3,5 | 4,2 |
| 3 | 20 - ТаН | нет | 1-21 | 10,2 | 2,1 | 1,7 |
| 4 | 20 - ТаНК | нет | 1-21 | 10,2 | 1,8 | 1,3 |
| 5 | 20 - TaH2K | нет | 1-21 | 10,1 | 1,6 | 1,2 |
| 6 | 15 - ТаН | ТаН | 0-26 | 7,2 | 1,7 | 1,5 |
| 7 | 15 - TaD2 | TaD2 | 0-26 | 6,8 | 1,5 | 1,2 |
| 8 | 15 - TaB2K | TaB2K | 0-26 | 7,7 | 1,7 | 1,6 |
| 9 | 15 - ТаН2 | ТаН2 | 0-26 | 7 | 1,3 | 1,0 |
| 10 | 20 - ТаН | BN | 0-31 | 5,1 | 1,9 | 1,5 |
| 11 | 20 - ТаН2 | BN | 0-31 | 5 | 1,4 | 1,4 |
| 12 | 20 - Та | Та | 0-31 | 5,7 | 1,9 | 2,8 |
| 13 | 20 - W | W | 0-31 | 5,9 | 1,6 | 2,3 |
| 14 | 20 - W2B | W2B | 0-31 | 5,7 | 1,5 | 1,6 |
| 15 | 20 - WB2 | WB2 | 0-31 | 5,6 | 1,4 | 1,5 |
| 16 | 20 - WN | WN | 0-31 | 5,7 | 1,4 | 1,6 |
| 17 | 20 - WC | WC | 0-31 | 5,7 | 1,5 | 1,7 |
| 18 | 20 - TaB2 | TaB2 | 0-31 | 5,4 | 1,1 | 1,25 |
| 19 | 20 - TaN | TaN | 0-31 | 5,5 | 1,4 | 1,85 |
| 20 | 20 - TaC | TaC | 0-31 | 5,6 | 1,4 | 1,75 |
| 21 | 20 - ТаН2 | W2B5 | 0-31 | 5 | 2,1 | 1 |
| 22 | 20 - TaH2 | ZrH2 | 0-31 | 4,9 | 1,9 | 1,4 |
| 23 | 20 - ТаН | ZrH2 | 10-41 | 2,7 | 2,2 | 2,7 |
| 24 | 20 - ТаН | ZrH2 | 0-31 | 4,9 | 1,9 | 1,5 |
| 25 | 20 - ТаН | Li(AlH4) | 0-31 | 4,9 | 2,1 | 2 |
| 26 | 20 - ТаН2 | LiNH2 | 0-31 | 5 | 2,1 | 2 |
| 27 | 20 - ТаН | BN | 0-31 | 5,1 | 1,9 | 1,5 |
| 28 | 20 - BN | ZrH2 | 0-31 | 5,4 | 2 | 2,3 |
| 29 | 20 - BN | BN | 0-31 | 5,6 | 1,6 | 2,3 |
| 30 | 20 - BNK | BNK | 0-31 | 5,5 | 1,4 | 1,4 |
| 31 | 20 - W2B5 | ZrH2 | 10-41 | 2,8 | 2,3 | 2,6 |
| 32 | 20 - W2B5 | ZrH2 | 0-31 | 5,3 | 1,7 | 1,4 |
| 33 | 20 - W2B5 | ZrF4 | 0-31 | 5,5 | 2,1 | 2,3 |
| 34 | 20 - W2B5 | BN | 10-41 | 2,8 | 1,9 | 2,6 |
| 35 | 20 - W2B5 | BN | 0-31 | 5,5 | 1,5 | 1,4 |
| 36 | 20 - W2B5 | Fe | 0-31 | 5,5 | 2,1 | 0,9 |
| 37 | 25 - BN | BN | 10-46 | 2,3 | 1,8 | 2,2 |
| 38 | 25 - BN | BN | 0-36 | 4,1 | 1,2 | 1,8 |
| 39 | 25 - W2B5 | W2B5 | 10-46 | 2,3 | 2,0 | 1,8 |
| 40 | 25 - W2B5 | W2B5 | 0-36 | 4,1 | 1,6 | 1,6 |
| 41 | 25 - W2B5 | BN | 10-46 | 2,3 | 1,6 | 1,8 |
| 42 | 25 - W2B5 | BN | 0-36 | 4 | 1,1 | 1 |
| 43 | 25 - TaH2K | NH3BH3 | 10-46 | 2,1 | 2,2 | 2 |
| 44 | 25 - TaH2K | H2B(NH3)2BH4 | 10-46 | 2,1 | 1,6 | 1,4 |
| 45 | 25 - ТаН2 | BeH2 | 0-36 | 3,63 | 1,85 | 1,2 |
| 46 | 25 - TaH2 | Be3N2 | 0-36 | 3,76 | 1,8 | 1,1 |
| 47 | 25 - ТаН2 | AlH3 | 0-36 | 3,52 | 1,6 | 1,0 |
| 48 | 25 - ТаН2 | LiBH4 | 0-36 | 3,54 | 1,7 | 1,15 |
| 49 | 25 - TaH2 | LiNH2 | 0-36 | 3,59 | 1,6 | 1,05 |
| 50 | 25 - ТаН2 | Li3N | 0-36 | 3,64 | 1,8 | 1,5 |
| 51 | 25 - ТаН2 | Миш-Мет | 0-36 | 3,56 | 1,75 | 0,7 |
| 52 | 25 - ТаН2 | B3N3He6 | 0-36 | 3,5 | 1,9 | 1,45 |
| 53 | 25 - (W -1 5 см + BCH2 - 7 см + W - 3 см) | H2O + 6Li (7%) | 0-36 | 3,6 | 2,0 | 2,7 |
| 54 | 25 - (W - 15 см + BCH2 - 7 см + W - 3 см) | NH3BH3 | 0-36 | 3,52 | 2,0 | 2,6 |
| 55 | 25 - ТаН2 | NH3BH3 | 0-36 | 3,6 | 1,6 | 1 |
| 56 | 25 - ТаН2 | ZrF4 | 10-46 | 2,1 | 2 | 2 |
| 57 | 25 - ТаН2 | ZrF4 | 0-36 | 3,6 | 1,5 | 1,3 |
| 58 | 25 - ТаН2 | ZrH2 | 10-46 | 2,1 | 1,6 | 1,6 |
| 59 | 25 - ТаН2 | ZrH2 | 0-36 | 3,6 | 1,4 | 0,8 |
| 60 | 25 - ТаН2 | Fe | 10-46 | 2,1 | 1,5 | 2,2 |
| 61 | 25 - ТаН2 | Fe | 0-36 | 3,6 | 1,3 | 1,1 |
| 62 | 25 - ZrH2 | ZrH2 | 0-36 | 3,96 | 1,85 | 3 |
| 63 | 15 - TaHK | нет | 0-16 | 18 | 0,7 | 1,7 |
| 64 | 20 - TaHK | нет | 0-21 | 10,3 | 0,5 | 1,2 |
| 65 | 20 - W2B5 | нет | 0-21 | 11,5 | 0,5 | 1,5 |
| 66 | 20 - BNK | нет | 0-21 | 11,5 | 0,7 | 2,8 |
| 67 | 20 - W | нет | 0-21 | 12,6 | 0,8 | 2,9 |
| 68 | 25 - ТаН | нет | 20-46 | 2,1 | 3,1 | 4,7 |
| 69 | 251 - Предлагаемое решение - Устройство | 0-26 | 7,1 | 0,4 | 1,6 |
В результате взаимодействия нейтронов с энергией 14 МэВ с ядрами тантала по ядерным реакциям (n,2n)-σ(n,2n)=2,26·10-24 см2 и неупругого рассеяния - (n,n')-σ(n,n')=2,45·10-24 см2, суммарное сечение замедления нейтронов при неупругом, упругом рассеяниях и (n,2n) реакции σTa=4,85·10-24 см2, на ядрах водорода при энергии нейтронов 14 МэВ сечение упругого рассеяния нейтронов σH=0,68·10-24 см2 [12]. Макроскопическое сечение замедления нейтронов с энергией 14 МэВ танталом ∑Ta=nTa·σTa=0,2668 1/см, гидридом тантала Следовательно, наличие водорода в гидриде тантала существенно не улучшает замедляющие свойства нейтронов с энергией 14 МэВ. Однако в результате их замедления на ядрах тантала в нейтронном спектре наблюдается широкий максимум в области энергий до 1 МэВ. Для этих энергий сечение замедления нейтронов ядром тантала σTa≈(0,7-2,5)·10-24 см2, ∑Ta=(0,0385-0,1375) 1/см, ядром водорода σH≈(11-4,3)·10-24 см2, - в этом случае эффективность замедления нейтронов ядрами водорода возрастает, что способствует переводу нейтронов в область энергий с меньшими факторами кермы и тем самым объясняет лучшее качество защиты TaH2K по сравнению с танталом и другими его гидридами, что увеличивает мощность кермы с материалом защиты из тантала на ~25%, чем из гидрида тантала (п.2 и п.5 таблицы). Таким образом, если в водородосодержащей защите внутри нейтронного канала вставить вкладыш п.4 и п.7 таблицы, не меняя размеров канала из W, Ta, BN, боридов, нитридов, карбидов вольфрама, тантала и т.д. определенной толщины, мощность кермы можно увеличить.
В рассмотренных выше расчетных исследованиях фантом располагали на расстоянии 1 см от выхода коллиматора, что позволяет лечить злокачественные новообразования кожи. При лечении гортани фантом расположен на расстоянии 10 см от торца коллиматора. В свободное пространство между биологической защитой и головой пациента установлена дополнительная - функциональная защита толщиной 10 см с таким же внешним диаметром, а внутренний ее размер является продолжением нейтронного канала конусной формы - п.п.5, 6, 7 таблицы. В функциональной защите для плеча выполнена выемка в наиболее эффективных материалах, например из TaH2K, TaB2K, BNK, боридов вольфрама, определенных размеров в зависимости от анатомии тела пациента. В расчетах п.п.6, 7, 8, 9 таблицы представлены варианты характеристики обоих видов защит, состоящих из одних гомогенных материалов: ТаН-ТаН, TaD2-TaD2 (дейтерид тантала), TaB2K-TaB2K (борид тантала с 10% долей керосина), TaH2-TaH2. При этом толщина биологической защиты составляет 15 см, что заметно отличает от толщины защиты УЦНТ, хотя дозиметрические характеристики вариантов нашей установки мало отличаются от прототипа. В расчетных исследованиях п.10 таблицы при толщине биологической защиты 20 см и РИП=31 см с функциональной защитой представлена комбинация материалов ТаН-BN, а в расчете п.11 таблицы ТаН2-BN также с РИП=31 см. В п.п.12÷20 таблицы представлены результаты расчетов комбинаций двух видов защит как с чистыми материалами Та-Та, W-W, а также их металлоподобных соединений: W2B, WB2, W2B5, WN, WC, TaB2, TaN, TaC. В расчетах с п.22 по п.27 таблицы в качестве биологической защиты использованы гидриды тантала, а функциональные - выполнены из ZrH2, LiNH2, Li(AlH4), BN. В п.п.28÷36 таблицы рассмотрены различные виды материалов функциональной защиты, включая BNK - с 10% объемной долей керосина, при толщине биологической защиты 20 см. В качестве функциональной защиты использованы также известные материалы из ZrF4 - п.33 и Fe - п.36 таблицы. В расчетах п.п.37÷52 толщина биологической защиты составляет 25 см, в качестве функциональной защиты, кроме названных, добавлены материалы: NH3BH3, Н2В(NH3)2ВН4, BeH2, Be3N2, AlH3, Li3N, В3N3Н6, LiBH4, а также гидрид мишметалла. Гидрид мишметалла состоит из (25-35)% лантана, (40-50)% церия, (4-15)% празеодима, (4-15)% неодима, (1-7)% самарий + гадолиний, а также 5,4% водорода по массе [13]. В расчетах п.п.53, 54 таблицы биологическая защита выполнена в виде чередующихся слоев вольфрама 15 см и 3 см, между ними борированный полиэтилен толщиной 7 см. В качестве функциональной защиты в первом варианте использована вода с литием-6 с объемной долей 7%, во втором - NH3BH3. В расчетах п.п.55÷61 таблицы в качестве биологической защиты использован TaH2, функциональная защита выполнена из NH3BH3, из гидрида или фторида циркония, из железа с РИП 36 см и 46 см. В расчете п.62 таблицы в качестве материалов обоих видов защит используется гидрид циркония. В п.68 таблицы представлены результаты только с биологической защитой толщиной 25 см из ТаН с фантомом, расположенным на расстоянии 20 см от нее, качество защиты Н и Кор не соответствуют прототипу. В приведенных выше расчетах радиус источника составляет 2,25 см, входной радиус коллиматора равен 2,3 см.
Улучшить качество защиты можно другим способом - уменьшением радиуса источника нейтронов и входного отверстия нейтронного канала. При конструировании радиационной защиты введем понятие терапевтической эффективности устройства - F. Она определена выражением F=D/L, где D - расстояние от среза нейтронного канала (точка С) на поверхности защиты до точки В (Фиг.3, D=ВС), в которой керма составляет до 20% от кермы в центре пучка. Величина D характеризуется нейтронно-физическими свойствами материалов защиты. Величина L - расстояние, прошедшее быстрым нейтроном без взаимодействия с материалами защиты (4) до точки В (Фиг.3, ВА1, ВА2, ВА3 и ВА4), усредненное, по всей поверхности источника нейтронов (10, Фиг.3). Величина L определена геометрическими размерами защиты устройства. На Фиг.3 поверхность источника нейтронов схематически разделена на 2 части - круг радиусом R1 и кольцо радиусами R1, R2. При вычислении величины L поверхность источника разделена на большее число частей в форме колец. В качестве детектора нейтронов использован водный фантом (8) толщиной 1 см, который располагали вплотную к защите; детекторы также разделены на круг радиусом r1 и несколько колец радиусами r1…r7.
Исследование терапевтической эффективности установки с источником нейтронов НГ-24 осуществляли с биологической защитой из TaB2 с керосином для двух толщин 15 см и 20 см - Фиг.3. Пространственное распределение доз на поверхности защиты - (4) определяли с помощью водного фантома - (8), расположенного вплотную к защите. Источник нейтронов - (10) толщиной 2 мм располагали на расстоянии 1 см от входного отверстия коллиматора - (12). Радиусы источника нейтронов составляли: 0,25 см, 0,5 см, 1 см, 1,5 см и 2,25 см. Радиус выходного окна нейтронного канала конической формы равен 3 см. При вычислении величины F рассматривали две геометрии: №1 - радиус входного отверстия нейтронного канала равен радиусу источника - (Rист.=Rвх.) и №2 - входной радиус нейтронного канала был максимальным и составлял 2,3 см, изменяли только размеры источника в названных диапазонах - (Rист.≤Rвх.).
На Фиг.4 представлены результаты расчета терапевтической эффективности устройства F. При Rист.=Rвх. - (20 и 22) F возрастает с увеличением радиуса источника. При Rист.≤Rвх. - (19 и 21) она остается примерно постоянной величиной для различной толщины защиты, что является отличительной особенностью представленных данных.
Терапевтическая эффективность установки УЦНТ с конусной формой нейтронного канала с РИП=86 см, D=1,55 см, L=20,2 см составляет F=0,077. В предлагаемой нами установке F=0,065 при толщине защиты 20 см и диаметре источника нейтронов и входного отверстия нейтронного канала 0,75 см - (22) (Фиг.4). Для толщины защиты 15 см F=0,115 при тех же параметрах источника нейтронов и канала - (20) (Фиг.4).
Расчетные исследования по улучшению эффективности радиационной защиты выполнены с биологической защитой толщиной 15 см из TaHK (п.63 таблицы) с фантомом вплотную к ней без функциональной защиты. В этом расчете радиус источника равен 0,3 см, входной радиус нейтронного канала - 0,43 см, величина Н=0,7 см, что лучше, чем у прототипа. В п.64 с толщиной биологической защиты 20 см из TaHK с радиусом источника 0,4 см и входным радиусом нейтронного канала 0,52 см получено качество защиты Н=0,5 см. В отличие от результатов п.4 с тем же материалом защиты, но с радиусом источника, равным 2,25 см, и входным радиусом нейтронного канала 2,3 см, величина Н=1,8 см. В п.п.65-67 с другими материалами защиты толщиной 20 см: W2B5, BNK и W при Rист.=0,4 см и Rвх.=0,52 см качество защиты Н составляет 0,7-0,8 см, причем Кор=2,8-2,9%, что несколько хуже прототипа. Таким образом, качество защиты - Н устройства улучшается с меньшими размерами источника нейтронов и соответствующими им входными размерами нейтронного канала диаметром 0,3÷1,5 см.
Полученные данные свидетельствуют о возможности оптимального выбора материалов из TaH2K, W2B5 и BN с толщинами биологической защиты 15 см, функциональной - 10 см. Качество защиты Н=0,4 см лучше прототипа, что позволит уменьшить лучевую нагрузку на здоровые ткани, расположенные вблизи опухоли, Кор=1,6% - п.69 таблицы.
Мощность кермы для биологической защиты с толщинами 15 см, 20 см и 25 см с фантомом в непосредственной близости от защиты составляет (7-7,2) сГр/мин, (5-5,5) сГр/мин, (3,6-4,1) сГр/мин соответственно. Для биологической защиты толщиной 20 см и функциональной защитой с фантомом вплотную, мощность кермы составляет 5÷5,5 сГр/мин. При расположении фантома на расстоянии 10 см от функциональной защиты мощность кермы составляет 2,7÷2,8 сГр/мин. Для удовлетворения клинических требований по мощности кермы необходимо выход источника нейтронов увеличить до 10 сГр/мин, что возможно при форсированном режиме работы генератора НГ-24 в течение терапевтического сеанса длительностью 10-15 минут.
Глубина половинной кермы в фантоме для различных комбинаций защиты составляет 5-6 см, что соответствует характеристикам ДТБН на пучке Б-3 реактора БР-10.
Принцип действия устройства
Терапевтическую установку собирают в медицинском блоке из защитных материалов, генератора нейтронов НГ-24 и соответствующих электрических кабелей для подключения к блоку управления. Вблизи источника нейтронов устанавливают детектор для измерения нейтронной дозы. В соседнем помещении размещают приборы, контролирующие длительность сеанса терапии. На начальном этапе проводят исследования доз в фантоме - по глубине и по радиусу пучка нейтронов. После расчетно-экспериментального анализа данных дозиметрии приступают к нейтронной терапии.
Показатели достижения технического результата
Предлагаемое устройство позволяет реализовать наш ранее приобретенный клинический опыт в лечении некоторых разновидностей онкологических заболеваний, расположенных на глубине до 5 см, методом ДТБН. Накопленный опыт на стационарном ядер