Ингибиторы киназ и способы их применения
Иллюстрации
Показать всеИзобретение относится к соединению формулы I и его пролекарству, представляющему собой 2-(5-(2-((3-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)уреидо)метил)-4-фторфенокси)-1 Н-индазол-1-ил)этилдигидрофосфат, а также к их фармацевтически приемлемым солям и фармацевтическим композициям на их основе. Указанные соединения являются ингибиторами киназ. Объектами изобретения также являются способы получения соединения формулы I, промежуточные соединения для его получения и способы лечения опосредованного киназами состояния у млекопитающего. В частности, указанные соединения могут применяться при лечении воспалительных заболеваний, аутоиммунных заболеваний, деструктивных заболеваний костей, пролиферативных заболеваний, инфекционных заболеваний, вирусных заболеваний или нейродегенеративных заболеваний. 10 н. и 5 з.п. ф-лы, 8 табл., 13 биологических пр., 9 препаративных пр.
Реферат
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США №60/763,712, поданной 31 января 2006 года, которая полностью включена в настоящую заявку путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к ингибиторам киназ, фармацевтическим композициям, содержащим такие ингибиторы, и способам получения указанных ингибиторов. Ингибиторы киназ по настоящему изобретению применимы для лечения воспаления, остеоартрита, ревматоидного артрита, рака, аутоиммунных заболеваний и других заболеваний, опосредованных цитокинами.
Предшествующий уровень техники
Ряд хронических и острых воспалительных заболеваний связан с перепроизводством провоспалительных цитокинов. Такие цитокины включают (но не ограничиваются ими) фактор некроза опухоли альфа (TNF-α), интерлейкин 1 бета (IL-1β), интерлейкин 8 (IL-8) и интерлейкин 6 (IL-6). Ревматоидный артрит (RA) представляет собой хроническое заболевание, начало которого и прогрессирование видимого разрушения костей и суставов, наблюдаемое при этом расстраивающем здоровье заболевании, непосредственно связаны с TNF-α и IL-1β. Терапевтические виды лечения RA, недавно получившие одобрение, включают растворимый рецептор TNF-α (ENBREL™) и антагонист рецептора IL-1 (ANAKINRA™). Эти виды лечения работают путем блокировки способности соответствующих цитокинов связываться с естественными рецепторами. В настоящее время исследуются альтернативные способы лечения опосредованных цитокинами заболеваний. Один из таких методов включает ингибирование сигнального пути, который регулирует синтез и продуцирование провоспалительных цитокинов, таких как р38.
Цитокин Р38 (также известный как CSBP или RK) представляет собой серин/треонин-митоген-активированную протеинкиназу (МАРК), которая, как было показано, регулирует провоспалительные цитокины. Сначала Р38 МАРК была идентифицирована как киназа, которая становится тирозинфосфорилированной в моноцитах мышей после лечения липосахаридом (LPS). Связь между р38 МАРК и ответной реакцией клеток на цитокины была впервые установлена Саклатвалой с сотр. (Saklatvala et al., Cell, 1994, 78:1039-1049), которые показали, что IL-1 активирует каскад протеинкиназы, что приводит к фосфорилированию небольшого белка теплового шока, Hsp27, вероятно, активированной митоген-акктивированным белком протеинкиназой 2 (МАРКАР киназа-2). Анализ последовательностей пептидов, полученных из очищенной киназы, показывает, что она родственна р38 МАРК, активированной LPS в моноцитах мыши (Han, J., et al., Science, 1994, 265:808-811). В то же время показано, что сама р38 МАРК активируется киназой в обратном направлении в ответ на множество клеточных стрессов, включающих УФ-облучение и осмотический шок, и была подтверждена идентичность киназы, которая непосредственно фосфорилирует Hsp27, как МАРКАР киназа-2 (Rouse, J., et al., Cell, 1994, 78:1027-1037). Впоследствии было показано, что р38 МАРК является молекулярной мишенью ряда производных пиридинилимидазола, которые ингибируют продупирование TNF из LPS-стимулированных моноцитов человека (Lee, J., et al., Nature, 372:739-746). Это было главным открытием, которое привело к разработке ряда селективных ингибиторов р38 МАРК и прояснению ее роли в цитокиновой передаче сигнала.
Теперь известно, что разнообразные формы р38 МАРК (α, β, γ, δ), каждая из которых кодирована отдельным геном, образуют часть каскада киназы, участвующего в реакции клеток на целый ряд стимулов, включающих осмотический стресс, УФ-свет и опосредованные цитокинами явления. Считается, что эти четыре изоформы р38 регулируют различные аспекты внутриклеточной передачи сигнала. Активация р38 представляет собой часть каскада передачи сигнала, которая приводит к синтезу и продуцированию провоспалительных цитокинов, таких как TNF-α. Р38 функционирует путем фосфорилирования субстратов в прямом направлении, которое включает другие киназы и факторы транскрипции. Показано, что агенты, которые ингибируют р38 МАРК, блокируют продуцирование цитокинов, включающих TNF-α; IL-6, IL-8 и IL-1β, но не ограниченных ими, в моделях in vitro и in vivo (Adams, J.L., et al., Progress in Medicinal Chemistry, 2001, 38:1-60).
Abl (известный также как Ableson) представляет собой тирозинкиназу, которая экспрессируется в гемопоэтических клетках и участвует в развитии различных «жидких опухолей», включающих хронический миелоидный лейкоз (CML) и острый лимфобластный лейкоз (ALL). Трансформация является результатом транслокации хромосомы, известной под названием филадельфийская хромосома. Это приводит к существенно активированной химере между Ableson и областью локализации сайта инициации реаранжировки (BCR) - Abl-BCR белку. Препарат GLEEVEC®, известный также под названием иматиниб (новартис), представляет собой сильный ингибитор Abl и в настоящее время используется для лечения пациентов с CML (N. Engl. J. Med., 2001, 344:1031-1037). Упомянутое лекарственное средство становится стандартом лечения при этом смертельном заболевании, и его также проверяют на целом ряде других злокачественных новообразований, включающих гастроинтестинальные стромальные опухоли (GIST).
Имеется подтверждение того, что фибробласты реагируют на белок фактора роста TGF-β, стимулируя Аbl-путь, и приводят к морфологическим изменениям, свидетельствующим о фиброзе; следовательно, Аbl мог бы играть роль в патогенезе фибротических заболеваний, подобных идиопатическому фиброзу легких. Леоф с сотр. (Leof et al., J. Clin. Invest., 2004, 114(9) 1308-1316) показали доклиническую эффективность препарата GLEEVEC® на модели опосредуемого блеомицином фиброза легких у мышей. В настоящее время препарат GLEEVEC® оценивают на пациентах с фиброзом легких.
Цитокин ТЕК (известный также под названием Tie-2) представляет собой еще один рецептор тирозинкиназы, экспрессируемый только на эндотелиальных клетках, которые, как было показано, играют роль в ангиогенезе. Связывание фактора ангиопоэтина-1 приводит в результате к аутофосфорилированию киназного домена ТЕК и процессу трансдукции сигнала, который, по-видимому, опосредует взаимодействие эндотелиальных клеток с периэндотелиальными поддерживающими клетками, тем самым способствуя развитию вновь образованных кровеносных сосудов. С другой стороны, фактор ангиопоэтин-2, по-видимому, противодействует действию ангиопоэтина-1 на ТЕК и нарушает ангиогенез (Maisonpierre et al., Science, 1997, 277:55-60). Цитокин Tie2 подвергается позитивной регуляции в ангиогенных сосудах опухоли (Trogan, E. Br. J. Cancer, 1998, 77:51-56), и существует доказательство того, что он может играть поддерживающую роль в гемопоэтических видах рака (L.Naldini et al., Cancer Cell, 2005, 8:211-226; Suda, T. et al., Cell, 2004, 118:149-161). Кроме его возможной роли в развитии рака, ангиогенез, возможно, также связан с заболеваниями, подобными ревматоидному артриту (RA), псориазу, и с равитием патологий, вызываемых воспалением. Образование паннуса, разрушительного легиона, ответственного за прогрессирование артрита, частично управляется образованием новых кровеносных сосудов, а патологическая роль Tie2 продемонстрирована недавно в работе (Lin, С.et al., Arthritis и Rheumatism, 2005, 52(5):1585-1594) на артритных моделях RA, индуцированного коллагеном у мышей. Следовательно, ингибирование Tie2 могло бы дать полезный эффект в отношении пролиферативных и воспалительных заболеваний.
Несколько других киназ связаны с прогрессированием пролиферативных заболеваний, таких как рак. Среди них многочисленные белки семейства Src, как показано, играют ту же роль, что Src и, возможно, предоставляют параллельные пути передачи сигнала во время неконтролируемой клеточной пролиферации. Основные примеры включают тирозинкиназы Lyn, Fyn, Lck и Hck. Lyn и Hck причастны к развитию острого лимфобластного лейкоза В-клеток (B-ALL), гемопоэтического рака В-клеток (Li, S. et al. Nat Genet., 2004 36(5):453-461).
Семейство рецепторов тирозинкиназы Eph (эритропоэтин продуцирующая гепатомная амплифицированная последовательность) связывает эфрины, которые управляют многочисленными клеточными процессами. По-видимому, Ephs играют роль модулирования адгезии, моторики и инвазивности опухолевых клеток, и некоторые доказательства демонстрируют активную роль Ephs и эфринов в образовании новых кровеносных сосудов во время патологических процессов. Рецепторы Eph A сверхпродуцируются в сосудистой сети опухолей легких, почек и желудка, и показано, что доминантно-негативные растворимые белки EphA2 или A3 модулируют ангиогенез и прогрессирование опухолей in vivo (Lackmarm M. et al., IUBMB Life, 2005, 57(6):421-31).
Эндотелиальные факторы роста сосудов и родственные им рецепторы, например KDR (VEGFR2) и FLT1 (VEGFRR1), являются основными регуляторами ангиогенеза. Белковое терапевтическое средство AVASTIN®, как было показано, является перспективным для лечения рака прямой кишки и действует посредством VEGFR-пути. SUTENT/SU11248 (сунитиниб малеат) (Pfizer) представляет собой сильнодействующий ингибитор KDR, он показал многообещающие результаты против карцином желудочно-кишечного тракта (GIST) и ренальных клеток.
Показано, что периферические моноциты крови (РВМС) экспрессируют и секретируют провоспалительные цитокины при стимуляции липополисахаридом (LPS) in vitro. Ингибиторы Р38 эффективно блокируют указанное действие, когда РВМС предварительно обрабатывают такими соединениями до стимуляции LPS (Lee, J.C., et al., Int. J. Immunopharmacol., 1988, 10:835-843). Эффективность ингибиторов р38 на моделях воспалительных заболеваний на животных стимулировала исследования основных механизмов, которые могли бы объяснить действие упомянутых ингибиторов. Роль р38 в реакции клеток на IL-1 и TNF исследовалась на ряде клеточных систем, имеющих отношение к воспалительной реакции с использованием пиридинилимидазольного ингибитора, таких как эндотелиальные клетки и IL-8 (Hashimoto, S., et al., J. Pharmacol. Exp. Ther., 2001, 293:370-375), фибробласты и IL-6/GM-CSF/PGE2 (Beyaert, R., et al., EMBO J., 1996, 15:1914-1923), нейтрофилы и IL-8 (Albanyan, E. A., et al.. Infect. Immun., 2000, 68:2053-2060) макрофаги и IL-1 (Caivano, M. и Cohen, P., J. Immunol., 2000, 164:3018-3025) и гладкомышечные клетки и RANTES (Maruoka, S., et al., Am. J. Respir. Crit. Care Med., 1999, 161:659-668). Деструктивные эффекты многих болезненных состояний вызваны сверхпродуцированием провоспалительных цитокинов. Способность ингибиторов р38 регулировать это сверхпродуцирование делает их превосходными кандидатами в качестве средств, модифицирующих заболевания.
Известные ингибиторы р38 МАРК проявляют активность на целом ряде моделей широко известных заболеваний. Ингибиторы р38 МАРК показывают положительные эффекты на ряде стандартных моделей воспаления у животных, включающих индуцированный коллагеном артрит у крыс (Jackson, J.R., et al., J. Pharmacol. Exp. Ther., 1998, 284:687-692); индуцированный адъювантом артрит у крыс (Badger, A. M., et al., Arthritis Rheum., 2000, 43:175-183; Badger, A.M., et al., J. Pharmacol. Exp. Ther., (1996) 279:1453-1461) и индуцированный каррагенаном отек лап у мышей (Nishikori, Т., et al., Eur. J. Pharm., 2002, 451:327-333). Молекулы, которые блокируют функцию р38, как показано, эффективны в отношении ингибирования резорбции костей, воспаления и других иммунных и обусловленных воспалением патологий на упомянутых моделях у животных.
Следовательно, безопасный и эффективный ингибитор киназ предоставил бы средства для лечения изнурительных заболеваний, которые можно регулировать модуляцией одной или нескольких киназ.
Публикация международной патентной заявки WO 2004/078116 раскрывает некоторые соединения в качестве ингибиторов киназ. Среди упомянутых соединений находятся некоторые N1-замещенные производные индазола, имеющие заместитель в положении 5, который содержит пиразол-5-илмочевинную группу. Примеры таких соединений включают соединения примеров 94 и 138, в которых N1 заместитель представляет собой соответственно метильную группу и 2-гидрокси-2-метилпропильную группу.
В настоящее время обнаружено, что соединения, обладающие наиболее желательными свойствами, можно получить, выбрав первичную спиртовую группу -СН2СН2OН, в качестве заместителя N1 и конкретный заместитель в положении 5, содержащий 3-трет-бутил-1-п-толил-1Н-пиразол-5-ильную группу.
Сущность изобретения
Настоящее изобретение относится к соединениям, которые ингибируют одну или несколько киназ и опосредованные киназами явления, такие как ингибирование продуцирования цитокинов, ангиогенез или клеточная пролиферация. Такие соединения находят применение в качестве терапевтических средств для заболеваний, которые можно лечить путем ингибирования сигнальных путей киназ.
Подробное описание изобретения
Один объект изобретения относится к соединению формулы I:
или его фармацевтически приемлемой соли.
Соединение может также быть описано химическим названием 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевина.
Обнаружено, что соединение формулы I обладает сильной активностью против некоторых киназ. Кроме того, наблюдается, что растворимость соответствующего соединения, в котором заместитель N1 замещен сложноэфирной фосфатной группой формулы -СН2СН2OРО3Н, на несколько порядков выше, чем растворимость соединения формулы I. Таким образом, соединение формулы I обладает уникальной возможностью для создания растворимых пролекарств. Более конкретно, как показано далее данными испытаний, соединение формулы I является существенно более сильнодействующим ингибитором Аbl и Tie2, чем соединения примеров 94 и 138 из WO 2004/078116. Кроме того, соединения примеров 94 и 138 из WO 2004/078116 не содержат первичную спиртовую группу, которая может быть дериватизирована для получения пролекарства.
Кроме соединения формулы I, изобретение также включает фармацевтически приемлемые соли соединения и сольваты соединения и его фармацевтически приемлемые соли.
Термин «фармацевтически приемлемый» указывает, что вещество или композиция совместима химически и/или токсикологически с другими ингредиентами, составляющими рецептуру, и/или с млекопитающими, которые подвергаются лечению ею.
Термин «сольват» относится к ассоциации или комплексу одной или нескольких молекул растворителя и соединения по изобретению. Примеры растворителей, которые образуют сольваты, включают воду, изопропанол, этанол, метанол, ДМСО, этилацетат, уксусную кислоту и этаноламин, но не ограничиваются ими. Термин «гидрат» относится к комплексу, в котором молекулой растворителя является вода.
Еще один объект настоящего изобретения относится к применению соединения формулы I в изготовлении лекарственного средства для лечения опосредованного киназами состояния у млекопитающего.
В еще одном объекте изобретение относится к способу лечения или профилактики опосредованного киназами состояния, включающему введение соединения формулы I в количестве, эффективном для лечения или профилактики опосредованного киназами состояния.
Изобретение также относится к пролекарствам соединения формулы I.
Термин «пролекарство» относится к соединению, которое можно превращать в физиологических условиях или путем сольволиза в конкретное соединение или в соль такого соединения.
Свободная гидроксигруппа соединения по изобретению может давать производное в качестве пролекарства путем превращения гидроксигруппы в такую группу, как (но не ограничивается перечисленными ниже) сложноэфирнофосфатная phosphate ester, полусукцинатная, диметиламиноацетатная или фосфорилоксиметилоксикарбонильная группа, как изложено в монографии (Advanced Drug Delivery Reviews, 1996, 19, 115). Карбаматные пролекарства гидроксигрупп также включены, как и карбонатные пролекарства, сульфонатные сложные эфиры и сульфатные сложные эфиры гидроксигрупп. Дериватизация гидроксигрупп с получением таких производных, как (ацилокси)метиловые и (ацилокси)этиловые простые эфиры, в которых ацильная группа может быть алкиловым сложным эфиром, необязательно замещенным группами, включающими эфирную, аминную и карбоксильную функциональные группы, но не ограниченными ими, или ацильная группа, представляющая собой сложный эфир аминокислоты, как описано выше, также включена. Пролекарства такого типа описаны в работе (J. Med. Chem., 1996, 39, 10). Более конкретные примеры включают замену атома водорода спиртовой группы такой группой, как (С1-С6)алканоилоксиметил, 1-((С1-С6)алканоилокси)этил, 1-метил-1-((С1-С6)алканоилокси)этил, (С1-С6)алкоксикарбонилоксиметил, N-(C1-С6)алкоксикарбониламинометил, сукциноил, (С1-С6)алканоил, α-амино(С1-С4)алканоил, арилацил и α-аминоацил или α-аминоацил-α-аминоацил, где каждая α-аминоацильная группа независимо выбрана из встречающихся в природе L-аминокислот, Р(O)(ОН)2, -Р(О)(O(С1-С6)алкил)2 или гликозил (радикал, возникающий при удалении гидроксильной группы полуацетальной формы углевода).
Таким образом, еще один объект настоящего изобретения относится к применению пролекарства соединения формулы I в изготовлении лекарственного средства для лечения соединением по пункту 1 состояния, опосредованного киназами у млекопитающего. В одном варианте осуществления изобретения пролекарство представляет собой фосфатное пролекарство.
Еще один объект настоящего изобретения относится к способу лечения или профилактики опосредованного киназами состояния у млекопитающего соединением формулы I, включающему введение млекопитающему пролекарства соединения формулы I в количестве, эффективном для лечения или профилактики упомянутого опосредованного киназами состояния. В одном варианте осуществления изобретения пролекарство представляет собой фосфатное пролекарство.
В соответствии с еще одним объектом изобретения настоящее изобретение относится к 2-(5-(2-((3-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)уреидо)метил)-4-фтор-фенокси)-1Н-индазол-1-ил)этилдигидрофосфату или его фармацевтически приемлемой соли.
Не желая связывать себя теорией, полагают, что фосфатный сложный эфир действует как пролекарство для соответствующего первичного спирта.
Как описано выше, было обнаружено, что фосфатный сложный эфир соединения формулы I обладает особенно хорошей растворимостью.
Термин «фармацевтически приемлемая соль», если не указано иное, включает соли, которые сохраняют биологическую эффективность соответствующей свободной кислоты или основания конкретного соединения и не являются нежелательными биологически или каким-либо иным образом. Соединение по изобретению может содержать достаточно кислую группу, достаточно основную группу или функциональные группы обоих типов и соответственно реагировать с любым числом неорганических или органических оснований или кислот с образованием фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей включают соли, полученные реакцией соединений по настоящему изобретению с неорганической или органической кислотой или с неорганическим основанием. Такие соли, включают сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, γ-гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты, но не ограничиваются ими. Так как единичные соединения по изобретению могут включать более одного кислотного или основного остатка, соединения по настоящему изобретению могут содержать моно-, ди- или три соли в одном соединении.
Если соединение по изобретению представляет собой основание, желательная фармацевтически приемлемая соль может быть получена любым подходящим способом, имеющимся в данной области техники, например обработкой свободного основания кислым соединением, например неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидильная кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота или подобные.
Если соединение по изобретению представляет собой кислоту, желательная фармацевтически приемлемая соль может быть получена любым подходящим способом, имеющимся в данной области техники, например обработкой свободной кислоты неорганическим или органическим основанием. Примеры подходящих неорганических солей включают соли, образованные щелочными и щелочноземельными металлами, такими как литий, натрий, калий, барий и кальций. Примеры подходящих солей органических оснований включают, например, соли аммония, дибензиламмония, бензиламмония, 2-гидроксиэтиламмония, бис(2-гидроксиэтил)аммония, фенилэтилбензиламина, дибензилэтилендиамина и им подобные соли. Другие соли кислотных остатков могут включать, например, соли, образованные с прокаином, хинином и N-метилглюкозамином, плюс соли, образованные с основными аминокислотами, такими как глицин, орнитин, гистидин, фенилглицин, лизин и аргинин.
Соединения формулы I включают также и другие свои соли, которые необязательно являются фармацевтически приемлемыми солями и которые могут использоваться в качестве промежуточных соединений для получения и/или очистки соединений формулы I и/или для разделения энантиомеров соединений формулы I.
Изобретение также охватывает меченные изотопами соединения по настоящему изобретению, которые идентичны соединениям, перечисленным здесь, но за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или атомное число, которые отличаются от атомной массы или атомного числа, обычно встречающихся в природе. Меченные изотопами соединения по настоящему изобретению можно обычно получать по следующим методикам, аналогичным методикам, раскрываемым на схемах и/или в примерах, приведенных ниже, путем замены реагента, не содержащего изотопной метки, реагентом, меченным изотопом.
Синтез соединений по изобретению
Соединения по настоящему изобретению можно получать синтетическими путями, которые включают способы, аналогичные способам, хорошо известным в химии, или как описано в публикации международной патентной заявки WO 2004/078116, в частности, учитывая описание, которое содержится здесь. Исходные вещества обычно доступны из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, WI), или легко получаются способами, которые хорошо известны специалистам в данной области техники (например, получаются способами, как правило, описанными в справочных изданиях (Louis F. Fieser и Mary Fieser, Reagents for Organic Synthesis, v.1-19, Wiley, N.Y. (1967-1999 ed.) или (Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая дополнения (доступны также через online базу данных Beilstein).
Еще один объект настоящего изобретения относится к способу получения соединения формулы I или его фармацевтически приемлемой соли, который включает:
(а) сочетание соединения формулы II
или его соли, в которых Р1 представляет собой атом водорода или группу, защищающую гидроксил, с соединением формулы III
в котором Z представляет собой уходящую группу, или с соответствующим изоцианатом; или
(b) восстановление соединения формулы IV
в котором Re представляет собой атом водорода или спиртовый остаток;
с последующим удалением любой защитной группы и, если требуется, образованием фармацевтически приемлемой соли.
Примеры удобных групп, защищающих гидроксил, обозначенных Р1, включают циклические полукетали, такие как тетрагидро-2Н-пиран-2-ил.
Уходящая группа, обозначенная Z, может представлять собой, например, незамещенную или замещенную гидрокарбилоксигруппу, например галоген(1-6С)алкоксигруппу, такую как 2,2,2-трихлорэтокси, алкенилоксигруппу, такую как CH2=O(CH3)O-, или арилоксигруппу, необязательно замещенную, например, одной или несколькими группами, выбранными из F, Cl, Вr и NO2. Конкретные значения для необязательно замещенной арилоксигруппы включают фенокси, 4-хлорфенокси, 4-бромфенокси, 4-фторфенокси, 4-нитрофенокси и 2-нитрофенокси. В конкретном варианте осуществления изобретения Z представляет собой фенокси.
Показано, что соединение II можно успешно выделять с хорошим выходом и высокой степенью чистоты без стадии хроматографии, когда Z в соединении III представляет собой необязательно замещенную арилоксигруппу, такую как феноксигруппа.
Сочетание соединения формулы (II) с соединением формулы (III), когда Z представляет собой необязательно замещенную феноксигруппу, удобно проводить при температуре от 0 до 100°С, и более конкретно при температуре окружающей среды. Подходящие растворители включают апротонные растворители, такие как простые эфиры (например, тетрагидрофуран или п-диоксан), ДМФА, ДМСО или ацетонитрил. Реакцию сочетания удобно проводить в присутствии основания, такого как третичный амин (например, триэтиламина или DMA).
Конкретные значения Re, когда он обозначает остаток спирта, включают (1-6С)алкоксигруппы, такие как этокси.
Соединения формул (II) и (IV), как полагают, являются новыми и относятся к дополнительным объектам изобретения.
Соединения формулы (III), где Z представляет собой необязательно замещенную арилоксигруппу, как полагают, также являются новыми и относятся к дополнительным объектам изобретения.
Еще одним объектом настоящего изобретения является способ получения фосфатного пролекарства соединения формулы I, т.е. 2-(5-(2-((3-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)уреидо)метил)-4-фторфенокси)-1Н-индазол-1-ил)этилдигидрофосфата или его фармацевтически приемлемой соли, который включает фосфорилирование 1-(3-трет-бутил-1-п-толил-1Н-пиразол-5-ил)-3-(5-фтор-2-(1-(2-гидроксиэтил)-1Н-индазол-5-илокси)бензил)мочевины или ее соли.
Фосфорилирование удобно осуществлять взаимодействием спирта с диалкил- или диарилдиалкилфосфинамидитом, таким как ди-трет-бутил диизопропилфосфинамидит или дифенилдиизопропилфосфинамидит, с последующим удалением алкильных или арильных групп на фосфатном продукте гидролизом или каталитическим гидрированием.
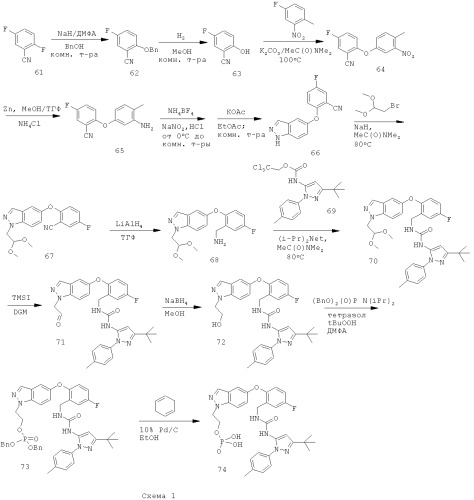
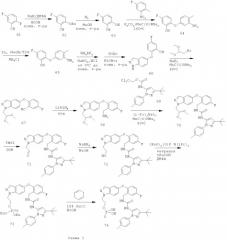
Для пояснения на схемах 1 и 2 и в примерах иллюстрируются способы получения соединений по настоящему изобретению, а также ключевых интермедиатов. Специалисты в данной области поймут, что для синтеза соединений по настоящему изобретению можно использовать другие синтетические пути. Хотя конкретные исходные вещества и реагенты описаны в схемах и рассматриваются ниже, их можно легко заменить другими исходными веществами и реагентами, чтобы обеспечить получение целого ряда производных и/или условия реакции. Кроме того, многие из соединений, полученных способами, описанными ниже, могут быть дополнительно модифицированы с учетом данного описания с помощью традиционной химии, хорошо известной специалистам.
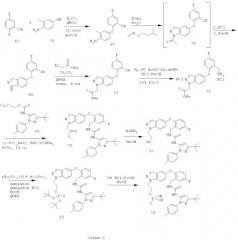
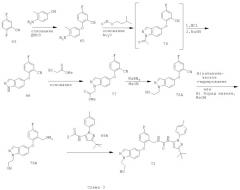
Восстановление нитрильной группы в соединении 77, как показано на схеме 2, требует высоких концентраций кислоты (например, НСl или уксусной кислоты), чтобы свести к минимуму образование димера. Однако более высокие концентрации кислоты могут вызвать гидролиз сложноэфирного производного 78 в соответствующую кислоту. Схема 3 иллюстрирует усовершенствованный способ получения соединения формулы I, который уменьшает образование примесей димера и кислоты.
Схема 3 иллюстрирует способ восстановления сложноэфирной группы соединения 77 в соответствующую спиртовую группу перед проведением восстановления нитрильной группы, чтобы получить соединение 79А, не содержащее примесей кислот и с минимальным содержанием примесей димера.
Более конкретно, соединение 77 можно восстанавливать по стадиям: сначала сложноэфирную группу восстанавливают натрийборгидридом в подходящем растворителе, чтобы получить соответствующее спиртовое производное 78А. Затем восстанавливают нитрильную группу соединения 78А в стандартных условиях каталитического гидрирования или действием борида никеля в подходящем органическом растворителе и получают соответствующее метиламиносоединение 79А.
Путь, показанный на схеме 3, обеспечивает несколько преимуществ, по сравнению с путями, показанными на схеме 2, для образования соединения формулы I. Используя пути, показанные на схеме 3, восстановление нитрильной группы можно осуществлять при более высоких концентрациях НСl, что благоприятствует снижению количества примеси образующегося димера. Кроме того, путь, показанный на схеме 3, отменяет использование натрийборгидрида на конечной стадии, что позволяет избежать дополнительных стадий очистки для удаления остаточных борных примесей из конечного продукта. Таким образом, путем исключения стадии восстановления боргидридом натрия ранее в последовательности реакций, остаточный бор можно легко удалить во время промежуточных стадий последовательности. Кроме того, реакцию сочетания аминоспирта 79А с соединением 69А можно проводить при более низких температурах, повышая таким образом чистоту продукта 72. Соответственно, путь, показанный на схеме 3, дает возможность улучшить производительность синтеза соединения формулы I и в результате обеспечивает эффективный синтетический путь получения соединения формулы I, который является более приспособляемым для крупномасштабного производства или более подходящим для такого производства.
Соответственно, предоставляется также способ получения соединения формулы (II), включающий:
(1) восстановление соединения формулы (V)
в котором Р2 представляет собой водород или группу, защищающую гидроксил, в условиях каталитического гидрирования или в присутствии борида никеля.
Касательно стадии (i): катализаторы гидрирования включают любой подходящий палладиевый катализатор, такой как Pd(OH)2 или палладий, нанесенный на уголь. Гидрирование происходит в кислых условиях (таких, как при прибавлении кислоты, например НС1 или уксусной кислоты) или при добавлении аммиака. Каталитическое гидрирование можно проводить в любой подходящей системе растворителей, таких как спирт (например, метанол, этанол, изопропанол), сложный эфир (например, этилацетат) или простой эфир (например, ТГФ). Смешанные растворители, например спирт и ТГФ, также подходят для стадии гидрирования. Давление водорода может составлять от 25 до 100 фунт/кв. дюйм, например 40 фунт/кв. дюйм. Восстановление обычно проводят при температурах от 20 до 100°С.
Касательно стадии (i): борид никеля можно получать in situ из соли переходного металла, предпочтительно соли Ni(II), и натрийборгидрида. В предпочтительном варианте осуществления изобретения борид никеля получают из хлорида никеля (II) и натрийборгидрида. Реакцию удобно проводить в подходящем растворителе, таком как спирт (например, метанол, этанол, изопропанол). Восстановление обычно проводят при температуре окружающей среды.
Соединение формулы (V) может быть получено восстановлением соединения формулы (VI)
где Р3 такой, как определено для Р2, используя условия восстановления для любого сложного эфира (например, натрийборгидрид) в подходящем растворителе, таком как спирт (например, метанол, этанол, изопропанол).
При получении соединений по настоящему изобретению может быть необходима защита отдельных функциональных групп (например, первичных или вторичных аминогрупп, спиртов и т.п.) промежуточных соединений. Необходимость такой защиты будет варьироваться в зависимости от природы функциональной группы и условий способов получения. Например, подходящие аминозащитные группы (NH-Pg) включают ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Удобные защитные группы для гидроксила включают тетрагидро-2Н-пиран-2-ильную, бензильную, триалкилсилильную и ацетальную. Необходимость такой защиты легко определяет специалист в данной области. Для общего описания защитных групп и их применения см. (Т.W.Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991).
СПОСОБЫ ЛЕЧЕНИЯ
Соединения по изобретению можно использовать для лечения заболеваний, опосредованных модуляцией или регуляцией протеинкиназ. Соответственно, еще один объект изобретения относится к способам лечения или профилактики заболеваний или состояний, описанных здесь, путем введения млекопитающему, например человеку, терапевтически эффективного количества соединения по настоящему изобретению или его сольвата, метаболита или фармацевтически приемлемой соли в количестве, эффективном для лечения или профилактики указанного заболевания. В одном варианте осуществления изобретения способ включает введение млекопитающему соединения по настоящему изобретению в количестве, эффективном для ингибирования одной или нескольких киназ.
Термин «эффективное количество» относится к количеству соединения, которое при введении млекопитающему, нуждающемуся в таком лечении, является достаточным, чтобы осуществить лечение заболевания, опосредованного активностью одной или нескольких протеинкиназ, таких как р38 МАРК, и связанных с ними явлений, опосредованных киназами, таких как продуцирование цитокинов. Так, например, терапевтически эффективное количество соединения по настоящему изобретению, или его соли, или его активного метаболита представляет собой количество, достаточное для модуляции, регуляции или ингибирования активности одной или нескольких протеинкиназ таким образом, чтобы уменьшить или облегчить болезненное состояние, которое опосредовано такой активностью.
Термин «лечение» предназначен для обозначения по меньшей мере облегчения болезненного состояния у млекопитающего, например человека, на которое влияет, по меньшей мере частично, активность одной или нескольких протеинкиназ. Термины «лечить» и «лечение» относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, где объект должен предотвратить или замедлить (уменьшить) нежелательное физиологическое изменение или нарушение. Для целей настоящего изобретения полезные или желательные клинические результаты включают (но не ограничиваются ими) облегчение симптомов, уменьшение степени развития заболевания, стабилизированное (т.е. не ухудшающееся) состояние болезни, задержка или замедление прогрессирования заболевания, улучшение или облегчение болезненного состояния и ремиссию (или частичную, или полную), или определяемую, или неопределяемую. «Лечение» может также означать продление времени жизни по сравнению с временем жизни, ожидаемым при отсутствии лечения. Выражение «те, кто нуждается в лечении» включает тех, кто уже страдает рассматриваемым заболеванием или состоянием, а также тех, кто подвержен такому заболеванию или состоянию, или тех, у кого необходимо предотвратить такое заболевание или состояние.
Количество соединения по настоящему изобретению, вводимое млекопитающему, будет варьироваться в зависимости от ряда факторов, таких как конкретное соединение, болезненное состояние и его тяжесть, особенность (например, масса тела) млекопитающего, нуждающегося в лечении, но может быть определено по стандартной методике специалистом в данной области.
Термин «млекопитающее», используемый здесь, относится к теплокровному животному, которое страдает заболеванием, описанным здесь, или для которого существует риск развития такого заболевания, и включает (но не ограничивается перечисленными ниже) морских свинок, собак, кошек, крыс, мышей, хомяков и приматов, в том числе людей.
Один объект настоящего изобретения относится к соединениям по настоящему изо