N,n-дизамещенные никотинамид-(z)-o-метилоксимы, обладающие фунгицидной активностью
Иллюстрации
Показать всеИзобретение относится к химии N,N-дизамещенным никотинамид-(Z)-O-метилоксимам общей формулы I
где если Х означает метиленовую группу, то R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, если X означает карбонильную группу, то R означает стирил, n-хлорстирил или бензил, R' означает метил, обладающий фунгицидной активностью. Технический результат: получены и описаны новые соединения, которые могут быть эффективны против вредоносных грибов. 10 пр., 1 табл.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к N,N-дизамещенным никотинамид-(Z)-O-метилоксимам общей формулы I, где если Х означает метиленовую группу, то R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, если Х означает карбонильную группу, то R означает стирил, n-хлорстирил или бензил, R' означает метил, обладающим фунгицидной активностью
N,N - дизамещенные никотинамид-(Z)-O-метилоксимы общей формулы I могут найти применение для борьбы с вредоносными грибами в медицине, ветеринарии, сельском хозяйстве, строительстве.
Известны соединения общей формулы II, где R означает орто-замещенный фенил [Патент ЕР 477631, 1990], обладающий фунгицидной активностью
Известны азадиоксациклоалкены общей формулы III
где Е означает метиленовую группу, А означает замещенный арил или гетарил, обладающие фунгицидной активностью [Пат. WO 95/04728, 1993].
Среди производных никотиновой кислоты наиболее близки по структуре к соединениям формулы I никотинамиды общей формулы IV
где Х означает 2-фурил, 2-пиридил, 3-пиридил, незамещенный или замещенный атомом галогена фенил, Y означает незамещенный, замещенный атомом галогена или бензилокси-группой фенил, проявляющие фунгитоксичность [Пат. РФ 2341525, 2008].
Несмотря на эффективность существующих сегодня фунгицидных препаратов, поиск новых средств борьбы с вредоносными грибами всегда остается актуальным из-за появления резистентных штаммов.
Техническая задача, решаемая настоящим изобретением, состоит в расширении ассортимента фунгицидов для более эффективной борьбы с вредоносными грибами.
Поставленная задача решается получением N,N-дизамещенных никотинамид-(Z)-O-метилоксимов общей формулы I, где если Х означает метиленовую группу, то R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, если Х означает карбонильную группу, то R означает стирил, n-хлорстирил или бензил, R' означает метил, обладающих фунгицидной активностью.
N,N - дизамещенные никотинамид-(Z)-O-метилоксимы общей формулы I, где Х означает метиленовую группу, R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, могут быть получены метилированием N,N-дизамещенных (Z)-никотинамидоксимов общей формулы V, где Х означает метиленовую группу, R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, в присутствии оснований различными метилирующими агентами, например диметилсульфатом, по известной методике [Rubina K. O-Alkylation of pyridine aldoximes under phase-transfer conditions. / Rubina K., Goldberg Yu., Gaukhman A., Shymanska M. // Synth. Comm. - 1989. - P.3129-3138.]:
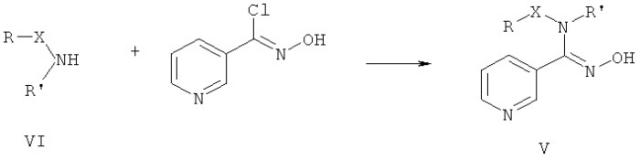
а также взаимодействием литиевых солей соединений общей формулы VI, где X, R и R' имеют те же значения, что и в формуле V, с O-метилникотингидроксамоилхлоридом:
Реакции взаимодействия O-замещенных гидроксамоилхлоридов с основаниями описаны в литературе [Andersen N.H. Reaction of O-Methylbenzohydroximoyl Chlorides with Sodium Methoxide. Inversion of Configuration at Trigonal Carbon during Nucleophilic Substitution. / Andersen N.H., Costin C.R., Syrdal D.D., Svedberg D.P. // J. Am. Chem. Soc. - 1973. - P. 2051-2051].
Соединения общей формулы V могут быть получены известным способом из никотингидроксамоилхлорида и аминов общей формулы VI, где X, R и R' имеют те же значения, что и в формуле V:
Аналогичные реакции описаны в литературе [Ехnеr О. Configuration and conformation of amidoximes. N,N-dialkyl derivatives. / Exner 0., Motekov N. // Coll. Czech Chem. Comm. -1982. - Vol.47. - P. 814 - 827].
N,N-дизамещенные никотинамид-(Z)-O-метилоксимы общей формулы I, где Х означает карбонильную группу, R означает стирил, n-хлорстирил или бензил, R' означает метил, могут быть получены ацилированием хлорангидридами кислот VII, где R означает стирил, n-хлорстирил или бензил, соединений общей формулы VIII, где R' означает метил:
Соединения общей формулы VIII в свою очередь могут быть получены аналогично соединениям общей формулы V из соответствующих аминов. Никотингидроксамоилхлорид и O-метилникотингидроксамоилхлорид могут быть получены известными способами из соответствующих альдоксимов прямым хлорированием, а также из соответствующих N,N-незамещенных амидоксимов по реакции диазотирования. Такие способы представлены в литературе [Chiang Y.H. Chlorination of oximes. I. Reaction and mechanism of the chlorination of oximes in commercial chloroform and methylene chloride. / Chiang Y.H. // J. Org. Chem. - 1971. - Vol.36 - P. 2146-2155].
Изобретение может быть проиллюстрировано следующими примерами.
Пример 1. Раствор 1,65 г (8,55 ммоля) гидрохлорида никотингидроксамоилхлорида в 10 мл МеОН прибавляли по каплям к 4 мл 7 М раствора MeNH2 в МеОН при 0-5°С и перемешивали при указанной температуре 8 ч. Растворитель отгоняли в вакууме, к остатку добавляли 15 мл воды и экстрагировали СНСl3 (3×10 мл). Экстракт сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент СНСl3-МеОН 10:1). Получили 1.05 г (79%) (Z)-N-метилникотинамидоксима в виде белого порошка с т.пл. 108-110°С. Спектр ЯМР 1Н ((CD3)2SO, δ, м.д., J, Гц): 2.59 (д, 3 Н, СН3, J=6.6); 5.91 (к, 1 Н, NH, J=6.6); 7.41-7.49 (м, 1Н, 5-СН ру); 7.83 (д, 1 Н, 4-СН ру, J=8.3); 8.61 (д, 1 Н, 6-СН ру, J=4.2); 8.62 (с, 1 Н, 2-СН ру); 9.81 (с, 1 Н, ОН).
Пример 2. Раствор 1,30 г (6,7 ммоль) гидрохлорида никотингидроксамоилхлорида в 25 мл МеОН прибавляли по каплям к 2,42 г (20 ммоль) N-метил-N-бензиламина в 30 мл МеОН при 0-5°С и перемешивали при указанной температуре 8 ч. Растворитель отгоняли в вакууме, к остатку добавляли 15 мл воды и экстрагировали СНСl3 (3×10 мл). Экстракт сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент СНСl3-МеОН 10:1). Получили 1,29 г (80%) (Z)-N-метил-N-бензилникотинамидоксима в виде белого порошка с т.пл. 126-128°С. Спектр ЯМР 1H ((СD3)2SO, δ, м.д., J, Гц): 2.60 (с, 3 Н, СН3); 4.07 (с, 2 Н, СН2); 7.18-7.28 (м, 3 Н, СН Ph); 7.29-7.37 (м, 2 H, СН Ph); 7.43-7.51 (м, 1 Н, 5-СН ру); 7.81 (д, 1 Н, 4-СН ру, J=9.4); 8.56 (с, 1 Н, 2-СН ру); 8.58 (д, 1 Н, 6-СН ру, J=6.2); 9.39 (с, 1 Н, ОН).
Пример 3. Смесь 0.37 г (6.8 ммоля) MeONa метилата натрия, 15 мл сухого ДМФА и 1.03 г (6.8 ммоль) N-метилникотинамидоксима охлаждали до 0°С и прибавляли к ней по каплям 0.65 мл (6.8 ммоль) диметилсульфата, поддерживая температуру 0-5°С. Реакционную массу перемешивали в течение 6 часов при той же температуре. Затем ДМФА удаляли в вакууме, а остаток растворяли в 30 мл холодной воды и эктрагировали эфиром (3×15 мл). Экстракт сушили над безводным сульфатом магния. Эфир удаляли в вакууме. Остаток перекристаллизовывали из изопропанола. Получили 0.54 г (48%) N-метилникотинамид-(Z)-O-метилоксима в виде белых кристаллов с т.пл. 83-85°С. Спектр ЯМР 1H (CDCl3, δ, м.д., J, Гц): 2.72 (д, 3 Н, NНСН3, J=5.6); 3.85 (с, 3 Н, ОСН3); 5.21 (уш.с, 1 H, NH); 7.29-7.36 (м, 1 Н, 5-СН ру); 7.76 (д, 1 Н, 4-СН ру, J=10.0); 8.62 (д, 1 Н, 6-СН ру, J=4.8); 8.71 (с, 1 Н, 2-СН ру).
Пример 4. К раствору 0,45 г (2,17 ммоль) N-(n-хлорфенил)-N-(2-фурилметил)амина в 10 мл ТГФ при температуре -10 - -5°С в атмосфере аргона прибавляли 1,36 мл 1,6 N (2,17 ммоль) раствора бутиллития. Затем, не снимая охлаждения, перемешивали смесь 20 минут и добавляли раствор 0,37 г (2,17 ммоль) O-метилникотингидроксамоилхлорида в 5 мл ТГФ. Реакционную массу кипятили в течение 10 часов, выливали в воду и экстрагировали эфиром (3×5 мл). Экстракт сушили над безводным сульфатом магния. Эфир удаляли в вакууме. Остаток хроматографировали на колонке с силикагелем (элюент гексан-ЕtOАс 5:1). Получили 0,15 г (20%) N-(n-хлорфенил)-N-(2-фурилметил)никотинамид-(Z)-O-метилоксим в виде светло-коричневых кристаллов с т.пл. 73-75°С. ЯМР 1H-спектр ((CD3)2SO, δ, м.д, J, Гц): 3.94 (с, 3 Н, ОСН3), 4.93 (с, 2 Н, СН2); 6.38-6.42 (м, 2Н, 3, 4-СН фурил); 6.85-7.20 (A2B2-система, 4 Н, С6Н4, J=10.2); 7.30-7.35 (м, 1 Н, 5-СН ру); 7.60 (с, 1 Н, 5-СН фурил); 7.65-7.70 (д, 1 Н, 4-СН ру, J=7.2); 8.45-8.55 (м, 2 H, 2, 6-СН ру).
Пример 5. Смесь 224 мг (4,1 ммоль) метилата натрия, 15 мл сухого ДМФА и 1 г (4,1 ммоль) N-бензил-N-метилникотинамидоксима охлаждали до 0°С и прибавляли к ней по каплям 0,4 мл (4,1 ммоль) диметилсульфата, поддерживая температуру 0-5°С. Смесь перемешивали в течение 6 часов при той же температуре. Затем ДМФА удаляли в вакууме, а остаток растворяли в 60 мл холодной воды и эктрагировали эфиром (3×20 мл). Экстракт сушили над безводным сульфатом магния. Эфир удаляли в вакууме. Остаток хроматографировали на колонке с силикагелем (элюент СНСl3-МеОН 10:1). Получили 190 мг (18%) N-бензил-N-метилникотинамид-(Z)-O-метилоксима. Спектр ЯМР 1H ((СO3)2SO, δ, м.д., J, Гц): 2.65 (с, 3 Н, NCH3); 3.53 (с, 3 Н, ОСН3); 4.11 (с, 2 Н, СН2); 7.20 (д, 2 Н, СН Ph, J=6.9); 7.25-7.37 (м, 3 Н, СН Ph); 7.45-7.51 (м, 1 Н, 5-СН ру); 7.74 (д, 1 Н, 4-СН ру, J=7.8); 8.50 (с, 1 Н, 2-СН ру); 8.59 (д, 1 Н, 6-СН ру, J=4.7).
Пример 6. Раствор 1,3 г (6,7 ммоль) гидрохлорида никотингидроксамоилхлорида в 25 мл МеОН прибавляли по каплям к 2,7 г (20 ммоль) N-метил-N-(2-фенилэтил)амина в 30 мл МеОН при 0-5°С и перемешивали при указанной температуре 8 ч. Растворитель отгоняли в вакууме, к остатку добавляли 15 мл воды и экстрагировали СНСl3 (3×10 мл). Экстракт сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент СНСl3-МеОН 10:1). Получили 1,4 г (82%) (г)-N-метил-N-(2-фенилэтил)никотинамидоксима в виде желтого масла. Спектр ЯМР 1H ((СD2)2SO, δ, м.д., J, Гц): 2.68 (т, 2Н, CH2 CH 2Ph, J=5.7); 2.75 (с, 3 Н, NCH3); 3.06 (т, 2 Н, CH2 CH 2Ph, J=5.7); 6.98 (д, 2 Н, СН Ph, J=8.6); 7.10-7.27 (м, 3 Н, 2СН Ph, 5-СН ру); 7.35-7.47 (м, 2 СН, СН Ph, 4-СН ру); 8.30 (с, 1 Н, 2-СН ру); 8.32 (д, 1 Н, 6-СН ру, J=5.7); 9.55 (с, 1 Н, ОН).
Пример 7. К раствору 0,138 г (0.84 ммоля) N-метилникотинамид-О-метилоксима и 0,122 г (1 ммоль) ДМАП в 25 мл СНСl3 прибавляли раствор 0,168 г (1 ммоль) циннамоилхлорида в 5 мл СНСl3. Смесь кипятили 6 ч, охлаждали, промывали 20 мл воды и сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент EtOАс-гексан 5:1). Получили 0,051 г (24%) N-метил-N-(Е)-циннамоилникотинамид-(Z)-O-метилоксима в виде масла. Спектр ЯМР 1H ((CD3)2SO, δ, м.д., J, Гц): 3.14 (с, 3 Н, NСН3); 3.95 (с, 3 Н, ОСН3); 6.52 (д, 1 Н, PhCH=CH, J=19.0); 6.91 (д, 1 Н, PhCH=CH, J=19.0); 7.25-7.35 (м, 3 Н, СН Ph); 7.52-7.65 (м, 2 H, СН Ph); 7.66-7.72 (м, 1 H, 5-СН ру), 8.28 (д, 1 H, 4-СН ру, J=9.3); 8.79 (д, 1 H, 6-СН ру, J=5.0); 9.04 (c, 1 H, 2-СН ру).
Пример 8. К раствору 300 мг (1,81 ммоль) N-метилникотинамид-O-метилоксима и 244 мг (2,0 ммоль) ДМАП в 20 мл СНСl3 прибавляли раствор 365 мг (2,18 ммоль) n-хлорциннамиолхлорида в 20 мл СНСl3. Смесь кипятили 6 ч, охлаждали, промывали 20 мл воды и сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент EtOAc-гексан 5:1).
Получили 150 мг (25%) N-метил-N-((E-n-хлорциннамоил)никотинамид-(Z)-O-метилоксима в виде белых кристаллов с т.пл. 79-81°С. Спектр ЯМР 1Н ((СD3)2SO, δ, м.д., J, Гц): 3.06 (с, 3 Н, NСН3); 3.80 (с, 3 Н, ОСН3); 6.55 (д, 1 Н, PhCH=CH, J=20.0); 6.91 (д, 1 Н, PhCH=CH, J=20.0); 7.50-7.68 (A2B2-система, 4 Н, С6Н4, J=7.8); 7.51-7.57 (м, 1 Н, 5-СН ру); 8.12 (д, 1 Н, 4-СН ру, J=7.0); 8.67 (д, 1 Н, 6-СН ру, J=4.1); 8.93 (с, 1 Н, 2-СН ру).
Пример 9. К раствору 300 мг (1,81 ммоль) N-метилникотинамид-O-метилоксима и 244 мг (2,0 ммоль) ДМАП в 20 мл СНСl3 прибавляли раствор 309 мг (2,0 ммоль) фенилацетилхлорида в 20 мл СНСl3. Смесь кипятили 6 ч, охлаждали, промывали 20 мл воды и сушили над безводным сульфатом магния. Растворитель отгоняли в вакууме, остаток хроматографировали на колонке с силикагелем (элюент EtOAc). Получили 70 мг (17%) N-метил-N-(фенилацетил)никотинамид-(Z)-О-метилоксима в виде масла. Спектр ЯМР 1H ((CD3)2SO, δ, м.д., J, Гц): 2.98 (с, 3 Н, NСН3); 3.80 (с, 2 Н, СН2); 3.92 (с, 3 Н, ОСН3); 7.17-7.22 (м, 2 H, СН Ph); 7.23 (м, 3 Н, СН Ph); 7.45-7.49 (м, 1 Н, 5-СН ру); 7.87 (д, 1 Н, 4-СН ру, J=7.4); 8.62 (д, 1 Н, 6-СН ру, J=3.9); 8.70 (с, 1 Н, 2-СН ру).
ЯМР 1H-спектры зарегистрированы на приборе Bruker AM300 в (CD3)2SO.
Пример 10. Предварительную оценку фунгицидной активности некоторых соединений проводили in vitro против фитопатогенных грибов: Rhizoctonia solani Kühn (R.s.), Fusarium moniliforme Sheldon (F.m.) и Helminthosporium sativum Pammel, King et Bakke (Н.s.). Концентрация активного компонента составляла 30 мг/л. В качестве питательной среды использовали сахарозно-картофельный агар. Инокулированные среды выдерживали в термостате при 25°С в течение 3 суток. Активность соединений определяли как процент подавления роста мицелия гриба по отношению к контролю.
Фунгицидная активность N,N-дизамещенных никотинамид-(Z)-O-метилоксимов общей формулы I приведена в таблице.
По предварительной оценке активность N,N-дизамещенных никотинамид-(Z)-O-метилоксимов общей формулы I в ряде случаев сравнима или превышает активность эталона.
| Фунгицидная активность N,N-дизамещенных никотинамид-(Z)-О-метилоксимов общей формулы I | ||||||
| Соединение | Подавление радиального роста мицелия грибов в сравнении с контролем, % | |||||
| № | X | R | R' | R.s. | F.m. | H.s. |
| 1 | CH2 | 2-фурил | n-СlС6Н4- | 65 | 52 | 52 |
| 2 | СН2 | Ph | Ме | 37 | 17 | 48 |
| 3 | СН2 | Вn | Me | 39 | 66 | 86 |
| 4 | C=O | PhCH=CH- | Me | 48 | 47 | 74 |
| 5 | C=O | n-СlС6Н4СН=СН- | Me | 62 | 62 | 81 |
| 6 | C=O | Вn | Me | 25 | 32 | 6 |
| Эталон* | 70 | 60 | 69 | |||
| *Эталон - коммерческий фунгицид спироксамин (8-трет-бутил-1,4-диоксаспиро[4.5]декан-2-илметил(этил)(пропил)амин). |
N,N-дизамещенные никотинамид-(Z)-O-метилоксимы общей формулы I, где если Х означает метиленовую группу, то R означает фенил, бензил или 2-фурил, R' означает метил или n-хлорфенил, если Х означает карбонильную группу, то R означает стирил, n-хлорстирил или бензил, R' означает метил, обладающие фунгицидной активностью