Способ изготовления внутрикостных имплантатов
Иллюстрации
Показать всеИзобретение относится к медицине. Описан способ изготовления внутрикостного имплантата с биосовместимым покрытием, включающий нанесение плазменным напылением на металлическую титановую основу имплантата биологически активного покрытия, при котором напыление при различных режимах ведут послойно, при этом четвертый слой наносят дистанцией напыления 70 мм, толщиной 20÷30 мкм. Для приготовления четвертого слоя смешивают порошки оксида алюминия или гидроксиапатита дисперстностью 40÷90 мкм с порошком гидроксиапатита дисперсностью менее 40 мкм или порошком оксида алюминия дисперсностью 1÷3 мкм в количестве 70÷95 мас.% и 5÷30 мас.%, соответственно, смесь перемешивают, отжигают в течение 1,5÷3 ч и перетирают. Внутрикостный имплантат обладает высокими остеоинтеграционными свойствами и характеризуется повышенной прочностью. 3 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Изобретение относится к медицине, а именно к ортопедической стоматологии, и может быть использовано для изготовления внутрикостных имплантатов на металлической основе.
Известен способ изготовления стоматологических имплантатов, в котором для повышения их ретенционной способности применяют покрытия из специально приготовленных порошков кобальт-хромовых, кобальт-никелевых сплавов, стоматологической нержавеющей стали для соответствующих им основ имплантатов. Дисперсность таких порошков составляет 40÷100 мкм. Ретенционные покрытия из них имеют высокую адгезионную прочность. Способ включает приготовление порошка из смеси заданного состава, ее размол до размеров 1÷8 мкм, гранулирование в 2,5%-ном растворе поливинилового спирта, протирку через сито с ячейками, в 2-3 раза превышающими необходимый размер порошка, спекание при температуре 1000÷1300°С, дробление и рассев (патент РФ на изобретение №2151668, МПК B22F 9/04, С22С 1/04, A61K 6/04, опубл. 27.06.2000 г.).
Однако использование порошков со значительной полидисперсностью приводит к формированию покрытия с неравномерной пористостью. Кроме того, для улучшения функциональных характеристик биосовместимых покрытий целесообразно использование не биотолерантных материалов, а биоинертных или биоактивных покрытий и введение в их структуру керамических частиц нанодиапазона.
Известен способ изготовления внутрикостного стоматологического имплантата с плазмонапыленным многослойным биоактивным покрытием, в котором повышение адгезии покрытия и достижение необходимой пористой структуры решается путем плазменного напыления на титановую основу имплантата при различных режимах системы покрытий из пяти слоев, состоящих из титана или гидрида титана, гидроксиапатита кальция и их смеси (патент РФ на изобретение №2146535, МПК A61L 27/00, F61C 8/00, опубл. 20.03.2000 г.).
Однако данный способ является дорогостоящим и трудоемким, при этом он не обеспечивает формирование равномерной структуры покрытия.
Наиболее близким к предлагаемому решению является способ изготовления внутрикостных имплантатов, заключающийся в нанесении плазменным напылением на металлическую титановую основу имплантата биологически активного покрытия. В данном способе напыление при различных режимах ведут послойно, при этом первым слоем напыляют титан или гидрид титана дисперсностью 3÷5 мкм, дистанцией напыления 70÷80 мм и толщиной 5÷10 мкм, вторым слоем - титан или гидрид титана дисперсностью 50÷100 мкм, дистанцией напыления 100 мм, толщиной 50÷115 мкм, третьим слоем наносят механическую смесь титана или гидрида титана дисперсностью 40÷70 мкм и гидроксиапатита дисперсностью 5÷10 мкм с соотношением 60÷80 и 20÷40 мас.% соответственно, дистанцией напыления 80 мм и толщиной слоя 15÷20 мкм, четвертым слоем - оксид алюминия или гидроксиапатит дисперсностью 40÷70 мкм, дистанцией напыления 70 мм, толщиной слоя 20÷30 мкм (патент РФ на изобретение №2074674, МПК A61F 2/28, опубл. 10.03.1997 г.).
Однако данный способ не позволяет получить равномерную пористую структуру биосовместимых керамических покрытий.
Задачей предлагаемого изобретения является создание внутрикостного имплантата с биосовместимым покрытием, обладающим высокими остеоинтеграционными свойствами и характеризующимся повышенной прочностью.
Техническим результатом является создание равномерной пористой структуры покрытия за счет применения порошков с равномерным гранулометрическим составом и регулируемого введения в его структуру частиц нанодиапазона.
Поставленная задача достигается тем, что в способе, включающем нанесение плазменным напылением на металлическую титановую основу имплантата биологически активного покрытия, при котором напыление при различных режимах ведут послойно, при этом первым слоем напыляют титан дисперсностью 3÷5 мкм, дистанцией напыления 70÷80 мм и толщиной 5÷10 мкм, вторым слоем титан дисперсностью 50÷100 мкм, дистанцией напыления 100 мм, толщиной 50÷115 мкм, третьим слоем наносят механическую смесь титана дисперсностью 40÷70 мкм и гидроксиапатита дисперсностью 5÷10 мкм с соотношением 60÷80 и 20÷40 мас.% соответственно, дистанцией напыления 80 мм и толщиной слоя 15÷20 мкм, четвертый слой наносят дистанцией напыления 70 мм, толщиной 20÷30 мкм, согласно предлагаемому решению для приготовления четвертого слоя смешивают порошки оксида алюминия или гидроксиапатита дисперстностью 40÷90 мкм с порошком гидроксиапатита дисперсностью менее 40 мкм или порошком оксида алюминия дисперсностью 1÷3 мкм в количестве 70÷95 мас.% и 5÷30 мас.%, соответственно, смесь перемешивают, отжигают в течение 1,5÷3 ч и перетирают.
Смесь порошков оксида алюминия отжигают при температуре 1200÷1250°С, а смесь порошков гироксиапатита или порошка гироксиапатита с порошком оксида алюминия отжигают при температуре 800÷950°С.
Проведенный анализ возможности усовершенствования структуры биосовместимых керамических покрытий с целью улучшения их равномерности и повышения биоактивности показал, что, управляя размерами и формой используемых при напылении порошков, можно придавать материалам совершенно новые функциональные характеристики, резко отличающиеся от характеристик массивных материалов (В.М.Елинсон и др. Наноструктурирование поверхности полимерных материалов: способ управления их медико-биологическими характеристиками и перспективы применения // Вакуумная наука и техника. Москва. - 2008, с.253-263; Патент SU №1634044 A1, H01J 9/04. Способ изготовления металлопористых катодов / И.П.Мельникова, Д.А.Усанов).
Увеличение размеров частиц свыше 90 мкм ослабляет их адгезию вследствие недостаточного прогрева распыляемых частиц в плазменной струе и малой деформации при ударе о подложку. При напылении мелких частиц до 40 мкм они сильно прогреваются, однако обладают невысокой кинетической энергией, поэтому мало деформируются при ударе о подложку, напорное давление в контакте невелико и в конечном итоге мала прочность сцепления с подложкой. При увеличении размеров частиц более 40 мкм возрастает их масса и силы инерции, поэтому частицы меньше тормозятся и с большой скоростью соударяются о подложку. Это приводит к значительной деформации, увеличению площади контакта, возрастанию напорного давления и в конечном итоге к повышению адгезии покрытия к подложке.
Предлагаемый способ заключается в создании комбинированных частиц исходного порошка для напыления закреплением (иммобилизацией) мелких частиц гидроксиапатита размером менее 40 мкм или оксида алюминия размером 1÷3 мкм на крупных частицах гидроксиапатита или оксида алюминия размером 40÷90 мкм с применением отжига. В процессе плазменного распыления в высокотемпературной струе теплоотвод от мелкой частицы к крупной сохранит часть мелких закрепленных частиц от полного расплавления. При ударе о подложку комбинированная частица раздробится с отрывом мелкой от крупной частицы или произойдет пластическая деформация мелкой частицы с возникновением нанообразований на ней. При этом отлетевшая мелкая частица, имея кинетическую энергию и давление на подложку, соответствующие удару крупной частицы, разобьется на частицы нанометрового размера.
При этом при использовании мелкого порошка в количестве более 30 мас.% в смеси происходит значительное изменение выбранного ранее размера частиц напыляемого порошка, что приводит к изменению необходимой пористости покрытия. Использование менее 5 мас.% мелкого порошка не приводит к желаемому эффекту от увеличения количества вводимых наночастиц в покрытие.
При проведении отжига смеси порошков в течение времени, меньшем 1,5 ч, не происходит диффузионный процесс спекания частиц смеси порошков, а отжиг в течение времени, большем 3 часов, экономически невыгоден и может привести к появлению массивного образца, исчезновению частиц порошка как самостоятельных единиц.
В процессе высокотемпературного отжига мелкие, наиболее активные частицы исходного порошка, припекаются друг к другу и к более крупным частицам, а при последующем легком разломе их нельзя отделить в виде самостоятельных частиц.
Крупные же конгломераты (60÷90 мкм), малоактивные при отжиге, разрушаются в процессе размола до более мелких частиц исходного размера. Таким образом, предварительно отожженный и размолотый порошок становится менее полидисперсным, чем исходный, и структура пористых каркасов из него получается более однородной.
Подобная обработка исходных порошков с размерами частиц, различающимися почти в 2 раза, может привести к повышению его равномерности по гранулометрическому составу и, в конечном итоге, к повышению прочности и равномерности пористой структуры покрытия из него, а также может быть использована для выполнения иммобилизации мелких частиц на крупных. Вводимые в исходные порошки мелкие частицы в значительной степени отличаются от них по размеру. Поэтому применение термомеханической обработки (ТМО) будет способствовать получению равномерной по гранулометрическому составу смеси мелких и крупных порошков.
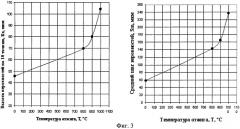
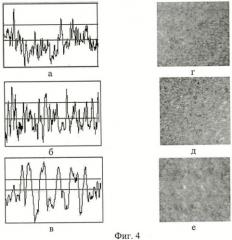
Предлагаемое изобретение поясняется чертежами, где на Фиг.1 представлено увеличенное в 300х раз изображение микрогранул предварительно отожженной и растертой смеси алундовых порошков; на Фиг.2 - результаты исследования плазмонапыленных покрытий на основе гидроксиапатита (ГА) на атомно-силовом микроскопе, где а) исходный ГА с размером участка сканирования 0,6×0,6 мкм, б), в) ГА после ТМО с размером участка сканирования 2×2 мкм при 800 и 950°С соответственно, г), д), е) ГА+20% Al2O3 с размерами участков сканирования 1,2×1,2, 2×2, 1,78×0,575 мкм соответственно; на Фиг.3 - графики зависимостей параметров шероховатости поверхности от температуры отжига смеси порошков гидроксиапатита (80 мас.% ГА 40÷100 мкм + 20 мас.% ГА менее 40 мкм); на Фиг.4 - изображение поверхности образцов с гидроксиапатитовым покрытием (г, д, е - увеличение 90х) и ее профиля (а, б, в - увеличение 150х) на подслое из титана с напыленными слоями из титанового порошка, где а) г) - изображение покрытия при напылении ГА в исходном состоянии, б), д) - при напылении ГА, состоящего из 80 мас.% ГА с размером 40÷90 мкм и 20 мас.% ГА с размером менее 40 мкм, после термомеханической обработки с отжигом при 800°С, в), е) - при напылении ГА, состоящего из 80 мас.% ГА с размером 40÷90 мкм и 20 мас.% ГА с размером менее 40 мкм, после термомеханической обработки с отжигом при 1000°С.
Способ осуществляется следующим образом.
Крупнозернистые порошки оксида алюминия (Al2O3) по ЕТО.035.331ТУ (с частицами сферической формы) или белого электрокорунда (Al2O3) по ТУ3988-075-00224450-99 (с частицами осколочной формы) с размером частиц ~40÷90 мкм в количестве 80 мас.% и алунда электровакуумного (Al2O3) с размером частиц ~1÷3 мкм в количестве 20 мас.% перемешивали в выпарительной керамической чаше в течение 15÷20 мин. Свободно насыпанные смеси алундовых порошков (Al2O3) отжигали при температурах 1100, 1200, 1250, 1300, 1400, 1500°С в водороде в течение 3 ч, после чего растирали их в керамической ступе в течение 20 мин. Предварительно отожженная и растертая смесь алундовых порошков становится более равномерной по гранулометрическому составу, что связано с исчезновением ультрадисперсной фракции мелкого порошка (~1 мкм и менее), которая после обработки смеси порошков закреплена на микрогранулах (Фиг.1).
Образцы для механических испытаний на сжатие изготавливали прессованием в пресс-форме из смеси отожженных и растертых порошков оксида алюминия, в которую в качестве пластификатора добавляли глазурь в количестве 2% от ее веса. Далее производили спекание при температуре 1750°С в атмосфере водорода в течение 10 мин.
Результаты испытаний образцов на сжатие приведены в таблице 1.
| Таблица 1 | |
| Температура отжига смесей, Т°С | Прочность образцов на сжатие, σв, кг/мм2 |
| Без отжига | 17,4 |
| 1100 | 22,2 |
| 1200 | 35,5 |
| 1250 | 35,4 |
| 1300 | 28,5 |
| 1400 | 25,6 |
| 1500 | 24,8 |
Из таблицы видно, что прочность алундовых порошков после термомеханической обработки увеличилась. Максимальная прочность достигается при отжиге смеси алундовых порошков при температуре 1200÷1250°С, что указывает на равномерную и наиболее оптимальную укладку частиц.
Для приготовления четвертого слоя на основе гидроксиапатита смешивали исходный порошок гидроксиапатита с размером частиц 40÷90 мкм с порошком гидроксиапатита с размером частиц менее 40 мкм в количестве 20 мас.% от веса исходного порошка (1-смесь), а также исходный порошок гидроксиапатита с размером частиц 40÷90 мкм и порошок оксида алюминия с размером частиц 1÷3 мкм в количестве 20 мас.% (2-смесь). После тщательного перемешивания смеси порошков в керамической ступе их отжигали в керамической лодочке в муфельной печи при температурах из интервала 800÷1000°С в течение 3 часов, после чего размалывали в керамической ступе легким нажатием пестика в течение 20 минут. Полученные порошки напыляли на образцы из титана марки ВТ1-00 в соответствии с патентом РФ №2074674. Послойное плазменное напыление покрытий осуществляли в атмосфере в струе защитного газа аргона, при этом расход плазмообразующего газа 20÷40 л/мин, скорость перемещения плазмотрона при напылении 80÷700 мм/мин, напряжение дуги 30 В, скорость вращения детали 110÷160 об/мин. Напыление последнего термомеханически обработанного слоя проводили при токе плазменной дуги 450÷540 А, с дистанцией напыления 70 мм.
Проведенный анализ морфологии покрытия на профилометре и структуры покрытия из гидроксиапатита в поверхностном слое с использованием оптического и атомно-силового микроскопов подтвердил повышение их равномерности при развитии макрорельефа за счет укрупнения частиц в результате процесса иммобилизации частиц исходного порошка при термомеханической обработке (ТМО), а также наличие наночастиц в покрытии из частиц гидроксиапатита после ТМО при 800 и 950°С и нанообразований на частицах оксида алюминия, закрепленных на частицах гидроксиапатита при ТМО (таблица 2, фиг.2). Последнее приводит к увеличению площади контакта соприкасаемых поверхностей имплантата и костной ткани, а также повышению его активности. Величина открытых поровых каналов в структуре возрастает согласно формуле Козени соответственно увеличению среднего размера частиц (таблица 3). Величина открытого порового канала определялась при помощи металлографического анализа поверхности в светлом поле.
| Таблица 2 | |||||
| Влияние температуры отжига гидроксиапатита и смесей на его основе на шероховатость плазмонапыленных покрытий. | |||||
| Состав порошка | Температура спекания ТМО (Т, °С) | Параметры шероховатости, мкм | |||
| Rz | Rmax | Sm | S | ||
| ГА (40÷90 мкм) | Без обработки | 45,8 | 54,9 | 58,7 | - |
| ГА (40÷90 мкм) | 800 | 49,9 | 62,6 | 121 | 23,4 |
| ГА (40÷90 мкм) + ГА (менее 40 мкм) | 800 | 69,9 | 97,5 | 143 | 26,6 |
| ГА (40÷90 мкм) + ГА (менее 40 мкм) | 950 | 90 | - | 200 | - |
| ГА (40÷90 мкм) + ГА (менее 40 мкм) | 1000 | 104 | 125 | 237 | 34,0 |
| ГА (40÷90 мкм) + Al2O3 (2 мкм) | 800 | 67,8 | 91,1 | 110 | 25,7 |
| ГА (40÷90 мкм) + Al2O3 (2 мкм) | 1000 | 69,2 | 106 | 131 | 25,1 |
Некоторые результаты таблицы 2 представлены в виде графиков (фиг.3), которые наглядно подтверждают, что наиболее приемлемым рабочим интервалом температур является 800÷950°С. Этот интервал температур является достаточным для выполнения процесса иммобилизации мелких частиц оксида алюминия на микрочастицах гидроксиапатита. Температуру ниже 800°С используют для сушки гидроксиапатита при химическом жидкофазном синтезе. При температуре выше 950°С происходит интенсивное спекание частиц гидроксиапатита с образованием грубых конгломератов, которые трудно поддаются последующему измельчению.
| Таблица 3 | ||
| Влияние температуры отжига исходного порошка на величину открытого порового канала в покрытиях на основе гидроксиапатита. | ||
| Используемые порошки | Температура спекания порошка, °С | Величина открытого порового канала, мкм |
| ГА (40÷100 мкм) | без обработки | 5÷7 |
| ГА (40÷100 мкм) + ГА (менее 40 мкм) | 800 | 15,0÷19,5 |
| ГА (40÷100 мкм) + ГА (менее 40 мкм) | 950 | 29,0÷32,0 |
| ГА (40÷100 мкм) + ГА (менее 40 мкм) | 1000 | 39,0÷40,0 |
Из таблицы 3 видно, что наиболее приемлемая величина открытого порового канала также достигается при температуре 800-950°С.
Термомеханическая обработка частиц гидроксиапатита и смеси частиц на его основе в интервале температур от 800 до 950°С (фиг.4) приводит к укрупнению частиц без значительного изменения соотношения аморфной и кристаллических фаз и незначительному снятию напряжений в частицах. Этот интервал является наиболее приемлемым для термомеханической обработки гидроксиапатита и смеси на его основе. Значительное укрупнение частиц биосовместимого материала на основе гидроксиапатита при температурах термомеханической обработки, больших 950°С, приводит к ухудшению качества напыления в результате образования крупных открытых поровых каналов и, как следствие, значительных непокрытых участков подслоя (таблица 3).
По результатам проведенных исследований можно сделать вывод, что для повышения функциональных характеристик биосовместимых покрытий на основе оксида алюминия и гидроксиапатита целесообразно использовать процесс термомеханической обработки исходных порошков для выполнения процесса иммобилизации микрочастиц оксида алюминия и гидроксиапатита на гранулах этих материалов с целью развития макро- и микрорельефов биосовместимого покрытия при выравнивании его структуры и последующего наноструктурирования покрытий из иммобилизированных частиц при плазменном напылении на имплантат.
Таким образом, заявляемое техническое решение позволяет создать внутрикостный имплантат с развитой морфологией поверхности покрытия, напыленного из смеси частиц разного размера гидроксиапатита после ТМО при разных температурах, за счет макрорельефа, сформированного микрочастицами, с повышением равномерности (фиг.2) и улучшением параметров пористости структуры покрытия при сохранении микрорельефа, который сформирован наночастицами в покрытиях на основе частиц гидроксиапатита и нанообразованиями в покрытиях из крупных частиц гидроксиапатита и мелких частиц оксида алюминия.
1. Способ изготовления внутрикостных имплантатов, включающий послойное нанесение плазменным напылением на металлическую титановую основу имплантата биологически активного покрытия, при этом первым слоем напыляют титан дисперсностью 3÷5 мкм, дистанцией напыления 70÷80 мм и толщиной 5÷10 мкм, вторым слоем напыляют титан дисперсностью 50÷100 мкм, дистанцией напыления 100 мм, толщиной 50÷115 мкм, третьим слоем наносят механическую смесь титана дисперсностью 40÷70 мкм и гидроксиапатита дисперсностью 5÷10 мкм с соотношением 60÷80 и 20÷40 мас.% соответственно, дистанцией напыления 80 мм и толщиной слоя 15÷20 мкм, четвертый слой наносят дистанцией напыления 70 мм, толщиной 20÷30 мкм, отличающийся тем, что для приготовления четвертого слоя смешивают порошки оксида алюминия или гидроксиапатита дисперстностью 40÷90 мкм с порошком гидроксиапатита дисперсностью менее 40 мкм или порошком оксида алюминия дисперсностью 1÷3 мкм в количестве 70÷95 мас.% и 5÷30 мас.% соответственно, смесь перемешивают, отжигают в течение 1,5÷3 ч. и перетирают.
2. Способ по п.1, отличающийся тем, что смесь порошков оксида алюминия отжигают при температуре 1200÷1250°С;
3. Способ по п.1, отличающийся тем, что смесь порошков гироксиапатита или порошка гироксиапатита с порошком оксида алюминия, отжигают при температуре 800÷950°С.
4. Способ по п.1, отличающийся тем, что смесь частиц перетирают в ступе в течение 20 мин.