Новый способ синтеза (е)-стильбеновых производных, который позволяет получить ресвератрол и писатаннол
Иллюстрации
Показать всеНастоящее изобретение относится к вариантам нового способа получения (E)-стильбенового производного формулы (VI), которые используются для получения полигидроксистильбенов, в частности ресвератрола или писатаннола, проявляющих антиоксидантный эффект, к новым промежуточным соединениям формулы (III), (IV), (V) и (VII), используемым в данных способах, а также к применению соединения формулы (I), (II), (III), (IV) или (VII) в качестве промежуточного соединения в синтезе (E)-стильбенового производного формулы (VI) или полигидроксистильбена.
Значения заместителей R1, R1', R2', R, A, Ar, R' такие, как указаны в формуле изобретения. 8 н. и 18 з.п. ф-лы, 1 ил., 32 пр.
Реферат
Объектом данного изобретения является новый способ синтеза (Е)-стильбеновых производных, предназначенных, в частности, для получения ресвератрола и писатаннола.
Более конкретно, изобретение относится к способу синтеза (Е)-стильбеновых производных формулы (VI), описанной в данной патентной заявке, в частности (Е)-триметилресвератрола, (Е)-трибензилресвератрола и (Е)-тетраметилписатаннола, которые позволяют получить ресвератрол и писатаннол.
Полигидроксистильбены представляют собой соединения, которые найдены в различных растениях и которым уделено особенное внимание, так как они проявляют большое разнообразие терапевтических свойств.
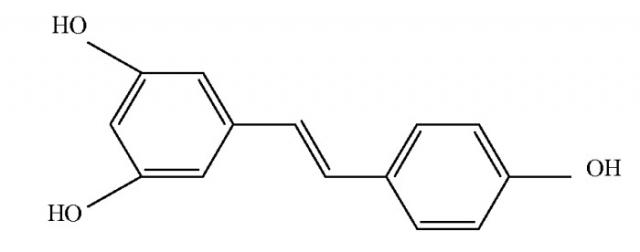
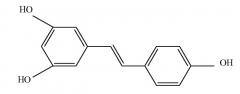
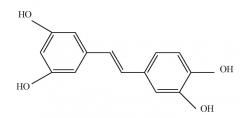
Данные производные включают ресвератрол ((Е)-3,5,4'-тригидроксистильбен) и писатаннол ((Е)-3,5,3',4'-тетрагидроксистильбен) формул:
ресвератрол
писатаннол
Ресвератрол и писатаннол представляют собой соединения, принадлежащие классу полифенолов, известных по проявлению антиоксидантных эффектов, способных предотвращать или замедлять вредные воздействия окислительного стресса.
В терапевтической области ресвератрол каталогизирован как средство против агрегации тромбоцитов, противовоспалительное средство или вазодилатор или как ингибитор пролиферации клеток.
Данные соединения приведены в разработке многих синтетических путей, но последние являются неудовлетворительными с производственной точки зрения.
Предусмотренные синтетические пути требуют в большинстве случаев защиты фенольных функциональных групп, либо в виде простых эфирных производных (обычно метильных, изопропильных, бензильных или силильных производных), либо в виде сложноэфирных производных (обычно ацетильных или бензоильных производных), и полигидроксистильбены затем получают высвобождением указанных функциональных групп известными способами.
Самый широко применяемый способ получения ресвератрола или писатаннола описан в ряде публикаций и патентных заявок, включающих следующие: ЕР 1466884; WO 2003/086414. Он заключается в конденсации по Виттигу или Виттигу-Хорнеру защищенного гидроксиароматического (или полигидроксиароматического) альдегида, такого как защищенный 3,5-дигидроксибензальдегид, с солью фосфония или фосфонатом, таким как защищенный бромид 4-гидроксибензилтрифенилфосфония.
Однако реакции Виттига или Виттига-Хорнера приводят к смеси (Е)- и (Z)-стильбеновых изомеров, которые трудно разделить, поэтому требуется дополнительная стадия для преобразования нежелательного Z-изомера в Е-изомер или с йодом в качестве катализатора, как описано в US 2004/00115020, или же взаимодействием с диарилдисульфидом, как описано в Chem. Pharm. Bull., (1992), 40(10), 2842-2844. Эта дополнительная стадия приводит к образованию побочных продуктов, поэтому требуется сложная стадия очистки, которая не очень желательна в производственном плане. Преобразование Z-изомера в E-изомер может быть осуществлено путем взаимодействия Z-изомера с комплексом палладия(II), как описано в J. Org. Chem., (2002), 67, 4627-4629. Однако большое количество указанного комплекса, который будет использоваться [20 мол.% (MeCN)2PdCl2], делает способ очень дорогим.
Другой общепринятый путь получения ресвератрола или писатаннола заключается в получении α-фенилкоричной кислоты по реакции Перкина, как описано в WO 2000/69430 и в Tetrahedron, 59, (2003), 3315-21, путем взаимодействия гидрокси- (или полигидрокси)фенилуксусной кислоты (или простого эфирного/сложноэфирного производного) с (защищенным или незащищенным) гидрокси- (или полигидрокси)ароматическим альдегидом. Декарбоксилирование производного коричной кислоты (Cu/хинолин при 260°С) затем дает производное стильбена.
Однако последняя реакция подразумевает жесткие условия (высокая температура, загрязнение металлического катализатора) для декарбоксилирования и обычно приводит к преобладанию (Z)-изомера, при этом требуется проведение дополнительной стадии изомеризации.
В другом пути синтеза ресвератрола или писатаннола используют реакции типа реакции Хека, такие как конденсация 3,5-диацетоксистирола с 4-ацетоксибромбензолом, как описано в WO 2005/023740, или же конденсация 4-ацетоксистирола с 3,5-диметоксибензоилхлоридом, как описано в WO 2001/60774, или же вновь конденсация с 3,5-диацетоксибензоилхлоридом, раскрытая в WO 2005/069998.
Однако данные реакции требуют использования исходных соединений, которые трудны для получения, таких как 3,5-диацетоксистирол, а также катализаторов на основе солей палладия, которые являются дорогостоящими и не очень устойчивыми при требуемых условиях реакции, что приводит к низким и невоспроизводимым выходам.
Для устранения недостатков вышеприведенных синтетических путей и снижения затрат на получение ресвератрола и писатаннола изобретатели разработали альтернативный путь синтеза полигидроксистильбенов.
Этот новый путь заключается в получении (Е)-стильбеновых производных из производных 1,2-диарилэтанона.
Полученные (Е)-стильбеновые производные представляют собой изомеры Е-типа, с которых затем снимают защиту с получением соединений, представляющих интерес, таких как, например, ресвератрол или писатаннол.
Новый синтетический путь обладает, в дополнение к освобождению от стадии разделения Е- и Z-изомеров, которая прежде представляла проблему в данной области, преимуществом применения, в качестве исходных соединений, производных 1,2-диарилэтанона, которые могут быть получены с низкими затратами из реагентов, таких как гидроксиароматические кислоты, необязательно этерифицированные, и гидроксиароматические сложные эфиры.
Фигура 1 демонстрирует новую схему синтеза полигидроксистильбенов, раскрываемую в данной патентной заявке.
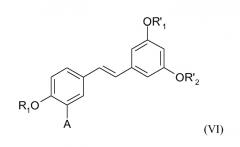
Первым объектом данной заявки, таким образом, является способ синтеза (Е)-стильбеновых производных формулы (VI)
в которой
А представляет собой водород или группу OR2, и
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3,
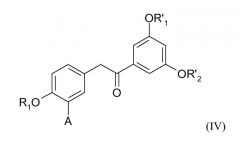
отличающийся тем, что производное 1,2-диарилэтанона формулы (IV)
в которой
А представляет собой водород или группу OR2, и
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3;
подвергают взаимодействию в качестве промежуточного соединения синтеза.
В рамках настоящего изобретения, когда R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, это означает, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную или гексильную группу. Когда R1, R2, R'1 и R'2 представляют собой аралкильную группу, содержащую от 7 до 16 атомов углерода, это означает, например, бензильную, 1-фенилэтильную, нафтилметильную или 1-нафтилэтильную группу.
В рамках настоящего изобретения, что касается заместителей, термин “алкокси” означает, например, радикал метокси, этокси, пропокси или бутокси.
Галогеновый радикал означает Cl, Br, F или I.
Предпочтительный аспект изобретения заключается в синтезе следующих (Е)-стильбеновых производных формулы (VI):
- (Е)-триметилресвератрола, в котором А представляет собой атом водорода, R1, R'1 и R'2 являются метильными группами, или
- (Е)-трибензилресвератрола, в котором А представляет собой атом водорода, R1, R'1 и R'2 являются бензильными группами,
для получения ресвератрола, и
- (Е)-тетраметилписатаннола, в котором А представляет собой -ОСН3, R1, R'1 и R'2 являются метильными группами,
для получения писатаннола.
Такие соединения формулы (VI) описаны в литературе.
Промежуточные соединения формулы (IV), в которой А представляет собой водород и каждый из R1, R'1 и R'2 представляет собой бензильную группу, или в которой А представляет собой группу -ОСН3 и каждый из R1, R'1 и R'2 представляет собой метильную группу, или в которой А представляет собой водород, R1 и R'2 представляют собой метильную группу и R1 представляет собой изопропильную группу, или в которой А представляет собой группу -OR2, R'1 и R'2 представляют собой метильную группу и R1 и R2 образуют углеводородную цепь -(СН2)n- c n=1, являются новыми соединениями, которые представляют собой следующий объект изобретения.
Данные новые соединения формулы (IV) включают, в частности, следующие:
- 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанон (или 3,5,4'-трибензилоксидезоксибензоин);
- 1-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)этанон (или 3,5,3',4'-тетраметоксидезоксибензоин);
- 1-(3,5-диметоксифенил)-2-(4-изопропилоксифенил)этанон, и
- 1-(3,5-диметоксифенил)-2-(3,4-метилендиоксифенил)этанон,
которые применяются для получения следующих производных формулы (VI) соответственно:
- (E)-трибензилресвератрола, который позволяет получить ресвератрол в процессе стадии, описанной ниже;
- (Е)-тетраметилписатаннола, который позволяет получить писатаннол в процессе стадии, описанной ниже;
- (Е)-3,5-диметокси-4'-изопропилоксистильбена, и
- (Е)-3,5-диметокси-3',4'-метилендиоксистильбена.
Другой предпочтительный аспект изобретения заключается в синтезе (Е)-триметилресвератрола (соединения формулы (VI)) из соединения формулы (IV), 1-(3,5-диметоксифенил)-2-(4-метоксифенил)этанона (или 3,5,4'-триметоксидезоксибензоина).
Соединения формулы (IV) можно использовать в двух различных схемах для получения производного (Е)-стильбена формулы (VI), что и является основой данного изобретения:
- либо восстановлением соединения формулы (IV) с получением спирта формулы (V) и затем дегидратацией образовавшегося спирта (путь А);
- либо синтезом производных арилсульфонилгидразона путем взаимодействия соединения формулы (IV) c арилсульфонилгидразидом, а затем взаимодействием образовавшихся арилсульфонилгидразонов с основанием (путь В).
Синтез 1,2-диарилэтанонов формулы (IV)
1,2-Диарилэтаноны формулы (IV), используемые в способе согласно изобретению, предпочтительно получают реакцией декарбоксилирования исходя из сложных β-кетоэфиров формулы (III)
в которой
А представляет собой водород или же группу OR2,
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3,
R представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода.
В рамках данного изобретения, когда R представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, это означает, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную или гексильную группу.
Реакцию декарбоксилирования сложных β-кетоэфиров формулы (III) с получением кетонов формулы (IV) можно проводить в кислых условиях в присутствии, например, пар кислота/растворитель, таких как следующие пары: концентрированная хлористоводородная кислота/уксусная кислота, концентрированная хлористоводородная кислота/этанол или серная кислота/уксусная кислота, или же без растворителя, в присутствии борной кислоты или ангидрида, как описано в Advanced Organic Chemistry, Reaction, Mechanisms and Structure, John Wiley & Sons, 4th edition, page 629.
Предпочтительно, реакцию декарбоксилирования проводят без растворителя в присутствии 1-5 эквивалентов борной кислоты или ангидрида борной кислоты при температуре от 100 до 180°С, более предпочтительно в присутствии 1-2 эквивалентов борной кислоты или еще более предпочтительно с 1 эквивалентом борной кислоты.
В данном изобретении предлагаются, с этой целью, новые соединения формулы (III), в которой:
R представляет собой метильную группу, и
или А представляет собой водород и группы R1, R'1 и R'2 представляют собой метильные группы или бензильные группы,
или А представляет собой группу -ОСН3 и каждая из групп R1, R'1 и R'2 представляет собой метильную группу,
или А представляет собой водород, R'1 и R'2 представляют собой метильную группу и R1 представляет собой изопропильную группу,
или А представляет собой группу -OR2, R'1 и R'2 представляют собой метильную группу и R1 и R2 образуют углеводородную цепь -(СН2)n- c n=1;
включающие, в частности, следующие соединения:
- метил 3-(3,5-диметоксифенил)-2-(4-метоксифенил)-3-оксопропионат;
- метил 3-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)-3-оксопропионат;
- метил 3-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)-3-оксопропионат;
- метил 3-(3,5-диметоксифенил)-2-(4-изопропилоксифенил)-3-оксопропионат;
- метил 3-(3,5-диметоксифенил)-2-(3,4-метилендиоксифенил)-3-оксопропионат;
причем эти соединения позволяют получить соответственно следующие соединения формулы (IV):
- 1-(3,5-диметоксифенил)-2-(4-метоксифенил)этанон;
- 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанон;
- 1-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)этанон;
- 1-(3,5-диметоксифенил)-2-(4-изопропилоксифенил)этанон; и
- 1-(3,5-диметоксифенил)-2-(3,4-метилендиоксифенил)этанон;
используемые соответственно для получения (Е)-триметилресвератрола, (Е)-трибензилресвератрола, (Е)-тетраметилписатаннола, (Е)-3,5-диметокси-4'-изопропилоксистильбена и (Е)-3,5-диметокси-3',4'-метилендиоксистильбена.
Сложные β-кетоэфиры формулы (III) можно получить, предпочтительно, по реакции конденсации типа реакции Клайзена между простыми эфирными/сложноэфирными производными (I) и простыми эфирными/сложноэфирными производными (II), такими как описано, например, в Advanced Organic Chemistry, Reaction, Mechanisms and Structure, John Wiley & Sons, 4th edition, page 491-493, как представлено ниже:
В формулах (I) и (II)
А представляет собой водород или же группу OR2,
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3, и
R и R' представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода.
В данном изобретении, когда R' представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, это означает, например, метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, втор-бутильную, трет-бутильную, пентильную или гексильную группу.
Данную реакцию конденсации обычно проводят в присутствии сильного основания при температуре кипения реакционной среды с обратным холодильником со стехиометрическими количествами простых эфирных/сложноэфирных производных (I) и (II).
В качестве примеров сильного основания можно назвать алкоксиды щелочных металлов, такие как этоксид натрия, или гидриды щелочных металлов, такие как гидрид натрия.
В предпочтительных условиях осуществления способа, описанного выше, используют от 2 до 5 эквивалентов сильного основания, в частности от 2 до 2,5 эквивалентов.
Исходные простые эфиры/сложные эфиры (I) и (II) можно синтезировать из соответствующих гидроксиароматических кислот, гидроксиароматических сложных эфиров или этерифицированных гидроксиароматических кислот известными способами, такими как описано в J. Med. Chem., 30(11), (1987), 2121-26; Tetrahedron, 59, (2003), 3315-22; Chem. Lett., 11, (1999), 1193-94; J. Am. Chem. Soc., 126(32), (2004), 9882-83. Данные исходные соединения представляют собой недорогие реагенты, которые являются простыми для использования специалистом в данной области.
4-Гидроксифенилуксусную кислоту, резорциловую кислоту и 3,4-дигидроксифенилуксусную кислоту можно привести в качестве примеров гидроксиароматических кислот.
Путь А для синтеза соединений формулы (VI)
Данный путь заключается в восстановлении кетонов формулы (IV), описанной выше, для получения производных 1,2-диарилэтанола формулы (V), указанной ниже:
в которой
А представляет собой водород или же группу OR2,
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3.
Кетоны формулы (IV) могут быть восстановлены путем применения или адаптации способов, описанных, например, в Advanced Organic Chemistry, Reaction, Mechanisms and Structure, John Wiley & Sons, 4th edition, page 910-918.
В предпочтительных условиях способа, описанного выше, кетоны формулы (IV) восстанавливают с образованием спиртов формулы (V) действием гидрида металла, такого как LiAlH4 или NaBH4. Это восстановление обычно осуществляют, используя от 0,25 до 3 эквивалентов гидрида металла. В частности, можно использовать 1 эквивалент NaBH4.
Альтернативно, для кетонов формулы (IV), в которой А представляет собой водород или же группу OR2 и R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3, восстановление можно осуществить путем гидрирования. В предпочтительных условиях гидрирование проводят в присутствии катализаторов, таких как Pd/C, в растворителе, таком как метанол или этанол, при давлении водорода порядка от 3×105 Па (3 бар) до 50×105 Па (50 бар), при температуре от температуры окружающей среды до приблизительно 50°С. В частности, указанную реакцию гидрирования проводят при давлении водорода от 5×105 Па до 10×105 Па, при температуре окружающей среды, в присутствии от 5 до 20 мас.% Pd/C по отношению к кетону формулы (IV).
Данная реакция позволяет получить, в частности, следующие предпочтительные соединения формулы (V):
- 1-(3,5-диметоксифенил)-2-(4-метоксифенил)этанол,
- 1-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)этанол
и, более конкретно, новое соединение формулы (V), в которой А представляет собой водород и R1, R'1 и R'2 представляют собой бензильную группу, включающее, в частности, 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанол. Данное новое соединение получено взаимодействием соединения формулы (IV), 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанона, как указано выше.
После того как образуются спирты формулы (V), последние подвергают дегидратации в присутствии каталитических количеств сильной кислоты, такой как, например, серная кислота, п-толуолсульфоновая кислота или фосфорная кислота.
Предпочтительно, реакцию дегидратации проводят в ароматическом растворителе, таком как толуол, при температуре кипения с обратным холодильником, в присутствии каталитических количеств п-толуолсульфоновой кислоты от 1 до 20 мол.% по отношению к спирту формулы (V) и более предпочтительно от 5 до 10 мол.%. Воду, образовавшуюся в ходе реакции, обычно удаляют азеотропной перегонкой. Согласно данной методике получают (Е)-стильбеновые производные формулы (VI) по изобретению.
Путь В для синтеза соединений формулы (VI)
Этот другой путь заключается, на первой стадии, в синтезе арилсульфонилгидразоновых производных формулы (VII) путем взаимодействия соединения формулы (IV) с арилсульфонилгидразидом, как указано на следующей схеме:
Данную реакцию обычно проводят в спиртовом растворителе, таком как метанол или этанол, или в ароматическом растворителе, таком как толуол, в присутствии каталитических количеств кислоты, такой как серная кислота или хлористоводородная кислота, если необходимо.
Производные арилсульфонилгидразида известны из литературы или являются коммерчески доступными. В качестве примеров можно назвать фенилсульфонилгидразид и п-толуолсульфонилгидразид, продаваемые фирмой Aldrich.
В предпочтительных условиях данную реакцию проводят при температуре кипения с обратным холодильником в этаноле или толуоле, используя избыток арилсульфонилгидразида от 1,1 до 1,5 эквивалентов. Предпочтительным является п-толуолсульфонилгидразид.
Соединения формулы (VII)
синтезированные таким образом, отличаются тем, что:
Ar представляет собой фенильную или о-, м- или п-толильную группу,
А представляет собой водород или же группу OR2,
R1, R2, R'1 и R'2 представляют собой, независимо друг от друга, линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или аралкильную группу, содержащую от 7 до 16 атомов углерода, которая необязательно замещена одной или несколькими алкокси- или галогеновыми группами, причем для R1 и R2 также возможно образование углеводородной цепи -(СН2)n- c n=1-3.
В частности, в данном изобретении предлагаются новые соединения формулы (VII), отличающиеся тем, что:
Ar представляет собой п-толильную группу, и
или А представляет собой водород и все три группы R1, R'1 и R'2 представляют собой метильные группы или бензильные группы,
или А представляет собой группу -ОСН3 и каждая из групп R1, R'1 и R'2 представляет собой метильную группу,
или А представляет собой водород, R'1 и R'2 представляют собой метильную группу и R1 представляет собой изопропильную группу,
или А представляет собой группу -OR2, R'1 и R'2 представляют собой метильную группу и R1 и R2 образуют углеводородную цепь -(СН2)n- c n=1.
Данные новые соединения формулы (IV) включают, в частности, следующие:
- N-[1-(3,5-диметоксифенил)-2-(4-метоксифенил)этилиден]-N'-тозилгидразин,
- N-[1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этилиден]-N'-тозилгидразин и
- N-[1-(3,5-диметоксифенил)-2-(4-изопропилоксифенил)этилиден]-N'-тозилгидразин;
причем эти соединения особенно применимы для получения ресвератрола согласно данному изобретению, и
- N-[1-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)этилиден]-N'-тозилгидразин и
- N-[1-(3,5-диметоксифенил)-2-(3,4-метилендиоксифенил)этилиден]-N'-тозилгидразин;
которые особенно применимы для получения писатаннола согласно данному изобретению.
Согласно способу по изобретению, на второй стадии, арилсульфонилгидразоны формулы (VII) подвергают взаимодействию в условиях Шапиро или Бамфорда-Стевенса путем применения или адаптации способов, описанных, например, в Organic Chemistry, Reactions, Mechanisms and Structure, John Wiley & Sons, 4th edition, pages 1019-1021.
Данную реакцию обычно проводят в растворителе в присутствии основания и в присутствии каталитических количеств катализатора фазового переноса или поверхностно-активного вещества, если они необходимы.
В предпочтительных условиях осуществления способа, описанного выше, используют избыток сильного основания от 2 до 3 эквивалентов, такого как производные лития, например метиллитий, этиллитий, бутиллитий или диизопропиламид лития, в негидроксилированных растворителях, таких как диэтиловый эфир, изопропиловый эфир, метил-трет-бутиловый эфир, ТГФ или диоксан, при температуре от 0°С до 5°С.
В других предпочтительных условиях используют, по меньшей мере, один эквивалент сильного основания, более предпочтительно избыток сильного основания от 2 до 5 эквивалентов, такого как алкоксиды щелочных металлов, например метоксид натрия, трет-бутоксид калия или амид натрия, или гидриды щелочных металлов, например гидрид натрия или гидрид калия, или щелочные основания, например гидроксид натрия или калия или карбонат натрия или калия, при температуре кипения реакционной среды с обратным холодильником, в гидроксилированных или негидроксилированных растворителях, предпочтительно негидроксилированных растворителях, имеющих температуру кипения, по меньшей мере, 90°С, предпочтительно, по меньшей мере, 100°С, таких как ароматические растворители, например толуол, ксилолы, мезитилен, этилбензол или хлорбензол, диоксан или этиленгликоль, или в простых гликолевых эфирах с температурой кипения, по меньшей мере, 100°С.
Для ускорения растворения оснований в реакционной среде можно использовать катализаторы фазового переноса, такие как четвертичные аммониевые соли, например триэтилбензиламмонийхлорид, или простые полигликолевые эфиры, например тритон Х100®.
В других предпочтительных условиях реакцию проводят в негидроксилированном растворителе, имеющем температуру кипения, по меньшей мере, 100°С, при температуре кипения реакционной среды с обратным холодильником, в присутствии от 2,1 до 2,2 эквивалентов трет-бутоксида калия и в присутствии от 1 до 10 мол.% тритона Х100® по отношению к арилсульфонилгидразону формулы (VII).
(Е)-Стильбеновые производные формулы (VI), определенной выше, получены таким образом и могут быть преобразованы в полигидроксистильбены, как описано ниже.
В частности, в данном изобретении предлагается новое соединение формулы (VI), отличающейся тем, что:
А представляет собой водород, R'1 и R'2 представляют собой метильную группу и R1 представляет собой изопропильную группу.
Данное новое соединение представляет собой следующее:
- (Е)-3,5-диметокси-4'-изопропилоксистильбен.
Особенно предпочтительный аспект данного изобретения заключается в осуществлении синтеза (Е)-триметилресвератрола, (Е)-трибензилресвератрола и (Е)-тетраметилписатаннола из соединений формулы (VII), раскрытой выше.
Получение полигидроксистильбенов (ресвератрола и писатаннола) из (Е)-стильбеновых производных формулы (VI)
C (Е)-стильбеновых производных формулы (VI) может быть снята защита способами, известными в литературе. Удаление защиты может быть осуществлено путем применения или адаптации способов, описанных, например, в WO 2003/086414, WO 2001/060774, EP 1466884 или Tetrahedron, 59(18), (2003), 3315-3321.
В предпочтительных технологических условиях используют от 3 до 10 молярных эквивалентов трибромида бора при температуре от -30°С до температуры окружающей среды.
(Е)-Гидроксистильбеновые производные формулы (VIII), например, в виде ресвератрола (В означает Н) получали, таким образом, согласно схеме, показанной ниже:
Согласно данному методу возможно согласно способу по изобретению получить ресвератрол и писатаннол из соединений формулы (IV) и, более конкретно, из соединений формулы (VII), определенной выше.
Данное изобретение также относится к способу синтеза соединения формулы (VII), описанной выше, с использованием, по меньшей мере, одного соединения, выбранного из соединений формул (I), (II), (III) и (IV), определенных в данной патентной заявке.
Настоящее изобретение также включает любое применение соединения формулы (I), (II), (III), (IV) или (VII), как определено выше, в качестве промежуточного соединения в синтезе (Е)-стильбенового производного формулы (VI), в частности (Е)-триметилресвератрола, (Е)-трибензилресвератрола или (Е)-тетраметилписатаннола, или в качестве промежуточного соединения в синтезе (Е)-полигидроксистильбенового производного, такого как ресвератрол или писатаннол.
Цель последующих примеров состоит в том, чтобы завершить данное описание без ограничения объема изобретения.
Пример 1
Синтез метил 3-(3,5-диметоксифенил)-2-(4-метоксифенил)-3-оксопропионата
24,1 г 60% гидрида натрия в минеральном масле (0,601 моль), которое промывали 2 раза 60 мл циклогексана и 60 мл ТГФ, помещают в трехгорлую круглодонную колбу на 1000 мл. Затем при температуре окружающей среды вводят раствор 48,2 г метил 3,5-диметоксибензоата (0,243 моль) в 100 мл ТГФ. Смесь кипятят с обратным холодильником и добавляют раствор 43,8 г метил п-метоксифенилацетата (0,243 моль), растворенного в 60 мл ТГФ, на протяжении 10 ч. Смесь поддерживают при кипении с обратным холодильником в течение 5 ч. Смесь охлаждают до температуры 0-5°С и добавляют раствор уксусной кислоты (38,0 г, т.е. 0,633 моль) в 100 мл ТГФ на протяжении 1/2 часа при этой температуре. Затем при температуре окружающей среды добавляют 150 мл воды и ТГФ отгоняют. Реакционную среду экстрагируют 500 мл метил-трет-бутилового эфира (МТВЕ) и органическую фазу промывают 100 мл насыщенного водного раствора бикарбоната натрия, промывают 50 мл воды и концентрируют на роторном испарителе с выделением 74,4 г сырого сложного β-кетоэфира в виде желтого масла, т.е. выход сырого продукта 89%.
200 мл метанола добавляют к 60 г данного сырого сложного β-кетоэфира и эту смесь поддерживают при температуре окружающей среды при перемешивании в течение 1 ч. Затем полученный осадок отфильтровывают и операцию повторяют со 150 мл метанола. Выделяют 24,7 г твердого вещества белого цвета.
5 г данного осадка поглощают 50 мл МТВЕ, нагретого до температуры кипения с обратным холодильником, температуру доводят до температуры окружающей среды и нерастворимый продукт (0,5 г) отфильтровывают. Фильтрат концентрируют досуха и полученный осадок повторно суспендируют в 20 мл метанола, нагретого до температуры кипения с обратным холодильником. После охлаждения до температуры окружающей среды осадок, который образовался, отфильтровывают и промывают на фильтре 5 мл метанола. Таким образом, выделяют 3,6 г твердого вещества белого цвета, и это твердое вещество имеет температуру плавления 76°С.
ЯМР (CDCl3) 200 МГц
Протон: δ 3,75 с (3H); δ 3,8 с (9H); δ 5,5 с (1H); δ 6,6 т 1H); δ 6,9 д (2H); δ 7,1 д (2H); δ 7,35 д (2H);
C13 (Dept 135): δ 52,5 (COOCH3); δ 55,07 и 55,37 (OCH3); δ 59,49 (CH); δ 105,65 (аром. CH); δ 106,60; 114,20; 130,45 (аром. CH).
Пример 2
Синтез метил 3-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)-3-оксопропионата
18,9 г 60% гидрида натрия в минеральном масле (0,47 моль), которое промывали 2 раза 50 мл циклогексана и затем 100 мл ТГФ, помещают в трехгорлую круглодонную колбу на 1000 мл и затем вводят 65,7 г метил 3,5-дибензилоксибензоата (0,189 моль) в 100 мл ТГФ. Смесь кипятят с обратным холодильником и добавляют раствор 48,3 г метил 4-бензилоксифенилацетата (0,189 моль) в 120 мл ТГФ на протяжении 10 ч. Смесь поддерживают при кипении с обратным холодильником в течение 4 часов, затем охлаждают до 0-5°С и при этой температуре добавляют раствор 29,4 г уксусной кислоты (0,49 моль) в 240 мл ТГФ. Затем добавляют 360 мл воды и отгоняют ТГФ при атмосферном давлении. Добавляют 360 мл МТВЕ, проводят разделение отстаиванием и органическую фазу выделяют и промывают 100 мл насыщенного водного раствора бикарбоната натрия. Органическую фазу концентрируют на роторном испарителе с получением 106,5 г сложного β-кетоэфира в виде вязкого желтого масла, т.е. выход сырого продукта 98%.
1 г данного продукта, элюированного на колонке с силикагелем (этилацетат/гептан 20/80), приводит к выделению 0,5 г метил 3-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)-3-оксопропионата в виде вязкого светло-желтого масла.
ЯМР (CDCl3) 200 МГц
Протон: δ 3,75 с (3H); δ 5,05 с (6H); δ 5,48 с (1H); δ 6,78 т (1H); δ 6,95 д (2H); δ 7,15 д (2H); δ 7,28 д (2H);
C13: δ 52,8 (COOCH3); δ 59,6 (CH); 70,1 и 70,4 (CH2OPh); δ 107-160 (аром. CH); δ 169,6 (C=O).
Пример 3
Синтез метил 3-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)-3-оксопропионата
23,8 г 60% NaH в минеральном масле (0,59 моль) помещают в трехгорлую круглодонную колбу на 1 л и промывают в круглодонной колбе 2 раза 60 мл циклогексана, а затем добавляют 46,7 г метил 3,5-диметоксибензоата (0,238 моль), растворенного в 200 мл ТГФ. Смесь кипятят с обратным холодильником и добавляют 50 г метил 3,4-диметоксифенилацетата (0,238 моль), растворенного в 120 мл ТГФ, на протяжении 10 ч. Смесь поддерживают при кипении с обратным холодильником в течение 2 часов, охлаждают до 0-5°С и при этой температуре добавляют по каплям 37,1 г (0,61 моль) уксусной кислоты, разведенной в 120 мл ТГФ. Затем добавляют 300 мл воды и отгоняют ТГФ. Смесь охлаждают до температуры окружающей среды и экстрагируют 400 мл МТВЕ, органическую фазу затем промывают 100 мл воды и реакционную среду концентрируют с выделением 92,9 г сырого метил 3-(3,5-диметоксифенил)-2-(3,4-диметоксифенил)-3-оксопропионата в виде вязкого желтого масла.
ЯМР (CDCl3) 200 МГц
Протон: δ 3,75 с (3H); δ 3,80 с (6H); δ 3,95 с (3H); δ 3,98 с (3H); δ 5,5 (1H); δ 6,5-7,3 м (6H);
C13: δ 52,5 (COOCH3); δ 56,46 и 56,53 (OCH3); δ 59,88 (CH); δ 99,67; 106,24; 111,50; 112,02; 121,02; 125,98; 146,48; 148,72; 149,29; 159,27 (аром. CH); δ 167,89 (C=O); δ 198,97 (COOCH3).
Пример 4
Синтез 1-(3,5-диметоксифенил)-2-(4-метоксифенил)этанона
26,7 г борной кислоты (0,43 моль) и 74,4 г сырого метил 3-(3,5-диметоксифенил)-2-(4-метоксифенил)-3-оксопропионата (0,216 моль), полученного по методике примера 1, помещают в круглодонную колбу, снабженную дистилляционной насадкой. Проводят нагревание, при этом температуру доводят постепенно до 100°С в течение 1 часа, 120°С в течение 1 часа, 140°С в течение 1 часа и затем 160°С в течение 4 часов при отгонке легких продуктов. Смесь охлаждают до 80°С, добавляют 250 мл воды и затем 200 мл толуола, смесь перемешивают при 60°С в течение 1 часа, затем проводят разделение отстаиванием и фазу толуола выделяют, промывают 100 мл насыщенного водного раствора бикарбоната натрия и концентрируют на роторном испарителе. Полученный сырой маслянистый продукт поглощают 200 мл МТВЕ для осаждения продукта, который отфильтровывают и сушат. Таким образом, после сушки получают 33,6 г 1-(3,5-диметоксифенил)-2-(4-метоксифенил)этанона в виде твердого вещества кремовато-белого цвета, т.е. выход 54,4% по отношению к сырому исходному сложному β-кетоэфиру. Т.пл.: 93-4°С.
ЯМР (CDCl3) 200 МГц
Протон: δ 3,5 с (3H); δ 3,6 м.д. (ppm) с (6H); δ 4,2 с (2H); δ 6,62 т (1H); δ 6,85 д (2H); δ 7,15 д (2H); δ 7,18 д (2H);
C13 (Dept 135): δ 44,6 (CH2); δ 55,1 и 55,4 (OCH3); δ 105,2; 106,3; 114; 130,2 (аром. CH).
Пример 5
Синтез 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанона
34,8 г сырого метил 3-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)-3-оксопропионата (0,0608 моль), полученного по методике примера 2, и 7,51 г борной кислоты (0,121 моль) помещают в круглодонную колбу на 250 мл. Реакционную среду нагревают до 100°С в течение 1 часа, 120°С в течение 1 часа, 140°С в течение 1 часа и затем 150-155°С в течение 5 часов при отгонке легких продуктов. Смесь охлаждают до 60°С и добавляют водный раствор 8,5 г гранул гидроксида натрия, растворенных в 175 мл воды. Смесь затем кипятят с обратным холодильником в течение 3 часов и вновь охлаждают до 60°С, добавляют 250 мл толуола, проводят разделение отстаиванием, органическую фазу выделяют и промывают 75 мл воды, а затем фазу толуола концентрируют на роторном испарителе. Выделяют 19,4 г сырого 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанона.
15 г данного сырого продукта кипятят с обратным холодильником в 140 мл метанола и смесь охлаждают и выдерживают при 20-25°С в течение 1 ч. Полученный осадок отфильтровывают, повторно суспендируют в 75 мл метанола, отфильтровывают и сушат при 40°С с получением 7 г 1-(3,5-дибензилоксифенил)-2-(4-бензилоксифенил)этанона в виде твердого вещества белого цвета, температура плавления которого равна 87°С.
ЯМР (