Фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре
Иллюстрации
Показать всеИзобретение относится к новым фторированным производным 1,4-нафтохинона общей формулы (II), обладающим цитотоксической активностью по отношению к раковым клеткам человека в культуре. В формуле
R=NHCH2COOH, NHCH2COOC2H5,
NH(CH2)3COOH, NH(СН2)3СООН,
NH(CH2)2COOH, OOC(CH2)3NH2.
Предлагаемые соединения могут найти применение в медицине для терапии злокачественных новообразований. 1 ил., 4 табл.
Реферат
Изобретение относится к области биоорганической химии и молекулярной биологии, а именно к фторированным производным 1,4-нафтохинона, содержащим аминокислотные фрагменты и обладающим цитотоксической активностью по отношению к раковым клеткам человека в культуре.
Клетки млекопитающих обычно используют обратимое фосфорилирование остатков тирозина в белках для передачи внеклеточного сигнала к внутриклеточным мишеням. Учитывая это, нарушение медиаторов передачи сигнала через фосфорилирование белков, а именно протеинкиназ и фосфатаз, связано с развитием большого числа заболеваний человека, включая раковые заболевания. Известно, что Cdc25A и Cd25B фосфатазы важны для контроля клеточного цикла и активируют циклинзависимые киназы, которые играют важную роль в регуляции пролиферации клеток. Cdc25A и Cd25B фосфатазы человека обладают онкогенными свойствами и гиперэкспрессированы в различных раковых клетках человека. В связи с этим, они представляют интерес как мишени для антираковых препаратов [Boutros R., Dosier С., Ducommun В. Curr. Opin. Cell. Biol. 2006. V.18, P.185; Kristjansdottir K., Rudolf J.J. Chem. Biol., 2004. V.11. P.1043]. Среди большого числа различных исследованных соединений только некоторые производные нафтохинона [Eckstein J.W. Invest. New. Drugs. 2000. V.18, P.149; Pesttell K.Е., Ducruet A.P., Wipf P., et al. Oncogene., 2002. V.19. P.6607], и особенно нафтохинон NSC 95397 из National Cancer Institute library [Lazo J.S., Nemoto K., Pestell K.E. et al., Mol. PharmacoL, 2002. V.61. P.720] обладают способностью эффективно ингибировать Cdc25A фосфатазу.
Было показано, что пара-нафтохиноны, 7-аминохинолин-5,8-хинон и замещенные изохинолин-5,8-хиноны являются коровыми структурами для синтеза потенциальных ингибиторов Cdc25 фосфатаз; примером таких производных является соединение DA3003-1 [Lazo J.S., Nemoto K., Pestell K.Е. et al., Mol. Pharmacol., 2002. V.61. P.720; Wipf P., Joo В., Nguyen Т., Lazo J.S. Org. Biol. Chem., 2004, V.2. P.2173]. Показано, что производные хинона инактивируют Cdc25B фосфатазу либо по реакции Михаэля, либо за счет окисления каталитически важного остатка цистеина [Brisson М., Nguyen Т., Wipf Р., et al., Mol. Pharmocol., 2005. V.68. Р.1810-1820]. Известно, что некоторые замещенные производные хинолин-5,8-хинона по положениям С(2), С(3) и С(4) являются эффективными ингибиторами Cdc25B фосфатазы и роста раковых клеток [Cossy J., Belotti D., Brisson М., et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287]. Коровая структура пара-хинона входит в состав 14-ти широко используемых в клинике лекарственных препаратов и представляется фундаментальной для синтеза новых потенциальных ингибиторов ферментов, которые являются мишенями в антираковой терапии [Cossy J., Belotti D., Brisson М., et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287].
Известен тетрафторированный 2-(2-меркаптоэтанол)-3-метил-5,6,7,8-тетрафтор-1,4-нафтохинон (фторированный-Cpd 5), который обладает более высокой активностью в подавлении роста Нер3В клеток, чем исходный Cpd 5 (Ham W.H. et al., 2004, Bioorg. Med. Chem. Lett., 2004, V.14. P.4103-4105). Фторированный-Cpd 5 был получен по реакции 2-метил-3,5,6,7,8-пентафтор-1,4-нафтохинона с 2-меркаптоэтанолом.
Недостатками известного Cpd 5 соединения и его фторированного производного являются их высокая токсичность, поскольку они содержат атомы серы - тиоловые группы, которые легко окисляются (подвергаются окислительному стрессу) с образованием токсичных радикалов.
Наиболее ближайшим к заявляемым соединениям - прототипом, является средство, представляющее собой фторированные производные 1,4-нафтохинона общей формулы (I):
где 1) R1=NHC(СН3)3, R2, R3=F; 2) R1=NHCH2CH2SCH3, R2, R3=F; 3) R1=N(СН2СН3)2, R2, R3=F; 4) R1=N(CH2CH2)2O, R2, R3=F; 5) R1=NHCH2CH2CH2CH3, R2, R3=F; 6) R1=NHC6H5, R2, R3=F; 7) R1=N(CH3)CH2CH2OH, R2, R3=F; 8) R1, R3=NHCH2CH2CH2CH3, R2=F; 9) R1=N(CH2CH2OH)2, R2, R3=F; 10) R1=NHC6H5, R2=СН3, R3=F; 11) R1=ОСН3, R2, R3=F; 12) R1=NH(CH2)2SS(CH2)2HN(2-пентафтор-1,4-нафтохинонил), R2, R3=F; 13) R1=NHC2H5, R2, R3=F; 14) R1=N+C5H5, R2=O-, R3=F; 15) R1=NHCH2CH2OH, R2, R2=F; 16) R1, R2=ОСН3, R3=F, обладающее цитотоксической активностью по отношению к раковым клеткам человека в культуре (патент RU 2387635, С2, 27.04.2010).
Известные соединения получают взаимодействием гексафтор-1,4-нафтохинона или 2-метилпентафтор-1,4-нафтохинона (для соединения 10) с азот- и кислородцентрированными нуклеофилами.
Недостатком известных соединений является то, что они проявляют сильное различие в ингибировании роста раковых клеток различного типа и некоторые из них подавляют рост раковых и обычных клеток при почти одинаковых концентрациях.
Технической задачей данного изобретения является создание фторированных производных 1,4-нафтохинона, содержащих аминокислотные фрагменты и обладающих цитотоксической активностью по отношению к раковым клеткам человека в культуре, а также в меньшей степени подверженных реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса.
Поставленная техническая задача достигается предлагаемыми фторированными производными 1,4-нафтохинона общей формулы (II):
где:
| 1) R=NHCH2COOH | 4) R=NH(СН2)3СООН |
| 2) R=NHCH2COOC2H5 | 5) R=NH(CH2)2COOH |
| 3) R=NH(CH2)5COOH | 6) R=ООС(СН2)3NH2 |
Предлагаемые соединения получают взаимодействием гексафтор-1,4-нафтохинона (III) с аминокислотой или ее эфиром и характеризуют с помощью методов элементного анализа или масс-спектроскопии высокого разрешения, спектров ЯМР 1Н и 19F. Ниже приведена общая схема получения заявляемых соединений:
где HR: 1)H2NCH2COOH; 2) H2NCH2COOC2H5; 3) H2N(CH2)5СООН; 4) H2N(СН2)3СООН; 5) H2N(CH2)2COOH; 6) HOOC(CH2)3NH2.
Фторированные производные 1,4-нафтохинона в меньшей степени подвергаются реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса за счет отсутствия атомов серы и индукционного эффекта электроотрицательных атомов фтора, поэтому они могут быть более перспективными соединениями для направленного подавления развития раковых клеток, синтезирующих в повышенных количествах онкогенные протеинкиназы и фосфатазы.
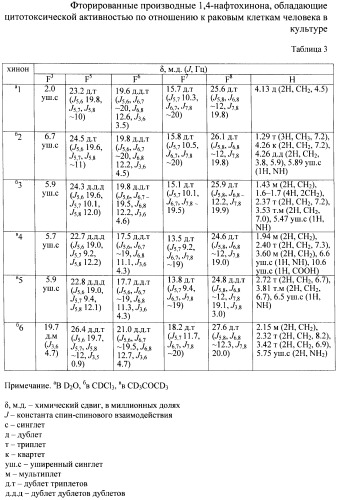
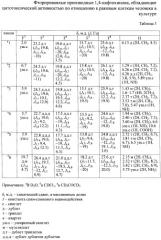
В таблице 1 представлены заявляемые фторированные производные 1,4-нафтохинона и их структурные формулы. Физико-химические характеристики фторированных производных 1,4-нафтохинона представлены в таблице 2. Характеристики спектров ЯМР 1H и 19F представлены в таблице 3.
Изобретение иллюстрируется следующими примерами конкретного получения предлагаемых соединений.
Пример 1.
Получение (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино) уксусной кислоты (1). Раствор 0.147 г (1.96 ммоль) глицина в 0.5 мл воды прикалывали к суспензии 0.200 г (0.75 ммоль) хинона (III) в 3 мл диоксана и перемешивали при комнатной температуре 23 дня. После очистки методом ТСХ (силикагель, незакрепленный слой, этилацетат) получили 0.147 г (61%) хинона (1) Красно-оранжевые кристаллы, т.пл. >120°С, с разложением. Найдено [М]+ 321.0055. C12H4F5NO4. Вычислено М 321.0055. Спектр ЯМР, δ/м.д. (J/Гц):19F 2.0 уш.с. (F3), 23.2 д.т (J5,6 19.8, J5,7, J5,8 ~10) (F5), 19.6 д.д.т (J5,6, J6,7 ~20, J6,8 12.6, J3,6 3.5) (F6), 15.7 д.т (J5,7 10.3, J6,7, J7,8 ~20) (F7), 25.6 д.т (J5,8, J6,8 ~12, J7,8 19.8) (F8); 1H 4.13 д (2Н, СН2, 4.5).
Пример 2.
Получение этилового эфира (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусной кислоты (2). Смесь 0.200 г (0.75 ммоль) хинона (III), 0.157 г (1.13 ммоль) гидрохлорида этилового эфира глицина, 0.063 г (1.13 ммоль) КОН и 2 мл ДМСО перемешивали 24 ч при комнатной температуре. Затем добавляли воду (~5 мл), осадок отделяли на центрифуге, промывали водой и кристаллизовали из этанола. Выход хинона (2) 0.173 г (66%), красные кристаллы, т.пл. 139-142°С. Найдено [M]+ 349.0362. C14H8F5NO4. Вычислено М 349.0368. Спектр ЯМР, δ/м.д. (J/Гц): 19F 6.7 уш.с. (F3), 24.5 д.т (J5,6 19.6, J5,7, J5,8 ~11) (F5), 19.8 д.д.т (J5,6, J6,7 ~20, J6,8 12.2, J3,6 4.5) (F6), 15.8 д.т (J5,7 10.5, J6,7, J7,8 ~20) (F7), 26.1 д.т (J5,8, J6,8 ~12, J7,8 19.8) (F8); 1H 1.29 т (3Н, СН3, 7.2), 4.26 к (2Н, СН2, 7.2), 4.26 д.д (2Н, СН2, 3.8, 5.9), 5.89 уш.с (1Н, NH).
Пример 3
Получение 3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино) масляной кислоты (4). Смесь 0.101 г (0.380 ммоль) хинона (III), 0.051 г (0.495 ммоль) γ-аминомасляной кислоты и 7 мл диоксана перемешивали 11 суток при комнатной температуре. Осадок отделяли на центрифуге, растворитель удаляли в вакууме. Получили 0.108 г (81%) хинона (4), красные кристаллы, т.пл. 192°С, с разложением. Найдено, %: С 47.86; Н 2.33; F 26.93. C14H8F5NO4. Вычислено, %: С 48.15; Н 2.31; F 4.01. Спектр ЯМР, δ/м.д. (J/Гц): 19F 5.7 уш.с. (F3), 22.7 д.д.д. (J5,6 19.0, J5,7 9.2, J5,8 12.2) (F5), 17.5 д.д.т. (J5,6, J6,7 ~19, J6,8 11.1, J3,6 4.3) (F6), 13.5 д.т. (J5,7 9.2, J6,7, J7,8 ~19) (F7), 24.6 д.т. (J5,8, J6,8 ~12, J7,8 19.0) (F8); 1Н 1.94 (2Н, CH2), 2.40 т (2Н, CH2, 7.3), 3.60 м (2Н, СН2), 6.6 уш.с. (1Н, NH), 10.6 уш.с. (1Н, СООН).
Пример 4
Получение пентафтор-1,4-диоксо-1,4-дигидронафт-2-иловый эфир 4-аминомасляной кислоты (6). Раствор 0.101 г (0.98 ммоль) γ-аминомасляной кислоты в 0.5 мл воды прикалывали к суспензии 0.200 г (0.75 ммоль) хинона (III) в 2 мл диоксана. Полученную смесь перемешивали при комнатной температуре 2 суток. Растворители удаляли в вакууме водоструйного насоса, из сухого остатка экстрагировали хлороформом фракцию, обогащенную хиноном (6). Растворитель удаляли отгонкой, остаток очищали многократной перекристаллизацией из хлороформа. Получили 0.066 г (25%) хинона (6), желтые кристаллы, т.пл. >120°С, с разложением. Найдено, %: С 47.83; Н 2.34; N 4.05. C14H8F5NO4. Вычислено, %: С 48.15; Н 2.31; N 4.01. Спектр ЯМР, δ/м.д. (J/Гц): 19F 19.7 д.м (J3,6 4.7) (F3), 26.4 д.д.т (J5,6 19.7, J5,7, J5,8 ~12, J3,5 0.9) (F5), 21.0 д.д.т (J5,6, J6,7 ~19.5, J6,8 12.7, J3,6 4.7) (F6), 18.2 д.т (J5,7 11.7, J6,7, J7,8 ~20) (F7), 27.6 д.т (J5,8, J6,8 ~12.3, J7,8 20.0) (F8); 1H 2.15 м (2Н, CH2), 2.32 т (2Н, CH2, 8.2), 3.42 т (2Н, СН2, 6.9), 5.75 уш.с (2Н, NH2).
Пример 5
Проводили испытание влияния предлагаемых соединений на рост различных линий раковых клеток в культуре. Клетки аденокарциномы молочной железы человека MCF-7 выращивали в среде IMDM, клетки миеломы человека (линия RPMI 6228) выращивали с использованием среды RPMI 1640 с 40 мкг/мл гентамицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% СО2 в 96-луночных планшетах.
Для сравнения относительной активности всех соединений в одинаковых условиях их растворяли в ДМСО в высокой концентрации (10 мг/мл), а затем стоковый раствор разбавляли ДМСО для получения серии растворов с нужной концентрацией. При использовании клеток аденокарциномы молочной железы после формирования
50-70% монослоя в культуральную среду добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема) и следили за ростом клеточной культуры в течение 3-х суток.
При использовании клеток линии миеломы человека, которая является суспензионной культурой, клетки рассевали в 96-луночный планшет в количестве 100 мкл на лунку, концентрация 2×105 клеток/мл; через 12-24 часа добавляли исследуемые препараты фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема смеси в лунке).
Действие фторированных производных 1,4-нафтохинона на клетки MCF-7 и RPMI 6228 в культуре и подавление их роста проводили с помощью теста, основанного на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид (МТТ) в формазан (МТТ-тест), который кристаллизуется внутри клетки. Так как у нежизнеспособных клеток ферменты не функционируют и отсутствуют кофакторы этого превращения, они не окрашиваются МТТ. Образовавшийся осадок формазана в жизнеспособных клетках растворяли в изопропаноле и его количество определяли спектрофотометрически по поглощению на длине волны λ=560 нм.
В качестве положительного контроля использовали клетки, которые выращивали в отсутствие фторированных производных 1,4-нафтохинона. Было установлено, что ДМСО в использованной концентрации (1%) заметного влияния на рост раковых клеток не оказывает. Кроме того, установлено, что исследуемые соединения не влияют на окраску клеток в МТТ-тесте, если они добавлены в лунки с клетками непосредственно перед проведением теста.
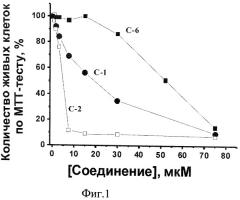
Для оценки относительной активности всех предлагаемых соединений в подавлении роста раковых клеток были исследованы зависимости количества живых клеток от концентрации этих соединений. В качестве примера на фиг.1 приведены данные для трех из исследованных соединений. Определение концентрации соединений (C50), при которой происходит подавление (ингибирование) роста клеток на половину (50%), проводили с помощью МТТ-теста. На фиг.1 приведены данные для хинонов С-1 (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусная кислота), С-2 (этиловый эфир (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусной кислоты) и С-6 (3,5,6,7,8-пентафтор-1,4-диокса-1,4-дигидронафт-2-иловый эфир 4-аминомасляной кислоты). Количество живых клеток в контроле (инкубация клеток без соединений) принимали за 100%.
С помощью таких кривых определяли концентрацию соединения (C50), при которой происходит подавление (ингибирование) роста клеток наполовину. Данные по влиянию заявляемых соединений (ингибирование на 50%, C50) на рост раковых клеток миеломы человека (RPMI 6228) и аденокарциномы человека (MCF-7), а также контрольных клеток мышиных фибробластов линии LMTK после инкубации в течение 48 ч приведены в табл.4, где *приведены усредненные данные для как минимум трех независимых экспериментов. **Для соединения 4 указано понижение количества жизнеспособных клеток в процентах в присутствии ингибитора в максимальной концентрации (25 мкг/мл), а для соединений 5 и 6 при этой концентрации заметного ингибирования роста клеток не обнаружено.
Из таблицы 4 видно, что предлагаемые соединения подавляют рост раковых клеток миеломы (RPMI 6228) и аденокарциномы человека (MCF-7) в культуре при концентрациях 3,2-63,5 мкМ (или 0,1-7,5 мкг/ мл). Большая часть новых фторированных производных 1,4-нафтохинона (соединения 1, 4-6) демонстрирует значения C50 в диапазоне 20-63,5 мкМ в случае двух типов раковых клеток (RPMI 6228 и MCF-7), в то время как соединения 2 и 3 ингибируют рост этих клеток в более низких концентрациях (3,2-11 мкМ).
Фторированные производные 1,4-нафтохинона являются ингибиторами Cdc25A и Cd25B фосфатаз, которые играют важную роль в регуляции пролиферации клеток и гиперэкспрессированы в различных раковых клетках человека. Поскольку модификация киназ должна вести к гибели клеток, фторированные производные 1,4-нафтохинона проявляют цитотоксичность (как и другие известные антираковые препараты) как по отношению к раковым, так и по отношению к нормальным соматическим клеткам млекопитающих. Однако фторированные 1,4-нафтохиноны в большей степени ингибируют именно раковые клетки, а не обычные клетки млекопитающих.
Из табл.4 также видно, что подавление роста раковых клеток на 50% с помощью соединений 1, 2 и 3 происходит при концентрациях в 1,9-6,4 раз более низких, чем клеток нормальных фибробластов. Три соединения (4, 5 и 6), которые ингибируют рост раковых клеток двух типов (RPMI 6228 и MCF-7) примерно с одинаковой эффективностью (C50=40-63,5 мкМ), а заметного подавления роста клеток нормальных фибробластов не наблюдается даже при очень высоких концентрациях порядка 71-75 мкМ (25 мкг/мл). Полученные данные свидетельствуют о том, что некоторые новые фторированные производные 1,4-нафтохинона могут оказаться очень перспективными для избирательного подавления роста раковых клеток. Таким образом, предлагаемые новые фторированные производные 1,4-нафтохинона являются эффективными ингибиторами роста раковых клеток и являются потенциально перспективными для их использования в антираковой терапии.
| Таблица 1 | ||
| Фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре | ||
| 1 | (3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусная кислота | |
| 2 | Этиловый эфир (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусной кислоты | |
| 3 | 6-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)капроновая кислота | |
| 4 | 4-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)масляная кислота | |
| 5 | 3-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)пропионовая кислота | |
| 6 | 3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иловый эфир 4-аминомасляной кислоты |
| Таблица 2. | ||
| Фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре | ||
| 1 | (3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусная кислота | Красно-оранжевые кристаллы, т.пл. >120°С, с разложением. Найдено [M]+ 321.0055. C12H4F5NO4. Вычислено М 321.0055. |
| 2 | Этиловый эфир (3,5,6,7,8-пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)уксусной кислоты | Красные кристаллы, т.пл. 139-142°С. Найдено [М]+ 349.0362.C14H8F5NO4. Вычислено М 349.0368. |
| 3 | 6-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)капроновая кислота | Бордовые кристаллы, т.пл. 168-170°С, с разложением. Найдено, %: С 50.64; Н 3.20; N 3.74. C16H12NO4. Вычислено, %: С 50.94; Н 3.21; N 3.71. |
| 4 | 4-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)масляная кислота | Красные кристаллы, т.пл. 192°С, с разложением. Найдено, %: С 47.86; Н 2.33; F 26.93. C14H8F5NO4. Вычислено, %: С 48.15; H 2.31; F 4.01. |
| 5 | 3-(3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иламино)пропионовая кислота | Бордовые кристаллы, т.пл. >160°С, с разложением. Найдено, %: С 46.32; Н 1.80; N 4.29. C13H6F5NO4. Вычислено, %: С 46.58; Н 1.80; N 4.18. |
| 6 | 3,5,6,7,8-Пентафтор-1,4-диоксо-1,4-дигидронафт-2-иловый эфир 4-аминомасляной кислоты | Желтые кристаллы, т.пл. >120°С, с разложением. Найдено, %: С 47.83; Н 2.34; N 4.05. C14H8F5NO4. Вычислено, %: C 48.15; H 2.31; N 4.01. |
| Таблица 4. | ||||
| Фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре | ||||
| Тип клетокНомер соединения | Величина С50, мкМ* | Отношение С50 для LMTK и раковых клеток | ||
| RPMI 6228 | MCF-7 | LMTK | ||
| 1 | 25,4±5,0 | 20,0±4,0 | 60±12,0 | 2,4-3,0 |
| 2 | 6,8±1,8 | 3,2±0,6 | 13,0±3,0 | 1,9-4,0 |
| 3 | 6,7±1,7 | 14,0±3,0 | 43,0±8,0 | 3,3-6,4 |
| 4 | 40,0±8,0 | 50±10,0 | 10,0±2,0%** | >>10 |
| 5 | 63,5±12 | 60±12,0 | Нет ингибирования** | >>100 |
| 6 | 56,2±11,0 | 43,9±7,0 | Нет ингибирования** | >>100 |
Фторированные производные 1,4-нафтохинона общей формулы (II): где
| 1) R=NHCH2COOH | 4) R=NH(СН2)3СООН |
| 2) R=NHCH2COOC2H5 | 5) R=NH(CH2)2COOH |
| 3) R=NH(CH2)5COOH | 6) R=ООС(СН2)3NH2, |