Способ получения растительно-микробных ассоциаций для фиторемедиации на основе микроразмножаемых растений и плазмидосодержащих ризосферных бактерий
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ получения растительно-микробных ассоциаций для фиторемедиации на основе микроразмножаемых растений томата, рапса и арабидопсиса и плазмидосодержащих ризосферных бактерий, обладающих антимикробной активностью против бактерий вида Erwinia carotovora и грибов вида Phytophthora infestans, включает колонизацию посадочного материала культивируемых in vitro растений штаммом Pseudomonas aureofaciens BKM В-2500 Д, несущим плазмиды pBS216, pKSl, придающие устойчивость ему к нафталину и мышьяку, или Pseudomonas aureofaciens BKM B-2501 Д, несущим плазмиды pBS216, pBS501, придающие устойчивость ему к нафталину и никелю. Изобретение позволяет повысить защиту растений от токсического воздействия нафталина и тяжелых металлов, а также рост и устойчивость растений к фитопатогенным микроорганизмам. 5 ил., 3 табл.
Реферат
Изобретение относится к биотехнологии, микробиологической промышленности и сельскому хозяйству, а именно к микробиологическим средствам защиты растений от болезней, вызываемых фитопатогенами, с помощью колонизации микроорганизмами, способными к деградации токсичных соединений и тяжелых металлов.
Повышение продуктивности сельскохозяйственных растений и их устойчивости к различным биотическим и абиотическим стрессовым факторам внешней среды является важнейшей проблемой современной агробиотехнологии. Получение растений, способных поглощать и деградировать различные токсичные химические соединения посредством растительно-микробных ассоциаций, является перспективным способом для фиторемедиации. Значительный ущерб сельскохозяйственным культурам причиняется фитопатогенными микроорганизмами. Получение растений, устойчивых к болезням, вызываемым фитопатогенными микроорганизмами, посредством растительно-микробных ассоциаций, является перспективным способом повышения устойчивости растений.
Известно, что грибы-фитопатогены по вредоносности занимают первое место среди прочих возбудителей заболеваний. Например, эффективное возделывание томатов ограничивается такими болезнями как фитофторозное увядание (Phytophthora infestans), сухая гниль или фузариоз (Fusarium sp.), сухая пятнистость или альтернариоз (Alternaria sp.), также несколькими разновидностями бактериоза (кольцевая гниль, бурая бактериальная гниль (Erwinia carotovora). Возделывание рапса ограничивается заболеваниями: белая гниль (Sclerotinia sclerotiorum), коричневая пятнистость листьев - лептосферия (Leptosphaeria maculans), сухая пятнистость или альтернариоз (Alternaria sp.), сухая гниль - вертициллез (Verticillium), серая гниль - ботритис (Botrytis), черная ножка - ризоктония (Rhizoctonia solani), желтуха листьев - фузариоз (Fusarium avenaceum).
В современном сельском хозяйстве защита от фитопатогенов достигается различными комплексными подходами. Одним из методов является применение химических средств защиты. Недостаток этого метода - наносимый урон для экологии. Второй подход - использование методов традиционной селекции, когда выводятся сорта, обладающие повышенной устойчивостью к определенным расам грибов. Недостатком классического селекционно-генетического метода является большая продолжительность времени для получения одного сорта. Третий путь - используется способ защиты растений с помощью генетической инженерии. Этот метод позволяет переносить в растения отдельные гены резистентности и получать растения с повышенной устойчивостью к фитопатогенам за более короткие сроки. Применение генно-инженерных технологий позволяет ускорить процесс создания нового сорта растений по сравнению с традиционной селекцией и получить прогнозируемый эффект по определенному признаку. Этот метод предусматривает необходимость тщательной оценки риска и выгоды использования генетически модифицированных (ГМ) растений.
Продуктивность растений и их безопасность может снижаться при выращивании растений на почвах, загрязненных пестицидами, гербицидами и тяжелыми металлами. Различные поллютанты представляют серьезную опасность, поскольку, накапливаясь в сельскохозяйственных растениях могут поступать в организм человека и вызывать ряд тяжелых заболеваний.
Для возможности детоксикации растениями токсичных соединений используют методы генной инженерии. Для этого в растения переносят гены деградации тяжелых металлов и органических соединений (Drace P.M.W., Chargelegue D., Vine N.D., Dolleweerd J., Obregon P., Ma J. K.-C. Transgenic plants expressing antibodies: a model for phytoremediation. FASEB. 0892-6638/02/0016-1855; Rugh C.L, Wide H.D, Stack N.M, Thompson D.M, Summers A.O., Meagher R.B. Mercuric ion reduction and resistance in transgenic Arabidopsis thaliana plants expressing a modified bacterial merA gene. Proc. Natl. Acad. Sci. USA. 1996. V.93, pp.3182-3187).
Разрабатываются концепции биоремедиации, основанные на совместном использовании различных комбинаций растений и специфических штаммов природных ризосферных микроорганизмов, способных стимулировать рост растений и защищать их от фитопатогенов, а также деградировать углеводороды нефти и трудно разлагаемые пестициды. Дальнейшее развитие этого перспективного биотехнологического направления является важной задачей при разработке новых биоремедиационных технологий защиты окружающей среды.
Известны способы защиты сельскохозяйственных растений от фитопатогенов путем обработки семян или культивируемых в открытом и закрытом грунте растений препаратами микроорганизмов - антагонистов фитопатогенов таких видов, как Bacillus species, Azotobacter, Arthrobacter, Pseudomonas, Streptomyces, Frankia species.
Многие из этих микроорганизмов обитают в ризосфере растений и способны синтезировать регуляторы роста растений (фитогормоны), улучшать фосфорное питание растений, фиксировать атмосферный азот, индуцировать резистентность к фитопатогенам за счет синтеза антибиотиков и сидерофоров. Использование таких штаммов находит широкое применение в современной агробиотехнологии.
Известен способ защиты злаковых культур от грибных возбудителей путем обработки растений порошком, приготовленным путем высушивания культуры Bacillus species. Этот штамм продуцирует комплекс антибиотических веществ и литических ферментов, обуславливающих антагонизм к широкому спектру фитопатогенных грибов (хитиназы, β-1,3-глюканазы, антибиотические пептиды). Использование этого препарата позволяет снизить заболевания растений корневыми гнилями и повысить урожай (Мелентьев А.И., Усанов Н.Г., Логинов О.Н. Штамм бактерий Bacillus sp.739 для получения препаратов против грибных возбудителей болезней злаковых культур // Патент РФ №1743019, БИ №14, 1994).
Известен способ предпосевной обработки семян ризосферным микроорганизмом Azotobacter vinelandii ИБ4. Этот штамм обладает способностью продуцировать цитокинины, проявляя при этом ростстимулирующую активность. Эти свойства позволяют использовать его для борьбы с грибными болезнями пшеницы и фасоли (Barea J.M., Brown М.Е. Effects of plant growth produced by Azotobacter paspali related to synthesis of plant growth regulating substances // J. Appl. Bacteriol. 1974. V.40. P.583-599).
Известен способ, включающий предпосевную обработку бактериями рода Pseudomonas семян огурцов, капусты и картофеля. Бактерии этого рода обладают способностью синтезировать сидерофоры - желто-зеленые флуоресцирующие водорастворимые пигменты, обладающие ингибирующим действием на фитопатогены и стимулирующим действием на растения (Ермолаева Н.И., Иванова Н.И., Скворцова Н.П. и др. Применение биометода в открытом и защищенном грунте: Использование ризосферных бактерий рода Pseudomonas для предпосевной обработки огурцов, капусты и картофеля // Защита растений. 1992. №8. С.24-25).
Применение этих методов защиты растений эффективно, но имеет ряд недостатков. Обработка растений микробиологическими препаратами приводит к кратковременным положительным эффектам и требует нескольких обработок растений в период вегетации, поскольку микроорганизмы, используемые в биопрепаратах, не способны установить прочную ассоциативную связь с растениями вследствие конкуренции с другими почвенными микроорганизмами в окружающей среде. В этих методах не всегда достигается положительный эффект защиты растений против болезней, вызываемых фитопатогенными микроорганизмами, что может быть связано как с потерей жизнеспособности клеток (микроорганизмов), так и с низкой степенью приживаемости полезных микроорганизмов на растениях. Недостаточная эффективность закрепления защитно-стимулирующих веществ на поверхности семян и растений в значительной мере влияет на поражение рассады почвенными фитопатогенами и, в конечном счете, на урожай. Кроме того, возникает необходимость специального оборудования для нанесения препаратов на объекты обработки, а также высокие нормы расхода препаратов и, как следствие, завышенные затраты.
Известно применение штамма Pseudomonas aureofaciens ИБ51 для защиты пшеницы от заболеваний, вызываемых грибными фитопатогенами. В качестве препарата против заболеваний пшеницы использовали суспензию, полученную при культивировании данного штамма, ею обрабатывали семена пшеницы in vivo. Препарат подавляет развитие заболеваний пшеницы, вызываемых твердой головней и корневыми гнилями (Логинов О.Н., Свешникова Е.В., Силищев Н.Н., Мелентьев А.И., Галимзянова, Н.Ф., Бойко Т.Ф. Штамм бактерий Pseudomonas aureofaciens для получения препарата против заболеваний пшеницы, вызываемых грибными фитопатогенами // Патент РФ, №2203945, БИ №13, 2003).
Недостатком метода является его малая эффективность за счет того, что семена обрабатывались в условиях in vivo, т.е. в присутствии других различных микроорганизмов, которые могут препятствовать установлению ассоциативной связи с растением, в случае, если этот штамм является колонизатором. Поэтому в этом случае сложно контролировать степень защиты и ее временной период.
Известен способ микроразмножения растений in vitro, который включает следующие стадии:
1. Стерилизация растительного материала: срезают молодые, полностью развернувшиеся листья, выращенные в теплице, дезинфицируют их, обработав 5% раствором гипохлорита натрия, содержащим 0,5% Твин 20 в течение 10 мин, затем ополаскивают трижды в стерильной дистиллированной воде.
2. Разрезают листья (стебли) на кусочки длиной 5-10 мм и помещают их на питательную среду МС (Murashige Т., Skooge F. A revised medium for rapid growth and bioassays with tobacco cultures // Physiol. Plant. 1962. V.15. P.473-497), содержащую необходимые добавки и регуляторы роста.
3. Инкубируют при 25-29°С, 16-часовом световом дне и освещенности 1000 лк. Придаточные побеги или регенеранты образуются из экспланта через 4 недели.
4. Делят каждую культуру и через 4 недели переносят на ту же среду. Эту процедуру продолжают до получения необходимого числа растений.
5. Укореняют побеги, перенеся их на агаризованную среду МС, содержащую ауксины (например, 1 мг/л нафтилуксусной кислоты). Укоренившиеся побеги пересаживают в почву (Биотехнология растений: культура клеток. Под редакцией Р.Г.Бутенко. М.: Агропромиздат.1989. С.280).
Этот метод широко применяется в современной биотехнологии. Он имеет ряд преимуществ перед обычным вегетативным способом:
- быстрый способ размножения, обеспечивающий получение в течение нескольких месяцев тысяч растений, идентичных материнской линии;
- получение здорового посадочного материала, свободного от патогенных микроорганизмов (грибы и бактерии), а также возможность элиминации патогенных форм вирусов и выращивание безвирусного материала;
- отсутствие сезонности в работе и возможность производства посадочного материала в любое время года;
- экономия значительных площадей и ресурсов, которые обычно требуются для выращивания и поддержания здорового маточного материала;
- для многих видов растений - возможность консервации избыточно произведенного посадочного материала;
- минимальные требования к производственным площадям и количеству квалифицированного персонала.
Недостатком метода является то, что обычно микроразмноженные in vitro растения при переносе в естественные условия роста не имеют «иммунитета» и часто не способны противостоять фитопатогенам и неблагоприятным условиям внешней среды.
Известен способ микробной колонизации растений табака, пшеницы, льна, картофеля штаммами метилобактерий Methylovorus mays и метанотрофными бактериями Methyomonas methanica in vitro, который заключается в том, что 15-дневные черенки стерильных растений табака, выращенных в культуре in vitro на агаризованной питательной среде инокулировали бактериальными штаммами. Для этого штаммы метило- или метанобактерий выращивали в течение ночи в жидкой среде Канеда (Доронина Н.В., Кудинова Л.В., Троценко Ю.А. Methylovorus mays - новый вид аэробных облигатных метилобактерий, ассоциированных с растениями // Микробиология. 2000. Т.69. С.712-716) на качалке (180 об/мин) при комнатной температуре. Полученную суспензию разводили до концентрации 103-106 клеток на 1 мл и наносили стерильной кисточкой на листья стерильных растений табака. Растения инкубировали при 22-24°С в термальной комнате. Через каждые три недели растения черенковали, пересаживали на свежие среды и тестировали на наличие ассоциативности микроорганизмов с растениями.
Содержание клеток в листьях составляет 1-3 тыс. колониеобразующих единиц на 1 см2. При последующих размножениях ассоциативные микроорганизмы сохраняются в межклетниках растений и участвуют в метаболизме растений как симбионты, поставляя растениям регуляторы роста, витамины, полисахариды и другие полезные соединения. Это указывает на прочную ассоциативную связь бактерий с растениями. Наличие ассоциативной связи используемых микроорганизмов с растениями оказывало положительное влияние на рост и морфогенез растений (Каляева М.А., Иванова Е.Г., Доронина Н.В., Захарченко Н.С., Троценко Ю.А., Бурьянов Я.И. Влияние аэробных метилотрофных бактерий на морфогенез пшеницы мягкой (Triticum aestivum) m vitro 2003 // Физиология растений. Т50, №3. С.354-359).
В этой работе не показана возможность влияния такой колонизации на повышение устойчивости растений к фитопатогенам.
Известен способ колонизации растений картофеля и земляники штаммом бактерий Pseudomonas aureofaciens BKM B-2188 in vitro, который заключается в том, что 15-дневные черенки стерильных растений картофеля и мутовки земляники, выращенных в культуре in vitro на агаризованной питательной среде МС, инокулировали бактериальным штаммом Pseudomonas aureofaciens BKM B-2188. Для этого бактериальный штамм выращивали в течение ночи в жидкой среде LB (Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. M: Мир. 1984. С.84) на качалке (180 об/мин) при комнатной температуре. Полученную суспензию разводили до концентрации 103-106 клеток на 1 мл и наносили стерильной кисточкой на листья стерильных растений. Растения инкубировали при 22-24°С в термальной комнате. Через каждые четыре недели растения черенковали, пересаживали на свежие среды и тестировали на наличие ассоциативности микроорганизмов с растениями. Тестирование различных эксплантов показало наличие бактерий псевдомонад во всех органах растений. Содержание бактерий в листьях в первом пассаже микроразмножения составляло 1-3 тыс. колониеобразующих единиц на 1 см2, а в корнях 10-20 тыс.колониеобразующих единиц на 1 см2, что указывает на ризосферную специфичность штамма. В последующих пассажах микроразмножения содержание бактерий Pseudomonas aureofaciens BKM В-2188 Д в растительных эксплантах стабильно сохранялось. Это указывает на прочную ассоциативную связь бактерий с растениями. Наличие ассоциативной связи используемых микроорганизмов с растениями оказывало положительное влияние на рост и морфогенез растений. Колонизированные растения отличались повышенной устойчивостью к фитопатогенным микроорганизмам: Erwinia carotovora, Sclerotinia sclerotiorum, Phytophthora infestans (Захарченко Н.С., Кочетков В.В., Бурьянов Я.И., Воронин A.M. Способ защиты посадочного материала растений против заболеваний, вызываемых фитопатогенными микроорганизмами. Патент №2380886. 2010 г.).
В этой работе не показана способность колонизированных растений расти на средах, содержащих тяжелые металлы и полициклические ароматические углеводороды (ПАУ).
Известен способ улучшать рост растений рапса, ячменя, сорго при инокуляции семян штаммом Pseudomonas aureofaciens BKM B-2500 Д при комплексном загрязнении модельного субстрата нафталином, фенантреном и арсенитом натрия (Сизова О.И., Анохина Т.О., Сиунова Т.В., Кочетков В.В., Воронин A.M. Штамм бактерий Pseudomonas aureofaciens BKM B-2500 Д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв арсенитом натрия. Патент РФ на изобретение №2396338. Приоритет изобретения 02.07.2008 г.).
Показано, что инокуляция растений рапса штаммом Pseudomonas aureofaciens BKM B-2500 Д способствует практически полной деградации нафталина в присутствии арсенита натрия. Остаточное содержание нафталина в этом варианте составляло 2,77 мг/кг по сравнению с контролем (91,15 мг/кг нафталина в конце эксперимента). Эффективность деградации нафталина штаммом Pseudomonas aureofaciens BKM B-2500 Д составляла около 97% по сравнению с чувствительным штаммом Pseudomonas aureofaciens BS1393(pBS216) 69% (т.е. в 1,4 раза выше).
Инокуляция семян сорго штаммом Pseudomonas aureofaciens ВКМ В-2500 Д способствует повышению всхожести растений и увеличению их биомассы при комплексном загрязнении почвы нафталином, фенантреном и арсенитом натрия. В комплексно загрязненной почве общий сухой вес неинокулированных растений сорго составляет в среднем 71 мг, а растений, обработанных штаммом Pseudomonas aureofaciens ВКМ В-2500 Д 356 мг, таким образом, биомасса увеличивается в 5 раз. В результате инокуляции семян сорго улучшается всхожесть растений.
Инокуляция семян ячменя ярового штаммом Pseudomonas aureofaciens ВКМ В-2500 Д способствует повышению всхожести растений и увеличению их биомассы при комплексном загрязнении почвы нафталином (1 г/кг), фенантреном (0,2 г/кг) и арсенитом натрия (50 мг/кг).
В этой работе не показана возможность влияния колонизации Pseudomonas aureofaciens ВКМ В-2500 Д на повышение устойчивости растений к фитопатогенам.
Известен способ влияния бактеризации in vivo растений сорго и ячменя штаммом бактерий Pseudomonas aureofaciens ВКМ В-2501 Д на улучшение роста растений при загрязнении почвы нафталином и никелем (Анохина Т.О., Сиунова Т.В., Сизова О.И., Кочетков В.В., Воронин A.M. Штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д для биодеградации полициклических ароматических углеводородов в условиях загрязнения почв солями никеля. Патент РФ на изобретение №2396339. Приоритет изобретения 02.07.2008 г.).
Показано, что инокуляция семян сорго штаммом Pseudomonas aureofaciens ВКМ В-2501 Д способствует повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составлял в среднем 45 мг, а растения, обработанного предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д, 77,6 мг. Таким образом, биомасса увеличивается в 1,7 раз и становится сравнимой с контрольными растениями, выращенными на чистой почве.
Показано, что инокуляция семян ячменя штаммом Pseudomonas aureofaciens ВКМ В-2501 Д способствовала повышению всхожести растений и увеличению их биомассы в условиях загрязнения почвы нафталином (1 г/кг), фенантреном (0,2 г/кг) и никелем (400 мг/кг). В загрязненной почве сухой вес одного неинокулированного растения составляет в среднем 28 мг, а растения, обработанного предлагаемым штаммом Pseudomonas aureofaciens ВКМ В-2501 Д, 44 мг. Биомасса увеличивалась более чем в 1,5 раза и становилась сравнимой с контрольными растениями, выращенными на чистой почве. В результате инокуляции семян ячменя улучшается всхожесть растений.
В этой работе не показана возможность влияния колонизации на повышение устойчивости растений к фитопатогенным микроорганизмам.
Задачей, стоявшей перед авторами, являлось создание способа получения растительно-микробных ассоциаций для фиторемедиации на основе микроразмножаемых растений и плазмидосодержаших ризосферных бактерий.
Наиболее близкими работами к предлагаемому способу являются следующие: 1) в работе Захарченко Н.С. и др. «Применение ассоциативных микроорганизмов для повышения устойчивости растений к фитопатогенам и ксенобиотикам» (International conference on biomolecular science in honor of the 75th anniversary of the birth of professor Yuri Ovchinnikov, 28 september - 2 oktober. 2009. С 216) проведено изучение микробно-растительного взаимодействия. Показано, что колонизация растений штаммом Pseudomonas aureofaciens BS1393 способствует повышению устойчивости растений томата и табака к грибным и бактериальным патогенам Sclerotinia sclerotiorum и Erwinia carotovora. Проведено изучение влияния плазмид биодеградации нафталина на свойства ризосферного штамма Р. aureofaciens BS1393. Колонизация растений данным штаммом приводила к повышению устойчивости растений к нафталину; 2) в работе Юхмановой А.А. и др., «Взаимосвязь ассоциативных микроорганизмов с растениями повышает устойчивость растений к фитопатогенам» (11-я Международная Пущинская школа-конференция молодых ученых, 29 октября - 2 ноября 2007 г. С.225) показано, колонизация растений табака и картофеля штаммом Pseudomonas aureofaciens 1393 повышает устойчивость растений к фитопатогену Erwinia carotovora; 3) в работе Сизовой О.И. и др. «Ризосферные бактерии Pseudomonas aureofaciens и Pseudomonas chlororaphis, окисляющие нафталин в присутствии мышьяка» (Прикладная биохимия и микробиология, 2010. Т. 46, №1, С.45-50) показано, что штамм Pseudomonas aureofaciens ВКМ В-2500 Д (Pseudomonas aureofaciens BS1393(pBS216, pKSl) обладает высокой антагонистической активностью по отношению к широкому кругу фитопатогенных грибов и бактерий, стимулирует рост растений, в котором плазмида pBS216 обеспечивает деградацию нафталина, а плазмида pKSl устойчивость к мышьяку.
Технический эффект, который может быть получен при использовании предлагаемого изобретения, заключается в том, что колонизация защищает растения от токсичного воздействия ПАУ, вследствие уменьшения содержания ПАУ в средах (почвах) за счет экспрессии в бактериях генов биодеградации ПАУ, улучшает рост растений и повышает их устойчивость к фитопатогенам, за счет синтеза микроорганизмами регуляторов роста и антибиотических веществ. Это достигается за счет получения стабильной ассоциации «целевой микроорганизм - растение».
Поставленная задача решается тем, что посадочный материал культивируемых in vitro растений колонизируют штаммами бактерий Pseudomonas aureofaciens BKM B-2500 и Pseudomonas aureofaciens BKM B-2501.
Оптимальными условиями достижения технического результата являются:
- использование микроклонально размноженных гнотобиотических растений;
- использование для колонизации облигатных микроорганизмов, не обладающих фитотоксическим действием;
- использование ассоциативных непатогенных микроорганизмов для колонизации с титром клеток 103-105.
Следует обратить внимание на то, что для колонизации in vitro желательно использовать облигатные штаммы, поскольку они не конкурируют с растениями за источники питания.
Исходным бактериальным штаммом для получения используемых плазмидосодержащих штаммов был штамм бактерий Pseudomonas aureofaciens BS1393, подавляющий рост многих фитопатогенных грибов и бактерий за счет продуцирования антибиотически активных соединений и используемый для получения на его основе препарата для защиты растений (Воронин A.M., Кочетков В.В. Эффективный биофунгицид для защиты растений. Агро XXI. 2003. №1-6. С.64-66).
Штамм Pseudomonas aureofaciens BS1393 был ранее депонирован во Всероссийской коллекции микроорганизмов под номером BKM B-2188 Д.
Этот штамм использован в качестве реципиента для внесения в него плазмид биодеградации и устойчивости к мышьяку и тяжелым металлам по методикам, описанным ранее (Сиунова Т.В., Анохина Т.О., Машукова А.В., Кочетков В.В., Воронин A.M. Ризосферный штамм Pseudomonas chlororaphis, способный к деградации нафталина в присутствии кобальта/никеля. Микробиология. 2007. Т.76. №2. С.212-218).
Используемый в предлагаемом методе штамм бактерий Pseudomonas aureofaciens BS1393(pBS216, pKSl) имеет лабораторный номер Pseudomonas aureofaciens BS1503 и депонирован во Всероссийской коллекции микроорганизмов (ИБФМ РАН) под номером Pseudomonas aureofaciens BKM В-2500 Д.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д характеризуются следующими признаками.
Среды культивирования.
Штамм хорошо растет на следующих средах: мясо-пептонном агаре, LB (бакто-триптон 10 г/л, дрожжевой экстракт 5 г/л, хлористый натрий 10 г/л, рН 7,2), Кинг Б (пептон 20 г/л, K2НРО4 1,5 г/л, MgSO4×7H2O 1,5 г/л, глицерин 10 мл/л,), триптозо-соевом агаре (триптозо-соевый экстракт 30 г/л), минеральной синтетической среде М9 (Na2HPO4 6 г/л, КН2РO4 3 г/л, NH4Cl 1 г/л, NaCl 0,5 г/л, 1М MgSO4 2 мл, 1М CaCl2 1 мл, глюкоза 2 г/л), минеральной синтетической среде М9 с нафталином 1-2 г/л в качестве единственного источника углерода и энергии.
Устойчивость к антибиотикам.
Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), триметоприму (100 мкг/мл), хлорамфениколу (100 мкг/мл), карбеницилину (1000 мкг/мл), гентамицину (20 мкг/мл). Чувствителен к канамицину (50 мкг/мл), тетрациклину (20 мкг/мл).
Хромосомная устойчивость к тяжелым металлам.
Штамм обладает исходным уровнем хромосомной устойчивости к цинку, кадмию, хромату. Максимальная толерантная концентрация (МТК) цинка 1,5 мМ, кадмия 0,2 мМ, хромата 0,2 мМ.
Принципиальные физиологические свойства.
Штамм обладает фунгицидными и бактерицидными свойствами. Антагонистическая активность используемого штамма по отношению к фитопатогенным грибам и бактериям не отличается от активности исходного бесплазмидного штамма Pseudomonas aureofaciens BS1393.
Принципиальные специфические продукты.
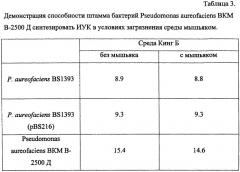
Штамм синтезирует гетероциклические феназиновые антибиотики (феназин-1-карбоновую кислоту, 2-оксифеназин-1-карбоновую кислоту и 2-оксифеназин), сидерофоры, индолил-3-уксусную кислоту (ИУК).
Устойчивость к мышьяку.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д устойчив к арсениту натрия (NaAsO2) и арсенату натрия (Na2AsO3). Минимальная ингибирующая концентрация (МИК) арсенита натрия 16 мМ, арсената натрия 40 мМ.
Генетические признаки.
Штамм бактерий Pseudomonas aureofaciens BKM В-2500 Д содержит природную плазмиду биодеградации нафталина pBS216 (Кочетков В.В., Балакшина В.В., Мордухова Е.А., Воронин A.M. Плазмиды, кодирующие биодеградацию нафталина в ризосферных бактериях рода Pseudomonas. Микробиология. 1997. Т.66. №2. С.211-216) и генетически сконструированную плазмиду устойчивости к мышьяку pKSl, ранее обозначенную как pUCP22::arsRBC (Сизова О.И., Любунь Е.В., Кочетков В.В., Валидов Ш.З., Воронин A.M. Влияние природных и генетически модифицированных ризосферных бактерий Pseudomonas aureofaciens на накопление мышьяка растениями. Прикладная биохимия и микробиология. 2004. Т.40. №1. С.78-82).
Сведения по биологической безопасности.
Штамм не патогенен для теплокровных животных и человека. Не обладает фитопатогенной активностью, о чем свидетельствует отсутствие мацерации на ломтиках картофеля при нанесении на них уколом живых клеток штамма.
Используемый в предлагаемом методе штамм бактерий Pseudomonas aureofaciens BS1393(pBS216, pBS501) имеет лабораторный номер Pseudomonas aureofaciens BS1504 и депонирован во Всероссийской коллекции микроорганизмов (ИБФМ РАН) под номером Pseudomonas aureofaciens ВКМ В-2501 Д.
Штамм Pseudomonas aureofaciens ВКМ В-2501 Д характеризуется следующими признаками.
Среды культивирования.
Штамм хорошо растет на следующих средах: мясо-пептонном агаре, LB (бакто-триптон 10 г/л, дрожжевой экстракт 5 г/л, хлористый натрий -10 г/л, рН 7,2), Кинг Б (пептон 20 г/л, K2HPO4 1,5 г/л, MgSO4×7Н2О 1,5 г/л, глицерин 10 мл/л,), триптозо-соевом агаре (триптозо-соевый экстракт 30 г/л), минеральной синтетической среде М9 (Na2HPO4 6 г/л, KH2PO4 3 г/л, NH4Cl 1 г/л, NaCl 0,5 г/л, 1М MgSO4 - 2 мл, 1М CaCl2 1 мл, глюкоза 2 г/л), минеральной синтетической среде М9 с нафталином 1-2 г/л в качестве единственного источника углерода и энергии.
Устойчивость к антибиотикам.
Штамм проявляет устойчивость к стрептомицину (100 мкг/мл), триметоприму (100 мкг/мл), хлорамфениколу (100 мкг/мл), карбеницилину (1000 мкг/мл). Чувствителен к канамицину (50 мкг/мл), гентамицину (20 мкг/мл), тетрациклину (20 мкг/мл).
Хромосомная устойчивость к тяжелым металлам.
Штамм обладает исходным уровнем хромосомной устойчивости к цинку, кадмию, хромату. Максимальная толерантная концентрация (МТК) цинка 1,5 мМ, кадмия 0,2 мМ, хромата 0,2 мМ.
Принципиальные физиологические свойства.
Штамм обладает фунгицидными и бактерицидными свойствами. Антагонистическая активность предлагаемого штамма по отношению к фитопатогенным грибам и бактериям не отличается от активности исходного бесплазмидного штамма Pseudomonas aureofaciens BS1393.
Принципиальные специфические продукты.
Штамм синтезирует гетероциклические феназиновые антибиотики (феназин-1-карбоновую кислоту, 2-оксифеназин-1-карбоновую кислоту и 2-оксифеназин), сидерофоры, индолил-3-уксусную кислоту (ИУК).
Устойчивость к тяжелым металлам (кобальту, никелю).
Штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д устойчив к катионам никеля и кобальта. Максимальная толерантная концентрация (МТК) хлорида никеля 400 мкМ, хлорида кобальта 200 мкМ.
Генетические признаки.
Штамм бактерий Pseudomonas aureofaciens ВКМ В-2501 Д содержит природную плазмиду биодеградации нафталина pBS216 (Кочетков В.В., Балакшина В.В., Мордухова Е.А., Воронин A.M. Плазмиды, кодирующие биодеградацию нафталина в ризосферных бактериях рода Pseudomonas. Микробиология. 1997. Т.66. №2. С.211-216) и природную плазмиду pBS501, содержащую cnr-подобный оперон, обеспечивающий устойчивость к кобальту и никелю, связанную с выводом катионов металлов из клетки (Сиунова Т.В., Кочетков В.В., Валидов Ш.З., Сузина Н.Е., Воронин A.M. Продукция феназиновых антибиотиков у штамма Pseudomonas aureofaciens, содержащего плазмиду резистентности к кобальту и никелю. Микробиология. 2002. Т.71. №6. С.778-785).
Штаммы Pseudomonas aureofaciens ВКМ В-2500 Д и Pseudomonas aureofaciens ВКМ В-2501 Д были получены на основе штамма Pseudomonas aureofaciens ВКМ В-2188, отличительным признаком которого является его способность подавлять рост фитопатогенных грибов и бактерий.
Штамм подавляет рост грибов Gaeumannomyces graminis, Fusarium oxysporum, Fusarium graminearum, Fusarium moniliforme, Fusarium solani, Fusarium heterosporum, Fusarium culmorum, Fusarium nivale, Sclerotinia sclerotiorum, Rhyzoctonia solani, Rhizoctonia abernoldii, Rhizoctonia cerealis, Pythium altum, Bipolaris sorokiniana, Verticillium dahliae, Verticillium alboatrum, Alternaria solani, Alternaria brassicicola, Helminthosporium sativum, Helminthosporium avenae, Colletotrichum lagenarium, Botrytis cinerea. Это выражалось в наличии вокруг лунок с бактериями зоны полного отсутствия роста грибного мицелия (стерильная зона) или очень слабого подроста в зоне задержки грибного роста (подавление роста). Диаметр зоны ингибирования грибов варьирует в пределах 10-21 мм.
Кроме того, штамм подавляет рост фитопатогенных бактерий Erwinia carotovora, Erwinia atroseptica, Erwinia amilovora, Xanthomonas campestris, Agrobacterium tumefaciens, Pseudomonas syringae, Pseudomonas fluorescens.
Для проверки способности колонизированных растений штаммами Pseudomonas aureofaciens ВКМ В-2500 Д и Pseudomonas aureofaciens ВКМ В-2501 Д проявлять устойчивость к фитопатогенным микроорганизмам и к деградации ПАУ и тяжелых металлов проводили искусственное заражение растений фитопатогенами на фоне, содержащихся в среде или почве, тяжелых металлов - солей никеля (кобальта) или мышьяка и нафталина.
К исследуемым растениям относятся paпс (Brassica napus ssp.oleifera, L.) сорт «Галант», томат (Lycopersicon esculentum L.) сорт «Космос» и арабидопсис (Arabidopsis taliana) экотип «Columbia».
К исследуемым патогенам относятся бактериальный штамм эрвиний (Erwinia carotovora), грибной патоген - фитофтора (Phytophthora infestans).
Штаммы Pseudomonas aureofaciens ВКМ В-2500 и Pseudomonas aureofaciens ВКМ В-2501 выращивают на среде LB, содержащей 10 г бактотриптона (Difco, США), 5 г дрожжевого экстракта (Difco), 10 г NaCl, воды дистиллированной до 1 л, рН 7.5. При исследовании антагонистических свойств штаммов по отношению к фитопатогенным грибам и бактериям использовали глюкозо-картофельный агар (20% глюкозы, экстракционная вытяжка из 70 г картофеля, дистиллированная вода до 300 мл, агар 20 г/л, рН 7,2), а также среды Кинга В и М9 с глюкозой.
Возможность осуществления предлагаемого способа подтверждается представленными примерами, но не ограничивается ими.
Пример 1. Стерилизация семян арабидопсиса.
Семена арабидопсиса стерилизуют 10% раствором гипохлорита натрия в течение 30 мин, затем промывают 4 раза стерильной водопроводной водой в течение 2 часов. Семена раскладывают на агаризованную среду МС и инкубируют 48 ч при 24°С для контроля стерильности семян. Стерильные проростки пересаживают в отдельные прозрачные сосуды и выращивают при температуре 22-24°С, 16-часовом дне и освещении 2 клк. Культивирование и микроклональное размножение гнотобиотических растений проводят на агаризованной среде Мурасига-Скуга (МС), содержащей стандартный набор солей и включающей 7 г/л агара и 30 г/л сахарозы (рН 5,8), а также регуляторы роста: 6-бензиламинопурин (6-БАП) в количестве 1 мг/л и нафтилуксусную кислоту (НУК) 0,1 мг/л. Черенкование проводят 1 раз в месяц. Для этого растения высотой 15-20 см делят на 4 части и рассаживают в пробирки.
Через месяц проводят очередное черенкование и таким образом растения размножают до нужного количества. Затем микроразмноженный in vitro посадочный материал из пробирок высаживают в закрытый грунт в условия in vivo для адаптации. Через 2 недели, когда растения укоренятся, их пересаживают в почву для продолжения вегетации.
Пример 2. Стерилизация семян томатов и рапса.
Семена томата и рапса стерилизуют по методу, описанному в примере 1.
Пример 3. Колонизация проростков арабидопсиса штаммом Pseudomonas aureofaciens ВКМ В-2500.
Для колонизации используют 15-дневные черенки стерильных растений арабидопсиса, выращенных в культуре in vitro, как описано в примере 1. Черенки однократно опрыскивают суспензией бактерий Pseudomonas aureofaciens ВКМ В-2500 Д с титром 103-105 клеток/мл. Через 4 недели после черенкования проводят тестирование на установление ассоциативной связи бактерий с растениями. Для этого из разных эксплантов (вновь выросших листьев, корней, стеблей) получают экстракты путем гомогенизации растительной ткани. Экстракт наносят на поверхность питательной среды LB в чашках Петри и инкубируют при температуре 22-24°С два дня.
Содержание бактерий в листьях в первом пассаже микроразмножения составляет 1-3 тыс. колониеобразующих единиц на 1 см2, а в корнях 10-20 тыс. колониеобразующих единиц на 1 см2, что указывает на ризосферную специфичность штамма.
В последующих пассажах микроразмножения содержание бактерий Pseudomonas aureofaciens ВКМ В-2500 Д в растительных эксплантах стабильно сохраняется.
Пример 4. Колонизация проростков арабидопсиса штаммом Pseudomonas aureofaciens ВКМ В-2501.
Колонизацию проростков арабидопсиса проводят по методу, описанному в примере 3.
Содержание бактерий в листьях в первом пассаже микроразмножения составляет 2-4 тыс. колониеобразующих единиц на 1 см2, а в корнях 10-30 тыс. колониеобразующих единиц на 1 см2, что указывает на ризосферную специфичность штамма.
Пример 5. Проверка устойчивости растений арабидопсиса, колонизированных штаммом Pseudomonas aureofaciens ВКМ В-2500, к бактериальному фитопатогену Erwinia carotovora.
Штамм Erwinia carotovora В 15 выращивают в LB среде до плотности 106 кл/мл и используют для инфицирования отдельных листьев и целых растений. Заражение растений проводят методом укола иглой, смоченной в суспензии бактерий. Листья инкубируют в чашках Петри на влажной фильтровальной бумаге при температуре 22-24°С.
Степень повреждения оценивают спустя 1-14 сут после заражения. Уже через сутки на контрольных листьях отмечается разрушение ткани мезофилла. К концу вторых суток поражение контрольных листьев составляет 100% по площади, в то время как колонизированные листья остаются без признаков повреждения. Аналогичные симптомы наблюдаются при заражении целых растений. Колонизированные растения остаются неповрежденными в течение всего времени эксперимента, в то время как контрольные полностью гибнут.
Пример 6. Проверка устойчивости растений томата, колонизированных штаммом Pseudomonas aureofaciens BKM В-2500, к бактериальному фитопатогену Erwinia carotovora.
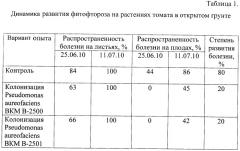
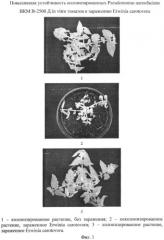
Проверку устойчивости растений томата проводят по методу, описанному в примере 5. Колонизированные растения проявляют повышенную устойчивость к бактериальному фитопатогену Erwinia carotovora В 15 (Фиг.1).
Пример 7. Проверка устойчивости растений арабидопсиса, рапса и томатов, колонизированных штаммом Pseudomonas aureofaciens BKM B-2501, к бактериальному фитопатогену Erwinia carotovora В 15.
Проверку устойчивости растений проводят по методу, описанному в примере 5. Колонизированные растения рапса проявляют повышенную устойчивость к бактериальному фитопатогену Erwinia carotovora В 15 (Фиг.2).
Пример 8. Проверка устойчивости растений томата, колонизированных штаммом Pseudomonas aureofaciens BKM В-2500, к грибному фитопатогену Phytophthora infestans.
Фитопатогенный гриб для тестирования растений выращивают на глюкозо-картофельном агаре. Культуру грибов поддерживают при +4°С. Для определения устойчивости колонизированных растений к заражению Phytophthora infestans берут как целые растения, так и отдельные листья.
Для отдельных листьев используют метод заражения в чашках Петри. Заражение отдельных листьев растений проводят, помещая кусочки агара с мицелием на срез черешка листа. Листья инкубируют в чашках Петри на влажной фильтровальной бумаге при температуре 22-24°С. Степень повреждения оценивают спустя месяц после заражения.
Уже в первые дни эксперимента на неколонизированных листьях заметны признаки поражения - темные некротические пятна - и в дальнейшем полная гибель. У колонизированных листьев таких признаков нет, они остаются полностью здоровыми и неповрежденными (Фиг.3).
Целые растения заражают грибами, помещая кусочки мицелия гриба в междоузлия листьев. Растения выращивают при температуре 22-24°С. Уже через неделю на контрольных листьях заметен некроз ткани. К концу втор