Способ повышения ангиогенного потенциала мезенхимальных стволовых клеток жировой ткани
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в клеточной трансплантологии и тканевой инженерии. Посредством комбинированного воздействия на культивированные МСК гипоксии и подавления экспрессии каталитической субъединицы Nox2 цитоплазматической NADPH-оксидазы с помощью малых интерферирующих РНК, способ позволяет существенно повысить их ангиогенный потенциал за счет увеличения продукции этими клетками основного ангиогенного фактора - VEGF. 8 ил., 1 табл., 4 пр.
Реферат
Настоящее изобретение относится к области клеточной биологии и может быть использовано в клеточной трансплантологии и тканевой инженерии для повышения эффективности стимуляции роста кровеносных сосудов при трансплантации мезенхимальных стволовых клеток (МСК), а также для изучения механизмов участия этих клеток в регенерации тканей. Предлагается способ, позволяющий повысить ангиогенный потенциал МСК из жировой ткани за счет увеличения продукции этими клетками ангиогенных факторов в результате сочетанного воздействия на них гипоксии и подавления экспрессии цитоплазматической NADPH-оксидазы с помощью малых интерферирующих РНК (siRNA).
Введение
Инвалидизация людей в результате перенесенных травм или тяжелых заболеваний, вызванных нарушениями кровоснабжения тканей, таких как инсульт, инфаркт или критическая ишемия нижних конечностей, связана с невозможностью полноценной регенерации поврежденных тканей и органов. Несмотря на многокомпонентную медикаментозную терапию и применение эндоваскулярной и хирургической реваскуляризации остается значительная часть больных, у которых эти мероприятия неэффективны или не могут быть проведены из-за диффузного поражения тканей. Единственной альтернативой для таких больных может быть терапия, направленная на стимуляцию роста новых сосудов в ишемизированных тканях с помощью генной или клеточной терапии (трансплантации пациентам стволовых и прогениторных клеток) [3].
В последние годы все большее внимание исследователей привлекает возможность использования в качестве источника аутологичных МСК жировой ткани, доступность получения которой в достаточном объеме практически для любого пациента позволяет рассматривать ее как оптимальный ресурс для клеточной терапии, в том числе и для стимуляции роста кровеносных сосудов в ишемизированных тканях.
Уровень техники
Ранее в нашей лаборатории был показан и детально исследован стимулирующий эффект МСК, выделенных из жировой ткани, на рост кровеносных сосудов [5] и нервов [4]. При этом было установлено, что стимулирующий эффект МСК на ангиогенез в значительной мере обусловлен способностью этих клеток продуцировать различные ангиогенные факторы, и прежде всего фактор роста эндотелия - VEGF [5]. Несмотря на многообещающие результаты, полученные при использовании МСК в целях стимуляции ангиогенеза в ишемизированных тканях, существенной проблемой остается недостаточная эффективность клеточной терапии. Данные экспериментальных работ показывают, что причиной недостаточной эффективности МСК в восстановлении функции сердца у больных инфарктом миокарда может быть массовая гибель клеток после их введения в поврежденную ткань. Поэтому особую актуальность приобретает разработка методов подготовки клеток с повышенным ангиогенным потенциалом, с тем, чтобы малого числа клеток оказалось бы достаточно для достижения терапевтического эффекта.
Одним из подходов повышения терапевтического эффекта МСК является введение в эти клетки генетических конструкций, которые содержат последовательности, кодирующие стимуляторы роста кровеносных сосудов, и, прежде всего, фактор роста эндотелия сосудов VEGF [6]. Существенными недостатками этой группы методов, однако, являются трудоемкость и методические сложности, связанные с тем, что МСК чрезвычайно плохо поддаются плазмидной трансфекции. Замена же плазмидных векторов вирусными конструкциями при подготовке культуры, предназначенной для последующей трансплантации, не может считаться абсолютно безопасной.
С этой точки зрения более перспективным представляется способ повышения ангиогенного потенциала МСК за счет увеличения продукции клетками ангиогенных факторов, в основе которого лежит предтрансплантационная инкубация клеток в условиях гипоксии (1% O2 в течение 48 часов) [5]. По нашим оценкам, выращивание МСК из жировой ткани в условиях гипоксии приводит к повышению продукции VEGF примерно в 3 раза. Следует, однако, отметить, что, во-первых, увеличение содержания фактора роста эндотелия сосудов, достигаемое данным методом, сравнительно невелико, а во-вторых, эффект поддерживается только условиями гипоксии, соблюдение которых при трансплантации сопряжено с техническими трудностями. В силу указанных недостатков, которые могут быть обобщены понятием «низкая эффективность», этот метод, являющийся наиболее близким аналогом изобретения, представляется малопригодным для широкого использования в практике. В связи с этим, нами была предпринята попытка усовершенствовать способ повышения ангиогенного потенциала МСК, основанный на воздействии гипоксии, с целью существенного повышения его эффективности.
Раскрытие изобретения
При разработке настоящего изобретения во внимание были приняты следующие факты.
Первое. Повышение продукции VEGF в условиях снижения уровня кислорода является частью защитного механизма отдельной клетки и организма в целом, который позволяет сохранять функциональную активность в неблагоприятных условиях. Так, VEGF может препятствовать индукции программированной гибели (апоптоза) клеток, испытывающих недостаток кислорода. В масштабе ткани повышение продукции VEGF в ответ на гипоксию вызывает рост новых кровеносных сосудов, что способствует восстановлению адекватного уровня кислорода. Однако основным компенсаторным эффектом клетки на гипоксию, видимо, следует считать ее «ответ», выражающийся в индукции образования активных форм кислорода (АФК) [1]. Закономерно предположить, что наличие этого мощного компенсаторного механизма должно снижать эффективность и время действия гипоксии на функциональную активность клетки, в том числе и на выражающийся в повышении продукции VEGF ангиогенный потенциал клетки. Соответственно, в условиях подавления процесса образования АФК можно ожидать усиления эффектов гипоксии.
Второе. Известно, что АФК способны участвовать в различных каскадах внутриклеточной сигнализации, в том числе и ингибирующих продукцию ангиогенных факторов роста [2]. Если в МСК ЖТ действует указанный механизм, то добиться повышения эффективности индукции экспрессии ангиогенных факторов под действием гипоксии можно путем снижения содержания в клетке АФК.
Третье. Считается, что основным источником АФК в различных типах клеток являются цитоплазматические NADPH-оксидазы, которые представляют собой мембраносвязанные мультисубъединичные ферментативные комплексы, использующие NADPH в качестве донора электрона при одноэлектронном восстановлении кислорода. Центральными каталитическими субъединицами этих ферментов являются белки Nox. В настоящее время известно 7 гомологов Nox-белков, Nox1-5, а также Duoxl и 2. В состав некоторых NADPH-оксидаз, например, тех, большими каталитическими субъединицами которых являются белки Nox2 или Nox1, входит также малый трансмембранный белок p22phox. Механизмы активации комплексов на основе белков Nox1-3 сходны и включают взаимодействие с цитоплазматическими регуляторными белками p40phox, p47phox, p67phox, NOXO1, NOXA1 и Rac2. Регуляция фермента на основе белка Nox4 остается мало изученной, и долгое время он считался постоянно активным во многих клетках. Однако недавно в гладкомышечных клетках сосудистой стенки был обнаружен белок Poldip2, активирующий Nox4-зависимую NADPH-оксидазу. Подавление активности и/или синтеза в клетках некоторых ферментов этой группы приводит к снижению уровня АФК [2]. Кроме того, в ряде работ была показана связь этих белков с индукцией роста кровеносных сосудов, а также их участие в регуляции активности эндотелиальных клеток и их предшественников [7]. Соответственно, способом подавления индукции АФК с высокой вероятностью могло бы быть воздействие на цитоплазматические NADPH-оксидазы МСК жировой ткани. Однако данных о том, какие NADPH-оксидазы представлены в этих клетках и связаны ли они с регуляцией их ангиогенной активности, к моменту создания настоящего изобретения получено не было.
С учетом этого, решение поставленной задачи предполагало:
а) определение экспрессирующихся в МСК ЖТ каталитических и регуляторных субъединиц цитоплазматических NADPH-оксидаз;
б) оценку влияния гипоксии на их экспрессию, с выявлением каталитических субъединиц с наиболее выраженными и устойчивыми изменениями экспрессии в условиях недостатка кислорода;
в) выбор подходящего метода для подавления экспрессии каталитических субъединиц NADPH-оксидазы, выявленных на стадии «б»;
г) определение результата сочетанного (комбинированного) воздействия гипоксии и подавления экспрессии ключевой формы (форм?) NADPH-оксидазы избранным (на стадии «в») методом на уровень индукции VEGF.
При осуществлении изобретения впервые было экспериментально установлено, что цитоплазматические NADPH-оксидазы МСК жировой ткани представлены, главным образом, ферментами на основе каталитических субъединиц Nox2 и Nox4 (пример 1, фиг.1). С помощью иммунофлуоресцентного окрашивания и конфокальной микроскопии показано, что фермент Nox2 располагается в ядре клетки и в ламеллоподиях, а Nox4 - в околоядерном пространстве и в составе внутриклеточных мембранных структур (пример 1, фиг.2).
В результате исследования связи уровня экспрессии Nox2 и Nox4 с гипоксией было показано, что в ответ на снижение содержания кислорода через 40 часов наблюдается многократное повышение экспрессии обоих генов: примерно в 10 и в 16 раз для Nox2 и Nox4, соответственно. Однако оказалось, что индукция экспрессии Nox2 и Nox4 носит кратковременный характер, и спустя еще 8 часов инкубации (48 часов гипоксии) уровень мРНК, хотя и не возвращался к исходному, однако в обоих случаях демонстрировал явную тенденцию к нормализации (пример 2, фиг.3).
В качестве метода подавления экспрессии обнаруженных в МСК ЖТ форм цитоплазматических NADPH-оксидаз использовали РНК-интерференцию. При этом трансфекция клеток специфическими в отношении Nox2 и Nox4 коммерческими siRNA (Novus Biologicals) уже через 24 часа приводила к снижению содержания обоих белков, причем подавление экспрессии фермента с каталитической субъединицей Nox2 было как более выраженным, так и более длительным (пример 3, фиг.4).
Анализ уровня экспрессии VEGF методом ПЦР показал, что в условиях нормального содержания кислорода (20%) подавление экспрессии формы фермента Nox2 с помощью специфических siPHK не сказывается на экспрессии VEGF, а ингибирование биосинтеза в клетке изоформы Nox4 вдвое снижает уровень экспрессии VEGF, что позволяет рассматривать каталитическую единицу Nox4 как имеющую отношение к экспрессии данного фактора в норме. При гипоксии наблюдалась обратная зависимость: при подавлении синтеза Nox4 наблюдавшиеся изменения экспрессии VEGF (в сравнении с уровнем мРНК этого фактора при гипоксии) были статистически недостоверными, тогда как ингибирование с помощью siPHK формы фермента Nox2 приводило к дополнительному почти 2-кратному повышению биосинтеза VEGF в сравнении с уровнем, достигаемым в результате применения только гипоксии.
Проведенные эксперименты позволили заключить, что обнаруженная нами в МСК ЖТ цитоплазматическая NADPH-оксидаза, содержащая субъединицу Nox2, участвует в регуляции экспрессии VEGF в условиях гипоксии и, соответственно, модулирование уровня биосинтеза этой субъединицы может быть использовано в качестве инструмента воздействия на уровень экспрессии VEGF в этих клетках. При подавлении экспрессии Nox2-содержащей NADPH-оксидазы на фоне гипоксии достигается дополнительное двукратное (в сравнении с только гипоксией) увеличение биосинтеза VEGF в клетках, а следовательно, и повышение их ангиогенного потенциала.
Таким образом, сущность предлагаемого изобретения заключается в получении культивируемых МСК ЖТ с повышенным за счет эффективной продукции VEGF ангиогенным потенциалом, где высокий уровень экспрессии VEGF достигается в результате поддержания клеток в условиях гипоксии при одновременном подавлении экспрессии цитоплазматической NADPH-оксидазы малыми интерферирующими РНК против каталитической субъединицы Nox2.
Краткое описание фигур
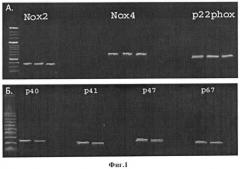
Фиг.1. Содержание мРНК каталитических и регуляторных субъединиц NADPH-оксидаз в культивируемых МСК человека. А. - мРНК каталитических субъединиц. Приведены результаты ПЦР-анализа, проведенного на клетках, полученных от 3 доноров Б. - мРНК регуляторных субъединиц. Приведены результаты ПЦР-анализа, проведенного на клетках, полученных от 2 доноров.
Фиг 2. Анализ внутриклеточного распределения каталитических субъединиц NADPH-оксидаз в МСК жировой ткани с помощью иммунофлуоресцентного окрашивания и конфокальной микроскопии. А. - окрашивание антителами против Nox2 (красная флуоресценция). Б. - окрашивание антителами против Nox4 (красная флуоресценция). Ядра клеток докрашены DAPI.
Фиг.3. Содержание мРНК каталитических субъединиц NADPH-оксидаз в МСК человека, культивируемых в условиях гипоксии. А. - Содержание мРНК Nox2. Б. - Содержание мРНК Nox4.
Фиг.4. Оценка содержания каталитических субъединиц NADPH-оксидазы после проведения РНК-интерференции генов Nox2 и Nox4 при помощи электропорации. А1 и А2 - контрольные МСК, 24 и 72 часа культивирования, соответственно. В1 и В2 - МСК, электропорированные РНК анти-Nox4, 24 и 72 часа, соответственно. С1 и С2 - МСК, электропорированные РНК анти-Nox2, 24 и 72 часа, соответственно.
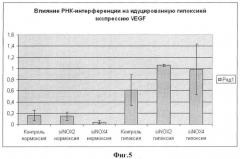
Фиг.5. Содержание мРНК VEGF в МСК человека, культивируемых в условиях нормоксии (столбцы 1-3) и гипоксии (столбцы 4-6), без обработки (столбцы 1 и 4) и после трансфекции малыми интерферирующими РНК против Nox2 (столбцы 2 и 5) или против Nox4 (столбцы 3 и 6).
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, были использованы опубликованные ранее нами методики выделения МСК из жировой ткани, а также хорошо известные специалистам методики по культивированию клеток, описанные в цитированных источниках.
Пример 1.
Анализ содержания и локализации цитоплазматических NADPH-оксидаз в МСК жировой ткани
Анализ содержания мРНК субъединиц NАD(Р)Н-оксидаз
МСК получали из жировой ткани 5 различных доноров в соответствии с методикой, описанной в [5], и культивировали их до второго пассажа в CO2- инкубаторе (5% CO2; 95% воздуха) при 37°С. В данном эксперименте клетки инкубировали в среде роста мезенхимальных стволовых клеток AdvanceSTEM (HyClone), содержащей 10% коммерческой добавки (AdvanceSTEM Supplement, HyClone), 100 U/ml пенициллина и 100 U/ml стрептомицина, хотя может быть использована и другая среда, пригодная для выращивания стволовых клеток, например применяемая в прототипе среда Игла, модифицированная Дульбекко (DMEM), содержащая 10% фетальной бычьей сыворотки (ФБС, HyClone), 100 Ед/мл пенициллина и 10 мкг/мл стрептомицина (GIBCO BRL).
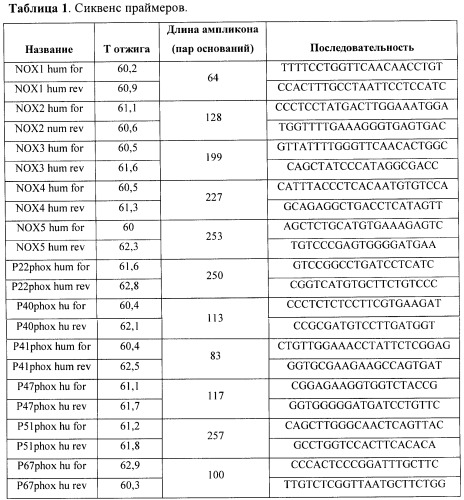
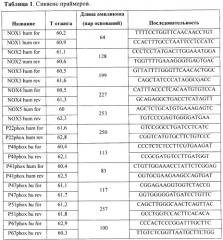
Суммарную мРНК из полученной культуры выделяли с помощью набора для выделения РНК («RNeasy Mini Kit», «QIAGEN», США) и конвертировали в кДНК согласно стандартному протоколу фирмы «Fermentas», используя олиго-dT-праймеры. Анализ экспрессии генов проводили методом ПРЦ в реальном времени с применением Sybr Green («Синтол», Россия). Сиквенс и температуры отжига использованных в работе праймеров представлены в Таблице 1.
В результате ПЦР-анализа было установлено, что культивируемые МСК содержат мРНК каталитических субъединиц p22phox, Nox2, Nox4 и Noxl (фиг.1А). мРНК других известных каталитических субъединиц NADPH-оксидаз (Nox3, Nox5, Duox1 и Duox2) в МСК ЖТ обнаружено не было. Помимо каталитических, эти клетки также содержат мРНК регуляторных субъединиц фермента р40, р41, р47 и р67 (фиг.1Б).
Анализ внутриклеточного распределения каталитических субъединиц NADPH-оксидаз
Физиологическая роль NAD(Р)Н-оксидаз во многом определяется их локализацией внутри клетки, поскольку продуцируемые ими анионы супероксида способны к диффузии на очень короткие расстояния и, следовательно, взаимодействуют со своими мишенями в непосредственной близости от места их продукции. Для того чтобы выяснить роль NAD(P)H-оксидаз в регуляции функциональной активности МСК, мы исследовали внутриклеточное распределение гомологов большой каталитической субъединицы этого фермента, Nox2, мРНК которых были обнаружены нами в этих клетках в ходе выполнения данной работы, а именно Nox1 и Nox4. Экспрессию каталитических субъединиц NAD(P)H-оксидаз оценивали с помощью иммунофлуоресцентного окрашивания культивируемых МСК и последующего анализа с помощью конфокального микроскопа. Для этого клетки, растущие на покровных стеклах, отмывали от среды роста ФСБ, а затем фиксировали в 4% растворе параформальдегида. После этого троекратно отмывали и для предотвращения неспецифического связывания антител инкубировали в блокирующем растворе, содержащем 2% БСА/ФСБ/10% нормальной козьей сыворотки в течение 30 мин при комнатной температуре. После удаления излишка блокирующего раствора срезы инкубировали в течение 60 мин с кроличьими поликлональными антителами против Nox2, Nox4 или Nox1. В качестве отрицательного контроля использовали блокирующий раствор, не содержащий антител. По истечении 60 минут стекла отмывали в ФСБ и в течение 30 мин инкубировали в растворе вторичных козьих антител (1:1000) против иммуноглобулина кролика, конъюгированных с флуорохромами Alexa 488 или Alexa 594 (Molecular Probes, США). После промывки в ФСБ на срезы на 2 мин наносили раствор DAPI/ФСБ для окрашивания ядер клеток. После отмывки от DAPI стекла с клетками помещали в водорастворимую среду Aqua Poly/Mount (Polysciences, кат. №18606).
В результате было установлено, что белок Nox2 локализован в околоядерном пространстве, а также в ламеллоподиях клеток, белок Nox4 - на поверхности клеток, а также в связи с внутриклеточными мембранными структурами (фиг.2). Что касается Nox1, то он обнаруживался в незначительных количествах во всех клеточных компартментах. Поскольку содержание этого белка в клетках оказалось весьма малым, дальнейшие исследования были сосредоточены на NADPH-оксидазах, имеющих в качестве каталитических субъединиц белки Nox2 или Nox4.
Пример 2.
Влияние гипоксии на экспрессию цитоплазматических NADPH-оксидаз в МСК жировой ткани
Для того чтобы оценить влияние гипоксии на экспрессию субъединиц NADPH-оксидаз, МСК 2-4 пассажа, достигшие 70-80% конфлюента, помещали на сутки в среду роста мезенхимальных стволовых клеток AdvanceSTEM (HyClone), не содержащей ростовых добавок. Через 24 часа инкубации в такой среде клетки переносили на 40 или 48 часов в CO2-инкубатор с контролем содержания кислорода (Galaxy 48R, New Bronswick), которое поддерживалось либо на уровне 1% (гипоксия), либо на уровне 20% (нормоксия). После инкубации из клеток выделяли суммарную РНК и конвертировали ее в кДНК так, как это описано в примере 1. Анализ экспрессии генов каталитических субъединиц Nox2 и Nox4 проводили методом ПНР в реальном времени с применением Sybr Green («Синтол», Россия), используя праймеры для кодирующих эти белки последовательностей (см. табл.1). Содержание исследуемых мРНК нормировали по уровню сигнала, получаемого для кДНК генов домашнего хозяйства GAPDH и Act. Результаты ПЦР обсчитывали при помощи стандартного - ΔΔCt метода. Результаты представлены как среднее значение ±SEM.
Из представленных на фиг.3 данных следует, что через 40 часов после помещения клеток в условия гипоксии наблюдалось многократное в сравнении с контролем (сохранение условий нормоксии) повышение экспрессии обоих генов: примерно в 10 и в 16 раз для Nox2 и Nox4, соответственно. Следует, однако, отметить, что индукция экспрессии Nox2 и Nox4 носила кратковременный характер, и спустя еще 8 часов инкубации (48 часов гипоксии) уровень мРНК обоих белков уменьшался в несколько раз в сравнении с максимумом (фиг.3).
Пример 3.
Подавление экспрессии NADPH-оксидаз МСК жировой ткани с помощью малых интерферирующих РНК
Для подавления экспрессии обнаруженных в МСК изоформ NADPH-оксидаз использовали метод РНК-интерференции. Клетки, культивированные в обычных условиях (см. пример 1) до второго пассажа, при достижении 70-80% конфлюента бережно снимали с чашки Петри раствором Q-Tase (HyClone). He менее 5×105 клеток ресуспендировали в 100 мкл раствора для трансфекции МСК (Amaxa) и добавляли специфические в отношении Nox2 или Nox4 коммерческие siRNA (Novus Biologicals) до финальной концентрации 5 нМ. Полученную взвесь клеток помещали в кювету для трансфекции (Amaxa) и проводили трансфекцию в нуклеофекторе (Nucleofector Device, Amaxa) по программе G006. Аналогичную процедуру повторяли с Stealth™ RNAi negative control medium (Invitrogen) в качестве контроля.
После завершения программы клетки помещали в нагретую до 37°С среду роста мезенхимальных стволовых клеток AdvanceSTEM (HyClone), не содержащую ростовых добавок и антибиотиков, и через 24 или 72 часа проводили электрофорез образцов сред в денатурирующих условиях в присутствии додецилсульфата натрия по методу Лэммли с последующим иммуноблоттингом. Для этого отбирали образцы кондиционированной среды. Концентрацию белка в образцах среды измеряли по методу Бредфорд. Образцы смешивали с буфером для нанесения (62,5 мМ трис-HCl, 2% ДСН, pH 6,8, 10% глицерин, 0,05% БФС, 10% β-меркаптоэтанол) и инкубировали 5 минут при 95°С. Электрофорез проводили в приборе Protean 3 (Bio-Rad) в электродном буфере (0,025 М трис- 0,192 М глицин, 0,1% ДСН, pH 8,3). Разделение осуществляли в 12% ПААГ толщиной 1 мм (40 мкг белка на дорожку) при 120 В до выхода лидирующего красителя из геля. Для определения молекулярных масс белков использовали смесь окрашенных белков (BioRad).
Сразу после завершения электрофореза осуществляли электроперенос белков на PVDF-мембраны с размером пор 0,45 мкм (Immobilon, США), для чего использовали буфер (0,025 М) трис- (0,192 М) глицин, pH 8,3, с 20% этанолом и 0,02% ДСН. Процесс переноса проводили в течение 60 мин при силе тока 350 мА.
После переноса белков мембраны окрашивали антителами. Чтобы предотвратить неспецифическое связывание антител мембрану блокировали в течение 30 минут в 5% растворе сухого обезжиренного молока в ТСБТ (трис-солевой буфер с Tween-20: 20 мМ трис-HCl, pH 7,6, 20 мМ NaCl, содержащий дополнительно 0,1% Tween 20), а затем инкубировали в течение 1 часа с первичными поликлональными антителами кролика к Nox2 и Nox4 (Abcam) в 1% растворе обезжиренного молока на ТСБТ. После инкубации с первичными антителами мембрану отмывали тремя сменами ТСБТ и инкубировали 60 мин в растворе вторичных антител против IgG кролика, конъюгированных с пероксидазой хрена в ТСБТ, содержащем 1% обезжиренное молоко. Затем мембраны тщательно отмывали от конъюгата вторичных антител раствором ТСБТ и использовали для визуализации полос белка методом детекции хемилюминесценции при помощи рентгеновской пленки "Bio Max" (Kodak).
Полученные данные приведены на фиг.4. Очевидно, что уже через 24 часа после электропорации содержание обоих белков снижалось, хотя в случае Nox4 оно было менее выраженным, чем в случае Nox2. Кроме того, подавление экспрессии Nox2 под действием siPHK продолжалось и через 72 часа после трансфекции (фиг.4).
Пример 4.
Влияние подавления экспрессии Nox2 или Nox4 на экспрессию VEGF в условиях гипоксии.
В МСК 2 пассажа, достигших 70-80% конфлюэнта, проводили РНК-интерференцию с siRNA против Nox2 или Nox4 и затем культивировали трансфицированные клетки 24 часа для адаптации и подавления экспрессии таргетных белков, как описано в примере 3. После этого клетки помещали в условия гипоксии или нормоксии (см. пример 2). Через 48 часов из клеток выделяли суммарную РНК и получали кДНК, как описано в примере 1. Анализ экспрессии гена VEGF проводили методом ПРЦ в реальном времени с применением Sybr Green («Синтол», Россия). При этом использовали праймеры fw: 5'-AGAGCAGAAGTCCCATGAAGTGA-3'; rw: 5'-TCAATCGGACGGCAGTAGCT-3' и температуру отжига 62°С.
Статистический анализ данных проводился с использованием программы SigmaStat9.0. Для сравнения маленьких групп и ненормальных распределений использовался U-критерий Манна-Уитни. Различия считались статистически значимыми при уровне значимости p<0,05.
В результате проведенных исследований, во-первых, было подтверждено [5], что инкубация МСК в условиях гипоксии вызывает повышение в них уровня VEGF примерно в 2-3 раза (сравни столбцы 1 и 4 на фиг.5).
Во-вторых, впервые было показано, что
а) в условиях нормоксии подавление экспрессии Nox2 не вызывает изменений экспрессии VEGF (сравни столбцы 1 и 2 на фиг.5), тогда как подавление экспрессии Nox4 приводит к снижению уровня мРНК VEGF примерно в 2 раза (сравни столбцы 1 и 3 на фиг.5); а
б) в условиях гипоксии, напротив, подавление экспрессии Nox4, хотя и демонстрирует определенную тенденцию к повышению продукции VEGF, однако не приводит к получению достоверных результатов, тогда как ингибирование с помощью siPHK активности гена Nox2 имеет результатом примерно 5-6-кратное повышение содержания VEGF в сравнении с уровнем при нормоксии (сравни столбцы 2 и 5) и почти двукратное увеличение его относительно уровня, достигаемого только при гипоксии (сравни столбцы 4 и 5).
На основании полученных данных был сделан вывод о том, что повышение эффективности метода стимуляции ангиогенного потенциала МСК ЖТ, основанного на применении гипоксии, может быть достигнуто в результате предварительной обработки культивированных клеток siPHK против каталитической субъединицы NADPH-оксидазы Nox2.
Способ повышения ангиогенного потенциала мезенхимальных стволовых клеток жировой ткани (МСК ЖТ), который предусматривает помещение клеток, культивированных в обычных для выращивания МСК условиях (5% СО2; 95% воздуха; 37°С) и среде роста, содержащей антибиотики и фетальную сыворотку и/или ростовые добавки, в условия гипоксии, характеризующиеся содержанием кислорода в газовой смеси 1%, и инкубацию их в той же среде, но без сыворотки или ростовых добавок, в течение 48 ч, отличающийся тем, что перед помещением МСК ЖТ в условия гипоксии проводят трансфекцию клеток малыми интерферирующими РНК против каталитической субъединицы Nox2 цитоплазматической NADPH-оксидазы.